Introduction
وقد أوضح ثروة من البيانات التجريبية أن النخاب يؤثر خطوات حاسمة في تطوير القلب. خلال التنمية، والمستعرض الحاجز يؤدي إلى كتلة من الخلايا الظهارية المعروفة باسم proepicardium 1-4. خلايا من proepicardium ثم تهاجر ومغلف عضلة القلب تشكيل النخاب. وفي أعقاب ذلك، مجموعة فرعية من الخلايا النخابية الخضوع EMT مما أدى إلى هجرة السكان من الخلايا المشتقة النخاب (EPDCs) التي تغزو في وقت لاحق عضلة القلب. وقد أظهرت النسب الوراثي وكذلك فيروسات تتبع التجارب التي EPDCs تفرق في مختلف الأنساب بما في ذلك خلايا العضلات الملساء، الخلايا الليفية، الخلايا البطانية والعضلية (إن وجدت). لذلك EPDCs تساهم بشكل كبير في تطوير الأوعية الدموية التاجية والهندسة المعمارية عضلة القلب 1،2،4-9. وعلاوة على ذلك، فإن النخاب أمر ضروري لتطوير طبقة المدمجة البطين 10-12. لهأظهرت xample Gittenberger دي غروت آخرون أن تثبيط آل إليه proepicardium يؤدي إلى مجموعة من العيوب مثل عضلة القلب رقيقة، حلقات ناقصة من القلب وغير طبيعي تشكيل حاجز بين البطينين، ونتيجة لذلك، الفتك الجنينية 13. عوامل نظير الصماوي يفرز من النخاب الجنينية تعدل انتشار cardiomyocyte والتمايز. واتساقا مع ذلك، أدى الحذف النخاب معين من مسارات الإشارات مثل حمض الريتينويك (RA)، وعوامل نمو الخلايا الليفية (عوامل النمو FGFs) وWNT / β-كاتينين في نمو عضلة القلب المعيبة والفتك الجنينية 14-16.
على الرغم من أنه يعتقد بأن النخاب أن تكون هادئة في قلوب الكبار، وقد أظهرت الدراسات الحديثة أن يتم إعادة تنشيط البرنامج التنموي في النخاب التالية إصابة القلب 17،18. عند التنشيط، والخلايا تخضع انتشار السريع وEMT التي تؤدي إلى تشكيل EPDC. هذه الخلايا تحدث نفس capacitذ أن تفرق في الخلايا الليفية وخلايا العضلات الملساء ولكن ليس العضلية أو الخلايا البطانية 18. بالإضافة إلى ذلك، EPDCs تفرز عوامل proangiogenic التي تساعد في الأوعية الدموية في المنطقة المصابة، وبالتالي تسهل تحسين وظيفة القلب عن طريق تقليل حجم احتشاء. ونظرا لهذه النتائج، اكتسبت النخاب الفائدة في دراسة التطور القلب والأوعية الدموية والأمراض والتجدد.
التكنولوجيا المعدلة وراثيا قد أحدثت ثورة الأبحاث الطبية في القرن ال21. مع المعونة من التكنولوجيا المعدلة وراثيا، ونماذج الماوس المريضة محاكاة حالة الإنسان عملية الأيض وpathophysiologically وقد وضعت بنجاح. ومع ذلك، فقد تم دراسة سلوك الخلية النخابية في هذه المسوخ تحديا ويرجع ذلك أساسا إلى الفتك الجنينية المبكرة. وبالنظر إلى الدور الهام الذي النخاب يلعب في التنمية القلب والتجديد، وأنشأنا نظام الثقافة في المختبر لعلاية الفؤاد الماوسخلايا لتر. وتسمح هذه الطريقة للثقافة على المدى الطويل من الخلايا النخابية ويسهل دراسة مفصلة لاثنين من الخصائص الهامة للالنخاب: قدرته على الهجرة والتمييز. يمكن زرع البطينين المستأصل من الماوس على المواد الهلامية الكولاجين والتي يمكن استخدامها لإجراء فحوصات الهجرة. يتم تربيتها في مصفوفة 3D أن يعيد مصفوفة الكولاجين الغنية خارج الخلية في الطبقة تحت التأمور يلخص في الجسم الحي خلية علم وظائف الأعضاء بشكل أفضل. وبدلا من ذلك يمكن تربيتها على الشرائح غرفة من أجل إنشاء أحادي الطبقة النخابية التي يمكن استخدامها لمجموعة متنوعة من التطبيقات المصب. هذا أحادي الطبقة يمكن أن تستخدم لصبغ للبروتينات تقاطع الضيقة التي ستوفر رؤى حول قدرة النخاب الخضوع EMT وهو أمر حاسم للهجرة. وبالإضافة إلى ذلك، يمكن أيضا أن يتم التجارب التمايز الخروج على هذه الخلايا. وعلاوة على ذلك، يمكن تحليل الجينات الشخصية التعبير عن طريق استخراج الحمض النووي الريبي من الخلايا وأداء الكمي تفاعل البلمرة المتسلسل (QPCR). وأخيرا، يمكن أيضا التعامل مع الطبقات الوحيدة مع وكلاء تليها التحليل الجزيئي لاختبار العلاجات المحتملة. وضعت معا، وهذا النظام الثقافة النخابية يوفر لنا الفرصة لتصور وجمع البيانات الجزيئية التي تعزز فهمنا حول تطوير النخابية.
ميزة أخرى مرغوبة من هذا الأسلوب هو أنه واضح وصريح وليس هناك حاجة الإعداد مزيدا من التفاصيل. باختصار، يتم حصاد الأجنة في E11.5 أو E12.5 يلي الذي رفعه القلب. البطينين ثم يتم تربيتها على أي هلام الكولاجين أو الشرائح غرفة. وفي وقت لاحق، وهذه الخلايا يمكن استخدامها لإجراء التجارب المصب.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
تمت الموافقة على جميع التجارب من قبل لجنة رعاية الحيوان المؤسسية واستخدام ديوك-جامعة سنغافورة الوطنية كلية الدراسات العليا الطبية.
1. استرداد الجنينية البطينات
- تضحية الماوس حاملا توقيت في المرحلة الجنينية المطلوب (E11.5 أو E12.5) باستخدام غرفة القتل الرحيم مع امدادات الغاز ثاني أكسيد الكربون أو أسلوب آخر القتل الرحيم المعتمدة.
- ضع الماوس على ظهرها على طاولة تشريح. تطهير البطن من الأنثى مع الايثانول 70٪. رفع الجلد فوق البطن وإجراء شق صغير (1-2 سم) مع شفرة، ثم اضغط على الجلد بكلتا يديه وسحب بعيدا لفضح جدار البطن.
- الآن قطع جدار البطن لفضح قرن الرحم. استخدام ملقط معقم لرفع قرن الرحم وقطع بعناية بعيدا أنسجة الدهون والأوعية الدموية التي تعلق على قرن الرحم. قطع في عنق الرحم لاسترداد الرحم.
- ضع قرن الرحم في طبق بتري تحتوي على العقيمة الباردة 1X الفوسفات بوف الدو المالحة (PBS) وشطف بلطف. وضع طبق بتري على الجليد.
- استخدام المقص لقطع طريق خط الوسط من قرن الرحم (مقابل إلى الموقع حيث يقع المشيمة) لفضح الأجنة التي لا تزال داخل الكيس المحي وتعلق على جدار الرحم عن طريق المشيمة.
- باستخدام ملقط معقم، وقطع فتح الكيس المحي الجنينية لتحرير الجنين.
- وضع الجنين في طبق بتري جديدة تحتوي على العقيمة الباردة برنامج تلفزيوني 1X. قطع رأس الجنين ووضعه على ظهرها. قطع مفتوحة في جدار الصدر للكشف عن القلب.
- استخدام ملقط معقم لرفع القلب وقطع الأوعية حوله لتحرير القلب من جدار الصدر. إيلاء اهتمام خاص على عدم الإضرار النخاب من القلب مع الأدوات الجراحية.
- تقليم قبالة المسالك تدفق وكل من الأذينين. نقل البطين إلى طبق آخر مع 1X PBS الباردة. وضع الطبق على الجليد.
- كرر الخطوات من 1،6-1،9 حتى يتم استرداد جميع البطينين.
ملاحظة: ثقافة هذه إإكسبلنتس النخابية إما على الشرائح غرفة زجاجية أو في جل الكولاجين لتطبيقات المصب.
- زجاج غرفة الشرائح
- لإعداد وسائل الإعلام والثقافة، وإضافة 10٪ مصل بقري جنيني (FBS)، 1٪ البنسلين / الستربتومايسين و2 نانوغرام / مل عامل نمو الخلايا الليفية المؤتلف 2 (FGF2) إلى متوسطة تعديل النسر Dulbecco وفي (DMEM). تنفيذ كافة الخطوات في غطاء تدفق الصفحي.
- إضافة وسائط الثقافة 500 ميكرولتر إلى كل بئر من غرفة 8-جيدا.
- وضع كل البطين رفعه في وسط البئر. توجيه البطين للحفاظ على الجانب تشريح أسفل على السطح السفلي من البئر.
- وضع بلطف لوحة في 37 درجة مئوية، و 5٪ CO 2 ثقافة الخلية الحاضنة.
- الحفاظ على الثقافة مع الحد الأدنى من اضطراب للسماح للإإكسبلنتس على الانضمام. تشكيل أحادي الطبقة النخابية يمكن ملاحظتها بعد 48-72 ساعة.
- لتمايز epicardخلايا الاتحاد العالمي للتعليم في خلايا العضلات الملساء والثقافة الخلايا أحادي الطبقة النخابية في وسائل الإعلام التمايز لمدة 6 أيام أخرى. لإعداد وسائل الإعلام التمايز، وإضافة 10٪ FBS، 1٪ البنسلين / الستربتومايسين و 50 نانوغرام / مل المؤتلف عامل النمو التحويلي بيتا 1 (TGF-β1) لDMEM.
- تغيير ثقافة وسائل الإعلام يوما بعد يوم.
- الكولاجين جل
- تحضير هلام الكولاجين في لوحة 96-جيدا باستخدام مجموعة 3D الكولاجين الثقافة التجارية وفقا لبروتوكول الشركة المصنعة.
- لإعداد حجم المطلوب من هلام الكولاجين، وخلط كمية مناسبة من محلول الكولاجين مع 5X من DMEM وماصة صعودا وهبوطا. الحل يجب أن تتحول الصفراء.
- إضافة حجم المقابلة من حل المعادلة وتخلط جيدا فورا من قبل pipetting صعودا وهبوطا. فإن الحل بدوره الوردي.
- ماصة 100 ميكرولتر من هذا الخليط في كل بئر من لوحة 96-جيدا. وضع لوحة في 37 درجة مئوية، و 5٪ CO 2 الحاضنة لمدة 30-60 دقيقة إلى alانخفاض هلام لتتبلمر.
- إضافة 200 ميكرولتر من وسائل الإعلام ثقافة المذكورة أعلاه إلى كل بئر.
- وضع كل البطين رفعه في وسط البئر. الشرق البطين للحفاظ على الجانب تشريح أسفل على جل الكولاجين (قمة البطين يجب مواجهة مجرب). وضع بلطف لوحة مرة أخرى في حاضنة الثقافة الخلية.
- بعد 3 أيام، وإزالة البطينين. وضع لوحة العودة إلى الحاضنة زراعة الخلايا لمدة 2 ايام اخرى.
- تغيير ثقافة وسائل الإعلام يوما بعد يوم.
3. التثبيت والتخيل
ملاحظة: يمكن تصور خلايا النخابية على أي من الشرائح الزجاجية غرفة أو هلام الكولاجين.
- نضح من وسائل الإعلام والثقافة، وإضافة حجم مساو من العقيمة برنامج تلفزيوني 1X لغسل الخلايا.
- إضافة ما يكفي 4٪ بارافورمالدهيد (PFA) لتغطية الخلايا. إصلاح الخلايا لمدة 10 دقيقة على 4 درجات مئوية.
- إزالة PFA وتغسل إإكسبلنتس مع 1X PBST (برنامج تلفزيوني 1X مع0.1٪ X-100 تريتون) لpermeabilize الخلايا.
- Immunostain مع الأجسام المضادة المطلوبة (مثل اليكسا فلور 488 phalloidin، ZO-1، α-تويولين وα السلس الأكتين العضلات) 7.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
باستخدام هذا البروتوكول الثقافة، والخلايا النخابية الأولية يمكن أن تكون معزولة مع نقاء عالية للتطبيقات المصب. الخلايا المستنبتة هي قادرة على الخضوع EMT، الهجرة وتفرق تماما كما تفعل الخلايا النخابية في الجسم الحي.
لتحديد نقاء ثقافتنا خلية النخابية الابتدائية، قمنا بتحليل إإكسبلنتس النخابية الناتجة عن Sema3d GFPCre / +، R26 توم / + الأجنة. وأعرب عن Sema3d في الخلايا النخابية خلال تطوير القلب في وقت مبكر، وبالتالي خلايا النخابية المشتقة من هذه الأجنة سيكون RFP المسمى. نحن معزولة البطينين من Sema3d GFPCre / +، R26 توم / + الأجنة لإإكسبلنتس النخابية. بعد 48-72 ساعة، وكنا قادرين على رؤية أحادي الطبقة من الخلايا النخابية. بتركيب المناعي طلب تقديم العروض والصور brightfield أظهرت أن غالبيةمن الخلايا التي هاجرت من البطينين من أصل النخابية (الشكل 1A - C). نحن التحقق من صحة مزيد من النتائج التي توصلنا من خلال عزل الحمض النووي الريبي من خلايا النخابية الابتدائية وأداء QPCR التي أظهرت تعبير قوي عن جينات معينة النخابية (Tbx18 وWT1) بدلا من الجين cardiomyocyte علامة (Nkx2.5) (الشكل 1C).
التالي درسنا قدرة الخلايا على الخضوع EMT من خلال تحليل قطبية خلية وخلية خلية الاتصال للخلايا النخابية. EMT هو عملية بيولوجية التي تسمح للخلايا الظهارية لانقاص قطبية خلية وخلية خلية الاتصال من أجل التحول إلى خلية الوسيطة المهاجرة. الخطوة الأولى من EMT هي مفرزة من الاتصالات خلية خلية. نحن immunostained الخلايا النخابية مع ZO-1 (المعروف أيضا باسم Tjp1، ضيق تقاطع البروتين 1) والذي أظهر توطين ZO-1 إلى غشاء البلازما مما يدل على أن الخلايا لديهابعد الخضوع EMT (الشكل 2A). التالي أجرينا المناعية للα-تويولين (الشكل 2B) وذلك لمراقبة تنظيم الأنابيب الدقيقة في إإكسبلنتس النخابية، والتي أظهرت محاذاة الاستقطاب التي تسهل الهجرة الاتجاه من خلايا النخابية. وبالإضافة إلى ذلك، لتحديد إمكانية التفريق بين الخلايا النخابية، ونحن مثقف لهم لمدة 6 أيام في وسائل الإعلام التمايز التي تحتوي على المؤتلف TGF-β1. تظاهر المناعية للSMA التمايز الناجح للخلايا النخابية إلى خلايا العضلات الملساء (الشكل 2C).
وأخيرا، لتحليل المستمدة النخاب الهجرة الخلية وEMT النخابية، ونحن أيضا تنفيذ عملية الكولاجين غزو هلام الفحص. وتصور الخلايا المشتقة النخاب التي كتبها phalloidin المناعية. الهجرة الناجحة من الخلايا المشتقة النخاب يمكن أن ينظر في جميع أنحاء ازدراع (الشكل 3A). لتحديد دepth من اختراق الخلية في مصفوفة الكولاجين، ولدت 3D إعادة الإعمار من الصور مبائر. ويمكن رؤية تغلغل الخلايا المشتقة النخاب في زي اكوام (الشكل 3B).
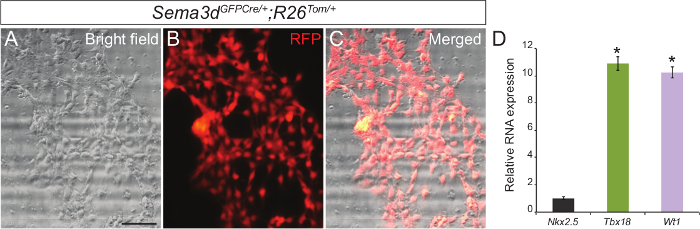
. الشكل 1: ثقافة الأولية من الخلايا الجنينية النخابية من قلوب ماوس brightfield الممثل (A) وطلب تقديم العروض المناعي (B) وصور من خلايا النخابية الأولية الناتجة عن E12.5 Sema3d GFPCre / +، R26 توم / + القلوب. اندمجت صورة brightfield والمناعي (C). مستويات التعبير مرنا النسبية للعلامات النخابية (Tbx18 وWT1) وعلامة cardiomyocyte (Nkx2.5) في الخلايا النخابية الابتدائية (D). وتم تطبيع النتائج إلى التعبير GAPDH، و يتم إعطاء مستويات التعبير النسبية كما فرق أضعاف مقارنة التعبير Nkx2.5 (ن = 3). يتم عرض البيانات كما يعني ± SD. شريط مقياس = 200 ميكرون. *، ف <0.05. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
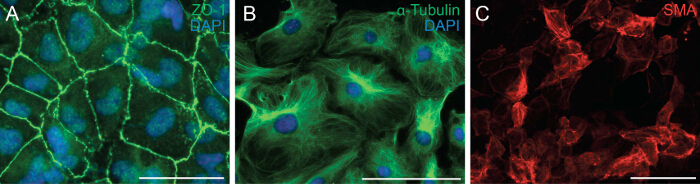
الشكل 2: التعليم الابتدائي خلايا النخابية أن تحتفظ بقدرتها على الخضوع EMT والتمايز المناعية على إإكسبلنتس النخابية لZO-1 (A، أخضر) أو α-تويولين (B، الأخضر). وقد استخدم دابي لتصور النوى (الأزرق). وتختلف الخلايا النخابية إلى خلايا العضلات الملساء لمدة 6 أيام وملطخة-α العضلات الملساء الأكتين (SMA) (C، أحمر). شريط مقياس = 100 ميكرون.3993fig2large.jpg "الهدف =" _ فارغة "> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

. كانت الهجرة خلية النخابية على سطح الكولاجين جل البطينات من أجنة E12.5 مثقف على ثلاثية الأبعاد مصفوفة هلام الكولاجين وملطخة فلور اليكسا 488 phalloidin لتصور المستمدة النخاب هجرة الخلايا واختراق (A): الشكل (3). استخدمت الصور متحد البؤر لبناء صورة ثلاثية الأبعاد لتحديد انتشار الخلايا على طول ض محاور (B). شريط النطاق = 50 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
ومن محوريا لتطوير التقنيات التي تسهل دراسة النخاب لتلبية الأهمية المتزايدة للالنخاب في التنمية القلب والتجدد. نظام الثقافة النخابية يطرح مزايا هامة للبحث النخابية.
وسيلة بديلة لعزل الخلايا النخابية هو استخدام مضان تنشيط الفرز الخلية (نظام مراقبة الأصول الميدانية). ويعتمد هذا الأسلوب على استخدام علامات النخابية (أو النخاب خلية محددة التعبير المعدلة وراثيا من البروتين الفلوري) لفصل الخلايا النخابية من الأنساب الأخرى. ومع ذلك، فقد أظهرت قدرا متزايدا من الأدلة على أن علامات النخابية لا أعرب حصرا في النخاب. على سبيل المثال، يتم التعبير عن Tbx18 في عضلة القلب من الحاجز بين البطينين (الحبس الاحتياطي)، في حين يتم التعبير عن WT1 في البطانة 19-21. وبالتالي، ونقاء من السكان من الخلايا النخابية معزولة أمر مشكوك فيه. في المقابل، فإن الأسلوب ثقافة الموصوفة هنا يأخذdvantage من طبيعة المهاجرة من الخلايا النخابية. وهذا يتيح للعزل السكان نقية للغاية من خلايا النخابية كما هو مبين من خلال تجاربنا وضع العلامات الوراثية. وهناك طريقة أخرى للحصول على خلايا النخابية يكون تمايز الخلايا الجذعية المحفزة الإنسان (hPSCs) إلى خلايا النخابية عن طريق تحوير في المقام الأول BMP، WNT ومسارات حمض يشير الريتينويك. هذه الخلايا المتمايزة تشبه الخصائص الفيزيائية والجزيئية للخلايا الجنينية النخابية. فهي ليست فقط قادرة على الخضوع EMT ولكن هي أيضا قادرة على التمايز إلى الخلايا الليفية وخلايا العضلات الملساء 22،23. على الرغم من هذه الطريقة واعدة جدا، وبشكل ملحوظ أكثر تعقيدا وتستغرق وقتا طويلا من ثقافة النخابية صفها في هذه الورقة.
وبالإضافة إلى ذلك، فإن هذا الأسلوب الثقافة لا يتطلب معدات متخصصة إضافية والإعداد زراعة الأنسجة الموجودة غير كافية. في حين تتبع هذا البروتوكول، لا بد من دفع الصورةالاهتمام PECIAL للا يضر النخاب مع الأدوات الجراحية عند استرداد القلب. وبالإضافة إلى ذلك، فمن الأهمية بمكان توجيه البطين رفعه مع الجانب تشريح تواجه إما سطح هلام الكولاجين أو الشرائح الغرفة من أجل تسهيل هجرة الخلايا النخابية. وأخيرا، ينبغي الحفاظ على الثقافة مع الحد الأدنى من اضطراب وذلك للسماح لليزدرع التمسك الطبق الثقافة.
ويمكن بعد ذلك من الخلايا التي تم الحصول عليها يمكن استخدامها لإجراء مجموعة متنوعة من التجارب المصب التي سوف تزيد من فهمنا للبيولوجيا الخلية النخابية. زراعة وإإكسبلنتس على الشرائح غرفة يوفر الطبقات الوحيدة النخابية لمختلف التجارب بما في ذلك انتشار النخابية الخلية، والبقاء على قيد الحياة، والهجرة، EMT والتمايز في الأنساب القلب. كما يوفر فرصة لاختبار تأثير المخدرات على خصائص الخلوية من النخاب فضلا عن التغيرات في التعبير الجيني المرتبط العلاج من تعاطي المخدرات. وبالإضافة إلى ذلك، مكعبlturing والنخاب على المواد الهلامية الكولاجين تمكن من تحليل الخلايا في مصفوفة 3D بدلا من مصفوفة 2D التقليدية، الذي يقدم مثالا أكثر دقة من علم وظائف الأعضاء في الجسم الحي.
ومع ذلك، فإن عيوب هذه التقنية يكون أن هذا الأسلوب يمكن أن تستخدم إلا لخلايا ثقافة النخابية من قلوب الجنينية بين E11.5-E12.5. خلال وقت لاحق من الحمل أو في فترة ما بعد الولادة والنخاب يفقد القدرة على التكاثر والهجرة. وبالتالي فإنه من الصعب استخدام هذا الأسلوب الثقافة لعزل الخلايا النخابية من المراحل الجنينية في وقت لاحق أو فئران بالغة.
وعلى الرغم من هذا القيد، وتستخدم هذه التقنية المهارات زراعة الأساسية والإعداد لتسهيل نمو الخلايا النخابية خارج الحي الذي من شأنه أن يكون مفيدا جدا لدراسة النخاب وأدوارها في التنمية القلب والتجدد.
Subscription Required. Please recommend JoVE to your librarian.
Acknowledgments
وأيد هذا العمل من جانب صناديق من دوق-جامعة سنغافورة الوطنية العليا الطبي مدرسة سنغافورة، ومؤسسة جوه وسنغافورة جبهة الخلاص الوطني الزمالة (جبهة الخلاص الوطني، NRFF2016-01) إلى Manvendra ك سينغ.
Materials
| Name | Company | Catalog Number | Comments |
| Dulbecco’s modified Eagle’s medium (DMEM) | Life tech invitrogen | 11995065 | |
| Penicillin/streptomycin solution | Life tech invitrogen | 15140122 | |
| Fetal bovine serum (FBS) | Life tech invitrogen | 10500064 | |
| Paraformaldehyde | Sigma | P6148-5KG | |
| Recombinant fibroblast growth factor 2 (FGF2) | PeproTech | 450-33 | |
| Recombinant transforming growth factor beta 1 (TGF-β1) | PeproTech | 100-21 | |
| ZO-1 antibody | Life tech invitrogen | 40-2200 | |
| α-Tubulin antibody | Sigma | T 6074 | |
| α-smooth muscle actin (SMA) antibody | Sigma | A 2547 | |
| Phalloidin antibody | Life tech invitrogen | A12379 | |
| 3D Collagen Culture kit | Millipore | ECM 675 | |
| 8-well chamber slide | Fisher Scientific | NNU 154534-PK | |
| Trizol reagent | Life Technologies | 15596-018 | |
| ViiA 7 Real-Time PCR System | Life Technologies | 4453536 | |
| Superscript First Strand Synthesis kit | Life Technologies | 11904-018 |
References
- Mikawa, T., Fischman, D. A. Retroviral analysis of cardiac morphogenesis: discontinuous formation of coronary vessels. Proc Natl Acad Sci U S A. 89, 9504-9508 (1992).
- Mikawa, T., Gourdie, R. G. Pericardial mesoderm generates a population of coronary smooth muscle cells migrating into the heart along with ingrowth of the epicardial organ. Dev Biol. 174, 221-232 (1996).
- Manner, J., Perez-Pomares, J. M., Macias, D., Munoz-Chapuli, R. The origin, formation and developmental significance of the epicardium: a review. Cells Tissues Organs. 169, 89-103 (2001).
- Gittenberger-de Groot, A. C., Vrancken Peeters, M. P., Mentink, M. M., Gourdie, R. G., Poelmann, R. E. Epicardium-derived cells contribute a novel population to the myocardial wall and the atrioventricular cushions. Circ Res. 82, 1043-1052 (1998).
- von Gise, A., Pu, W. T. Endocardial and epicardial epithelial to mesenchymal transitions in heart development and disease. Circ Res. 110, 1628-1645 (2012).
- Katz, T. C., et al. Distinct compartments of the proepicardial organ give rise to coronary vascular endothelial cells. Dev Cell. 22, 639-650 (2012).
- Singh, M. K., Lu, M. M., Massera, D., Epstein, J. A. MicroRNA-processing enzyme Dicer is required in epicardium for coronary vasculature development. J Biol Chem. 286, 41036-41045 (2011).
- Degenhardt, K., Singh, M. K., Epstein, J. A. New approaches under development: cardiovascular embryology applied to heart disease. J Clin Invest. 123, 71-74 (2013).
- Singh, M. K., Epstein, J. A. Epicardium-derived cardiac mesenchymal stem cells: expanding the outer limit of heart repair. Circ Res. 110, 904-906 (2012).
- Manner, J. Experimental study on the formation of the epicardium in chick embryos. Anat Embryol (Berl). 187, 281-289 (1993).
- Manner, J., Schlueter, J., Brand, T. Experimental analyses of the function of the proepicardium using a new microsurgical procedure to induce loss-of-proepicardial-function in chick embryos. Dev Dyn. 233, 1454-1463 (2005).
- Pennisi, D. J., Ballard, V. L., Mikawa, T. Epicardium is required for the full rate of myocyte proliferation and levels of expression of myocyte mitogenic factors FGF2 and its receptor, FGFR-1, but not for transmural myocardial patterning in the embryonic chick heart. Dev Dyn. 228, 161-172 (2003).
- Gittenberger-de Groot, A. C., Vrancken Peeters, M. P., Bergwerff, M., Mentink, M. M., Poelmann, R. E. Epicardial outgrowth inhibition leads to compensatory mesothelial outflow tract collar and abnormal cardiac septation and coronary formation. Circ Res. 87, 969-971 (2000).
- Lavine, K. J., et al. Endocardial and epicardial derived FGF signals regulate myocardial proliferation and differentiation in vivo. Dev Cell. 8, 85-95 (2005).
- Merki, E., et al. Epicardial retinoid X receptor alpha is required for myocardial growth and coronary artery formation. Proc Natl Acad Sci U S A. 102, 18455-18460 (2005).
- Stuckmann, I., Evans, S., Lassar, A. B. Erythropoietin and retinoic acid, secreted from the epicardium, are required for cardiac myocyte proliferation. Dev Biol. 255, 334-349 (2003).
- Huang, G. N., et al. C/EBP transcription factors mediate epicardial activation during heart development and injury. Science. 338, 1599-1603 (2012).
- Zhou, B., et al. Adult mouse epicardium modulates myocardial injury by secreting paracrine factors. J Clin Invest. 121, 1894-1904 (2011).
- Christoffels, V. M., et al. Tbx18 and the fate of epicardial progenitors. Nature. 458, 8-9 (2009).
- Rudat, C., Kispert, A. Wt1 and epicardial fate mapping. Circ Res. 111, 165-169 (2012).
- Duim, S. N., Kurakula, K., Goumans, M. J., Kruithof, B. P. Cardiac endothelial cells express Wilms' tumor-1: Wt1 expression in the developing, adult and infarcted heart. J Mol Cell Cardiol. 81, 127-135 (2015).
- Iyer, D., et al. Robust derivation of epicardium and its differentiated smooth muscle cell progeny from human pluripotent stem cells. Development. 142, 1528-1541 (2015).
- Witty, A. D., et al. Generation of the epicardial lineage from human pluripotent stem cells. Nat Biotechnol. 32, 1026-1035 (2014).



