Introduction
Une grande quantité de données expérimentales ont montré que l'épicarde influence des étapes cruciales dans le développement cardiaque. Au cours du développement, le septum transversum donne lieu à un amas de cellules mésothéliales connu sous le nom proepicardium 1-4. Les cellules de la proepicardium migrent ensuite et l'enveloppe du myocarde formant l'épicarde. Par la suite, un sous-ensemble de cellules épicardiques subissent EMT donnant lieu à une population migratoire des cellules dérivées épicarde (EPDCs) qui envahissent la suite du myocarde. lignée génétique ainsi que rétroviral traçage des expériences ont démontré que EPDCs se différencient en diverses lignées, y compris les cellules musculaires lisses, les fibroblastes, les cellules endotheliales et des cardiomyocytes (le cas échéant). Par conséquent EPDCs contribuent de manière significative au développement de la vascularisation coronarienne et de l' architecture du myocarde 1,2,4-9. En outre, l'épicarde est essentiel pour le développement de la couche compacte ventriculaire 10-12. Pour exemple Gittenberger de Groot et al. , ont démontré que l' inhibition de l'excroissance du proepicardium conduit à un réseau de défauts tels qu'une mince myocarde, mise en boucle déficiente du coeur et la formation du septum interventriculaire anormale et par conséquent, une létalité embryonnaire 13. facteurs paracrines sécrétées par l'épicarde embryonnaire modulent la prolifération des cardiomyocytes et la différenciation. Conformément à cela, la suppression spécifique de l' épicarde des voies de signalisation comme l' acide rétinoïque (RA), les facteurs de croissance des fibroblastes (FGF) et Wnt / β-caténine a entraîné une croissance du myocarde défectueux et une létalité embryonnaire 14-16.
Bien que l'épicarde croyait être au repos dans les cœurs adultes, des études récentes ont montré que le programme de développement est réactivé dans l'épicarde après une lésion cardiaque 17,18. Lors de l'activation, les cellules subissent une prolifération rapide et EMT qui aboutissent à la formation EPDC. Ces cellules présentent l'Capacity se différencier en fibroblastes et des cellules musculaires lisses mais non cardiomyocytes ou des cellules endothéliales 18. En outre, les EPDCs sécrètent des facteurs pro-angiogéniques que l'aide dans la vascularisation de la zone lésée et faciliter ainsi la fonction cardiaque améliorée en réduisant la taille de l'infarctus. En raison de ces résultats, l'épicarde a gagné l'intérêt pour l'étude du développement cardio-vasculaire, la maladie et la régénération.
La technologie transgénique a révolutionné la recherche médicale dans le 21e siècle. À l'aide des technologies transgéniques, des modèles de souris malades mimant la condition humaine et pathophysiologique métaboliquement ont été développés avec succès. Cependant, l'étude du comportement des cellules épicardique dans ces mutants a été un défi principalement due à une létalité embryonnaire précoce. Considérant le rôle important que l'épicarde joue dans le développement cardiaque et la régénération, nous avons mis en place un système de culture in vitro pour epicardia de la sourisl cellules. Cette méthode permet la culture à long terme des cellules épicardiques et facilite l'étude détaillée des deux propriétés importantes de l'épicarde: sa capacité à migrer et à se différencier. Ventricules excisé de la souris peuvent être cultivées sur des gels de collagène qui peuvent être utilisés pour réaliser des dosages de migration. Être cultivé dans une matrice 3D qui reproduit la matrice extracellulaire riche en collagène de la couche épicardique mieux récapitule in vivo dans la physiologie cellulaire. En variante, elles peuvent être cultivées sur des lames de la chambre, afin d'établir une monocouche épicardique qui peut ensuite être utilisé pour une variété d'applications en aval. Cette monocouche peut être utilisé pour colorer les protéines des jonctions serrées qui fourniront un aperçu sur la capacité de l'épicarde à subir EMT qui est crucial pour la migration. En outre, des expériences de différenciation peuvent également être effectuées sur ces cellules. En outre, le profil d'expression génique peut être analysé par extraction de l'ARN à partir des cellules eteffectuer une réaction en chaîne par polymérase quantitative (qPCR). Enfin, les monocouches peuvent également être traités avec des agents, suivie d'une analyse moléculaire pour tester les agents thérapeutiques potentiels. Mis ensemble, ce système de culture épicardique nous offre la possibilité de visualiser et de recueillir des données moléculaires qui favorise notre compréhension sur le développement épicardique.
Une autre caractéristique souhaitable de cette méthode est qu'elle est simple et aucune installation complexe est nécessaire. En bref, les embryons sont récoltés à E11.5 ou E12.5 suivant laquelle le cœur est excisée. Les ventricules sont ensuite cultivées soit sur un gel de collagène ou des diapositives de chambre. Ensuite, ces cellules peuvent être utilisées pour réaliser des expériences en aval.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Toutes les expériences ont été approuvées par le Comité institutionnel de protection et d'utilisation des animaux Duke-NUS Graduate Medical School.
1. Récupération de la Embryonic ventricules
- Sacrifiez une souris enceinte chronométré au stade embryonnaire souhaité (E11.5 ou E12.5) en utilisant une chambre de l'euthanasie avec l'approvisionnement en gaz de dioxyde de carbone ou d'une autre méthode d'euthanasie approuvée.
- Placez la souris sur le dos sur une table de dissection. Désinfecter l'abdomen de la femelle avec 70% d'éthanol. Soulevez la peau sur le ventre et faire une petite incision (1-2 cm) avec une lame, puis maintenez la peau avec les deux mains et tirez pour exposer la paroi abdominale.
- Maintenant, coupez la paroi abdominale pour exposer la corne utérine. Utilisez des pinces stériles pour soulever la corne utérine et soigneusement couper les tissus adipeux et les vaisseaux sanguins attachés à la corne utérine. Couper au niveau du col pour récupérer l'utérus.
- Placez la corne utérine dans une boîte de Pétri contenant du froid stérile 1x Phosphate Buff Ered Saline (PBS) et rincer doucement. Placez la boîte de Pétri sur de la glace.
- Utilisez des ciseaux pour couper à travers la ligne médiane de la corne de l'utérus (en face du site où le placenta est situé) pour exposer les embryons qui sont encore à l'intérieur du sac vitellin et attaché à la paroi utérine à travers le placenta.
- En utilisant des pinces stériles, couper ouvert le jaune sac embryonnaire pour libérer l'embryon.
- Placez l'embryon dans une nouvelle boîte de Pétri contenant stérile froid 1x PBS. Décapitez l'embryon et le placer sur son dos. Couper ouvert la paroi thoracique afin d'exposer le cœur.
- Utilisez des pinces stériles pour soulever le cœur et couper les vaisseaux autour de lui pour libérer le coeur de la paroi thoracique. Faites attention à ne pas endommager l'épicarde du coeur avec les outils chirurgicaux.
- Coupez le tube de sortie et les deux oreillettes. Transférer le ventricule à un autre plat avec 1x PBS froid. Placer le plat sur la glace.
- Répétez les étapes 1,6-1,9 jusqu'à ce que tous les ventricules sont récupérés.
Note: Culture ces explants épicardiques soit sur des lames de la chambre de verre ou sur un gel de collagène pour des applications en aval.
- Verre Chambre Diapositives
- Pour préparer le milieu de culture, ajouter 10% de sérum bovin fœtal (FBS), 1% de pénicilline / streptomycine et 2 ng / ml de facteur de croissance fibroblastique recombinant 2 (FGF2) au milieu de Eagle modifié par Dulbecco (DMEM). Effectuer toutes les étapes de la hotte à flux laminaire.
- Ajouter 500 ul de milieu de culture à chaque puits d'une chambre à 8 puits.
- Placer chaque ventricule excisé au centre d'un puits. Orientez le ventricule de garder le côté disséquée vers le bas sur la surface inférieure du puits.
- Placez délicatement la plaque dans un 37 ° C, 5% de CO 2 culture cellulaire incubateur.
- Maintenir la culture avec un minimum de perturbation pour permettre aux explants d'adhérer. La formation de la monocouche épicardique peut être observée après 48-72 h.
- Pour la différenciation des Epicardcellules ial dans les cellules musculaires lisses, la culture des cellules monocouches épicardiques dans les milieux de différenciation pendant encore 6 jours. Pour préparer le milieu de différenciation, ajouter 10% de FBS, 1% de pénicilline / streptomycine et 50 ng / ml de facteur de croissance transformant bêta 1 recombinant (TGF-β1) de DMEM.
- Changer le milieu de culture tous les deux jours.
- collagène Gel
- Préparer le gel de collagène dans une plaque à 96 puits en utilisant un kit 3D collagène culture commerciale selon le protocole du fabricant.
- Pour préparer le volume désiré de gel de collagène, mélanger la quantité appropriée de solution de collagène avec 5x de DMEM et la pipette de haut en bas. La solution doit virer au jaune.
- Ajouter un volume correspondant de solution de neutralisation et bien mélanger immédiatement par pipetage de haut en bas. La solution va virer au rose.
- Pipette 100 pi de ce mélange dans chaque puits d'une plaque de 96 puits. Placer la plaque dans un 37 ° C, 5% de CO 2 incubateur pendant 30-60 min à albas du gel à polymériser.
- Ajouter 200 ul de milieux de culture décrits ci-dessus à chaque puits.
- Placer chaque ventricule excisé au centre d'un puits. Orienter le ventricule à garder le côté disséqué sur le gel de collagène (apex du ventricule doit faire face à l'expérimentateur). Placez délicatement la plaque dans l'incubateur de culture cellulaire.
- Après 3 jours, retirez les ventricules. Mettez la plaque arrière dans l'incubateur de culture cellulaire pendant 2 jours.
- Changer le milieu de culture tous les deux jours.
3. Fixation et visualisation
Remarque: les cellules épicardiques peuvent être visualisées soit sur des diapositives de chambre de verre ou un gel de collagène.
- Aspirer les milieux de culture et ajouter un volume égal de stérile 1x PBS pour laver les cellules.
- Ajouter suffisamment à seulement 4% de paraformaldehyde (PFA) pour couvrir les cellules. Fixer les cellules pendant 10 min à 4 ° C.
- Retirer PFA et laver explants avec 1x PBST (PBS 1x avec0,1% de triton X-100) pour perméabiliser les cellules.
- Immunocoloration avec un anticorps désiré (par exemple , Alexa Fluor 488-phalloïdine; ZO-1, α-tubuline et α-actine musculaire lisse) 7.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
En utilisant ce protocole de culture, les cellules épicardiques primaires peuvent être isolés avec une grande pureté pour des applications en aval. Les cellules cultivées sont capables de subir une EMT, migrer et se différencier comme les cellules épicardiques faire in vivo.
Pour déterminer la pureté de notre culture cellulaire épicardique primaire, nous avons analysé les explants épicardiques générés par Sema3d GFPCre / +; R26 / Tom + embryons. Sema3d est exprimé dans les cellules épicardiques au cours du développement cardiaque précoce, ainsi des cellules épicardiques dérivées de ces embryons seront RFP étiquetés. Nous avons isolé ventricules de Sema3d GFPCre / +; R26 / Tom + embryons pour explants épicardiques. Après 48-72 heures, nous avons pu voir une monocouche de cellules épicardiques. Superposition l'immunofluorescence de DP et des images en fond clair a montré que la majoritédes cellules qui ont migré à partir des ventricules sont d'origine épicardique (Figure 1A - C). Nous avons confirmé nos résultats en outre par l' isolement d' ARN à partir de cellules épicardiques primaires et la réalisation qPCR qui a montré une forte expression de gènes spécifiques épicardiques (Tbx18 et WT1) par opposition à un gène marqueur de cardiomyocytes (Nkx2.5) (figure 1C).
Ensuite nous avons examiné la capacité des cellules à subir EMT en analysant le contact de la polarité cellulaire et cellule-cellule des cellules épicardiques. EMT est un processus biologique qui permet à une cellule épithéliale de perdre sa polarité cellulaire et contact cellule-cellule afin de se transformer en cellules mésenchymateuses migrateurs. La première étape de l'EMT est le détachement des contacts cellule-cellule. Nous immunocoloration des cellules épicardiques avec ZO-1 (également connu sous le nom Tjp1, une protéine de jonction serrée 1), qui a montré la localisation des ZO-1 à la membrane plasmique, ce qui indique que les cellules ontencore subir OGD (figure 2A). Ensuite nous avons effectué une immunocoloration pour l' α-tubuline (figure 2B) de manière à observer l'organisation des microtubules dans les explants épicardiques, qui a montré un alignement polarisé qui facilite la migration directionnelle des cellules épicardiques. En outre, afin de déterminer le potentiel de différenciation des cellules épicardiques, nous les avons mises en culture pendant 6 jours dans un milieu de différenciation contenant du TGF-β1 recombinant. Immunocoloration pour SMA a démontré une différenciation réussie de cellules épicardiques dans des cellules musculaires lisses (figure 2C).
Enfin, pour analyser la migration des cellules dérivées épicarde et EMT épicardique, nous avons également effectué un essai d'invasion de gel de collagène. cellules épicarde dérivées ont été visualisées par immunocoloration phalloïdine. Migration réussie de cellules dérivées épicarde peut être vu tout autour de l'expiant (figure 3A). Pour déterminer le depth de pénétration de cellules dans la matrice de collagène, la reconstruction 3D à partir d'images a été généré confocale. La pénétration des cellules dérivées épicarde peut être vu dans les piles z (figure 3B).
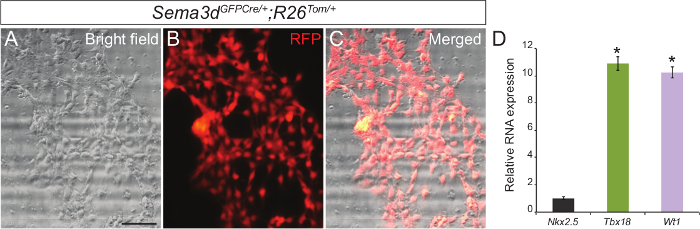
. Figure 1: Culture primaire des cellules épicardiques de coeurs de souris embryonnaires Représentant fond clair (A) et RFP immunofluorescence (B) des images de cellules épicardiques primaires générées à partir de E12.5 Sema3d GFPCre / +; R26 / Tom + coeurs. Fusionné l' image de fond clair et immunofluorescence (C). Les niveaux d'expression d'ARNm relatifs des marqueurs (épicardique et Tbx18 WT1) et cardiomyocytes marqueur (Nkx2.5) dans des cellules épicardiques primaires (D). Les résultats ont été normalisés à l' expression Gapdh, et les niveaux d'expression relatifs sont donnés comme une différence de pliage par rapport à l' expression de Nkx2.5 (n = 3). Les données sont présentées comme la moyenne ± écart-type. Barre d'échelle = 200 um. *, P <0,05. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
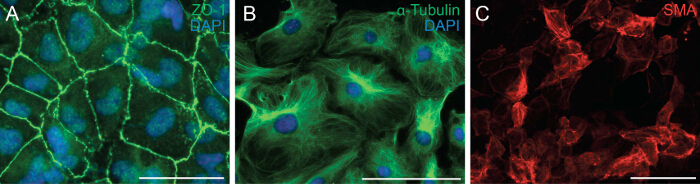
Figure 2: Primaire cellules épicardiques conservent leur capacité à Subir EMT et Différenciation immunocoloration sur des explants épicardiques pour ZO-1 (A, vert) ou α-tubuline (B, vert).. DAPI a été utilisé pour visualiser les noyaux (bleu). Épicardiques cellules ont été différenciées en cellules musculaires lisses pendant 6 jours et colorées avec du α-actine du muscle lisse (SMA) (C, rouge). Barre d'échelle = 100 um.3993fig2large.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 3:. Épicardique la migration des cellules sur la surface de gel de collagène ventricules à partir d' embryons E12.5 ont été cultivées sur une matrice de gel de collagène tridimensionnel et coloré avec Alexa Fluor 488-phalloïdine pour visualiser la migration des cellules épicarde dérivées et de pénétration (A). Les images confocales ont été utilisés pour construire une image en trois dimensions pour déterminer la pénétration cellulaire le long des axes z (B). Barre d'échelle = 50 pm. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Il est essentiel de développer des techniques qui facilitent l'étude de l'épicarde pour répondre à l'importance croissante de l'épicarde dans le développement cardiaque et la régénération. Le système de culture épicardique représente des avantages importants pour la recherche épicardique.
Une autre façon d'isoler des cellules épicardiques consiste à utiliser un tri cellulaire activé par fluorescence (FACS). Cette méthode repose sur l'utilisation de marqueurs épicardiques (ou l'expression transgénique spécifique aux cellules-épicarde d'une protéine fluorescente) pour séparer les cellules épicardiques d'autres lignées. Cependant, un nombre croissant de preuves a montré que les marqueurs épicardiques ne sont pas exclusivement exprimés dans l'épicarde. Par exemple, Tbx18 est exprimé dans le myocarde du septum interventriculaire (IVS) , tandis que Wt1 est exprimée dans l'endothélium 19-21. Par conséquent, la pureté de la population de cellules épicardiques isolé est discutable. En revanche, le procédé de culture décrit dans ce document prendvantage de la nature migratoire des cellules épicardiques. Ce qui permet l'isolement d'une population très pure de cellules épicardiques comme le montre nos expériences de marquage génétique. Une autre façon d'obtenir des cellules épicardiques serait la différenciation des cellules souches pluripotentes humaines (hPSCs) dans des cellules épicardiques essentiellement par modulation de la BMP, WNT et la signalisation des voies d'acide rétinoïque. Ces cellules différenciées ressemblent étroitement aux caractéristiques physiques et moléculaires des cellules épicardiques embryonnaires. Ils sont non seulement capables de subir EMT , mais sont aussi capables de se différencier en les fibroblastes et les cellules musculaires lisses 22,23. Bien que cette méthode est très prometteur, il est beaucoup plus compliqué et plus long que la culture épicardique décrite dans le présent document.
En outre, cette technique de culture ne nécessite pas d'équipement spécialisé supplémentaire et une installation de culture de tissu existant est suffisant. En suivant ce protocole, il est crucial de payer sattention pecial à ne pas endommager l'épicarde avec des outils chirurgicaux lors de la récupération du cœur. En outre, il est essentiel d'orienter le ventricule excisé avec le côté faisant face à disséquer, soit la surface du gel de collagène ou de la chambre coulisseau afin de faciliter la migration des cellules épicardiques. Enfin, la culture doit être maintenue avec une perturbation minimale de façon à permettre l'expiant d'adhérer à la boîte de culture.
La population de cellules obtenues peuvent ensuite être utilisées pour effectuer une variété d'expériences en aval qui favoriseront notre compréhension de la biologie des cellules épicardique. Culture des explants sur des lames de chambre fournit monocouches épicardiques pour diverses expériences, y compris la prolifération épicardique cellulaire, la survie, la migration, EMT et la différenciation en lignées cardiaques. Il fournit également la possibilité de tester l'effet des médicaments sur les propriétés cellulaires de l'épicarde ainsi que des changements d'expression des gènes associés au traitement de la toxicomanie. En outre, culturing l'épicarde sur des gels de collagène permet l'analyse des cellules dans une matrice en 3D au lieu de la matrice 2D classique, qui fournit une représentation plus précise de la physiologie in vivo.
Cependant, un inconvénient de cette technique est que cette méthode ne peut être utilisée pour la culture de cellules de épicardique du coeur entre embryonnaires E11.5-E12.5. Au cours de la gestation ou plus tard dans la période néonatale, l'épicarde perd la capacité à proliférer et à migrer. Ainsi, il est difficile d'utiliser cette méthode de culture pour isoler des cellules épicardiques à partir des stades embryonnaires ultérieures ou des souris adultes.
Malgré cette limitation, cette technique utilise les compétences de culture de base et la configuration pour faciliter la croissance des cellules épicardiques ex vivo qui serait très bénéfique pour l'étude de l'épicarde et ses rôles dans le développement cardiaque et la régénération.
Subscription Required. Please recommend JoVE to your librarian.
Acknowledgments
Ce travail a été soutenu par des fonds de DUKE-NUS Graduate École de médecine de Singapour, Goh fondation et Singapour NRF bourse (NRF-NRFF2016-01) à Manvendra K. Singh.
Materials
| Name | Company | Catalog Number | Comments |
| Dulbecco’s modified Eagle’s medium (DMEM) | Life tech invitrogen | 11995065 | |
| Penicillin/streptomycin solution | Life tech invitrogen | 15140122 | |
| Fetal bovine serum (FBS) | Life tech invitrogen | 10500064 | |
| Paraformaldehyde | Sigma | P6148-5KG | |
| Recombinant fibroblast growth factor 2 (FGF2) | PeproTech | 450-33 | |
| Recombinant transforming growth factor beta 1 (TGF-β1) | PeproTech | 100-21 | |
| ZO-1 antibody | Life tech invitrogen | 40-2200 | |
| α-Tubulin antibody | Sigma | T 6074 | |
| α-smooth muscle actin (SMA) antibody | Sigma | A 2547 | |
| Phalloidin antibody | Life tech invitrogen | A12379 | |
| 3D Collagen Culture kit | Millipore | ECM 675 | |
| 8-well chamber slide | Fisher Scientific | NNU 154534-PK | |
| Trizol reagent | Life Technologies | 15596-018 | |
| ViiA 7 Real-Time PCR System | Life Technologies | 4453536 | |
| Superscript First Strand Synthesis kit | Life Technologies | 11904-018 |
References
- Mikawa, T., Fischman, D. A. Retroviral analysis of cardiac morphogenesis: discontinuous formation of coronary vessels. Proc Natl Acad Sci U S A. 89, 9504-9508 (1992).
- Mikawa, T., Gourdie, R. G. Pericardial mesoderm generates a population of coronary smooth muscle cells migrating into the heart along with ingrowth of the epicardial organ. Dev Biol. 174, 221-232 (1996).
- Manner, J., Perez-Pomares, J. M., Macias, D., Munoz-Chapuli, R. The origin, formation and developmental significance of the epicardium: a review. Cells Tissues Organs. 169, 89-103 (2001).
- Gittenberger-de Groot, A. C., Vrancken Peeters, M. P., Mentink, M. M., Gourdie, R. G., Poelmann, R. E. Epicardium-derived cells contribute a novel population to the myocardial wall and the atrioventricular cushions. Circ Res. 82, 1043-1052 (1998).
- von Gise, A., Pu, W. T. Endocardial and epicardial epithelial to mesenchymal transitions in heart development and disease. Circ Res. 110, 1628-1645 (2012).
- Katz, T. C., et al. Distinct compartments of the proepicardial organ give rise to coronary vascular endothelial cells. Dev Cell. 22, 639-650 (2012).
- Singh, M. K., Lu, M. M., Massera, D., Epstein, J. A. MicroRNA-processing enzyme Dicer is required in epicardium for coronary vasculature development. J Biol Chem. 286, 41036-41045 (2011).
- Degenhardt, K., Singh, M. K., Epstein, J. A. New approaches under development: cardiovascular embryology applied to heart disease. J Clin Invest. 123, 71-74 (2013).
- Singh, M. K., Epstein, J. A. Epicardium-derived cardiac mesenchymal stem cells: expanding the outer limit of heart repair. Circ Res. 110, 904-906 (2012).
- Manner, J. Experimental study on the formation of the epicardium in chick embryos. Anat Embryol (Berl). 187, 281-289 (1993).
- Manner, J., Schlueter, J., Brand, T. Experimental analyses of the function of the proepicardium using a new microsurgical procedure to induce loss-of-proepicardial-function in chick embryos. Dev Dyn. 233, 1454-1463 (2005).
- Pennisi, D. J., Ballard, V. L., Mikawa, T. Epicardium is required for the full rate of myocyte proliferation and levels of expression of myocyte mitogenic factors FGF2 and its receptor, FGFR-1, but not for transmural myocardial patterning in the embryonic chick heart. Dev Dyn. 228, 161-172 (2003).
- Gittenberger-de Groot, A. C., Vrancken Peeters, M. P., Bergwerff, M., Mentink, M. M., Poelmann, R. E. Epicardial outgrowth inhibition leads to compensatory mesothelial outflow tract collar and abnormal cardiac septation and coronary formation. Circ Res. 87, 969-971 (2000).
- Lavine, K. J., et al. Endocardial and epicardial derived FGF signals regulate myocardial proliferation and differentiation in vivo. Dev Cell. 8, 85-95 (2005).
- Merki, E., et al. Epicardial retinoid X receptor alpha is required for myocardial growth and coronary artery formation. Proc Natl Acad Sci U S A. 102, 18455-18460 (2005).
- Stuckmann, I., Evans, S., Lassar, A. B. Erythropoietin and retinoic acid, secreted from the epicardium, are required for cardiac myocyte proliferation. Dev Biol. 255, 334-349 (2003).
- Huang, G. N., et al. C/EBP transcription factors mediate epicardial activation during heart development and injury. Science. 338, 1599-1603 (2012).
- Zhou, B., et al. Adult mouse epicardium modulates myocardial injury by secreting paracrine factors. J Clin Invest. 121, 1894-1904 (2011).
- Christoffels, V. M., et al. Tbx18 and the fate of epicardial progenitors. Nature. 458, 8-9 (2009).
- Rudat, C., Kispert, A. Wt1 and epicardial fate mapping. Circ Res. 111, 165-169 (2012).
- Duim, S. N., Kurakula, K., Goumans, M. J., Kruithof, B. P. Cardiac endothelial cells express Wilms' tumor-1: Wt1 expression in the developing, adult and infarcted heart. J Mol Cell Cardiol. 81, 127-135 (2015).
- Iyer, D., et al. Robust derivation of epicardium and its differentiated smooth muscle cell progeny from human pluripotent stem cells. Development. 142, 1528-1541 (2015).
- Witty, A. D., et al. Generation of the epicardial lineage from human pluripotent stem cells. Nat Biotechnol. 32, 1026-1035 (2014).



