Introduction
Et vell av eksperimentelle data har vist at epikardet påvirker kritiske trinn i hjerte utvikling. Under utviklingen septum transversum gir opphav til en klump av mesothelial celler kjent som proepicardium 1-4. Celler fra proepicardium deretter migrere og konvolutt hjertemuskelen danner epikardet. Etter dette, en undergruppe av epikardiale cellene gjennomgå EMT som gir opphav til en vandrende populasjon av epikard-avledede celler (EPDCs) som senere invaderer myokard. Genetisk samt retrovirale linjen tracing forsøk har vist at EPDCs differensiere til ulike linjene, inkludert glattmuskelceller, fibroblaster, endotelceller og kardiomyocytter (hvis noen). Derfor EPDCs bidra vesentlig til utviklingen av koronar blodkar og hjerteinfarkt arkitektur 1,2,4-9. Videre er epikardet vesentlig for utviklingen av det ventrikulære kompakte lag 10-12. for example Gittenberger-de Groot et al., demonstrerte at inhibering av utvekst av proepicardium fører til en rekke defekter slik som en tynn myokard, mangelfull looping av hjertet og unormal interventricular septum dannelsen og som et resultat, embryonale letalitet 13. Parakrint faktorer skilles fra embryonale epikardet modulere kardiomyocytt spredning og differensiering. I samsvar med dette, epikardet spesifikk delesjon av signalveier så som retinsyre (RA), fibroblast vekstfaktorer (FGF) og Wnt / β-catenin resulterte i defekt myokardial vekst og embryonale letalitet 14-16.
Selv om epikardet ble antatt å være stillestående i voksen hjerter, har nyere studier vist at utviklings programmet er reaktivert i epikardet følgende hjerteskade 17,18. Ved aktivering av cellene gjennomgår hurtig spredning og EMT som resulterer i EPDC formasjon. Disse cellene vise den capacity til å differensiere i fibroblast og glatte muskelceller, men ikke cardiomyocytes eller endotelceller 18. I tillegg EPDCs utsondre proangiogenic faktorer som hjelpemiddel i vaskularisering av det skadde området, og således letter forbedret hjertefunksjonen ved å redusere infarktstørrelse. På grunn av disse funn er epikardet fått interesse for studiet av hjerte-utvikling, sykdom og regenerering.
Transgen teknologi har revolusjonert medisinsk forskning i det 21. århundre. Ved hjelp av transgene teknologier, har syke musemodeller etterligne den menneskelige tilstand metabolsk og patofysiologisk blitt utviklet. Men å studere epikardiell celle atferd i disse mutantene har vært en utfordring i hovedsak på grunn av tidlig embryo dødelighet. Tatt i betraktning den betydning at epikardet spiller i hjerte utvikling og fornyelse, har vi etablert en in vitro kultur system for mus epicardial celler. Denne metoden gjør at langtidskultur av de epikardiale cellene og muliggjør detaljerte studier av de to viktigste egenskapene for epikard: dens evne til å migrere og differensiere. Den utskårende ventriklene fra mus kunne dyrkes på kollagen geler som kan brukes til å utføre migrasjon analyser. Som dyrkes i et 3D-matrise som replikerer den kollagenrikt ekstracellulær matriks av den subepicardial sjiktet bedre sammenfatter in vivo-cellefysiologi. Alternativt kan de dyrkes på kammers objektglass for å etablere en epikardial monolag som så kan brukes til en rekke av nedstrøms applikasjoner. Dette monolaget kan brukes til å farge for trange koplingsproteiner som vil gi innsikt i evnen til å gjennomgå epikardet EMT som er avgjørende for migrasjon. I tillegg kan differensiering eksperimenter også utføres på disse cellene. Videre kan genekspresjon profilen bli analysert ved å ekstrahere RNA fra cellene ogå utføre kvantitativ polymerasekjedereaksjon (qPCR). Til slutt, monolagene kan også bli behandlet med stoffer etterfulgt av en molekylær analyse for å teste for potensielle terapeutiske midler. Til sammen gir dette epikardiell kultur systemet oss mulighet til å visualisere og samle molekylære data som fremmer vår forståelse om epikardiell utvikling.
Et annet ønskelig trekk ved denne metoden er at den er enkel og ingen forseggjort oppsett er nødvendig. I korte trekk, blir embryoene høstet ved E11.5 eller E12.5 hvor hjertet skjæres ut. Ventriklene er deretter dyrket på enten kollagen gel eller kammer lysbilder. Deretter kan disse celler benyttes til å drive nedstrøms eksperimenter.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Alle forsøkene ble godkjent av Duke-NUS Graduate Medical School Institutional Animal Care og bruk komité.
1. Hente Embryonic ventriklene
- Ofre en tidsbestemt gravid musen på ønsket fosterstadiet (E11.5 eller E12.5) ved hjelp av en dødshjelp kammer med karbondioksid gass eller en annen godkjent dødshjelp metode.
- Plasser musen på ryggen på en dissekere bord. Desinfiser magen av den kvinnelige med 70% etanol. Løft huden over magen og lage et lite snitt (1-2 cm) med en kniv, og deretter holder huden med begge hender og dra bort for å avsløre bukveggen.
- Nå kuttes bukveggen for å eksponere livmorhorn. Bruk steril tang for å løfte opp livmorhorn og forsiktig klippe bort fett vev og blodårer festet til livmorhornet. Skåret i livmorhalsen for å hente livmoren.
- Plasser livmorhorn i en petriskål inneholdende sterilt kald 1x Phosphate Buff ket Saline (PBS) og skyll forsiktig. Sett petriskål på is.
- Bruk saks til å klippe gjennom midtlinjen av livmorhorn (motsatt til stedet hvor morkaken er plassert) å eksponere embryoene som fortsatt er inne i plommesekken og festet til livmorveggen via morkaken.
- Ved hjelp av steril pinsett, kuttet åpen embryonale plommesekken for å frigjøre embryo.
- Plasser embryoet i en ny petriskål inneholdende sterilt kald 1 x PBS. Halshogge embryoet og plassere den på ryggen. Klipp opp brystveggen for å avdekke hjerte.
- Bruk steril tang til å løfte hjerte og kuttet bort fartøyene rundt det å frigjøre hjertet fra brystveggen. Vær spesielt oppmerksom ikke å skade epikardet av hjertet med kirurgiske verktøy.
- Klipp av utløpskanalen og begge atriene. Overfør ventrikkelen til en annen skål med kaldt 1x PBS. Sett fatet på is.
- Gjenta trinn 01.06 til 01.09 før alt ventriklene blir hentet.
Merk: Kultur disse epikardiale explants enten på glass kammer lysbilder eller på kollagen gel for nedstrøms applikasjoner.
- Glass Chamber Slides
- For å fremstille dyrkningsmedier, tilsett 10% føtalt bovint serum (FBS), 1% penicillin / streptomycin og 2 ng / ml rekombinant fibroblast vekstfaktor 2 (FGF2) i Dulbeccos modifiserte Eagles medium (DMEM). Utføre alle trinnene i laminær hette.
- Tilsett 500 ul kulturmedium til hver brønn av en 8-brønners kammer.
- Plasser hver skåret ventrikkel i sentrum av en brønn. Orientere ventrikkel for å holde dissekert side ned på den nedre overflaten av brønnen.
- Forsiktig sette platen i en 37 ° C, 5% CO2 cellekulturinkubator.
- Opprettholde kulturen med minimal forstyrrelse for å la explants å overholde. Dannelse av det epikardiale monolaget kan observeres etter 48-72 timer.
- For differensiering av epicardial celler i glatte muskelceller, kultur de epikardiale monolagcellene i differensiering media for en annen 6 dager. For å forberede differensiering media, legger 10% FBS, 1% penicillin / streptomycin og 50 ng / ml rekombinant transformerende vekstfaktor beta 1 (TGF-β1) for å DMEM.
- Endre kulturen media annenhver dag.
- collagen Gel
- Klargjør kollagen gelen i en 96-brønns plate ved anvendelse av en kommersiell 3D Collagen Culture sett i overensstemmelse med fabrikantens protokoll.
- For å fremstille det ønskede volum av kollagen gel, blande den passende mengde av kollagen løsning med 5 x DMEM og pipetten opp og ned. Løsningen skal bli gul.
- Legge til et tilsvarende volum av nøytralisering løsning og bland godt straks ved å pipettere opp og ned. Løsningen vil bli rosa.
- Pipetter 100 ul av denne blanding i hver brønn av en 96-brønns plate. Sett platen i en 37 ° C, 5% CO2 inkubator i 30-60 min til allav gel å polymerisere.
- Tilsett 200 ul kulturmedium som er beskrevet ovenfor, til hver brønn.
- Plasser hver skåret ventrikkel i sentrum av en brønn. Orient ventrikkelen å holde dissekert siden ned i kollagen gel (apex av ventrikkelen skal vende eksperimentator). Forsiktig satt platen tilbake i cellekulturinkubator.
- Etter 3 dager, fjern ventriklene. Sette platen tilbake i cellekulturinkubator i ytterligere 2 dager.
- Endre kulturen media annenhver dag.
3. Fiksering og visualisering
Merk: epikardiell celler kan visualiseres på enten glass kammer lysbilder eller kollagen gel.
- Aspirer ut kulturmedier og tilsett et likt volum av sterilt 1 x PBS for å vaske cellene.
- Legg akkurat nok til 4% paraformaldehyd (PFA) for å dekke cellene. Fiksere cellene i 10 minutter ved 4 ° C.
- Fjern PFA og vask explants med 1x PBST (1x PBS med0,1% triton X-100) for å permeabilisere cellene.
- Immunfarging med ønsket antistoff (f.eks Alexa Fluor 488-phalloidin; ZO-1, α-Tubulin og α-glatt muskulatur aktin) 7.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Ved hjelp av denne kulturen protokollen, kan primær epikardiale celler isoleres med høy renhet for nedstrøms applikasjoner. De dyrkede celler er i stand til å gjennomgå EMT, migrere og skille like epikardiale celler gjør in vivo.
For å bestemme renheten av våre primære epikardiell cellekultur, analyserte vi epikardiale explants generert fra Sema3d GFPCre / +; R26 Tom / + embryoer. Sema3d er uttrykt i epikardiale celler under tidlig hjerte utvikling, og dermed epikardiale celler avledet fra disse embryoene blir RFP merket. Vi isolert ventriklene fra Sema3d GFPCre / +; R26 Tom / + embryoer for epikardiale explants. Etter 48-72 timer, var vi i stand til å se et monolag av epikardiale celler. Innkopiering RFP immunfluorescens og lysfelt bildene viste at et flertallav cellene som migrerte fra ventriklene er av epikardiell opprinnelse (Figur 1A - C). Vi har videre bekreftet våre resultater ved å isolere RNA fra primære celler, og epikardiale utføre qPCR som viste en sterk ekspresjon av spesifikke gener (epikardiale Tbx18 og WT1) i motsetning til en kardiomyocytt markørgen (Nkx2.5) (figur 1C).
Neste vi undersøkt evnen som cellene å gjennomgå EMT ved å analysere celle polaritet og celle-celle-kontakt av epikardiale celler. EMT er en biologisk prosess som gjør at en epitelcelle å miste sin celle polaritet og celle-celle-kontakt for å transformere til en vandrende celle mesenchymale. Det første trinn i EMT er løsgjøring av celle-celle-kontakter. Vi immunfarget epikardiale celler med ZO-1 (også kjent som Tjp1, Tight junction protein 1) som viser lokalisering av ZO-1 til plasmamembranen som indikerer at cellene harennå å gjennomgå EMT (figur 2A). Neste utførte vi farging for α-Tubulin (figur 2B) for å observere organisering av mikrotubuli i epikardiale eksplantater, som viste et polarisert oppstilling som muliggjør retningsbestemt vandring av epikardiale celler. I tillegg, for å bestemme differensierings potensialet i de epikardiale celler, dyrket vi dem i 6 dager i en differensierings medier inneholdende rekombinant TGF-β1. Farging for SMA demonstrert vellykket differensiering av epikardiale celler i glatte muskelceller (Figur 2C).
Til slutt, for å analysere epikardet-avledet cellemigrasjon og epikardiell EMT, også utførte vi en kollagen-gel invasjon assay. Epikardet-avledede celler ble visualisert ved phalloidin immunfarging. Vellykket migrering av epikardet-deriverte celler kan sees over hele eksplantering (figur 3A). For å bestemme depth av cellegjennomtrengning inn i kollagenmatriksen, ble 3D-rekonstruksjon som genereres fra konfokale bilder. Penetrasjon av epikard-avledede celler kan sees i z-stabler (figur 3B).
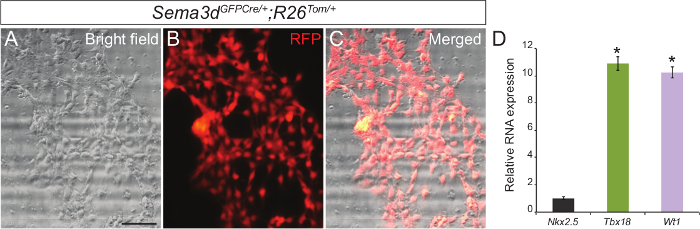
. Figur 1: Primær Culture of epikardiell Celler fra embryonale Muse Hjerter Representant lysfelt (A) og RFP immunfluorescens (B) bilder av primær epikardiale celler generert fra E12.5 Sema3d GFPCre / +; R26 Tom / + hjerter. Fusjonerte lysfelt og immunfluorescens bilde (C). Relative mRNA uttrykk nivåer av epikardiale markører (Tbx18 og WT1) og kardiomyocytt markør (Nkx2.5) i primær epikardiale celler (D). Resultatene ble normalisert til GAPDH uttrykk, og den relative ekspresjonsnivåer er gitt som et gangers forskjell i forhold til Nkx2.5 uttrykket (n = 3). Dataene er presentert som gjennomsnitt ± SD. Scale bar = 200 mikrometer. *, P <0,05. Klikk her for å se en større versjon av dette tallet.
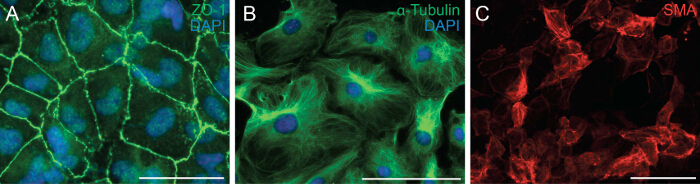
Figur 2: Primær epikardiell Celler Beholde sin evne til å gjennomgå EMT og Differensiering Farging på epikardiale explants for ZO-1 (A, grønn) eller α-Tubulin (B, grønn).. DAPI ble anvendt for å visualisere kjerner (blå). Epikardiale cellene ble differensiert i glatte muskelceller i 6 dager og farget med α-glattmuskel aktin (SMA) (C, rød). Scale bar = 100 mikrometer.3993fig2large.jpg "target =" _ blank "> Klikk her for å se en større versjon av dette tallet.

Fig. 3: Epikardial cellemigrering på Collagen Gel Surface ventriklene fra E12.5 embryoer ble dyrket på en tredimensjonal matrise kollagen gel og farget med Alexa 488 Fluor-phalloidin å visualisere epikardet-avledet cellemigrasjon og gjennomtrengning (A). Konfokale bilder ble brukt til å konstruere et tredimensjonalt bilde for å bestemme cellegjennomtrengning langs z-aksen (B). Scale bar = 50 mikrometer. Klikk her for å se en større versjon av dette tallet.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Det er avgjørende å utvikle teknikker som letter studiet av epikardet å imøtekomme den økende betydningen av epikardet i hjerte utvikling og fornyelse. Den epikardiell kultur system byr på betydelige fordeler for epikardiell forskning.
En alternativ måte å isolere epikardiale celler, er å bruke fluorescens-aktivert cellesortering (FACS). Denne metoden baserer seg på bruk av epikardiale markører (eller epikardet-celle-spesifikke transgene ekspresjon av et fluorescent protein) for å separere epikardiale celler fra andre linjer. Imidlertid har en økende mengde bevis vist at epikardiale markører ikke er utelukkende uttrykt i epikardet. For eksempel er Tbx18 uttrykt i hjertemuskelen av interventrikulære septum (IVS) mens WT1 uttrykkes på endotel 19-21. Derfor, er renheten av befolkningen i epikardiale celler isolert tvilsom. I motsetning til dette dyrkningsmetode som er beskrevet her tardvantage av den vandrende natur epikardiale celler. Dette muliggjør isolering av en meget ren populasjon av epikardiale celler, som vist ved våre genetiske merkingseksperimenter. En annen måte å skaffe epikardiale celler vil være differensiering av menneskelige pluripotente stamceller (hPSCs) i epikardiale celler ved å modulere primært BMP, WNT og retinsyre signalveier. Disse differensierte celler ligner de fysiske og molekylære egenskapene til embryonale epikardiale celler. De er ikke bare i stand til å gjennomgå EMT, men er også i stand til å differensiere til fibroblaster og glattmuskelceller 22,23. Selv om denne fremgangsmåte er meget lovende, er det betydelig mer komplisert og tidskrevende enn de epikardiale kultur som er beskrevet i denne artikkelen.
I tillegg vil denne kulturen teknikken ikke krever ekstra spesialutstyr og et eksisterende vev kultur oppsettet er tilstrekkelig. Mens du følger denne protokollen, er det avgjørende å betale special oppmerksomhet til ikke skade epikardet med kirurgiske verktøy når du henter hjertet. I tillegg er det viktig å orientere det utskårede ventrikkel med dissekert siden som vender enten overflaten av kollagen gel eller kammer lysbilde for å lette epikardiell cellemigrering. Endelig bør kulturen opprettholdes med minimal forstyrrelse, slik som å tillate eksplantatet å følge dyrkningsskålen.
Populasjonen av celler oppnådd kan deretter brukes til å utføre en rekke nedstrøms eksperimenter som vil øke vår forståelse av epikardiell cellebiologi. Dyrking explants på kammer lysbilder gir epikardiale monolagene for ulike eksperimenter inkludert epikardiell celleproliferasjon, overlevelse, migrasjon, EMT og differensiering i hjerte linjene. Det gir også en mulighet til å teste effekten av narkotika på de cellulære egenskapene epikardet samt genuttrykk endringer knyttet til medikamentell behandling. I tillegg culturing epikardet på kollagen geler muliggjør analyse av cellene i en 3D-matriks i stedet for den tradisjonelle 2D-matrise, som gir en mer nøyaktig illustrasjon av in vivo-fysiologi.
Imidlertid vil en ulempe ved denne teknikken er at denne fremgangsmåte bare kan brukes til kultur epikardiale celler fra embryonale hjerter mellom E11.5-E12.5. Under senere svangerskap eller i nyfødtperioden epikardet mister evnen til å spre seg og migrere. Således er det vanskelig å bruke denne dyrkningsmetode for å isolere celler fra epikardiale senere embryonale trinn eller voksne mus.
Til tross for denne begrensningen, bruker denne teknikken grunnleggende dyrkings ferdigheter og oppsett for å legge til rette for vekst av epikardiale celler ex vivo som ville være svært gunstig for studiet av epikardet og sine roller i hjerte utvikling og fornyelse.
Subscription Required. Please recommend JoVE to your librarian.
Acknowledgments
Dette arbeidet ble støttet av midler fra DUKE-NUS Graduate Medical School Singapore, Goh fundament og Singapore NRF fellesskap (NRF-NRFF2016-01) til Manvendra K. Singh.
Materials
| Name | Company | Catalog Number | Comments |
| Dulbecco’s modified Eagle’s medium (DMEM) | Life tech invitrogen | 11995065 | |
| Penicillin/streptomycin solution | Life tech invitrogen | 15140122 | |
| Fetal bovine serum (FBS) | Life tech invitrogen | 10500064 | |
| Paraformaldehyde | Sigma | P6148-5KG | |
| Recombinant fibroblast growth factor 2 (FGF2) | PeproTech | 450-33 | |
| Recombinant transforming growth factor beta 1 (TGF-β1) | PeproTech | 100-21 | |
| ZO-1 antibody | Life tech invitrogen | 40-2200 | |
| α-Tubulin antibody | Sigma | T 6074 | |
| α-smooth muscle actin (SMA) antibody | Sigma | A 2547 | |
| Phalloidin antibody | Life tech invitrogen | A12379 | |
| 3D Collagen Culture kit | Millipore | ECM 675 | |
| 8-well chamber slide | Fisher Scientific | NNU 154534-PK | |
| Trizol reagent | Life Technologies | 15596-018 | |
| ViiA 7 Real-Time PCR System | Life Technologies | 4453536 | |
| Superscript First Strand Synthesis kit | Life Technologies | 11904-018 |
References
- Mikawa, T., Fischman, D. A. Retroviral analysis of cardiac morphogenesis: discontinuous formation of coronary vessels. Proc Natl Acad Sci U S A. 89, 9504-9508 (1992).
- Mikawa, T., Gourdie, R. G. Pericardial mesoderm generates a population of coronary smooth muscle cells migrating into the heart along with ingrowth of the epicardial organ. Dev Biol. 174, 221-232 (1996).
- Manner, J., Perez-Pomares, J. M., Macias, D., Munoz-Chapuli, R. The origin, formation and developmental significance of the epicardium: a review. Cells Tissues Organs. 169, 89-103 (2001).
- Gittenberger-de Groot, A. C., Vrancken Peeters, M. P., Mentink, M. M., Gourdie, R. G., Poelmann, R. E. Epicardium-derived cells contribute a novel population to the myocardial wall and the atrioventricular cushions. Circ Res. 82, 1043-1052 (1998).
- von Gise, A., Pu, W. T. Endocardial and epicardial epithelial to mesenchymal transitions in heart development and disease. Circ Res. 110, 1628-1645 (2012).
- Katz, T. C., et al. Distinct compartments of the proepicardial organ give rise to coronary vascular endothelial cells. Dev Cell. 22, 639-650 (2012).
- Singh, M. K., Lu, M. M., Massera, D., Epstein, J. A. MicroRNA-processing enzyme Dicer is required in epicardium for coronary vasculature development. J Biol Chem. 286, 41036-41045 (2011).
- Degenhardt, K., Singh, M. K., Epstein, J. A. New approaches under development: cardiovascular embryology applied to heart disease. J Clin Invest. 123, 71-74 (2013).
- Singh, M. K., Epstein, J. A. Epicardium-derived cardiac mesenchymal stem cells: expanding the outer limit of heart repair. Circ Res. 110, 904-906 (2012).
- Manner, J. Experimental study on the formation of the epicardium in chick embryos. Anat Embryol (Berl). 187, 281-289 (1993).
- Manner, J., Schlueter, J., Brand, T. Experimental analyses of the function of the proepicardium using a new microsurgical procedure to induce loss-of-proepicardial-function in chick embryos. Dev Dyn. 233, 1454-1463 (2005).
- Pennisi, D. J., Ballard, V. L., Mikawa, T. Epicardium is required for the full rate of myocyte proliferation and levels of expression of myocyte mitogenic factors FGF2 and its receptor, FGFR-1, but not for transmural myocardial patterning in the embryonic chick heart. Dev Dyn. 228, 161-172 (2003).
- Gittenberger-de Groot, A. C., Vrancken Peeters, M. P., Bergwerff, M., Mentink, M. M., Poelmann, R. E. Epicardial outgrowth inhibition leads to compensatory mesothelial outflow tract collar and abnormal cardiac septation and coronary formation. Circ Res. 87, 969-971 (2000).
- Lavine, K. J., et al. Endocardial and epicardial derived FGF signals regulate myocardial proliferation and differentiation in vivo. Dev Cell. 8, 85-95 (2005).
- Merki, E., et al. Epicardial retinoid X receptor alpha is required for myocardial growth and coronary artery formation. Proc Natl Acad Sci U S A. 102, 18455-18460 (2005).
- Stuckmann, I., Evans, S., Lassar, A. B. Erythropoietin and retinoic acid, secreted from the epicardium, are required for cardiac myocyte proliferation. Dev Biol. 255, 334-349 (2003).
- Huang, G. N., et al. C/EBP transcription factors mediate epicardial activation during heart development and injury. Science. 338, 1599-1603 (2012).
- Zhou, B., et al. Adult mouse epicardium modulates myocardial injury by secreting paracrine factors. J Clin Invest. 121, 1894-1904 (2011).
- Christoffels, V. M., et al. Tbx18 and the fate of epicardial progenitors. Nature. 458, 8-9 (2009).
- Rudat, C., Kispert, A. Wt1 and epicardial fate mapping. Circ Res. 111, 165-169 (2012).
- Duim, S. N., Kurakula, K., Goumans, M. J., Kruithof, B. P. Cardiac endothelial cells express Wilms' tumor-1: Wt1 expression in the developing, adult and infarcted heart. J Mol Cell Cardiol. 81, 127-135 (2015).
- Iyer, D., et al. Robust derivation of epicardium and its differentiated smooth muscle cell progeny from human pluripotent stem cells. Development. 142, 1528-1541 (2015).
- Witty, A. D., et al. Generation of the epicardial lineage from human pluripotent stem cells. Nat Biotechnol. 32, 1026-1035 (2014).



