Introduction
Una gran cantidad de datos experimentales han puesto de manifiesto que el epicardio influye en los pasos críticos en el desarrollo cardíaco. Durante el desarrollo, el tabique transverso da lugar a un grupo de células mesoteliales conocidos como proepicardio 1-4. Las células de la proepicardio luego migran y el sobre el miocardio que forma el epicardio. Después de esto, un subconjunto de células epicárdicas someterse a aumento EMT dando a una población migratorio de las células derivadas del epicardio se (EPDCs) que posteriormente invaden el miocardio. linaje genético, así como el rastreo retroviral experimentos han demostrado que EPDCs diferenciarse en varios linajes, incluyendo células de músculo liso, fibroblastos, células endoteliales y cardiomiocitos (si los hay). Por lo tanto EPDCs contribuyen significativamente al desarrollo de la vasculatura coronaria y la arquitectura miocárdica 1,2,4-9. Además, el epicardio es esencial para el desarrollo de la capa compacta ventricular 10-12. Delanteroxample Gittenberger-de Groot et al. demostró que la inhibición de la excrecencia de la proepicardio conduce a una serie de defectos, tales como el miocardio delgada, looping deficiente del corazón y la formación de septum interventricular anormal y, como resultado, la letalidad embrionaria 13. factores paracrinos secretadas desde el epicardio embrionario modular la proliferación de los cardiomiocitos y la diferenciación. En consonancia con esto, la deleción-epicardio específica de las vías de señalización tales como el ácido retinoico (RA), factores de crecimiento de fibroblastos (FGFs) y Wnt / β-catenina resultó en el crecimiento del miocardio defectuoso y letalidad embrionaria 14-16.
Aunque el epicardio se creía que era quiescente en corazones adultos, estudios recientes han demostrado que el programa de desarrollo se reactiva en el epicardio después de una lesión cardiaca 17,18. Tras la activación, las células se someten a una rápida proliferación y EMT que dan lugar a la formación de EPDC. Estas células exhiben el capacity de diferenciarse en fibroblastos y células musculares lisas pero no cardiomiocitos o células endoteliales 18. Además, los EPDCs secretan factores proangiogénicos que ayudan en la vascularización de la zona lesionada y así facilitar la mejora de la función cardíaca mediante la reducción del tamaño del infarto. Debido a estos resultados, el epicardio ha ganado interés en el estudio del desarrollo cardiovascular, la enfermedad y la regeneración.
La tecnología transgénica ha revolucionado la investigación médica en el siglo 21. Con la ayuda de tecnologías transgénicas, los modelos de ratón enfermas que imitan la condición humana metabólicamente y fisiopatológico se han desarrollado con éxito. Sin embargo, el estudio del comportamiento de células epicárdica en estos mutantes ha sido un reto debido principalmente a la letalidad embrionaria temprana. Teniendo en cuenta el importante papel que juega el epicardio en el desarrollo y la regeneración cardiaca, hemos establecido un sistema de cultivo in vitro para ratón epicardiacélulas L. Este método permite que el cultivo a largo plazo de las células epicárdicas y facilita el estudio detallado de las dos propiedades importantes del epicardio: su capacidad de migrar y diferenciarse. Los ventrículos escindió del ratón podrían ser cultivadas en geles de colágeno que pueden ser utilizados para llevar a cabo los ensayos de migración. De haber sido cultivadas en una matriz 3D que reproduce la matriz extracelular rica en colágeno de la capa subepicárdica mejor recapitula la fisiología celular in vivo. Alternativamente, pueden ser cultivadas en portaobjetos de cámara con el fin de establecer una monocapa epicárdica que luego se puede utilizar para una variedad de aplicaciones aguas abajo. Esta monocapa se puede utilizar para teñir para proteínas de unión estrecha que proporcionará información sobre la capacidad del epicardio a someterse a EMT que es crucial para la migración. Además, los experimentos de diferenciación también pueden llevarse a cabo en estas células. Además, el perfil de expresión génica se puede analizar mediante la extracción de ARN de las células yla realización de la reacción en cadena de la polimerasa cuantitativa (qPCR). Por último, las monocapas también podrían ser tratados con agentes, seguido de un análisis molecular para probar posibles terapias. En conjunto, este sistema de cultivo epicárdica nos proporciona la oportunidad de visualizar y obtener datos molecular que promueve nuestro entendimiento sobre el desarrollo del epicardio.
Otra característica deseable de este método es que es sencilla y no se requiere ninguna configuración compleja. En resumen, los embriones se recogieron a E11.5 E12.5 o después de lo cual se extirpó el corazón. Los ventrículos se cultivan a continuación en cualquiera de gel de colágeno o la cámara de diapositivas. Posteriormente, estas células se pueden utilizar para llevar a cabo experimentos de aguas abajo.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Todos los experimentos fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de Duke-NUS Graduate Medical School.
1. Recuperación de la embrionaria Ventrculos
- Sacrificar un ratón embarazadas transitoria en la etapa embrionaria deseada (E11.5 E12.5 o) usando una cámara de eutanasia con el suministro de gas de dióxido de carbono u otro método de eutanasia aprobada.
- Coloca el ratón sobre su espalda en una mesa de disección. Desinfectar el abdomen de la hembra con un 70% de etanol. Levante la piel sobre el vientre y hacer una pequeña incisión (1-2 cm) con una cuchilla, a continuación, mantenga la piel con ambas manos y tire de él para exponer la pared abdominal.
- Ahora corte de la pared abdominal para exponer la trompa uterina. El uso de fórceps estériles para levantar el cuerno uterino y corte con cuidado los tejidos grasos y los vasos sanguíneos unidos a la trompa uterina. Cortar el cuello del útero para recuperar el útero.
- Coloque el cuerno uterino en una placa de Petri que contiene fosfato estéril fría 1x Buff Ered salino (PBS) y enjuagar suavemente. Coloque la placa de Petri en el hielo.
- Use las tijeras para cortar a través de la línea media del cuello uterino (opuesta al sitio donde se encuentra la placenta) para exponer los embriones que aún se encuentran en el interior del saco vitelino y pegado a la pared uterina a través de la placenta.
- El uso de pinzas estériles, cortar abierto el saco vitelino embrionario para liberar al embrión.
- Coloque el embrión en una nueva placa de Petri que contiene estéril frío 1x PBS. Decapitar al embrión y colocarlo en su parte posterior. A cielo abierto de la pared torácica para exponer el corazón.
- El uso de fórceps estériles para levantar el corazón y cortar los vasos alrededor de ella para liberar el corazón de la pared torácica. Prestar especial atención para no dañar el epicardio del corazón con las herramientas quirúrgicas.
- Se quita el tracto de salida y ambas aurículas. Transferir el ventrículo a otro plato con 1x PBS frío. Coloque el plato en el hielo.
- Repita los pasos 1.6-1.9 hasta que todos los ventrículos se recuperan.
Nota: Cultura estos explantes epicárdicas ya sea en la cámara de diapositivas de vidrio o en gel de colágeno para aplicaciones posteriores.
- Cámara de vidrio diapositivas
- Para preparar el medio de cultivo, añadir 10% de suero bovino fetal (FBS), 1% de penicilina / estreptomicina y 2 ng / ml de factor de crecimiento de fibroblastos recombinante 2 (FGF2) para el medio de Eagle modificado por Dulbecco (DMEM). Realizar todos los pasos de la campana de flujo laminar.
- Añadir 500 l de medios de cultivo a cada pocillo de una cámara de 8 pocillos.
- Coloque cada ventrículo escindido en el centro de un pozo. Oriente el ventrículo para mantener el lado diseccionado hacia abajo en la superficie inferior del pozo.
- Introduzca suavemente la placa en un 37 ° C, 5% de CO 2 incubadora de cultivo celular.
- Mantener el cultivo con el mínimo de perturbación para permitir que los explantes se adhieran. La formación de la monocapa epicárdica puede ser observado después de 48 a 72 hr.
- Para la diferenciación de epicardial células en células musculares lisas, cultivar las células epicárdicas monocapa en medio de diferenciación para otros 6 días. Para preparar el medio de diferenciación, añadir 10% de FBS, 1% de penicilina / estreptomicina y 50 ng / ml de factor de crecimiento transformante beta recombinante 1 (TGF-β1) a DMEM.
- Cambiar el medio de cultivo en días alternos.
- Gel de colágeno
- Preparar el gel de colágeno en una placa de 96 pocillos usando un kit comercial Cultura 3D colágeno de acuerdo con el protocolo del fabricante.
- Para preparar el volumen deseado de gel de colágeno, se mezcla la cantidad apropiada de solución de colágeno con 5x de DMEM y la pipeta hacia arriba y abajo. La solución debe tornarse amarilla.
- Añadir un volumen correspondiente de la solución de neutralización y mezclar bien inmediatamente pipeteando arriba y abajo. La solución se vuelve rosada.
- Pipetear 100 l de esta mezcla en cada pocillo de una placa de 96 pocillos. Colocar la placa en un 37 ° C, 5% de CO2 durante 30-60 minutos a Albajo el gel se polimerice.
- Añadir 200 l de medios de cultivo descritos anteriormente a cada pocillo.
- Coloque cada ventrículo escindido en el centro de un pozo. Oriente el ventrículo para mantener el lado diseccionado hacia abajo en el gel de colágeno (ápex del ventrículo debe enfrentar el experimentador). Introduzca suavemente la placa posterior en la incubadora de cultivo celular.
- Después de 3 días, retire los ventrículos. Coloque la placa de nuevo en la incubadora de cultivo celular durante otros 2 días.
- Cambiar el medio de cultivo en días alternos.
3. Fijación y Visualización
Nota: las células epicárdicas pueden visualizarse en cualquiera de portaobjetos de cámara de vidrio o gel de colágeno.
- Aspirar los medios de cultivo y añadir un volumen igual de PBS estéril 1x para lavar las células.
- Añadir la cantidad necesaria paraformaldehído al 4% (PFA) para cubrir las células. Fijar las células durante 10 minutos a 4 ° C.
- Retire PFA y lavar con explantes 1x PBST (PBS 1x con0,1% Tritón X-100) para permeabilizar las células.
- Inmunotinción con anticuerpo deseado (por ejemplo, Alexa Fluor 488-faloidina; ZO-1, α-tubulina y actina de músculo liso α-) 7.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
El uso de este protocolo de cultivo, las células epicárdicas primarios se pueden aislar con alta pureza para aplicaciones posteriores. Las células cultivadas son capaces de someterse a EMT, migrar y diferenciarse al igual que las células epicárdicas hacen en vivo.
Para determinar la pureza de nuestro cultivo de células del epicardio primaria, se analizaron los explantes epicárdicas generados a partir de Sema3d GFPCre / +; R26 TOM / + embriones. Sema3d se expresa en células epicárdicas durante el desarrollo cardíaco temprano, de este modo las células epicárdicas derivados de estos embriones será RFP etiquetado. Se aislaron los ventrículos del Sema3d GFPCre / +; R26 TOM / + embriones para explantes epicárdicas. Después de 48-72 horas, pudimos ver una monocapa de células epicárdicas. La superposición de la inmunofluorescencia RFP y las imágenes de campo claro mostró que una mayoríade las células que migran desde los ventrículos son de origen epicárdico (Figura 1 A - C). Hemos validado aún más nuestros resultados mediante el aislamiento de ARN de las células epicárdicas primaria y la realización de qPCR que mostró una fuerte expresión de genes específicos de epicardio (Tbx18 y WT1) en lugar de un gen marcador de cardiomiocitos (Nkx2.5) (Figura 1C).
A continuación examinamos la capacidad de las células a someterse a EMT mediante el análisis de la polaridad de la célula y célula-célula contacto de las células epicárdicas. EMT es un proceso biológico que permite una célula epitelial a perder su polaridad celular y el contacto célula-célula con el fin de transformar en una célula mesenquimal migratoria. El primer paso de EMT es la separación de los contactos célula-célula. Nos immunostained células epicárdicas con ZO-1 (también conocido como Tjp1, Tight unión proteína 1) que mostró localización de ZO-1 a la membrana plasmática que indica que las células tienensin embargo, a someterse a EMT (Figura 2A). A continuación se realizó la inmunotinción para α-tubulina (Figura 2B) con el fin de observar la organización de los microtúbulos en explantes epicárdicas, que mostraron una alineación polarizada que facilita la migración direccional de células epicárdicas. Además, para determinar el potencial de diferenciación de las células epicárdicas, les cultivaron durante 6 días en un medio de diferenciación que contienen TGF-β1 recombinante. La inmunotinción para la AME demostró la diferenciación de las células epicárdicas con éxito en células de músculo liso (Figura 2C).
Por último, para analizar la migración de células derivadas del epicardio y EMT epicárdica, también se realizó un ensayo de invasión de gel de colágeno. Las células derivadas del epicardio se visualizaron por faloidina inmunotinción. El éxito de la migración de las células derivadas del epicardio se puede ver todo el explante (Figura 3A). Para determinar el depth de penetración celular en la matriz de colágeno, reconstrucción 3D se genera a partir de imágenes confocal. La penetración de las células derivadas del epicardio se puede ver en z-pilas (Figura 3B).
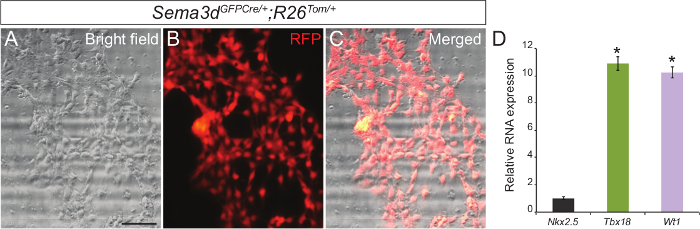
. Figura 1: cultivo primario de células epicárdicas de embriones de ratón Corazones campo claro Representante (A) y RFP inmunofluorescencia (B) imágenes de las células epicárdicas primarios generados a partir de E12.5 Sema3d GFPCre / +; R26 / Tom + corazones. Fusionado campo claro e inmunofluorescencia imagen (C). Los niveles de expresión de mRNA de marcadores epicárdicas (Tbx18 y WT1) y marcador de cardiomiocitos (Nkx2.5) en las células epicárdicas primarias (D). Los resultados se normalizaron a la expresión GAPDH, y el niveles relativos de expresión se dan como una diferencia veces en comparación con la expresión de Nkx2.5 (n = 3). Los datos se presentan como la media ± desviación estándar. Barra de escala = 200 micras. *, P <0,05. Haga clic aquí para ver una versión más grande de esta figura.
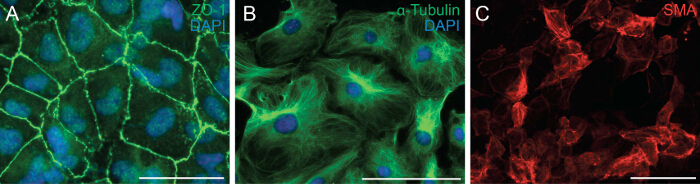
Figura 2: Primaria epicárdicos células sigan siendo capaces de someterse a EMT y Diferenciación inmunotinción en explantes epicárdicas de ZO-1 (A, verde) o α-tubulina (B, verde).. DAPI se utilizó para visualizar los núcleos (azul). Epicárdicos células se diferenciaron en células de músculo liso durante 6 días y se tiñeron con actina de músculo liso α-(SMA) (C, rojo). Barra de escala = 100 micras.3993fig2large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.

Figura 3:. Migración de células epicárdica en la superficie del gel del colágeno ventrículos a partir de embriones E12.5 fueron cultivadas en una matriz de gel de colágeno tridimensional y se tiñeron con Alexa Fluor 488-faloidina para visualizar la migración de células derivadas del epicardio y penetración (A). Las imágenes confocales se utilizaron para construir una imagen tridimensional para determinar la penetración de células a lo largo de los ejes z (B). Barra de escala = 50 micras. Haga clic aquí para ver una versión más grande de esta figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Es fundamental para el desarrollo de técnicas que facilitan el estudio del epicardio para atender a la creciente importancia del epicardio en el desarrollo cardiaco y la regeneración. El sistema de cultivo epicárdica plantea ventajas significativas para la investigación epicárdica.
Una forma alternativa para aislar las células epicárdicas es utilizar la clasificación de células activadas por fluorescencia (FACS). Este método se basa en el uso de marcadores epicárdicas (o expresión transgénica epicardio-celular específica de una proteína fluorescente) para separar las células epicárdicas de otros linajes. Sin embargo, una cantidad creciente de evidencia ha demostrado que los marcadores epicárdicas no se expresan exclusivamente en el epicardio. Por ejemplo, Tbx18 se expresa en el miocardio del tabique interventricular (IVS), mientras que Wt1 se expresa en el endotelio 19-21. Por lo tanto, la pureza de la población de células epicárdicas aislado es cuestionable. En contraste, el método de cultivo descrito en este documento hace unaVentaja de la naturaleza migratoria de las células epicárdicas. Esto permite el aislamiento de una población altamente pura de células epicárdicas como se muestra por nuestros experimentos de marcaje genéticos. Otra forma de obtener células epicárdicas sería la diferenciación de células madre pluripotentes humanas (hPSCs) en células epicárdicas modulando principalmente la BMP, WNT y vías de señalización del ácido retinoico. Estas células diferenciadas se asemejan mucho a las características físicas y moleculares de las células epicárdicas embrionarias. No sólo son capaces de someterse a EMT, pero también son capaces de diferenciarse en fibroblastos y células de músculo liso 22,23. Aunque este método es muy prometedor, es mucho más complicado y requiere mucho tiempo que la cultura del epicardio se describe en este documento.
Además, esta técnica de cultivo no requiere un equipo especializado adicional y una configuración de cultivo de tejido existente es suficiente. Mientras que después de este protocolo, es crucial que pagar sspecial atención a no dañar el epicardio con herramientas quirúrgicas al recuperar el corazón. Además, es fundamental para orientar el ventrículo escindido con el lado diseccionado con vista a la superficie del gel de colágeno o de diapositivas cámara con el fin de facilitar la migración de células epicárdica. Por último, el cultivo debe ser mantenida con una perturbación mínima a fin de permitir el explante se adhiera a la placa de cultivo.
La población de células obtenidas a continuación, se puede utilizar para realizar una variedad de experimentos posteriores que nuestra comprensión de la biología de células del epicardio. El cultivo de los explantes en la cámara de diapositivas proporciona monocapas epicárdicas para varios experimentos que incluyen la proliferación de células del epicardio, la supervivencia, la migración, la EMT y la diferenciación en linajes cardíacos. También proporciona una oportunidad para probar el efecto de los fármacos sobre las propiedades celulares del epicardio, así como los cambios de expresión de genes asociados con el tratamiento farmacológico. Además, culturing el epicardio en geles de colágeno permite el análisis de las células en una matriz 3D en lugar de la matriz 2D tradicional, que proporciona una ilustración más precisa de la fisiología in vivo.
Sin embargo, un inconveniente de esta técnica sería que este método sólo se puede utilizar para cultivo de células epicárdicas de los corazones embrionarias entre E11.5-E12.5. Durante la gestación de plazo o en el período neonatal el epicardio pierde la capacidad de proliferar y migrar. Por lo tanto, es difícil utilizar este método de cultivo para aislar las células epicárdicas de posteriores etapas embrionarias o ratones adultos.
A pesar de esta limitación, esta técnica utiliza habilidades de cultivo y configuración básica para facilitar el crecimiento de las células epicárdicas ex vivo que sería muy beneficioso para el estudio del epicardio y sus roles en el desarrollo cardiaco y la regeneración.
Subscription Required. Please recommend JoVE to your librarian.
Acknowledgments
Este trabajo fue apoyado por fondos de Duke-NUS Graduate Escuela de Medicina de Singapur, Goh fundación y comunión Singapur NRF (NRF-NRFF2016-01) para Manvendra K. Singh.
Materials
| Name | Company | Catalog Number | Comments |
| Dulbecco’s modified Eagle’s medium (DMEM) | Life tech invitrogen | 11995065 | |
| Penicillin/streptomycin solution | Life tech invitrogen | 15140122 | |
| Fetal bovine serum (FBS) | Life tech invitrogen | 10500064 | |
| Paraformaldehyde | Sigma | P6148-5KG | |
| Recombinant fibroblast growth factor 2 (FGF2) | PeproTech | 450-33 | |
| Recombinant transforming growth factor beta 1 (TGF-β1) | PeproTech | 100-21 | |
| ZO-1 antibody | Life tech invitrogen | 40-2200 | |
| α-Tubulin antibody | Sigma | T 6074 | |
| α-smooth muscle actin (SMA) antibody | Sigma | A 2547 | |
| Phalloidin antibody | Life tech invitrogen | A12379 | |
| 3D Collagen Culture kit | Millipore | ECM 675 | |
| 8-well chamber slide | Fisher Scientific | NNU 154534-PK | |
| Trizol reagent | Life Technologies | 15596-018 | |
| ViiA 7 Real-Time PCR System | Life Technologies | 4453536 | |
| Superscript First Strand Synthesis kit | Life Technologies | 11904-018 |
References
- Mikawa, T., Fischman, D. A. Retroviral analysis of cardiac morphogenesis: discontinuous formation of coronary vessels. Proc Natl Acad Sci U S A. 89, 9504-9508 (1992).
- Mikawa, T., Gourdie, R. G. Pericardial mesoderm generates a population of coronary smooth muscle cells migrating into the heart along with ingrowth of the epicardial organ. Dev Biol. 174, 221-232 (1996).
- Manner, J., Perez-Pomares, J. M., Macias, D., Munoz-Chapuli, R. The origin, formation and developmental significance of the epicardium: a review. Cells Tissues Organs. 169, 89-103 (2001).
- Gittenberger-de Groot, A. C., Vrancken Peeters, M. P., Mentink, M. M., Gourdie, R. G., Poelmann, R. E. Epicardium-derived cells contribute a novel population to the myocardial wall and the atrioventricular cushions. Circ Res. 82, 1043-1052 (1998).
- von Gise, A., Pu, W. T. Endocardial and epicardial epithelial to mesenchymal transitions in heart development and disease. Circ Res. 110, 1628-1645 (2012).
- Katz, T. C., et al. Distinct compartments of the proepicardial organ give rise to coronary vascular endothelial cells. Dev Cell. 22, 639-650 (2012).
- Singh, M. K., Lu, M. M., Massera, D., Epstein, J. A. MicroRNA-processing enzyme Dicer is required in epicardium for coronary vasculature development. J Biol Chem. 286, 41036-41045 (2011).
- Degenhardt, K., Singh, M. K., Epstein, J. A. New approaches under development: cardiovascular embryology applied to heart disease. J Clin Invest. 123, 71-74 (2013).
- Singh, M. K., Epstein, J. A. Epicardium-derived cardiac mesenchymal stem cells: expanding the outer limit of heart repair. Circ Res. 110, 904-906 (2012).
- Manner, J. Experimental study on the formation of the epicardium in chick embryos. Anat Embryol (Berl). 187, 281-289 (1993).
- Manner, J., Schlueter, J., Brand, T. Experimental analyses of the function of the proepicardium using a new microsurgical procedure to induce loss-of-proepicardial-function in chick embryos. Dev Dyn. 233, 1454-1463 (2005).
- Pennisi, D. J., Ballard, V. L., Mikawa, T. Epicardium is required for the full rate of myocyte proliferation and levels of expression of myocyte mitogenic factors FGF2 and its receptor, FGFR-1, but not for transmural myocardial patterning in the embryonic chick heart. Dev Dyn. 228, 161-172 (2003).
- Gittenberger-de Groot, A. C., Vrancken Peeters, M. P., Bergwerff, M., Mentink, M. M., Poelmann, R. E. Epicardial outgrowth inhibition leads to compensatory mesothelial outflow tract collar and abnormal cardiac septation and coronary formation. Circ Res. 87, 969-971 (2000).
- Lavine, K. J., et al. Endocardial and epicardial derived FGF signals regulate myocardial proliferation and differentiation in vivo. Dev Cell. 8, 85-95 (2005).
- Merki, E., et al. Epicardial retinoid X receptor alpha is required for myocardial growth and coronary artery formation. Proc Natl Acad Sci U S A. 102, 18455-18460 (2005).
- Stuckmann, I., Evans, S., Lassar, A. B. Erythropoietin and retinoic acid, secreted from the epicardium, are required for cardiac myocyte proliferation. Dev Biol. 255, 334-349 (2003).
- Huang, G. N., et al. C/EBP transcription factors mediate epicardial activation during heart development and injury. Science. 338, 1599-1603 (2012).
- Zhou, B., et al. Adult mouse epicardium modulates myocardial injury by secreting paracrine factors. J Clin Invest. 121, 1894-1904 (2011).
- Christoffels, V. M., et al. Tbx18 and the fate of epicardial progenitors. Nature. 458, 8-9 (2009).
- Rudat, C., Kispert, A. Wt1 and epicardial fate mapping. Circ Res. 111, 165-169 (2012).
- Duim, S. N., Kurakula, K., Goumans, M. J., Kruithof, B. P. Cardiac endothelial cells express Wilms' tumor-1: Wt1 expression in the developing, adult and infarcted heart. J Mol Cell Cardiol. 81, 127-135 (2015).
- Iyer, D., et al. Robust derivation of epicardium and its differentiated smooth muscle cell progeny from human pluripotent stem cells. Development. 142, 1528-1541 (2015).
- Witty, A. D., et al. Generation of the epicardial lineage from human pluripotent stem cells. Nat Biotechnol. 32, 1026-1035 (2014).



