Introduction
Een schat aan experimentele gegevens hebben aangetoond dat het epicard beïnvloedt kritische stappen in de ontwikkeling van het hart. Tijdens de ontwikkeling, het septum transversum leidt tot een klompje mesotheelcellen zogenaamde proepicardium 1-4. Cellen uit de proepicardium dan migreren en de envelop van de hartspier die het epicard. Vervolgens een subset van epicardiale cellen ondergaan EMT waardoor een trekkende populatie van epicard afgeleide cellen (EPDCs) dat vervolgens de hartspier binnendringen. Genetische en retrovirale lineage tracing experimenten hebben aangetoond dat EPDCs differentiëren in diverse lineages, waaronder gladde spiercellen, fibroblasten, endotheelcellen en cardiomyocyten (indien aanwezig). Daarom aanzienlijk EPDCs bijdragen aan de ontwikkeling van de coronaire vaatstelsel en myocard architectuur 1,2,4-9. Bovendien is het epicard is essentieel voor de ontwikkeling van ventriculaire compacte laag 10-12. voor example Gittenberger-de Groot et al. aangetoond dat remming van de uitgroei van de proepicardium leidt tot een scala aan defecten zoals een dunne myocardium deficiënte lussen van het hart en abnormale vorming interventriculair septum en daardoor embryonale letaliteit 13. Paracriene factoren uitgescheiden door de embryonale epicard moduleren cardiomyocyt proliferatie en differentiatie. Consistent hiermee epicard-specifieke deletie van signaaltransductiewegen zoals retinoïnezuur (RA), fibroblast groeifactoren (FGF's) en Wnt / β-catenine resulteerde in defecte myocardiale groei en embryonale letaliteit 14-16.
Hoewel de epicard werd geloofd rustig bij volwassen harten te zijn, hebben recente studies aangetoond dat de ontwikkelings-programma wordt geactiveerd in de epicard volgende cardiale letsel 17,18. Na activering van de cellen ondergaan snelle proliferatie en EMT die resulteren in EPDC formatie. Deze cellen vertonen de capacity te differentiëren in fibroblasten en gladde spiercellen, maar niet cardiomyocyten of endotheelcellen 18. Bovendien, de EPDCs scheiden pro-angiogene factoren die helpen bij de vascularisatie van de gewonde gebied en dus naar een verbeterde hartfunctie door vermindering van de infarctgrootte. Vanwege deze bevindingen, is het epicard belangstelling voor het onderzoek van hart- en ontwikkeling, ziekte en regeneratie gewonnen.
Transgene technologie heeft een revolutie teweeggebracht in het medisch onderzoek in de 21e eeuw. Met behulp van transgene technologie, zieke muismodellen nabootsen van de menselijke conditie metabolisch en pathofysiologisch zijn met succes ontwikkeld. Echter, het bestuderen van de epicardiale cel gedrag in deze mutanten is een uitdaging vooral te wijten aan de vroege embryonale dodelijkheid geweest. Gezien de belangrijke rol die het speelt in het epicard cardiale ontwikkeling en regeneratie, hebben wij een in vitro kweeksysteem voor muizen epicardia vastgesteldl cellen. Deze methode kan de lange termijn kweek van epicardiale cellen en vergemakkelijkt de gedetailleerde studie van de twee belangrijke eigenschappen van het epicard: het vermogen om te migreren en te differentiëren. De uitgesneden ventrikels van de muis kan worden gekweekt op collageen gels die kunnen worden gebruikt om migratie assays voeren. Wordt gekweekt in een 3D matrix die de collageen-rijke extracellulaire matrix van de subepicardiale laag repliceert beter de in vivo recapituleert celfysiologie. Als alternatief kunnen ze worden gekweekt op objectglaasjes kamer om een epicardiale monolaag die vervolgens kan worden gebruikt voor verschillende stroomafwaartse toepassingen stellen. Deze monolaag kan worden gebruikt om kleur wordt tight junction eiwitten die inzichten op het vermogen van het epicard met EMT ondergaan die cruciaal is voor migratie bieden. Bovendien differentiatie experimenten kunnen worden uitgevoerd door deze cellen uitgevoerd. Verder kan genexpressieprofiel worden geanalyseerd door het extraheren van RNA uit de cellen enhet uitvoeren van kwantitatieve polymerase chain reaction (qPCR). Tenslotte kunnen de monolagen worden behandeld met middelen, gevolgd door moleculaire analyse voor het testen van potentiële therapeutische middelen. In elkaar gezet, dit epicardiale cultuur systeem biedt ons de mogelijkheid om te visualiseren en moleculaire gegevens die ons begrip over epicardiale ontwikkeling bevordert te verzamelen.
Een andere gewenste eigenschap van deze werkwijze is dat het eenvoudig en zonder ingewikkelde installatie vereist. In het kort, worden de embryo's geoogst op E11.5 en E12.5 waarna het hart wordt weggesneden. De ventrikels worden vervolgens gekweekt op hetzij collageengel of kamer dia. Vervolgens kunnen deze cellen worden gebruikt voor stroomafwaartse experimenten.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Alle experimenten werden goedgekeurd door de Institutional Animal Care en gebruik Comite Duke-NUS Graduate Medical School.
1. Het ophalen van de Embryonale Ventrikels
- Offer een getimede zwangere muis op de gewenste embryonaal stadium (E11.5 of E12.5) met behulp van een euthanasie kamer met kooldioxide gastoevoer of een andere goedgekeurde euthanasie methode.
- Plaats de muis op zijn rug op een snijtafel. Ontsmet de buik van de vrouw met 70% ethanol. Til de huid over de buik en maken een kleine incisie (1-2 cm) met een mes, houd dan de huid met beide handen vast en weg te trekken naar de buikwand bloot te leggen.
- Knip nu de buikwand naar de baarmoeder hoorn bloot te leggen. Gebruik een steriel pincet op te heffen de baarmoeder hoorn en zorgvuldig weggesneden het vetweefsel en bloedvaten aan de baarmoeder hoorn. Afgesneden de baarmoederhals naar de baarmoeder te halen.
- Plaats de baarmoeder hoorn in een petrischaaltje met steriel koud 1x Fosfaat Buff Ered Saline (PBS) en spoel voorzichtig. Plaats de petrischaal op ijs.
- Gebruik een schaar door de middellijn van de uterushoorn (tegenover de plaats waar de placenta ligt) te snijden om de embryo's die nog in de dooierzak en via de placenta aan de baarmoederwand bloot.
- Met behulp van een steriel pincet, opengesneden de embryonale dooierzak naar het embryo te bevrijden.
- Plaats het embryo in een nieuwe petrischaaltje met steriel koude 1x PBS. Onthoofden het embryo en plaats deze op zijn rug. Opengesneden de borstwand naar het hart bloot te leggen.
- Gebruik een steriel pincet om het hart op te heffen en snijd de vaten rond het weg naar het hart te bevrijden van de borstwand. Besteed speciale aandacht van de epicard van het hart niet te beschadigen met de chirurgische instrumenten.
- Snij de uitstroom-darmkanaal en de beide atria. Breng de ventrikel naar een ander gerecht met koude 1x PBS. Zet de schotel op het ijs.
- Herhaal stap 1,6-1,9 totdat al de ventrikels worden opgehaald.
Let op: Culture deze epicardiale explantaten hetzij op glazen kamer dia's of op collageen gel voor downstream-toepassingen.
- Glass Chamber Slides
- De kweekmedia te bereiden, voeg 10% foetaal runderserum (FBS), 1% penicilline / streptomycine en 2 ng / ml recombinant fibroblast groeifactor 2 (FGF2) aan Dulbecco's gemodificeerd Eagle's medium (DMEM). Voer alle stappen in de laminaire stroming kap.
- Voeg 500 ul cultuur media aan elk putje van een 8-well kamer.
- Plaats elk uitgesneden ventrikel in het midden van een put. Waar zich het ventrikel naar de ontleed naar beneden in de bodem van de put te houden.
- Voorzichtig zet de plaat in een 37 ° C, 5% CO 2 celkweek incubator.
- Handhaving van de cultuur met een minimale verstoring om de explantaten te houden. Vorming van de epicardiale monolaag kan worden waargenomen na 48-72 uur.
- Voor de differentiatie van epicardial cellen in gladde spiercellen, de epicardiale cultuur monolaag cellen bij differentiatie media nog 6 dagen. De differentiatie media bereiden, voeg 10% FBS, 1% penicilline / streptomycine en 50 ng / ml recombinant transformerende groeifactor bèta 1 (TGF- β1) aan DMEM.
- Verander de cultuur media om de andere dag.
- collageen Gel
- Bereid de collageen gel in een 96-wells plaat met een commerciële 3D Collageen Culture kit volgens het protocol van de fabrikant.
- Om de gewenste hoeveelheid collageengel bereiden, meng de juiste hoeveelheid collageen oplossing met 5x DMEM en de pipet op en neer. De oplossing moet geel.
- Een overeenkomstig volume van de neutralisatie-oplossing en meng goed direct door en neer te pipetteren. De oplossing zal roze worden.
- Pipetteer 100 ul van dit mengsel in elk putje van een 96-wells plaat. Plaats de plaat in een 37 ° C, 5% CO2 incubator gedurende 30-60 min allaag van de gel te polymeriseren.
- Voeg 200 ul kweekmedia hierboven beschreven aan elk putje.
- Plaats elk uitgesneden ventrikel in het midden van een put. Oriënteer de ventrikel naar de ontleed naar beneden te houden op het collageen gel (top van de ventrikel moet het gezicht van de experimentator). Voorzichtig zet de plaat terug in de celkweek incubator.
- Na 3 dagen, verwijder de ventrikels. Plaats de plaat terug in de celkweek incubator gedurende nog 2 dagen.
- Verander de cultuur media om de andere dag.
3. Fixatie en Visualisatie
Opmerking: Epicardiale cellen kunnen worden gevisualiseerd aan beide glazen kamer dia's of collageen gel.
- Aspireren uit het kweekmedium en een gelijk volume steriel 1x PBS om de cellen te wassen.
- Voeg net genoeg 4% paraformaldehyde (PFA) om de cellen te dekken. Fixeer de cellen gedurende 10 min bij 4 ° C.
- PFA verwijderen en wassen explantaten met 1x PBST (PBS met 1x0,1% Triton X-100) om de cellen te permeabiliseren.
- Immunostain met gewenste antilichaam (bijv Alexa Fluor 488-falloïdine, ZO-1, α-tubuline en α-gladde spier actine) 7.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Met behulp van deze cultuur protocol, kunnen primaire epicardiale cellen worden geïsoleerd met een hoge zuiverheidsgraad voor downstream-toepassingen. De gekweekte cellen kunnen EMT ondergaan, migreren en differentiëren even epicardiale cellen in vivo.
Om de zuiverheid van onze primaire epicardiale celcultuur te bepalen, analyseerden we de epicardiale explantaten gegenereerd uit Sema3d GFPCre / +; R26 Tom / + embryo's. Sema3d wordt uitgedrukt in epicardiale cellen tijdens de vroege ontwikkeling van het hart, waardoor epicardiale cellen afkomstig van deze embryo RFP bestemd. We geïsoleerd ventrikels van Sema3d GFPCre / +; R26 Tom / + embryo's voor epicardiale explantaten. Na 48-72 uur, waren we in staat om een monolaag van epicardiale cellen te zien. Superpositie van de RFP immunofluorescentie en helderveld beelden toonden aan dat een meerderheidvan de cellen die gemigreerd van de ventrikels zijn epicardiale oorsprong (Figuur 1 A - C). Verder hebben we onze resultaten bevestigd door het isoleren van RNA uit primaire epicardiale cellen en het uitvoeren van qPCR die een sterke expressie van specifieke genen epicardiale (Tbx18 en WT1) in tegenstelling tot een cardiomyocyt merkergen (Nkx2.5) (Figuur 1C) vertoonde.
Vervolgens hebben we onderzocht het vermogen van de cellen om EMT ondergaan door analyse van de celpolariteit en cel-cel-contact of epicardiale cellen. EMT is een biologisch proces waarmee een epitheelcel zijn celpolariteit en cel-cel contact verliezen om te vormen tot een trekkende mesenchymale cel. De eerste stap van EMT is het losmaken van cel-cel contacten. We immunologisch epicardiale cellen met ZO-1 (ook bekend als Tjp1, tight junction eiwit 1) die lokalisatie van ZO-1 bleek de plasmamembraan aangeeft dat cellennog EMT (figuur 2A) ondergaan. Volgende voerden we immunokleuring voor α-tubuline (figuur 2B) om de organisatie van microtubuli in epicardiale explantaten die een gepolariseerde directionele uitlijning die migratie van epicardiale cellen vergemakkelijkt toonde observeren. Bovendien, om de differentiatie potentieel van de epicardiale cellen kunnen bepalen werden gekweekt hen 6 dagen in een medium dat differentiatie recombinant TGF-β1. Immunokleuring voor SMA aangetoond Succesvolle differentiatie van epicardiale cellen in gladde spiercellen (Figuur 2C).
Tot slot, om te analyseren-epicard afgeleide cel migratie en epicardiale EMT, voerden we ook een collageengel invasie assay. -Epicard afgeleide cellen werden zichtbaar gemaakt door phalloidin immunokleuring. Succesvolle migratie van epicard afgeleide cellen blijkt rondom het explantaat (figuur 3A). Om de d te bepalenepth van de mobiele penetratie in de collageen matrix, werd 3D-reconstructie gegenereerd uit confocale beelden. Penetratie van epicard afgeleide cellen kan worden gezien in z-stacks (Figuur 3B).
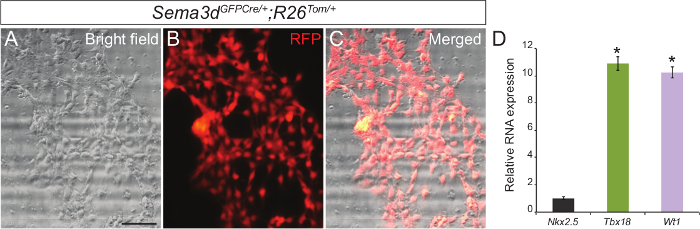
. Figuur 1: Primaire Cultuur van Epicardial Cellen uit embryonale Mouse Hearts vertegenwoordiger helderveld (A) en RFP immunofluorescentie (B) beelden van de primaire epicardiale cellen gegenereerd uit E12.5 Sema3d GFPCre / +; R26 Tom / + hart. Helderveld en immunofluorescentie afbeelding (C) samengevoegd. Relatieve mRNA-expressieniveaus van epicardiale markers (Tbx18 en WT1) en cardiomyocyt marker (Nkx2.5) in primaire epicardiale cellen (D). De resultaten werden genormaliseerd op GAPDH expressie en de relatieve expressieniveaus zijn indicatief voudig verschil met Nkx2.5 expressie (n = 3). De gegevens worden weergegeven als het gemiddelde ± SD. Schaal bar = 200 micrometer. *, P <0,05. Klik hier om een grotere versie van deze figuur te bekijken.
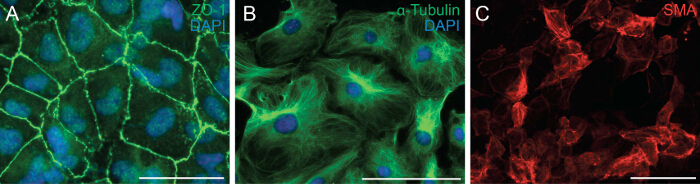
Figuur 2: Primaire Epicardial Cellen behouden hun vermogen om EMT en differentiatie Immunokleuring Onderga op epicardiale explantaten voor ZO-1 (A, groen) of α-tubuline (zwart, groen).. DAPI werd gebruikt om kernen (blauw) te visualiseren. Epicardiale cellen in gladde spiercellen gedifferentieerd gedurende 6 dagen en gekleurd met α-gladde spier actine (SMA) (C, red). Schaal bar = 100 micrometer.3993fig2large.jpg "target =" _ blank "> Klik hier om een grotere versie van deze figuur te bekijken.

Figuur 3:. Epicardiale celmigratie op de collageengel Surface Ventrikels uit E12.5 embryo's werden gekweekt op een driedimensionale matrix collageengel en gekleurd met Alexa Fluor 488-phalloidin visualiseren-epicard afgeleide celmigratie en penetratie (A). Confocale beelden werden gebruikt om een driedimensionaal beeld construeren celpenetratie langs de z-as (B) te bepalen. Schaal bar = 50 pm. Klik hier om een grotere versie van deze figuur te bekijken.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Het is cruciaal voor technieken die de studie van het epicard vergemakkelijken om aan de toenemende belang van het epicard cardiale ontwikkeling en regeneratie ontwikkelen. De epicardiale teeltsysteem stelt significante voordelen voor epicardiale onderzoek.
Een alternatieve manier om epicardiale cellen te isoleren is om fluorescentie-geactiveerde celsortering (FACS) gebruikt. Deze werkwijze berust op het gebruik van epicardiale merkers (of epicardium-celspecifieke transgene expressie van een fluorescerend eiwit) aan epicardiale cellen te scheiden van andere geslachten. Echter steeds meer bewijs blijkt dat epicardiale markers niet exclusief tot expressie in het epicard. Zo wordt Tbx18 uitgedrukt in het myocardium van het septum (IVS) terwijl WT1 tot expressie wordt gebracht in het endotheel 19-21. Vandaar dat de zuiverheid van de populatie van epicardiale cellen geïsoleerd is twijfelachtig. In tegenstelling, de kweekmethode hierin beschreven draaitdvantage van de migrerende aard van de epicardiale cellen. Hierdoor kan de isolatie van een zeer zuivere populatie van epicardiale cellen zoals aangetoond door onze genetische labelingsexperimenten. Een andere manier om epicardiale cellen te verkrijgen zou de differentiatie van humane pluripotente stamcellen (hPSCs) in epicardiale cellen door het moduleren voornamelijk BMP, WNT en retinoïnezuur signaalwegen. Deze gedifferentieerde cellen lijken de fysieke en moleculaire eigenschappen van embryonale epicardiale cellen. Ze zijn niet alleen in staat om EMT ondergaan, maar kunnen ook differentiëren tot fibroblasten en gladde spiercellen 22,23. Hoewel deze methode is veelbelovend, is aanzienlijk ingewikkeld en tijdrovend is dan de epicardiale cultuur in dit document beschreven.
Bovendien is deze cultuur techniek vereisen gespecialiseerde apparatuur en extra een bestaande weefselkweek opstart volstaat. Tijdens het volgen van dit protocol, is het cruciaal om s betalenpecial aandacht aan de epicard met chirurgische instrumenten niet beschadigen bij het ophalen van het hart. Bovendien is het essentieel om de uitgesneden ventrikel oriënteren de ontlede zijde of het oppervlak van de collageengel of kamer dia om epicardiale celmigratie vergemakkelijken. Tenslotte moet de kweek onderhouden met minimale verstoring zodanig om de explantatie te houden aan de kweekschaal.
De populatie van cellen verkregen kan vervolgens worden gebruikt om een verscheidenheid van stroomafwaartse experimenten die ons begrip van celbiologie epicardiale verder zal uitvoeren. Het kweken van de explantaten op kamer objectglaasjes voorziet epicardiale monolagen van verschillende experimenten epicardiale zoals celproliferatie, overleving, migratie, EMT en differentiatie in de hartspier lineages. Het geeft ook de mogelijkheid om het effect van geneesmiddelen op de cellulaire eigenschappen van het epicard testen en genexpressie veranderingen geassocieerd met de behandeling met geneesmiddelen. Bovendien, culturing het epicardium op collageen gels kan de analyse van de cellen in een 3D matrix in plaats van de traditionele 2D-matrix, die een nauwkeurigere weergave van de in vivo fysiologische verschaft.
Echter, een nadeel van deze techniek is dat deze methode alleen kan worden gebruikt om de cultuur epicardiale cellen uit embryonale hart tussen E11.5-E12.5. Tijdens zwangerschap of later in de neonatale periode verliest het epicard het vermogen om te prolifereren en te migreren. Het is dus moeilijk om deze cultuur methode epicardiale cellen te isoleren uit latere embryonale stadia of volwassen muizen.
Ondanks deze beperking deze techniek gebruikt elementaire kweken vaardigheden en installatie tot de groei van epicardiale cellen ex vivo die zeer gunstig zijn voor de studie van het epicard en de rollen cardiale ontwikkeling en regeneratie zou vergemakkelijken.
Subscription Required. Please recommend JoVE to your librarian.
Acknowledgments
Dit werk werd ondersteund door fondsen van Duke-NUS Graduate Medical School Singapore, Goh fundering en Singapore NRF Fellowship (NRF-NRFF2016-01) naar K. Manvendra Singh.
Materials
| Name | Company | Catalog Number | Comments |
| Dulbecco’s modified Eagle’s medium (DMEM) | Life tech invitrogen | 11995065 | |
| Penicillin/streptomycin solution | Life tech invitrogen | 15140122 | |
| Fetal bovine serum (FBS) | Life tech invitrogen | 10500064 | |
| Paraformaldehyde | Sigma | P6148-5KG | |
| Recombinant fibroblast growth factor 2 (FGF2) | PeproTech | 450-33 | |
| Recombinant transforming growth factor beta 1 (TGF-β1) | PeproTech | 100-21 | |
| ZO-1 antibody | Life tech invitrogen | 40-2200 | |
| α-Tubulin antibody | Sigma | T 6074 | |
| α-smooth muscle actin (SMA) antibody | Sigma | A 2547 | |
| Phalloidin antibody | Life tech invitrogen | A12379 | |
| 3D Collagen Culture kit | Millipore | ECM 675 | |
| 8-well chamber slide | Fisher Scientific | NNU 154534-PK | |
| Trizol reagent | Life Technologies | 15596-018 | |
| ViiA 7 Real-Time PCR System | Life Technologies | 4453536 | |
| Superscript First Strand Synthesis kit | Life Technologies | 11904-018 |
References
- Mikawa, T., Fischman, D. A. Retroviral analysis of cardiac morphogenesis: discontinuous formation of coronary vessels. Proc Natl Acad Sci U S A. 89, 9504-9508 (1992).
- Mikawa, T., Gourdie, R. G. Pericardial mesoderm generates a population of coronary smooth muscle cells migrating into the heart along with ingrowth of the epicardial organ. Dev Biol. 174, 221-232 (1996).
- Manner, J., Perez-Pomares, J. M., Macias, D., Munoz-Chapuli, R. The origin, formation and developmental significance of the epicardium: a review. Cells Tissues Organs. 169, 89-103 (2001).
- Gittenberger-de Groot, A. C., Vrancken Peeters, M. P., Mentink, M. M., Gourdie, R. G., Poelmann, R. E. Epicardium-derived cells contribute a novel population to the myocardial wall and the atrioventricular cushions. Circ Res. 82, 1043-1052 (1998).
- von Gise, A., Pu, W. T. Endocardial and epicardial epithelial to mesenchymal transitions in heart development and disease. Circ Res. 110, 1628-1645 (2012).
- Katz, T. C., et al. Distinct compartments of the proepicardial organ give rise to coronary vascular endothelial cells. Dev Cell. 22, 639-650 (2012).
- Singh, M. K., Lu, M. M., Massera, D., Epstein, J. A. MicroRNA-processing enzyme Dicer is required in epicardium for coronary vasculature development. J Biol Chem. 286, 41036-41045 (2011).
- Degenhardt, K., Singh, M. K., Epstein, J. A. New approaches under development: cardiovascular embryology applied to heart disease. J Clin Invest. 123, 71-74 (2013).
- Singh, M. K., Epstein, J. A. Epicardium-derived cardiac mesenchymal stem cells: expanding the outer limit of heart repair. Circ Res. 110, 904-906 (2012).
- Manner, J. Experimental study on the formation of the epicardium in chick embryos. Anat Embryol (Berl). 187, 281-289 (1993).
- Manner, J., Schlueter, J., Brand, T. Experimental analyses of the function of the proepicardium using a new microsurgical procedure to induce loss-of-proepicardial-function in chick embryos. Dev Dyn. 233, 1454-1463 (2005).
- Pennisi, D. J., Ballard, V. L., Mikawa, T. Epicardium is required for the full rate of myocyte proliferation and levels of expression of myocyte mitogenic factors FGF2 and its receptor, FGFR-1, but not for transmural myocardial patterning in the embryonic chick heart. Dev Dyn. 228, 161-172 (2003).
- Gittenberger-de Groot, A. C., Vrancken Peeters, M. P., Bergwerff, M., Mentink, M. M., Poelmann, R. E. Epicardial outgrowth inhibition leads to compensatory mesothelial outflow tract collar and abnormal cardiac septation and coronary formation. Circ Res. 87, 969-971 (2000).
- Lavine, K. J., et al. Endocardial and epicardial derived FGF signals regulate myocardial proliferation and differentiation in vivo. Dev Cell. 8, 85-95 (2005).
- Merki, E., et al. Epicardial retinoid X receptor alpha is required for myocardial growth and coronary artery formation. Proc Natl Acad Sci U S A. 102, 18455-18460 (2005).
- Stuckmann, I., Evans, S., Lassar, A. B. Erythropoietin and retinoic acid, secreted from the epicardium, are required for cardiac myocyte proliferation. Dev Biol. 255, 334-349 (2003).
- Huang, G. N., et al. C/EBP transcription factors mediate epicardial activation during heart development and injury. Science. 338, 1599-1603 (2012).
- Zhou, B., et al. Adult mouse epicardium modulates myocardial injury by secreting paracrine factors. J Clin Invest. 121, 1894-1904 (2011).
- Christoffels, V. M., et al. Tbx18 and the fate of epicardial progenitors. Nature. 458, 8-9 (2009).
- Rudat, C., Kispert, A. Wt1 and epicardial fate mapping. Circ Res. 111, 165-169 (2012).
- Duim, S. N., Kurakula, K., Goumans, M. J., Kruithof, B. P. Cardiac endothelial cells express Wilms' tumor-1: Wt1 expression in the developing, adult and infarcted heart. J Mol Cell Cardiol. 81, 127-135 (2015).
- Iyer, D., et al. Robust derivation of epicardium and its differentiated smooth muscle cell progeny from human pluripotent stem cells. Development. 142, 1528-1541 (2015).
- Witty, A. D., et al. Generation of the epicardial lineage from human pluripotent stem cells. Nat Biotechnol. 32, 1026-1035 (2014).



