Summary
يتم عرض المقارنة والاستفادة المثلى من اثنين من أساليب التخصيب دنا النبات العضوي: الطرد المركزي التفاضلي التقليدي وتجزئة من غنا الكلي على أساس حالة مثيلة. نقوم بتقييم كمية الحمض النووي الناتجة والجودة، وإظهار الأداء في قراءة قصيرة الجيل القادم التسلسل، ومناقشة إمكانات للاستخدام في قراءة طويلة تسلسل جزيء واحد.
Abstract
يحتوي الجينوم العضوي النباتي على عناصر كبيرة ومتكررة قد تخضع لعملية الاقتران أو إعادة التركيب لتشكيل هياكل معقدة و / أو شظايا دون الجينومية. توجد جينومات أورغانيلار أيضا في خلطات داخل خلية أو نوع معين من الأنسجة (هيتيروبلاسمي)، وقد تتغير وفرة الأنواع الفرعية في جميع مراحل التنمية أو عندما تكون تحت الضغط (التحول شبه المتكافئ). مطلوب الجيل التالي من تقنيات التسلسل (نغس) للحصول على فهم أعمق لهيكل الجينوم العضوي وظيفة. تستخدم دراسات التسلسل التقليدية عدة طرق للحصول على الحمض النووي العضوي: (1) إذا تم استخدام كمية كبيرة من الأنسجة بدءا، فمن المتجانسة وتعرض الطرد المركزي التفاضلي و / أو تنقية التدرج. (2) إذا تم استخدام كمية أقل من الأنسجة ( أي إذا كانت البذور أو المواد أو الفضاء محدودة)، يتم تنفيذ نفس العملية كما هو الحال في (1)، تليها تضخيم الجينوم كله للحصول على الحمض النووي كافية. (3) التحليل المعلوماتية الحيوية يمكن استخدامها ليقوموبالتالي الحمض النووي الجيني الكلي وتحليل قراءات أورغانيلار. كل هذه الأساليب لها تحديات ومواقف متأصلة. في (1)، قد يكون من الصعب الحصول على كمية كبيرة من الأنسجة بدءا. في (2)، يمكن أن تضخيم الجينوم كله إدخال التحيز التسلسل. وفي (3)، يمكن التماثل بين الجينوم النووية والعضلية التداخل مع التجمع والتحليل. في النباتات ذات الجينومات النووية الكبيرة، من المفيد إثراء الحمض النووي للعضلات للحد من تكاليف التسلسل وتعقيد تسلسل لتحليلات المعلوماتية الحيوية. هنا، قارنا طريقة الطرد المركزي التفاضلية التقليدية مع الطريقة الرابعة، نهج كبغ الميثيل المنسدلة تكييفها، لفصل الحمض النووي الجيني الكلي إلى الكسور النووية والعضلات. كلا الطرازين تعطي الحمض النووي كافية ل نغس، الحمض النووي التي هي المخصب للغاية لتسلسل أورغانيلار، وإن كان بنسب مختلفة في الميتوكوندريا والبلاستيك الكلور. نقدم الأمثل لهذه الأساليب لنسيج أوراق القمح ومناقشة المزايا الرئيسية و دوعيوب كل نهج في سياق مدخلات العينة، وسهولة البروتوكول، وتطبيق المصب.
Introduction
تسلسل الجينوم هو أداة قوية لتشريح الأساس الجيني الكامن وراء الصفات النباتية الهامة. تركز معظم الدراسات التسلسل الجينوم على محتوى الجينوم النووي، حيث أن غالبية الجينات تقع في النواة. ومع ذلك، فإن الجينوم العضوي، بما في ذلك الميتوكوندريا (عبر حقيقيات النوى) والبلاستيدات (في النباتات، والشكل المتخصص، والكلوروبلاست، ويعمل في عملية التمثيل الضوئي) يسهم معلومات وراثية هامة ضرورية لتنمية الكائنات الحية، والاستجابة للضغط، واللياقة البدنية العامة 1 . وعادة ما يتم تضمين جينومات أورغانيلار في الاستخراج الكلي للحمض النووي المقصود لتسلسل الجينوم النووي، على الرغم من أن أساليب للحد من عدد العضيات قبل استخراج الحمض النووي تستخدم أيضا 2 . وقد استخدمت العديد من الدراسات نتائج التسلسل من مجموع الاستخراج غنا لتجميع جينوم أورغانيلار 3 ، 4 ، 5 ،كريف "> 6 ، 7. ومع ذلك، عندما يكون الهدف من الدراسة هو التركيز على الجينوم العضلي، وذلك باستخدام مجموع غنا يزيد من تكاليف التسلسل لأن العديد من يقرأ" فقدت "تسلسل الحمض النووي النووي، وخاصة في النباتات ذات الجينوم النووية الكبيرة ، وعلاوة على ذلك، نظرا للازدواجية ونقل تسلسل الكيس العضلي في الجينوم النووي وبين العضيات، وحل موقف رسم الخرائط الصحيح من تسلسل يقرأ إلى الجينوم الصحيح هو بيوانفورماتيكالي تحدي 2 ، 8. تنقية جينوم عضوي من الجينوم النووي هو واحد استراتيجية للحد من هذه المشاكل.ويمكن استخدام مزيد من الاستراتيجيات المعلوماتية الحيوية لفصل يقرأ تلك الخريطة إلى مناطق التماثل بين الميتوكوندريا والكلوروبلاست.
في حين أن الجينوم العضوي من العديد من الأنواع النباتية قد تم تسلسلها، لا يعرف إلا القليل عن اتساع تنوع جينوم عضويالمتاحة في مجموعات البرية أو في تربية تربية المزارع. ومن المعروف أيضا جينومات أورغانيلار أن تكون الجزيئات الحيوية التي تخضع لإعادة ترتيب هيكلية كبيرة بسبب إعادة التركيب بين تسلسل تكرار 9 . وعلاوة على ذلك، يتم تضمين نسخ متعددة من الجينوم العضلي داخل كل عضلة، وترد عضيات متعددة داخل كل خلية. ليس كل نسخ هذه الجينوم متطابقة، والتي تعرف باسم هيتيروبلاسمي. على النقيض من الصورة الكنسي "الدوائر الرئيسية"، هناك الآن أدلة متزايدة على صورة أكثر تعقيدا من الهياكل الجينوم العضوي، بما في ذلك الدوائر شبه الجينومية، الكروموسومات الخطية، الخطية كونكاتامرس، والهياكل المتفرعة 10 . وتجدر الإشارة إلى أن تجميع الجينوم العضوي النباتي يزداد تعقيدا بسبب أحجامها الكبيرة نسبيا وتكرارها المقلوب والمباشر الكبير.
البروتوكولات التقليدية لعزل العضل، وتنقية الحمض النووي، والجنوم اللاحقة e التسلسل غالبا ما تكون مرهقة وتتطلب كميات كبيرة من إدخال الأنسجة، مع عدة غرامات إلى ما يزيد عن مئات غرام من الأنسجة ورقة الشباب اللازمة كنقطة انطلاق 11 ، 12 ، 13 ، 14 ، 15 ، 16 ، 17 . وهذا يجعل التسلسل الجينوم العضوي لا يمكن الوصول إليها عندما الأنسجة محدودة. في بعض الحالات، تكون كميات البذور محدودة، مثل عندما يكون ذلك ضروريا للتسلسل على أساس الأجيال أو في الخطوط العقيمة الذكرية التي يجب الحفاظ عليها عبر المعبر. في هذه الحالات، يمكن تنقيته الحمض النووي العضلي ثم تعرض لتضخيم الجينوم كله. ومع ذلك، يمكن أن تضخيم الجينوم كله إدخال التحيز تسلسل كبير، وهو مشكلة خاصة عند تقييم التباين الهيكلي، والهياكل شبه الجينومية، ومستويات هيتيروبلاسمي> 18. وقد ساهمت التطورات الحديثة في إعداد المكتبة للتكنولوجيات التسلسلية القصيرة القراءة في التغلب على الحواجز ذات المدخلات المنخفضة لتجنب تضخيم الجينوم بأكمله. على سبيل المثال، مجموعة إعداد مكتبة إلومينا نكستيرا شت تسمح بأقل من 1 نانوغرام من الحمض النووي لاستخدامها كمدخل 19 . ومع ذلك، فإن الاستعدادات القياسية للمكتبات لتطبيقات تسلسل قراءة طويلة، مثل تقنيات تسلسل باكبيو أو أكسفورد نانوبور، لا تزال تتطلب كمية عالية نسبيا من الحمض النووي المدخلات، والتي يمكن أن تشكل تحديا لتسلسل الجينوم العضوي. في الآونة الأخيرة، تم تطوير بروتوكولات تسلسل جديدة طويلة الصنع الصنع وقراءة طويلة للحد من كميات المدخلات والمساعدة في تسهيل تسلسل الجينوم في العينات حيث الحصول على كميات ميكروغرام من الحمض النووي صعب 20 ، 21 . ومع ذلك، لا يزال الحصول على الوزن الجزيئي عالية، الكسور العضوي النقي لتغذية هذه الاستعدادات مكتبة تحديا.
سعينا رo مقارنة وتحسين التخصيب الحمض النووي العضلي وطرق العزل مناسبة ل نغس دون الحاجة إلى تضخيم الجينوم كله. على وجه التحديد، كان هدفنا هو تحديد أفضل الممارسات لإثراء الحمض النووي العضلي عالي الوزن الجزيئي من مواد البدء المحدودة، مثل عينة فرعية من ورقة. يقدم هذا العمل تحليلا مقارنا لأساليب إثراء الحمض النووي العضوي: (1) تعديل، بروتوكول الطرد المركزي التفاضلي المعدل مقابل (2) بروتوكول تجزئة الحمض النووي على أساس استخدام دنا المتاحة تجاريا كبغ الميثيل ملزم نهج سحب البروتين المجال 22 تطبق على الأنسجة النباتية 23 . نوصي أفضل الممارسات لعزل الحمض النووي العضوي من الأنسجة ورقة القمح، والتي يمكن أن تمتد بسهولة إلى النباتات وأنواع الأنسجة الأخرى.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. جيل من المواد النباتية لعزل أورغانيلار واستخراج الحمض النووي
- النمو القياسي لشتلات القمح
- بذور النبات في الفيرميكوليت في الأواني الصغيرة، مربع مع 4 - 6 بذور لكل ركن. نقل إلى الدفيئة أو غرفة النمو مع دورة ضوء 16 ساعة، 23 ºC يوم / 18 ºC ليلة.
- المياه النباتات كل يوم. تسميد النباتات مع ¼ ملعقة صغيرة من الحبيبية 20-20-20 الأسمدة نيك عند الإنبات وفي 7 أيام بعد الإنبات.
- البدائل البديلة لشتلات القمح
- اتبع الخطوة 1.1، ولكن وضع الأواني في غرفة النمو المظلمة، 23 درجة مئوية لمدة 16 ساعة / 18 درجة مئوية لمدة 8 ساعات. بدلا من ذلك، تغطية النباتات في الاحتباس الحراري (على سبيل المثال، مع حاوية التخزين، ومع ذلك، يجب الحفاظ على التهوية المناسبة).
- النمو وجمع الأنسجة
- تنمو النباتات لمدة 12-14 أيام. بالنسبة لمعظم النمط الوراثي للقمحs، 75 - 100 الشتلات تنتج حوالي 10 - 12 غرام من الأنسجة، وهو ما يكفي لاستخراج اثنين من الخلايا العضلية باستخدام طريقة الطرد المركزي التفاضلية (القسم 2). مصنع واحد فقط هو ضروري إذا كان استخدام نهج الحمض النووي كبغ القائم على مثيلة القائم على مثيلة لكسر عضوي من الحمض النووي النووي (القسم 3).
- إذا كان استخدام نهج الطرد المركزي التفاضلي، وجمع الأنسجة الطازجة والمضي قدما على الفور لمعالجة العينات، كما هو موضح في القسم 2.
- إذا كان استخدام نهج كبغ ميثيل المنسدلة، وحصاد 20 ملغ أقسام من الأنسجة ورقة الشباب إلى أنابيب ميكروسنتريفوج (استخدام إما نمت القياسية أو الأنسجة المعتادة، انظر ممثل النتائج ). تجميد المفاجئة على النيتروجين السائل وتجميد في -80 درجة مئوية حتى الاستخدام. انتقل إلى تجزئة الدنا، كما هو موضح في القسم 3.
2. الطريقة رقم 1: استخراج الحمض النووي باستخدام الطرد المركزي التفاضلي (دس)
ملاحظة: الفرقتم تعديل بروتوكول الطرد المركزي إرجنتي من منشورين أن الظروف الأمثل لعزل كل من العضيات ولكن إثراء للميتوكوندريا 17 ، 24 . والبروتوكول الناتج أقل استهلاكا للوقت ويستخدم عددا أقل من المواد الكيميائية السامة مقارنة بالطرق السابقة. على وجه التحديد، أجرينا تعديلات على المخازن المؤقتة وغسل الخطوات، بما في ذلك إضافة البولي فينيل بيروليدون (بب) إلى العازلة استخراج ستي والقضاء على الخطوة غسل النهائي في نيتف العازلة، والذي يحتوي على فلوريد الصوديوم (ناف).
الحذر: إعداد واستخدام العازلة ستي ينبغي أن يؤديها تحت غطاء الدخان الكيميائية مع معدات الحماية الشخصية المناسبة، وهذا المخزن المؤقت يحتوي على 2-ميركابتويثانول (بمي).
- أشياء يجب القيام بها قبل البدء
- تأكد من أن جميع المعدات نظيفة للغاية، وأوتوكلاف أي المعدات التي يمكن تعقيمها (على سبيل المثال، طحن اسطوانات، عالية السرعة سنتريأنابيب فوج، الخ ).
ملاحظة: ينصح نصائح تصفية لجميع الخطوات التي تتطلب بيبتينغ لتجنب انتقال التلوث. - انظر قائمة المعدات والكواشف المطلوبة وإعداد المخازن المؤقتة ومخزونات العمل المطلوبة للطريقة رقم 1 ( الجدول 1 ). برد كتل طحن المبردة إلى -20 درجة مئوية والدوار ومخازن إلى 4 درجة مئوية، تعيين ميكروسنتريفوج إلى 4 درجة مئوية، وتشغيل حمام المياه 37 ºC.
- تأكد من أن جميع المعدات نظيفة للغاية، وأوتوكلاف أي المعدات التي يمكن تعقيمها (على سبيل المثال، طحن اسطوانات، عالية السرعة سنتريأنابيب فوج، الخ ).
- عزل العضيات
- حصاد 5 غرام من الأنسجة الطازجة وشطفه في الماء البارد والمعقم في كوب بارد على الجليد.
ملاحظة: احتفظ دائما بالعينات على الجليد أثناء جميع العمليات وعمليات النقل من وإلى أجهزة الطرد المركزي، وأغطية الدخان، الخ. بدلا من ذلك، العمل في غرفة باردة إذا كان هناك الوصول إلى مساحة كافية والمعدات لتنفيذ البروتوكول. - باستخدام مقص، وقطع الأنسجة الورقية إلى ~ 1 سم قطعة مباشرة إلى أنبوب 50 مل تحتوي على اثنين من طحن السيراميكاسطوانات.
ملاحظة: تنظيف أو تغيير مقص بين العينات لتجنب التلوث المتبادل. - إذا لم يكن هناك الخالط الأنسجة، واستخدام هاون ومدقة واتبع لتحل محل الخطوات 2.2.4 - 2.2.9.
- قطع الأنسجة ورقة إلى هاون قبل المبردة على الجليد. طحن العينات لمدة 2 - 3 دقائق في 15 مل من ستي (في غطاء الدخان).
- صب قبالة العازلة (ترك الأنسجة في هاون) من خلال قمع تحتوي على طبقة واحدة من قبل الرطب، القماش الترشيح العقيمة (~ 22- إلى 25 ميكرون حجم المسام؛ انظر البروتوكول الرئيسي لمزيد من التفاصيل) إلى أنبوب 50 مل آخر . إضافة 10 مل إضافية من ستي إلى هاون ومدقة والتجانس مرة أخرى.
- صب الأنسجة المتجانسة والعازلة في نفس القمع. شطف هاون ومدقة مع 10 مل من ستي وتصب في قمع. قم بضغط قطعة القماش في القمع واستخراجها قدر المستطاع.
ملاحظة: تغيير قفازات بين العينات لتجنب التلوث المتبادل. مواصلة مع المواليةتوكول في الخطوة 2.2.10.
- إضافة 20 مل من ستي (في غطاء الدخان) لكل أنبوب 50 مل.
- وضع العينات في كتل طحن المبردة قبل المبردة في جهاز طحن الأنسجة وطحن العينات لمدة 2 × 30 ثانية في 1750 دورة في الدقيقة. تدوير المواقع عينة ووضع العينات على الجليد لمدة ~ 1 دقيقة بين طحن.
ملاحظة: هاون ومدقة، خلاط، أو غيرها من الأنسجة طحن / التجانس الجهاز يمكن استخدامها في هذه الخطوة. ومع ذلك، فإن كل طريقة تؤثر على جودة الحمض النووي الناتجة لدرجات مختلفة، وبالتالي يجب تقييم طول الحمض النووي والجودة قبل الاستمرار مع التطبيقات المصب. - إدراج قمع في أنبوب نظيفة 50 مل وضعت في الجليد. وضع طبقة واحدة من القماش الترشيح في قمع وقبل الرطب مع 5 مل من ستي. لا تتجاهل تدفق من خلال.
- صب الأنسجة المتجانسة في قمع. شطف أنبوب طحن مع 15 مل من ستي، خلاصة وعكس الأنبوب لشطف الجدران والغطاء، وتصب في فونايل
- إزالة بعناية من الحجارة السيراميك ثم الضغط والخروج من القماش الترشيح في قمع.
ملاحظة: تغيير قفازات بين العينات لتجنب التلوث المتبادل. - التفاف قبعات أنبوب مع بارافيلم لتجنب تسرب. أجهزة الطرد المركزي في 2000 x ج لمدة 10 دقيقة في 4 درجة مئوية.
- نضح بعناية طاف باستخدام ماصة المصلية (تجنب إزعاج بيليه) ووضعه في 50 مل عالية السرعة أنبوب الطرد المركزي (إذا لم يكن لديك أنابيب حشوات ختم ضيق، والتفاف قبعات أنبوب مع بارافيلم لتجنب تسرب). تجاهل الكريات.
- توازن الأنابيب إلى داخل 0.1 غرام باستخدام ستي والطرد المركزي الناتجة طاف لمدة 20 دقيقة في 18،000 x ج و 4 درجة مئوية. لتحقيق التوازن بين الأنابيب، ووضع كوب صغير من الجليد على التوازن، الفارغة الحجم، وتزن العينات على الجليد للحفاظ على البرد. بدلا من ذلك، استخدم ميزان وغطاء الدخان في غرفة باردة.
- تجاهل طاف. إضافة 1 مل من ست إلى بيليه وإعادة تعليق بلطف لناأداة تعريف إنجليزية غير معروفة، خشن، بينتبروش. إضافة 24 مل من ست (الحجم النهائي من 25 مل) ومزيج / دوامة ( أي، اضغط على فرشاة الطلاء على جانب الأنبوب لإزالة جميع السائل).
- توازن الأنابيب إلى داخل 0.1 غرام باستخدام ست. أجهزة الطرد المركزي لمدة 20 دقيقة في 18،000 x ج و 4 درجة مئوية. وفي الوقت نفسه، وإعداد حل دنازي (انظر الجدول 1 للأسهم وحل وصفات العمل). لكل عينة، وجعل واحد 200 قسامة ميكرولتر في أنبوب 1.5 مل.
- تجاهل طاف، وصمة عار الأنبوب، وإعادة تعليق بيليه (لا يزال في أنبوب الطرد المركزي عالية السرعة) في 300 ميكرولتر من ست باستخدام فرشاة الطلاء لينة. وضع فرشاة الطلاء في أنبوب 1.5 مل أعدت مسبقا تحتوي على 200 ميكرولتر من محلول دنازي ودوامة فرشاة الطلاء لإزالة أي بيليه المتبقية عالقة في الفرشاة. ماصة الحل دنازي مرة أخرى في أنبوب الطرد المركزي عالية السرعة ودوامة بلطف لخلط.
- احتضان عند 37 درجة مئوية لمدة 30 دقيقة في حمام مائي (التفاف بارافيلم حول الجزء العلوي من أنبوب لمنع تسرب التكثيفز في الغطاء). مزيج بلطف عن طريق تحوم 2 مرات خلال الحضانة.
- ماصة بلطف خليط بيليه من الأنبوب باستخدام طرف ماصة مع فتحة واسعة ووضعه في أنبوب منخفض ربط 1.5 مل. إضافة 500 ميكرولتر من 400 ملي إدتا، ودرجة الحموضة 8.0، إلى أنبوب الطرد المركزي عالية السرعة وماصة بلطف للحصول على كل من بيليه المتبقية من الأنبوب. نقل إدتا لنفس 1.5 مل، وانخفاض ربط أنبوب كما خليط بيليه ومزيج بلطف عن طريق انقلاب.
- أجهزة الطرد المركزي في 18،000 x ج لمدة 20 دقيقة في 4 درجة مئوية. تجاهل طاف، وصمة عار الأنبوب، واستخدامها مرة واحدة لعزل الحمض النووي. إذا لزم الأمر، وتجميد الكريات في -20 درجة مئوية، ولكن هذا قد يؤدي إلى انخفاض العائد، كما دنازي المتبقية قد تتحلل من الحمض النووي العينة إذا لم يتم معالجتها على الفور.
- حصاد 5 غرام من الأنسجة الطازجة وشطفه في الماء البارد والمعقم في كوب بارد على الجليد.
- استخراج الحمض النووي من عضيات معزولة باستخدام نهج قائم على العمود التجاري
ملاحظة: انظر كتيب كيت للبروتوكول الكامل 25 ، ونرى أدناه لإجراء تعديلات. العلاقات العامةويعود مباشرة من العزلة العضلية إلى استخراج الحمض النووي. والتجميد المتكرر والذوبان يقلل من الأحجام الحمض النووي جزء ويؤدي إلى تدهور الحمض النووي من قبل دنازي المتبقية. الحد فورتيكسينغ أو بيبتينغ قوية، وهذا يمكن قص الحمض النووي. ويوصى باستخدام أنابيب ميكروسنتريفوج منخفضة ربط لتعظيم الانتعاش الحمض النووي.- إجراء استخراج الحمض النووي
ملاحظة: قراءة بروتوكول تجاري مفصل 25 قبل البدء في التأكد من أن المخازن المؤقتة يتم بشكل صحيح / تخزين وأن يتم فهم إجراءات عمود الدوران.- إضافة 180 ميكرولتر من العازلة أتل مباشرة في أنبوب مع بيليه (إذابة إذا تجمد سابقا ومعايرة إلى درجة حرارة الغرفة على مقاعد البدلاء).
- المضي قدما مع الخطوة 3 في بروتوكول "تنقية الحمض النووي من الأنسجة" في كتيب عدة، مع التعديلات التالية: تحلل 30 دقيقة في الخطوة 3، وتشمل اختياري ريبونوكلياز الهضم، وأزل في 3 × 200 ميكرولتر من إ كل في سيأنبوب باريت ومن ثم الجمع بين إلوتيونس).
- حفظ قسامة (20 ميكرولتر على الأقل) ل قر (انظر الخطوة 4.1). لتحديد كمية قبل التركيز، حفظ إضافية 1 ميكرولتر لقياس حساسية عالية.
- إذا رغبت في ذلك، المضي قدما مع تركيز العينة.
- إجراء استخراج الحمض النووي
- تركيز العينة مع وحدات تصفية التجارية
ملاحظة: انظر البروتوكول التجاري 26 لمزيد من التفاصيل. اعتمادا على استخدام المصب، قد لا يكون من الضروري لأداء تركيز العينة (على سبيل المثال، لتطبيقات نهاية نقطة ير و قر). ومع ذلك، لبناء مكتبة نغس، فإنه من المرجح أن يكون من الضروري تركيز الحمض النووي العضلي المخفف تم الحصول عليها بعد استخراج الحمض النووي.- إجراء عمود التركيز
- بعناية قبل وزن (انظر الجدول 2 ) وحدة تصفية فارغة (بدون أنبوب) على قطعة نظيفة من وزنها ورقة على التوازن التحليلي الرقمي. سجل الوزن.
- متزمتبيت إلوتيونس مجتمعة في وحدة التصفية وتزن بعناية مرة أخرى.
ملاحظة: يقول الدليل التجاري 26 أن وحدة تصفية الحد الأقصى لحجم 500 ميكرولتر، ولكن ما يصل إلى 575 ميكرولتر يمكن أن تضاف إلى وحدة في وقت واحد مع عدم وجود تجاوز. - وضع بعناية وحدة تصفية شغل في أنبوب (المقدمة مع الأعمدة). أجهزة الطرد المركزي في 500 x ج الوقت المطلوب لتحقيق حجم التركيز المطلوب. لعينة حجم من ~ 575 ميكرولتر، و 20 دقيقة تدور عادة ما يؤدي إلى تركيز حجم 15-30 ميكرولتر.
- إزالة وحدة التصفية من الأنبوب وتزن مرة أخرى. استخدام الجدول لتحديد ما إذا كان قد تم تحقيق حجم التركيز المطلوب. إن لم يكن، أجهزة الطرد المركزي مرة أخرى في 500 x ج لمدة أقصر من الوقت وتزن مرة أخرى؛ كرر حتى يتم التوصل إلى حجم التركيز المطلوب.
- وضع أنبوب جديد (المقدمة مع الأعمدة) على الجزء العلوي من وحدة التصفية وعكس. أجهزة الطرد المركزي لمدة 3 دقائق في 1000 x ج لنقل الشركةنسنترات إلى الأنبوب.
- تحديد حجم استردادها. وهذا عادة ما يكون ~ 3 - 5 ميكرولتر أقل من حجم المحسوبة، بسبب الاحتفاظ فلتر. إذا الإفراط في التركيز، تمييع مع الماء المعقم أو تي لتحقيق الحجم المطلوب.
- تحديد الحمض النووي باستخدام قياس حساسية عالية (لكل تعليمات الشركة المصنعة).
- إجراء عمود التركيز
3. الأسلوب رقم 2: ميثيل-تجزئة (مف) نهج لإثراء للحمض النووي العضوي من الحمض النووي الجيني الكلي
ملاحظة: تم تعديل هذا البروتوكول من بروتوكول استخراج الحمض النووي كيت مجموعة الحمض النووي جينوميوم المستخدم للنباتات والفطريات 27 والبروتوكول ميكروبيوم الدنا كيت التخصيب التجاري 28 . من الناحية النظرية، أي بروتوكول عزل الحمض النووي الذي ينتج الحمض النووي عالية الوزن الجزيئي يمكن أن تستخدم لسحب. وبالنسبة للتسلسل القصير القراءة، فإن أي استخراج ينتج في الغالب أكثر من 15 كيلو بايت شظايا كافية للاستخدام في السحب. لوNG- قراءة التسلسل، شظايا أكبر قد يكون مرغوبا فيه. لذلك، نحن الأمثل هذا البروتوكول لانتاج الحمض النووي عالية الوزن الجزيئي.
- عزل الحمض النووي الكلي
ملاحظة: انظر قائمة المعدات والكواشف المطلوبة وإعداد المخازن المؤقتة ومخزونات العمل المطلوبة للطريقة رقم 2 ( الجدول 1 ). إضافة الإنزيمات ليسينغ إلى المخزن المؤقت تحلل لجعل الحل تحلل العازلة العمل. بدوره على ثيرموميكسر وتعيينه إلى 37 درجة مئوية. بدوره على حمام الماء إلى 50 درجة مئوية ووضع العازلة قف في الحمام. وضع إتوه 70٪ في الثلاجة وتعيين ميكروسنتريفوج إلى 4 درجات مئوية.- مجموع استخراج الحمض النووي باستخدام أعمدة استخراج الحمض النووي التجارية
ملاحظة: قبل البدء، اقرأ الكتيب التجاري 29 للحصول على معلومات مفصلة حول استخدام الأعمدة أنيون تبادل الصرف الجاذبية. قد يتم إعداد الأعمدة باستخدام رف متخصص أو موضوعة فوق الأنابيب باستخدام حلقات بلاستيكية مقدمة. جميع الخطوات، بما في ذلك زيجب أن يسمح لها بالمضي قدما عن طريق تدفق الجاذبية، وينبغي أن لا تضطر السائل المتبقية من خلال.- طحن 20 ملغ من الأنسجة المجمدة في النيتروجين السائل في أنبوب منخفض ربط 2 مل باستخدام بيستليس طحن باليد مصممة للأنابيب 2 مل.
- إضافة 2 مل من تحلل العازلة حل العمل (الأنابيب سوف تكون كاملة جدا).
- احتضان في ثيرموميكسر في 37 درجة مئوية لمدة 1 ساعة مع التحريض لطيف في 300 دورة في الدقيقة. إذا كان ثيرموميكسر غير متوفر، احتضان على كتلة الحرارة والاختلاط عن طريق عبها لطيف كل 15 دقيقة هو بديل مناسب.
- إضافة 4 ميكرولتر من ريبونوكلياز (100 ملغ / مل، تركيز النهائي من 200 ميكروغرام / مل). عكس لخلط واحتضان في ثيرموميكسر لمدة 30 دقيقة عند 37 درجة مئوية، مع التحريض لطيف في 300 دورة في الدقيقة.
- إضافة 80 ميكرولتر من بروتين K (20 ملغ / مل، تركيز النهائي من 0.8 ملغ / مل)، عكس لخلط، واحتضان في ثيرموميكسر لمدة 2 ساعة عند 50 درجة مئوية، مع التحريض لطيف في 300 دورة في الدقيقة.
- أجهزة الطرد المركزي لمدة 20 دقيقة في 4 درجات مئوية و 15000 زغ لبيليه الحطام غير قابلة للذوبان.
- في حين أن العينات هي الطرد المركزي، موازنة الأعمدة مع 1 مل من العازلة كبت والسماح للعمود لتفريغ عن طريق تدفق الجاذبية.
- استخدام واسعة-- تتحمل غيض ماصة لتطبيق فورا العينة (تجنب بيليه) إلى عمود معاير والسماح لها تدفق كامل من خلال العمود. إذا أصبحت العينة غائمة، مرشح أو الطرد المركزي مرة أخرى قبل تطبيق على العمود (انظر الكتيب التجاري لمزيد من التفاصيل 29 ).
- مرة واحدة وقد دخلت العينة بالكامل الراتنج، وغسل العمود مع 4 × 1 مل من عازلة ق.
- تعليق العمود على نظيفة، 2 مل، وانخفاض ربط أنبوب ميكروسنتريفوج. أزل الحمض النووي الجيني مع 0.8 مل من العازلة قف بريوارمد في 50 درجة مئوية.
- يعجل الحمض النووي بإضافة 0.56 مل (0.7 مجلدات من العازلة شطف) من الأيزوبروبانول درجة حرارة الغرفة إلى الحمض النووي إلوتد.
- مزيج عن طريق انقلاب (10X) وأجهزة الطرد المركزي على الفور لمدة 20 دقيقة في 15،000 x ج و 4 درجة مئوية. رعايةتماما إزالة طاف دون إزعاج الزجاجي، المرفقة فضفاضة بيليه.
- غسل بيليه دنا الطرد المركزي مع 1 مل من الإيثانول البارد 70٪. أجهزة الطرد المركزي لمدة 10 دقيقة في 15،000 زغ و 4 درجات مئوية.
- إزالة بعناية طاف (كن حذرا مع هذه الخطوة كذلك) دون إزعاج بيليه. الهواء الجاف لمدة 5-10 دقيقة و ريسوسبيند الحمض النووي في 0.1 مل من العازلة شطف (إب). حل الحمض النووي بين عشية وضحاها في درجة حرارة الغرفة. تجنب بيبتينغ، والتي قد القص الحمض النووي.
- قياس العينات باستخدام عالية الحساسية الحمض النووي فحص الكمي (لكل تعليمات الشركة المصنعة).
- مجموع استخراج الحمض النووي باستخدام أعمدة استخراج الحمض النووي التجارية
- تجزئة مستندة إلى حبة من الحمض النووي ميثليته و أونميثيلاتد
ملاحظة: أظهر منشور صدر مؤخرا استخدام مجموعة متوفرة تجاريا 28 التي تستفيد من نهج المنسدلة باستخدام كبغ محددة النطاق الميثيل ملزمة المجال البروتين تنصهر إلى الإنسان مفتش فك جزء (MBD2-فك البروتين) إلى جزء(ونميثيلاتد) من محتوى الجينوم النووي (المميثلي للغاية) 23 . لم يتم اختبار كفاءة التجزئة في عينات القمح سابقا باستخدام هذه المجموعة من الأدوات التجارية التجارية 28 .- أشياء يجب القيام بها قبل البدء
- إعداد طازجة 80٪ من الإيثانول (800 ميكرولتر على الأقل لكل رد فعل). تعيين 5x ربط / غسل العازلة للذوبان الجليد على الجليد وإعداد 5 مل من العازلة 1X لكل عينة (تمييع 5X العازلة مع العقيمة، نوكليس خالية من المياه والحفاظ على الجليد خلال البروتوكول).
- إعداد MBD2-فك البروتين ملزمة الخرز المغناطيسي
- إعداد العدد المطلوب من مجموعات حبة. مقياس ردود الفعل للاستخدام بين 1 و 2 ميكروغرام من إجمالي الحمض النووي المدخلات، التي تتطلب 160 - 320 ميكرولتر من الخرز. لاحظ أن ردود الفعل المذكورة أدناه هي ل 1 ميكروغرام من إجمالي الحمض النووي المدخلات، لذلك فإنها تتطلب 160 ميكرولتر من الخرز. مقياس ردود الفعل وفقا للاحتياجات.
- باستخدام نصائح واسعة تتحمل، ماصة بلطف البروتين A المغناطيسي Bإيد الطين صعودا وهبوطا لإنشاء تعليق متجانس. كبديل، وتدوير بلطف أنبوب من الخرز لمدة 15 دقيقة في 4 درجات مئوية.
ملاحظة: لا دوامة الخرز. - تابع الإرشادات وفقا لتعليمات المصنع 28 .
- التقاط الحمض النووي النووي ميثليته
- لكل عينة على حدة، إضافة 1 ميكروغرام من الحمض النووي المدخلات إلى أنبوب يحتوي على 160 ميكرولتر من الخرز المغناطيسي MBD2-فك.
- إضافة 5X ربط / غسل العازلة حسب الاقتضاء نظرا لحجم عينة المدخلات الحمض النووي للتركيز النهائي من 1X (حجم 5X ربط / غسل العازلة لإضافة (ميكرولتر) = حجم المدخلات الحمض النووي (ميكرولتر) / 4). ماصة العينة صعودا وهبوطا عدة مرات لخلط باستخدام واسعة-- تتحمل طرف ماصة.
- تدوير الأنابيب في درجة حرارة الغرفة لمدة 15 دقيقة. ماصة بلطف العينات مع طرف ماصة تتحمل واسعة ونفض الغبار العينات 2-3 مرات في جميع أنحاء الحضانة لمنع حبة التثاقل.
ملاحظة: بيبتينغ وفليكينغ أمر بالغ الأهمية لضمان سحب فعالة من الحمض النووي ميثليته.
- جمع المخصب، ونميثيلاتد الحمض النووي العضلي
- تدور لفترة وجيزة الأنبوب الذي يحتوي على الحمض النووي و MBD2-فك ملزمة خليط حبة المغناطيسي. وضع أنبوب على الرف المغناطيسي لمدة لا تقل عن 5 دقائق لجمع الخرز إلى جانب الأنبوب. يجب أن يظهر الحل واضح.
- باستخدام واسعة-- تتحمل نصائح، إزالة بعناية طاف مسح دون إزعاج الخرز. نقل طاف (يحتوي أونميثيلاتد، الدنا المخصب العضوي) إلى نظيفة، وانخفاض ربط، أنبوب ميكروسنتريفوج 2 مل. تخزين هذه العينة في -20 أو -80 درجة مئوية، أو المضي قدما مباشرة إلى الخطوة 3.2.6 لتنقية.
- ألقي القبض على الحمض النووي النووي من الخرز المغناطيسي MBD2-فك
- إذا كان المطلوب أيضا جزء نووي، اتبع تعليمات الشركة المصنعة 28 لاستئصال الحمض النووي النووي من الخرز المغناطيسي MBD2-فك. تنقية كما هو موضح في الخطوة 3.2.7.
- حبة الحمض النووي تنقية
- تأكد من أن الخرز تنقية في درجة حرارة الغرفة ويتم خلطها بدقة. تابع البروتوكول وفقا للتعليمات الواردة في دليل مجموعة مف 28 .
ملاحظة: يمكن الآن أن تستخدم العينة لبناء مكتبة نغس أو تحليل المصب آخر.
- تأكد من أن الخرز تنقية في درجة حرارة الغرفة ويتم خلطها بدقة. تابع البروتوكول وفقا للتعليمات الواردة في دليل مجموعة مف 28 .
4. عينة الكمي ومراقبة الجودة
- قر فحص لتقييم تخصيب العضل
ملاحظة: تم تصميم رد فعل قر ومعلمات الفحص المدرجة هنا للاستخدام على روش ليتسيكلر 480، وربما تحتاج إلى تعديل لمختلف المعدات والكواشف. إذا قر غير متوفر، يمكن استخدام ير نقطة نهاية والتصور على هلام الاغاروز كمقياس نوعي من نقاء العينة، وذلك باستخدام نفس الاشعال والشروط الموصوفة هنا. أحجام أمبليكون سيكون ~ 150 نقطة أساس لجميع مجموعات التمهيدي. انظر الجدول 3 لترتيب التمهيديسيس و بيرينغس.- قر رد فعل الإعداد
- لإعداد الفردية 20 ميكرولتر رد فعل قر، ماصة بعناية ما يلي في بئر واحدة من لوحة قر 96 جيدا: 10 ميكرولتر من 2X سيبر الأخضر أنا سيد. 2 ميكرولتر من 10 ميكرومتر إلى الأمام وعكس التمهيدي مزيج (للتركيز النهائي من 0.5 ميكرومتر). 2 ميكرولتر من قالب (ضمن مجموعة من منحنى القياسية). و 6 ميكرولتر من العقيمة، نوكليس خالية H 2 O. للحد من الأخطاء بيبتينغ، فمن الأفضل لجعل مزيج الرئيسي مع جميع مكونات رد الفعل باستثناء القالب. إضافة مزيج الرئيسي إلى لوحة قر ومن ثم إضافة قالب من الفائدة لكل بئر. يجب إجراء ثلاث مكررات تقنية لكل عينة للتقليل إلى أدنى حد من آثار الخطأ بيبتينغ.
ملاحظة: في نهاية المطاف، يتم مقارنة نسبة النووي إلى دورات القياس الكمي العضوي بين العينات، لذلك الاختلافات الطفيفة في تركيز مقبولة. ومع ذلك، يجب أن تكون تركيزات الحمض النووي تقريبا داخل نطاق إيتش أخرى. - ختم لوحة مع عالية الجودة قر ختم الفيلم. دوامة بلطف العينات، مع الحرص على تجنب إنشاء أي فقاعات. تدور لفترة وجيزة لوحة أسفل لمدة 2 دقيقة في 4 درجات مئوية لجمع العينة والقضاء على أي فقاعات صغيرة.
- تحميل لوحة في الجهاز. قم بتشغيل برنامج قر وفقا للإرشادات المدرجة أدناه.
- لإعداد الفردية 20 ميكرولتر رد فعل قر، ماصة بعناية ما يلي في بئر واحدة من لوحة قر 96 جيدا: 10 ميكرولتر من 2X سيبر الأخضر أنا سيد. 2 ميكرولتر من 10 ميكرومتر إلى الأمام وعكس التمهيدي مزيج (للتركيز النهائي من 0.5 ميكرومتر). 2 ميكرولتر من قالب (ضمن مجموعة من منحنى القياسية). و 6 ميكرولتر من العقيمة، نوكليس خالية H 2 O. للحد من الأخطاء بيبتينغ، فمن الأفضل لجعل مزيج الرئيسي مع جميع مكونات رد الفعل باستثناء القالب. إضافة مزيج الرئيسي إلى لوحة قر ومن ثم إضافة قالب من الفائدة لكل بئر. يجب إجراء ثلاث مكررات تقنية لكل عينة للتقليل إلى أدنى حد من آثار الخطأ بيبتينغ.
- قر معلمات رد الفعل
ملاحظة: هذه هي المعلمات الافتراضية، باستثناء دورة الصلب لمرحلة التضخيم. ضبط هذا الإعداد لاستيعاب الاشعال محددة إذا كانت تلك المستخدمة تختلف عن الاشعال المعروضة في هذا البروتوكول.- قبل احتضان عند 95 درجة مئوية لمدة 5 دقائق، مع معدل منحدر من 4.4 درجة مئوية / ثانية.
- أداء 45 دورات التضخيم من (1) 95 درجة مئوية لمدة 10 ثانية، مع معدل منحدر من 4.4 درجة مئوية / ثانية. (2) 60 درجة مئوية لمدة 20 ثانية، مع معدل منحدر من 2.2 درجة مئوية / ثانية؛ و (3) 72 درجة مئوية لمدة 10 ثوان، مع معدل منحدر 4.4 درجة مئوية / ثانية (البيانات المكتسبة خلال (3)).
- استخدام أوبتيونال تذوب دورة منحنى 95 درجة مئوية لمدة 5 ثوانى، مع معدل منحدر 4.4 درجة مئوية / ثانية؛ 65 درجة مئوية لمدة 1 دقيقة، مع معدل منحدر من 2.2 درجة مئوية / ثانية؛ و 97 درجة مئوية، مع وضع الاستحواذ المستمر.
- استخدام دورة التبريد من 40 درجة مئوية لمدة 30 ثانية، مع معدل منحدر من 1.5 درجة مئوية / ثانية.
- معايير الفحص
- حدد قالب سيبر. تحقق من معلمات البرنامج في زر التجربة. مرة واحدة يتم تحميل لوحة، يمكن أن تبدأ الفحص، ويمكن ضبط الإعدادات أثناء الفحص قيد التشغيل.
- تعيين عينات باستخدام محرر نموذج. حدد عبس كوانت كما سير العمل وتعيين العينات كما غير معروف، والمعايير، أو الضوابط السلبية. تعيين النسخ المتماثل وملء أسماء عينة من الأول من كل تكرار. إضافة تركيزات ووحدات إلى المعايير.
- إعداد مجموعات فرعية للتحليل؛ يتم تعيين هذه في محرر مجموعة فرعية.
- للتحليل، حدد عبس كوانت / 2 مشتق ماكس من قائمة "إنشاء تحليل جديد".استيراد منحنى القياسية حفظها خارجيا (إن وجدت) ومن ثم ضرب حساب. سيحتوي التقرير على المعلومات المختارة.
- ولإجراء قياس دقيق مطلق لتحديد عدد النسخ أو تركيزها، استخدم منحنيا قياسيا يمثل العينة التي يجري اختبارها ( مثل الحمض النووي العضوي المعزول عن الأساليب المذكورة أعلاه). منذ كمية من الحمض النووي الميتوكوندريا المطلوبة لإعداد منحنى القياسية مرتفعة جدا لتحقيقها مع كمية معقولة من الأنسجة، لا تستخدم نسخ عدد النسخ التي يقدمها البرنامج، ولكن بدلا من ذلك فحص نقاط العبور (كب) القيم لتحديد الإثراء النسبي من أورغانيلار بالمقارنة مع الحمض النووي النووي في العينات. قارن هذه المبالغ النسبية لتلك التي من الحمض النووي الجيني الكلي (انظر ممثل النتائج ). اختبار كفاءة التمهيدي على خمس التخفيفات 1:10 من الحمض النووي الجيني الكلي من شتلات القمح التي نمت بشكل كامل، والتي تبلغ من العمر أسبوعين،ه أسطورة من الشكل 2 ).
- قر رد فعل الإعداد
- نابض المجال الكهربائي هلام (بفج)
ملاحظة: ويستند هذا البروتوكول على المبادئ التوجيهية المصنعة لأداء بفج لحل ارتفاع الحمض النووي الوزن الجزيئي. انظر جدول المواد.- إعداد الجل والعينات
- اتبع الإرشادات الخاصة بالهلام وإعداد العينات وتكييفها مع النظام المتاح.
- تشغيل المعلمات
- اتبع المبادئ التوجيهية لإعداد نظام الكهربائي واستخدام المعلمات التالية: وقت التبديل الأولي من 2 ثانية، وقت التبديل النهائي من 13 ثانية، تشغيل الوقت من 15 ساعة و 16 دقيقة، V / سم من 6، وشملت زاوية 120 درجة .
- وصمة عار وصورة هلام
- وصمة عار هلام مع صبغ الاختيار (على سبيل المثال، بروميد إثيديوم أو بديل مناسب) والصورة مع نظام التوثيق هلام مناسبة.
- إعداد الجل والعينات
- استخدام 1 نانوجرام من الحمض النووي كمدخلات لمجموعة دنا مكتبة الإعدادية، وفقا لتعليمات الشركة الصانعة.
- الباركود وبركة عينات للتسلسل في تشغيل واحد. أداء التسلسل وفقا للمبادئ التوجيهية الشركة المصنعة.
ملاحظة: يمكن تغيير معلمات التجميع والتسلسل تبعا لنوع الاهتمام، ومستوى التغطية المطلوب، والمنصة المستخدمة لتسلسل المكتبات. على سبيل المثال، حارة هيس لديها مخرجات أكثر بكثير من حلبة ميسق، لذلك العديد من العينات يمكن مضاعفة. تسلسل مجموعة فرعية أصغر من العينات لتحديد ما إذا كانت مستويات التغطية من جينوم عضوي كافية لتحليل المصب.- فحص جودة القراءة باستخدام فاستق 31 لتحديد مدى التشذيب والتصفية المطلوبة للبيانات.
- تقليم وتصفية يقرأ الخام باستخدام تريمموماتيك 32 أو برنامج آخر مماثل. استخدم الإعدادات التالية: إلوميناكليب 2:30:10 (لإزالة المحولات)، ليدينغ 3، ترايلينغ 3، سليدينغويندو 4:10، و مينلين 100.
- قم بتعيين نهاية المزاوجة التي تمت تصفيتها و المقلدة بنقطة المحول (بي) إلى الميتوكوندريا الربيعية الصينية (تسلسل مرجع نسبي NC_007579.1 33 )، و كلوروبلاست (نسبي المرجع المرجعي NC_002762.1 34 )، و الجينوم المرجعي النووي 35 باستخدام Bowtie2 36 ، مع الإعدادات التالية: -I 0 -X 800 - حساس.
- تحويل ملفات محاذاة سام إلى تنسيق بام (سامتولس) وفرز ملفات بام. استخدام ملفات بام لحساب التغطية على نطاق الجينوم والتغطية لكل قاعدة مع بيدتولز. تصور النتائج مع وظيفة R- مؤامرة.
- أشياء يجب القيام بها قبل البدء
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
البروتوكولات الواردة في هذه المخطوطة تصف طريقتين متميزتين لإثراء الحمض النووي العضوي من الأنسجة النباتية. وتعكس الشروط المعروضة هنا التحسين لأنسجة القمح. يتم وصف مقارنة بين الخطوات الرئيسية في البروتوكولات، والمدخلات الأنسجة المطلوبة، وإخراج الحمض النووي في الشكل 1 . خطوات بروتوكول دس اختبرنا اتباع ظروف مماثلة لتلك المذكورة سابقا ( الشكل 1A ). يجب معالجة الأنسجة المحصودة بشكل طازج وتعريضها للطرد المركزي التفاضلي و / أو التدرجات لعزل أورغانيلس سليمة. يتم القضاء على الحمض النووي النووي قبل العضلات هي ليسد، وأخيرا، يتم استخراج الحمض النووي واستخدامها لتطبيقات المصب. في المقابل، في بروتوكول مف، يمكن حصاد الأنسجة النباتية وتخزينها قبل الاستخدام، ولا يلزم العضيات سليمة. بدلا من ذلك، يتم تجزئة الحمض النووي النووي وعضوي من مجموع غنا على أساس وضع مثيلة من الحمض النووي. كلا بروتوكولات تنتج كميات متساوية تقريبا من الحمض النووي العضلي ( الشكل 1C ). من حيث إجمالي الناتج الحمض النووي العضلي بالنسبة لإدخال الأنسجة، وبروتوكول مف مفيد عندما الأنسجة محدودة، كما يمكن استخدام عينة صغيرة من مصنع واحد، ويمكن أن يسمح للنبات أن ينمو لمزيد من التحليل. عادة، في بروتوكولات دس، مطلوب جميع الأنسجة الهوائية من العديد من الشتلات، ويتم تجاهل هذه النباتات. ومع ذلك، فإن طريقة دس يمكن أن يكون الأمثل لإثراء على وجه التحديد لنوع واحد عضوي على الآخر، وهو أمر غير ممكن مع نهج مف. ومن الجدير بالذكر أن الوقت الإجمالي لكل بروتوكول هو ما يعادل تقريبا، على الرغم من أن هناك أقل التدريب العملي على الوقت في نهج مف.
كلا الأسلوبين إثراء للحمض النووي أورغانيلار، وإن كان مع نسب مختلفة من الميتوكوندريا وسلاسل بلاستيد:
"> يتم الحصول على كميات قليلة جدا من الحمض النووي العضوي النقي من أي طريقة (على الترتيب من ~ 50-100 نانوغرام؛ الشكل 1C ) لتقييم مستويات تخصيب الجينوم العضوي والتلوث الجينوم النووي في الحمض النووي معزولة عن كل من دس و مف تم استخدام مقايسة قر في هذا الفحص، وفرة النسبية من ثلاثة أمبليكونس ( أي النووية محددة، أكتين ، الميتوكوندريا محددة، NAD3 ؛ و كلوروبلاست محددة، بسب ) في الحمض النووي الجيني الكلي، وتم الحصول على جزء الحمض النووي العضلي من كلا الطريقتين ( الشكل 2 ). تم فحص قيم الكمي (C q ) لكل عينة ( الشكل 2A )، ولأن C q تعرف على أنها دورة ير حيث مضان من التضخيم الهدف يزيد فوق مستوى مضان الخلفية، C ف وفرة الهدف لديها علاقة عكسية. فيالعينة العاصمة، C ف من NAD3 وPSBB، على التوالي، في وقت سابق ~ 17 و 15 ~ دورات من الأكتين (التي لديها ف C من ~ 36) (انظر الشكل 2B للقيم س C ومستويات التخصيب). وهذا يعادل النظرية 167،181- و 47،790 أضعاف التخصيب ل NAD3 و بسب ، على التوالي، نسبة إلى أكتين في عينة العاصمة ( الشكل 2B ، انظر أسطورة الشكل 2 لحساب). في مجموع عينة الحمض النووي الجيني، وإثراء طية ل NAD3 و بسب نسبة إلى أكتين هي فقط 158 و 10،701، على التوالي. ليس من المستغرب أن تجد وفرة أعلى من أمبليكونس العضلي بالنسبة للأمبليكون النووي في الحمض النووي الجيني الكلي، بالنظر إلى أن الجينوم العضلي موجودة في أعداد أكبر نسخة في الخلية من الجينوم النووي 37 وأن عدد العضيات بيR قد تختلف تبعا لنوع الأنسجة أو المرحلة التنموية 38 ، 39 . عموما، تشير البيانات إلى أن طريقة دس تفضي تفضيلي للميتوكوندريا، وهو أمر متوقع، وسرعة الطرد المركزي هي الأمثل لعزل انتقائي الميتوكوندريا والحد من التلوث النووي والكلوروبلاست ".يظهر جزء ونميثيلاتد من غفنا الكلي مف أيضا إثراء كبير من كل من أمبليكونس أورغانيلار ومن المتوقع أن يحتفظ الكميات النسبية الأصلية من هذه الأهداف. التخصيب طية ل NAD3 و بسب نسبة إلى أكتين في جزء ونميثيلاتد هي 20،551 و 1،703،253، على التوالي ( الشكل 2A و 2 B ). في جزء ميثليته، وإثراء طية ل NAD3 و بسب نسبة إلى أكتين هي 31 و 823، على التوالي، إنديمشيرا إلى أن البروتين MBD2-فك هو كفاءة عالية في سحب من الحمض النووي النووي ميثليته. كما amplicon بلاستيدات الخضراء لديه وفرة أعلى من amplicon الميتوكوندريا في مجموع الحمض النووي الجيني (~ 6 C ف سابقا)، جزء الميثيلي (~ 5 C ف سابقا)، وجزء unmethylated (~ 6 C ف سابقا) عينات، وهذا يشير إلى أن وفرة الأم من هذه أمبليكونس لا تتغير بشكل كبير من قبل MDB2 المنسدلة. ونحن نركز هنا على أونميثيلاتد (أورغانيلار) جزء بسبب الاهتمام في تسلسل هذه الجينوم على وجه التحديد. ومع ذلك، إذا كان الجينوم النووي هو الفائدة الرئيسية، فإن مف والتسلسل اللاحق للجزء ميثليته سيؤدي إلى تغطية أعلى بكثير من الجينوم النووي من تسلسل الحمض النووي الجيني الكلي، وذلك بسبب انخفاض في دنا "التلوث".
ومن الجدير بالذكر أنه إذا قر غير متوفر، نهاية نقطة ير (باستخدام نفس الاشعال كما ل قر) يوفر كواليتاتقييم النقاء من عضوي. في هذه الحالة، سوف عينات الحمض النووي العضلي النقي تظهر التضخيم لل أمبليكونس الميتوكوندريا والبلاستيد، ولكن لا تضخيم كشفها من أمبليكون النووية على هلام الاغاروز، في حين يظهر الحمض النووي الجيني الكلي التضخيم لجميع مجموعات التمهيدي الثلاثة، كما هو موضح في الدراسات السابقة 11 ، 12 -
أورغانيلار الحمض النووي معزولة من كلا الأسلوبين هو مناسبة ل نغس:
تم تعيين تسلسل بي المقطوعة والمنقحة (انظر الخطوة 4.3) إلى الجينوم المرجعي للقمح العضوي المنشور سابقا، وتراوحت كمية القراءات المستخدمة لرسم الخرائط لكل عينة من 800،000 إلى 1100،000 قراءة ( الشكل 3I ). النتائج من رسم الخرائط دي نوفو تسلسل إلومينا يقرأ إلى كلوروبلاست القمح المتاحة والميتوكوندريا الجينومات تتفق مع قر قر( الشكل 3A و 3 B ، ~ 80٪ و ~ 10٪ من يقرأ خريطة للميتوكوندريا (طن متري) والكلوروبلاست (كب) الجينوم، على التوالي) وطريقة مف مما يعطي الحمض النووي الذي يعكس على الأرجح وفرة الأصلي من الجينوم العضلي اثنين ( أرقام 3A و 3 B ، ~ 20٪ و ~ 80٪ من يقرأ خريطة لالجينوم مت و كب جينوم، على التوالي). في كلا الطريقتين، والتغطية النظرية (انظر أسطورة الشكل 3 لحساب) من كل من الجينوم أورغانيلار القمح يتجاوز 100X التغطية (وتتراوح ما يصل إلى ~ 2000X تغطية لجينوم كلوروبلاست في جزء ونميثيلاتد من طريقة مف)، حتى عندما يتم مضاعفة 12 مكتبة ( الشكل 3C و 3D ؛ تم تجميع 6 مكتبات المدرجة في هذا التحليل مع 6 مكتبات إضافية لتحليل منفصل، لما مجموعه 12 المكتباتمجمعة في حارة تسلسل واحد). وقد تم الحصول على عرض أكثر تفصيلا للتغطية من خلال فحص جزء من الجينوم مغطاة في أعماق محددة، وكذلك في مستويات التغطية لكل قاعدة ( الشكل 3E -3I ). وبالنسبة لطريقة الموجات الهكتومترية (مف)، كان متوسط التغطية لكل قاعدة 300 ~ 450X لجينوم الطن المتري و 4000 - 5،000X لجينوم كب. بالنسبة لطريقة دس، كان متوسط التغطية لكل قاعدة 900 ~ 1،300 و ~ 500 - 700X ل جينوم مت و كب، على التوالي. ومع ذلك، كان هناك جزء صغير من كل من الجينوم مت و كب الجينوم التي كانت منخفضة للغاية أو تغطية عالية، وهذا كان ينظر في الحمض النووي العضوي المستمدة من أي من الأسلوبين ( الشكل 3I ). أما المناطق ذات التغطية الأعلى من المتوسط فهي على الأرجح تتوافق مع مناطق التماثل بين الجينوم العضوي، والأقاليم ذات التغطية المنخفضة قد تشير إلى تعدد الأشكال أو المتغيرات الصغيرة الأخرى بين الأصناف التي تتسلسلها والمراجع المنشورة. دعما لهذه الفكرة، هذه المساميرمن التغطية العالية كانت أكثر وضوحا للحمض النووي طن متري مشتقة من طريقة مف ( أرقام 3E و 3 I )، ويرجع ذلك على الأرجح إلى التغطية العالية من الجينوم كب في هذه الطريقة. غير المبررة، وتغطية الجينوم كب هي أكثر تفاوتا في طريقة مف من طريقة العاصمة ( الشكل 3g و 3 H )، والتي يمكن أن تكون بسبب التحيز طفيف في MBD2-فك المنسدلة على طول الحمض النووي كب. سوف تكون هناك حاجة لمزيد من التجارب لتحديد لماذا هذا هو الحال. وبغض النظر عن ذلك، كان الجينوم مت و كب الجينوم تغطية نسبيا نسبيا مع كل من الطرق ولا مناطق واسعة من التغطية المفقودة، والتي يمكن أن يتضح من فحص جزء من الجينوم تسلسل في عمق معين ( الشكل 3E -3H ). بالإضافة إلى ذلك، تعتبر مستويات التغطية لكل من الجينوم كافية لتحليل المصب، مثل تحليل المتغيرات. إذا اعتبر ذلك ضروريا لتحليل المتغيرات النادرة، والحد من خدرمن العينات المجمعة سيحقق تغطية أكبر. بدلا من ذلك، قد يتم تجميع عدد أكبر بكثير من العينات على حارة هيسق، مع تحقيق المزيد من عمق تسلسل، وإن كان في التضحية إلى طول تسلسل، والمكتبات هيسق محدودة حاليا في طول PE150 على النقيض من المكتبات PE300 ميسك.
لفحص مستويات تلوث الجينوم النووي باستخدام نهج رسم الخرائط، تم فحص الفئات بي قراءة الخرائط. بي يقرأ يمكن رسم خريطة الجينوم في مجموعة متنوعة من التكوينات. عندما يقرأ 1 و 2 محاذاة إلى المرجع في الأزياء رأسا لرأس، مع مسافة معينة "المتوقعة" بين اثنين من الاصحاب (على أساس متوسط حجم إدراج المكتبة وعادة ما يتم تحديدها كمعلمة الإدخال في برنامج رسم الخرائط )، ويقال هذه بي يقرأ لرسم خريطة "كونكوردانتلي". وعلى النقيض من ذلك، فإن رسم الخرائط "المتناقضة" هو الوضع الذي يضع فيه زملائه خريطة ديس أقل من المتوقعتانس إلى الجينوم المرجعي أو الخريطة في تكوينات بديلة (من الرأس إلى الذيل أو الذيل إلى الذيل). إذا كان زميل واحد فقط محاذاة إلى الجينوم المرجعي، ثم يقال أن قراءة بي لرسم لا متفق أو متنازع على الجينوم المرجعي. في جميع الفئات الثلاث قراءة الخرائط، بي يقرأ يمكن محاذاة إلى الجينوم إشارة واحدة أو عدة مرات.
بالنسبة لكل من الحمض النووي للعضلات المعزولة و DC- و مف، كانت قراءة الخرائط لجينوم الميتوكوندريا في الغالب في الطبقة المتناغمة بشكل متناغم ( الشكل 4A )، في حين يقرأ يقابل إلى الجينوم كلوروبلاست في نسب متساوية نسبيا من متفق مرة واحدة وبطريقة متقاربة أكثر من مرة واحدة ( الشكل 4B )، ويرجع ذلك على الأرجح إلى تكرار مقلوب كبير موجود في جينوم كلوروبلاست وأيضا إلى مستويات التغطية عالية للغاية. ومع ذلك، عدد أقل من بي يقرأ تعيينها إلى الجينوم النووي وتعيينها إلى حد كبير أكثر من مرة واحدة فيلا مطابقة أو أزياء متعارضة ( أي زميل واحد فقط هو قادر على الخريطة). هذه هي الأكثر احتمالا رسم الخرائط "خارج الهدف" إلى تسلسل في الجينوم النووي، والتي هي متماثلة للجينوم العضوي أو المناطق المفقودة. فقط كمية صغيرة من يقرأ (<5٪) تعيينها إلى الجينوم النووي بشكل متفق، مشيرا إلى مستويات منخفضة من التلوث الجينوم النووي في الحمض النووي العضوي معزولة عن طريقة دس أو مف ( الشكل 4C )، كما ينعكس أيضا من نتائج قر ( الشكل 2A ). تم أيضا تسلسل الجزء النووي بعد MBD2-فك المنسدلة من الربيع الصيني الأنسجة غير متحرك لتحديد مدى كفاءة الانسحاب هو في إزالة الحمض النووي ونميثيلاتد. أقل من 1٪ من يقرأ في المكتبة المستمدة من جزء نووي مقسمة إلى جينومات مرجعية عضوية، في حين أن 45٪ من جميع يقرأ تعيينها إلى الجينوم النووي ( الشكل 4 ). ومع ذلك، فإن معظم يقرأ تعيين بطريقة متناغمة، ثعلى الأرجح يعكس مستويات عالية من سوء التفكيك والتجزؤ في الجينوم المرجعي النووي القمح. وبصرف النظر عن ذلك، تشير النتائج إلى أن الانسحاب MBD2-فك هو كفاءة عالية في إزالة الحمض النووي العضلي ونميثيلاتد من الحمض النووي النووي ميثليته. ومن الجدير بالذكر أنه لأن الحمض النووي التخصيب العضوي الناجم عن هذه الأساليب يحتوي على مزيج من الميتوكوندريا وسلاسل كلوروبلاست، ولأن التشابهات التسلسل الناتجة عن نقل الجينات القديمة بين هذه العضيات تبقى في الجينوم، والتعيين المناسب للقراءة إلى محددة الجينومات يجب أن تحل بيوانفورماتيكالي.
انبعاث الأنسجة ورقة لا يغير بشكل كبير وفرة أورغانيل:
تقليديا، يفضل أن الأنسجة المحورة لعزل الحمض النووي الميتوكوندريا النبات من أجل خفض مستويات الفينول والنشا، والتي قد تتداخل مع استخراجn أو التطبيقات المصب 13 . ولتحديد ما إذا كان يمكن تغيير مستويات إثراء الجينوم العضوي أو تحسينها من خلال ظروف النمو، تعرضت كل من الأنسجة المقيدة وغير المحورة لبروتوكول مف والتسلسل. ومن المثير للاهتمام، إتيولاتيون لم يغير بشكل ملحوظ نسبة من يقرأ التي تم تعيينها إلى الجينوم المرجعية أورغانيلار ( أرقام 3A و 3 B ) أو تغطية لكل قاعدة ( الشكل 3I ) مقارنة مع ظروف غير متحررة. نحن أيضا عزل الحمض النووي الخلايا العضلية باستخدام الطرد المركزي التفاضلي، مع كل من الأنسجة إتيولاتد وغير المحرقة، وتم العثور على اختلاف بسيط في تخصيب اليورانيوم بين الأنسجة المختلفة باستخدام قر (لا تظهر البيانات). هذا يشير إلى أن الأنسجة ذات الصلة غير ذات الصلة أكثر من الناحية الفسيولوجية يمكن استخدامها لدراسات تسلسل أورغانيلار، مع عدم وجود تغيير ملموس في تخصيب اليورانيوم.
مراقبة الجودة يقترح ذلكمف الحمض النووي هو الأكثر مناسبة للتسلسل قراءة طويلة:
كما يصبح تسلسل قراءة طويلة يصبح أكثر سهولة للباحثين، وعزل الحمض النووي عالية الوزن الجزيئي أصبحت ذات أهمية متزايدة. لتقييم الحمض النووي العضلي معزولة مع أي من طريقة لنعومة والجودة، وقد تم توظيف بفج. مجموع الحمض النووي الجيني يهاجر عادة كما تشويه منتشر في بفغ، ويتم تحديد الوزن الجزيئي من قبل البروتوكول وكيف تم تخزين الحمض النووي والتعامل معها بعد الاستخراج. يجب أن يتجاوز الحمض النووي الجيني الكلي معزولة مع نصائح الجينومية 50 كيلو بايت، والتي تم التحقق منها باستخدام بفج ( الشكل 5 ، حارة 2). يتم استخدام الحمض النووي الجيني الكلي من النصائح الجينومية كمدخلات في مجموعة التخصيب ميكروبيوم لكسر النووية من الحمض النووي العضوي. الجزء النووي التي تم الحصول عليها بعد تجزئة لا تنخفض في الحجم، ولكن لا تزال تتمحور حول 50 كيلوبايت ( الشكل 5 ، حارة 4). هذا ليس سو، بالنظر إلى أن معالجة أكثر صرامة نسبيا للجزء النووي كما شطف من الخرز MBD2-فك ملزمة يتطلب الحرارة والبروتين K الهضم. ونظرا للكتلة المحدودة، لم يتم تشغيل جزء الكائن العضلي على بفغ، ولكن التحليل اللاحق مع تابستاتيون أشار الحمض النووي> 50 كيلوبايت (لا تظهر البيانات). الحمض النووي العضلي التي تم الحصول عليها مع الطرد المركزي التفاضلي لديها كتلة متوسطة من ~ 20 كيلو بايت، على الأرجح الناجمة عن بروتوكول العزلة العضلية الموسعة واستخراج الحمض النووي المستندة إلى العمود اللاحقة والتركيز. يمكن عزل العزلة العضلية المستندة إلى التدرج وأساليب استخراج الحمض النووي البديلة الحفاظ على أحجام أكبر جزء الحمض النووي. بغض النظر، الحمض النووي من حجم الحصول عليها في هذا البروتوكول يمكن استخدامها لتوليد 10- أو 15 كب تسلسل يقرأ إذا تم أخذ الرعاية أثناء إعداد المكتبة.
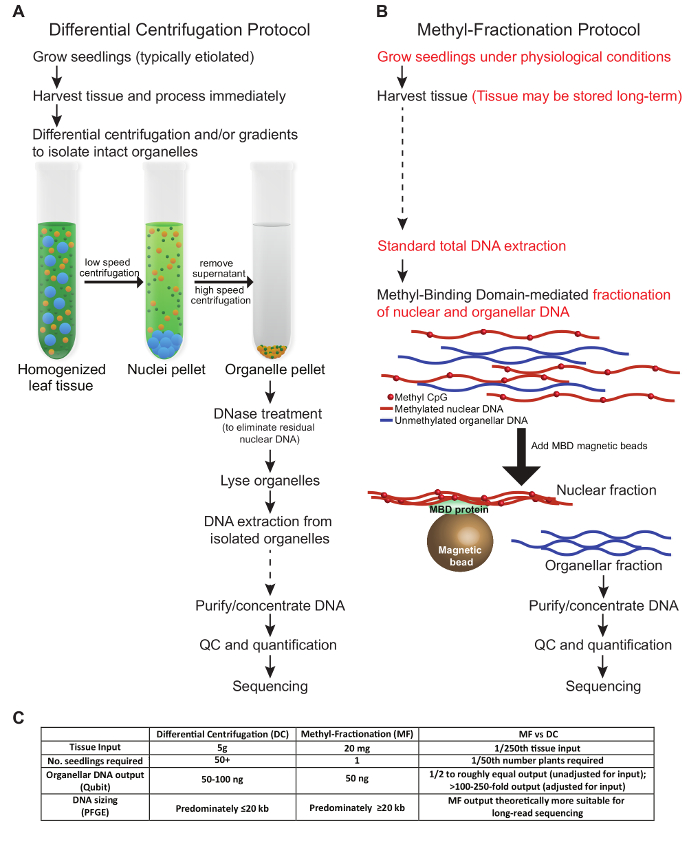
الشكل 1: عرض مقارن لميثو اثنيندس لإثراء ل دنا النبات أورغانيلار. ويتناقض بروتوكول دس التقليدي ( A ) مع بروتوكول الموجات الهكتومترية ( B ). فمن المستحسن لتجنب تجميد ذوبان العينات؛ ومع ذلك، يتم الإشارة إلى الخطوات التي يمكن تخزين العينات على المدى الطويل مع الأسهم المتقطعة ( A و B ). يتم تمييز الاختلافات الرئيسية بين البروتوكولات باللون الأحمر ( B ). ( C ) يقارن الجدول الطرق من حيث إدخال الأنسجة، وعدد من النباتات المطلوبة، خرج الحمض النووي، وحجم الحمض النووي الناتجة. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تقييم تلوث الحمض النووي النووي في الدنا الحبيبي المعزولة باستخدام طريقتين. (
( B ) ويبين الجدول القيم C ف ، والتي تظهر على الرسم البياني في ( A )، وإثراء طية من أمبليكونس الكونلي العضوي نسبة إلى أكتين . * طية تخصيب = 2 (سك أكتين - سك الهدف) . الصيغة يفترض كفاءة مثالية من 2 لكل مجموعة التمهيدي، منذ ديفيات قاصرأيون من كل مجموعة التمهيدي من 2 لا يكاد يذكر وسيكون له تأثير يذكر على الحساب والاتجاه العام ( أكتين = 1.961، NAD3 = 1.95، و بسب = 1.989 ). تم تقييم الكفاءات التمهيدي من خلال جعل منحنى القياسية مع سلسلة من خمس التخفيفات 1:10 من الحمض النووي الجيني الكلي. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: قراءة الخرائط والتغطية النظرية للكلوروبلاست والميتوكوندريا الجينومات. النسبة المئوية للقراءات التي تم تعيينها إلى الميتوكوندريا ( A ) أو كلوروبلاست ( B ) الجينوم المرجعي الربيع الصيني. المقابلة التغطية النظرية للميتوكوندريا الربيع الصيني ( C ) أو كلوروبلاست ( D ) الجين المرجعيميس، على افتراض أحجام الجينوم من 450 و 135 كيلو بايت، على التوالي، محسوبة باستخدام مجموع قراءة الأرقام ونسبة من يقرأ رسم الخرائط لمختلف الجينومات. توزيع الجينوم على نطاق واسع لتغطية الحمض النووي العضوي من طريقة مف ( E و G ) أو طريقة العاصمة ( F و H ). البيانات في لوحات E - H هو من عينة الربيع الصينية المحرقة، ولكن أظهرت جميع العينات الأخرى اتجاها مماثلا. ( I ) متوسط، أدنى، وأعلى تغطية لكل قاعدة لجميع العينات في لوحات A - D. تسميات العينات بما في ذلك عينات "E" تعيين إتيولاتد، و "ن" يعين عينات غير إتيولاتد. دس يشير إلى الحمض النووي معزولة مع طريقة الطرد المركزي التفاضلية و أونميثيلاتد يشير إلى الحمض النووي الذي هو في جزء ونميثيلاتد بعد الانسحاب مع MBD2-فك (بروتوكول مف). عينات المسمى "كريس" تعيين القمح تريتيكوم استيفوم"كريس". كس يعين عينات من القمح تريتيكوم استيفوم "الربيع الصيني. ملاحظة: بسبب تسلسل التماثل بين كلوروبلاست، الميتوكوندريا، والجينومات النووية الناتجة عن نقل الجينات القديمة بين جينوم عضوي، وكذلك بين الجينوم العضوي والنووي، نسبة صغيرة من القراءات الخام قد خريطة لعدة جينومات. وبالإضافة إلى ذلك، يقرأ أن لا ترسم إما الجينوم مرجعي عضوي غير ممثلة في هذا الرقم. وبالتالي، فإن النسب المعروضة هنا ( A و B ) لا مجموع 100٪. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: رسم بي للقراءة على الجينوم النووي القمح. النسبة المئوية لفئات بي قراءة أنواع الخرائط إلى الميتوكوندريا (A) ، كلوروبلاست (B) ، أو النووية (C) الجينوم إشارة الربيع الصيني. - E يعين عينات مقيسة و - ن يعين عينات غير متحرك. دس يشير إلى الحمض النووي معزولة مع طريقة الطرد المركزي التفاضلي، ونميثيلاتد يشير إلى الحمض النووي الذي هو في جزء ونميثيلاتد بعد الانسحاب مع MBD2-فك في بروتوكول مف، والمميثيل يعين الجزء النووي بعد MBD2-فك الانسحاب. عينات المسمى "كريس" تعيين القمح تريتيكوم استيفوم "كريس". كس يعين عينات من القمح تريتيكوم استيفوم "الربيع الصيني." لا يتم عرض قراءة غير محددة. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
أواد / 55528 / 55528fig5.jpg "/>
الشكل 5: فحص جودة الحمض النووي باستخدام بفج. القمح النووي الحمض النووي الكلي (حارة 2)، والحمض النووي العضوي القمح التي تم الحصول عليها من الطرد المركزي التفاضلي (حارة 3)، والجزء النووي بعد مف مع نهج الانسحاب MBD2-فك (حارة 4) تعرضت ل بفج على هلام الاغاروز 1٪ مع 1 كيلو بايت سلم الموسعة تستخدم علامة (الممرات 1 و 5). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
| اسم المخزن المؤقت | وصفة | ملاحظات | طريقة |
| ستي العازلة | 400 ملي سكروز، 50 ملي تريس الرقم الهيدروجيني 7.8، 20 ملي إدتا درجة الحموضة 8.0، 0.6٪ (ث / ت) بوليفينيلبيروليدون (بب)، 0.2٪ (ث / ت) ألبومين المصل البقري (بسا)، 0.1٪ (v / v) β-ميركابتوثانول (بمي) | مزيج العازلة التي تحتوي على السكروز فقط، تريس، و إدتا يمكن إجراء ما يصل إلى شهر مقدما والاحتفاظ بها في 4 درجات مئوية. بب، بسا، و بمي يجب أن تضاف طازجة إلى قسامة من المبلغ المطلوب من المخزن المؤقت قبل الاستخدام. | طريقة 1 |
| ست العازلة | 400 ملي سكروز، 50 ملي تريس الرقم الهيدروجيني 7.8، 0.6٪ (ث / ت) بوليفينيلبيروليدون (بب)، 0.1٪ (ث / ت) ألبومين المصل البقري (بسا) | مزيج العازلة التي تحتوي على السكروز فقط و تريس يمكن إجراء ما يصل إلى شهر مقدما وأبقى في 4 درجات مئوية. لاحظ أن العازلة ست لا تحتوي على إدتا أو بمي، ويحتوي على تركيز أقل من بسا. | طريقة 1 |
| الأسهم الدناز | 2 مغ / مل الدناز في 0.15 M كلوريد الصوديوم إلى تركيز الأسهم من 2 ملغ / مل | مخزن 200 أول أليكوتس في -20 درجة مئوية. لإعداد الدناز حل العمل (200 ميكرولتر من محلول الدناز لكل عينة) انظرالجدول 1 أدناه. انظر البروتوكول الكامل أدناه للحصول على تفاصيل كاملة من الهضم الدناز. يجب أن يتم إعداد الدناز حل العمل طازجة. لوقف رد فعل الدناز مطلوب 400 ملي إدتا الرقم الهيدروجيني 8.0 الحل (تركيز النهائي اللازمة لوقف رد فعل هو 0.2 M إدتا، انظر بروتوكول كامل لمزيد من التفاصيل). | طريقة 1 |
| الدناز حل العمل | 0.25 ملغ / مل دناز و 20 ملي مغكل 2 في ست العازلة | إعداد الطازجة، 200 أول لكل عينة. التراكيز المعروضة هي لحجم التفاعل النهائي، لذلك خلط: 62.5 ميكرولتر 2 ملغ / مل الدناز (على أساس النهائي 500 ميكرولتر حجم رد الفعل)، 4 ميكرولتر 1M مغكل 2 (على أساس 200 ميكرولتر حجم حل الدناز)، و 133.5 ميكرولتر من العازلة ست ل حجم النهائي من 200 ميكرولتر. | طريقة 1 |
| تحلل العازلة | 20 ملي إدتا الرقم الهيدروجيني 8.0؛ 10 ملي تريس الرقم الهيدروجيني 7.9؛ 500 ملي غوانيدين-هكل؛ 200 ملي كلوريد الصوديوم؛ 1٪ تريتون X-100؛ 0.5 ملغ / مل إنزيمات ليزينغ منتريتشوديرما هارزيانوم | مزيج جميع المكونات باستثناء الإنزيمات ليسينغ وتخزينها في درجة حرارة الغرفة. يجب أن تضاف الإنزيمات ليسينغ طازجة إلى قسامة صغيرة للاستخدام الفوري. | الطريقة الثانية |
الجدول 1: وصفات المخازن المؤقتة محلية الصنع والأسهم العاملة.
| ورقة عمل التركيز | |||||||
| اسم العينة | وزن الجهاز الفارغ (g) | وزن الجهاز معبأ (ز) | ملء حجم (أول، شغل ناقص الأوزان الفارغة) | الوزن بعد 1 تدور (20 دقيقة *، ز) | حجم بعد 1 تدور (أول، شغلناقص الأوزان الفارغة) | الوزن بعد 2 تدور (X دقيقة *، ز) | حجم بعد 2 تدور (أول، شغل ناقص الأوزان الفارغة) |
| لاحظ أن حجم استردادها الفعلي سيكون عدد قليل من أول أقل من حجم المحسوب. | |||||||
الجدول 2: ورقة عمل الترآيز.
| اسم | خصوصية الجينوم | مصدر تسلسل الجينات | تسلسل (5 '- 3') |
| Ta_ACTIN - F | نووي | غرامين سكافولد IWGSC_CSS_1AS_scaff_3272162: 10،663-12،557 | CAGGTATCGCTGACCGTATGA |
| Ta_ACتين - R | نووي | كما في الأعلى | GAAGGTAGGGCTGAACAAGAAAC |
| Ta_NAD3 - F | الميتوكوندريا | انضمام نسبي EU534409.1 | GGTGATGCCAGAAGTCGTTT |
| Ta_NAD3 - R | الميتوكوندريا | كما في الأعلى | CAGATCAATCTTGTTAGGAGGTACTG |
| Ta_PSBB - F | بلاستيدات الخضراء | انضمام نسبي KJ592713.1 | GCTACCTTTGCTTTGCTCTTCT |
| Ta_PSBB - R | بلاستيدات الخضراء | كما في الأعلى | GCTGCCTGTTTCCTTGTAGTT |
الجدول 3: قائمة الاشعال قر.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
حتى الآن، تركز معظم الدراسات التسلسل العضوي على أساليب دس التقليدية لإثراء الحمض النووي المحدد. وقد وصفت طرق لعزل العضيات من النباتات المتنوعة، بما في ذلك الطحلب 40 ؛ مونوكوتس مثل القمح 15 والشوفان 11 ؛ و ديكوتس مثل أرابيدوبسيس 11 ، عباد الشمس 17 ، وبذور اللفت 14 . تركز معظم البروتوكولات على الأنسجة الورقية 13 ، 14 ، 15 ، 16 ، 17 ، مع بعض قد تم تكييفها لمجموعة متنوعة من أنواع الأنسجة، بما في ذلك البذور 11 . وقد ثبت أيضا عزل عضيات من بروتوبلاستس 41 . ومع ذلك، وهذا ليس قابلا لجميع النظم، ولا هو ممكن عندما الأنسجة من الفائدة محدودة. العديد من هذه أورغاتم تصميم طرق عزل نيلار لاستعادة العضيات سليمة لتجارب محددة، مثل الدراسات الفسيولوجية. هذه البروتوكولات هي مرهقة وعادة ما تتطلب استخدام التدرجات الكثافة، مثل السكروز أو التدرجات بيركول، والتي هي فعالة جدا في عزل الكسور العضلية محددة ولكنها تتطلب إدخال الأنسجة الكبيرة ( أي ما يزيد على 5 غرام وأعلى من كيلوغرام، اعتمادا على نوع الأنسجة). ومع ذلك، قد يكون الأمثل طريقة دس لإثراء لكسور الخلوية محددة، مثل الميتوكوندريا أو كلوروبلاست، عن طريق تغيير سرعة الدوران وتدرجات الكثافة. في المقابل، فإن نهج مف يتطلب أقل بكثير المواد انطلاق (20 ملغ)، ولكن الحمض النووي الميتوكوندريا والبلاستيد تكون موجودة في وفرة النسبية في الأنسجة المستخدمة لاستخراج الحمض النووي. ومع ذلك، فإن بروتوكول مف يقدم نهجا بديلا لعزل الحمض النووي العضلي المختلط، وهو مفيد بشكل خاص للبدء مع كميات صغيرة من الأنسجة.
تي س تقييم عينة نقاء التالية العزلة عضية، معظم الدراسات حتى الآن فقط استخدام نهاية نقطة ير وهلام الكهربائي 11 ، 12 . وهذا يعطي مقياس نوعي عادل لنقاء العينة. ومع ذلك، قد لا تصور مستويات منخفضة من التضخيم على هلام الاغاروز. عدد قليل من التقارير تشمل المزيد من التدابير الكمية لمراقبة الجودة، مثل قر 14 . لتقييم كمي لنقاء عينة الحمض النووي معزولة من كلتا الطريقتين، استخدمنا قر والتسلسل لتحديد مدى الحمض النووي النووي لا يزال في العينة، وكذلك النسب النسبية للميتوكوندريا مقابل الحمض النووي الكلوروبلاست. كلا الأسلوبين تقييمها هنا هي فعالة في إزالة الحمض النووي النووي. كلا الطريقتين تنتج مزيجا من الحمض النووي الميتوكوندريا والكلوروبلاست، وإن كان ذلك بنسب مختلفة.
وتفيد التقارير أن النباتات المتنامية في الظلام (إتيولاتيون) تساعد على تسهيل العزلة العضلية بسبب انخفاض الفينولياتريف "> 13. ومع ذلك، في هذه المقارنة، لم نجد ميزة كبيرة للعمل مع الأنسجة المحرف على عينات نمت ضوء على الرغم من أن نسبة الكلوروبلاستات المتخصصة من المرجح أن تكون أعلى عندما نمت ضوء، وعدد بلاستيد الكلي، كما وهو ما يتجلى في نسبة قراءة المقارنات إلى جينوم كلوروبلاست، دون تغيير في ظروف ضوء مختلفة، لذلك، بالنسبة للتحليلات الوظيفية المصب، مثل تقييم هيتيروبلاسمي في الأنسجة المختلفة أو تحت الضغوطات المختلفة أو لتحليل التعبير، نوصي بإجراء تسلسل الجينوم على النباتات التي تزرع تحت ظروف ذات صلة فسيولوجيا.
للتطبيق مع تقنيات التسلسل قراءة قصيرة، وتقارن كل من التقنيات هنا تنتج كمية كافية من الحمض النووي والجودة. ومع ذلك، لتحقيق قراءات طويلة من> 20 كيلوبايت لتطبيقات تسلسل جزيء واحد، وكمية أكبر من الحمض النووي ذات جودة أعلى ضروري. على سبيل المثال، من الناحية المثالية،> 1 ميكروغرام من أورغا نقيةدنا القمح نيلار مع الوزن الجزيئي> 20 كيلو بايت ضروري لبروتوكولات في الداخل، وانخفاض المدخلات ل 20 كب إدراج الاستعدادات مكتبة 42 . وقد تؤدي البروتوكولات الجديدة التي تم تطويرها من قبل المستخدم والمدخلات المنخفضة إلى تقليل متطلبات الحمض النووي ( أي إلى 50 نانوجرام أو أقل 20 )، ولكن يبقى التحدي يتمثل في وجود دنا عالي الجودة وعالي الوزن الجزيئي في الاستعدادات المكتبية. فمن الضروري أن غالبية الحمض النووي هو> 20 كيلوبايت، كما سيتم إدراج شظايا أصغر بشكل تفضيلي في سمرتبيل وإلقاء حجم توزيع المكتبة 43 . حاولنا عددا من بروتوكولات استخراج الحمض النووي محلية الصنع وعدد من البروتوكولات التجارية لاستخراج الحمض النووي (لا يظهر). وبالنسبة لأنسجة أوراق القمح، تم الحصول على أفضل توازن بين كمية الحمض النووي ونوعيته، وخاصة الطول، باستخدام مجموعة تجارية 27 ، 29 . اعتمادا على أنواع النباتات والأنسجة من الفائدة، البديلفي البروتوكولات استخراج قد تكون على قدم المساواة مناسبة أو أكثر مثمرة. ومع ذلك، فإننا نخلص إلى أن الاستخراج الكلي من الحمض النووي الجيني ذات الوزن الجزيئي العالي> 50 كيلوبايت في الحجم، تليها تجزئة مع النهج MDD2-فك المنسدلة 28 ، هو قابل للقراءة طويلة تسلسل من المواد بدءا محدودة. يجب أن يختبر العمل المستقبلي حدود المواد الأولية المطلوبة بعد التجزؤ لإعداد مكتبة طويلة الأمد وتسلسل القراءة اللاحقة. والأهم من ذلك، أن هذا النهج يمكن أن يوفر طريقة قوية لعزل الحمض النووي من عينة فرعية من ورقة واحدة مناسبة للتسلسل قراءة طويلة، دون تضخيم الجينوم كله. ونحن نتوقع أن هذا النهج سوف تكون قابلة للتكيف بسهولة إلى أنواع الأنسجة إضافية وتنطبق على نطاق واسع على أنواع النباتات الأخرى. وسوف يكون مفيدا بشكل خاص في الحالات التي تكون فيها كميات الأنسجة تحد، مثل التسلسل في الأجيال الفردية في مخطط عبور أو في أنواع الأنسجة النادرة.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
الكتاب تعلن أنه ليس لديهم المصالح المتنافسة.
إن ذكر الأسماء التجاریة أو المنتجات التجاریة في ھذا المنشور ھو فقط لغرض تقدیم معلومات محددة ولا یعني التوصیة أو المصادقة من قبل وزارة الزراعة الأمریکیة. وزارة الزراعة الأمريكية هي مزود فرص متساوية وصاحب العمل.
Acknowledgments
ونود أن نعترف بتمويل من وزارة الزراعة الأمريكية - دائرة البحوث الزراعية ومن المؤسسة الوطنية للعلوم (يوس 1025881 و يوس 1361554). نشكر R. كاسبرز لصيانة الدفيئة ورعاية النبات. كما نشكر جامعة مينيسوتا مركز الجينوميات، حيث تم إجراء التحضيرات مكتبة إلومينا والتسلسل. كما نعرب عن امتناننا للتعليقات التي أبداها محررو المجلة وأربعة مراجعين مجهولين من شأنها تعزيز مخطوطةنا. كما نشكر منظمة التعاون والتنمية في الميدان الاقتصادي على زمالة ل سك لدمج هذه البروتوكولات للمشاريع التعاونية مع الزملاء في اليابان.
Materials
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol (beta-mercaptoethanol; BME) | Sigma Aldrich | M3148-100ml | |
| 2-propanol (Isopropyl alcohol/isopropanol), bioreagent | Sigma Aldrich | I9516 | |
| agarose, Bio-Rad Cetified Megabase agarose | Bio-Rad | 1613108 | |
| analytical balance | Mettler Toledo | AB54-S | |
| balance | Mettler Toledo | PB1502-S | |
| bovine serum albumin (BSA) | Sigma Aldrich | B4287-25G | |
| Ceramic grinding cylinders, 3/8in x 7/8in | SPEX SamplePrep | 2183 | |
| Cryogenic Blocks compatible with tissue homogenizer for holding 50 mL tubes | SPEX SamplePrep | 2664 | |
| DNaseI | Sigma | DN25 | |
| ethanol, absolute | Decon Laboratories | 2716 | |
| Ethylenediamine Tetraacetic Acid (EDTA), 0.5 M Solution, pH 8.0 | Fisher | BP2482-500 | |
| gel imaging system | |||
| gel stain | Such as GelRed or Ethidium Bromide | ||
| grinding pestle, wide tip for 2 mL conical tubes | |||
| Guanidine-HCl, 8 M solution | ThermoFisher | 24115 | |
| LightCycler 480 SYBR Green I Master | Roche | 4707516001 | |
| liquid nitrogen | |||
| Lysing enzymes from Trichoderma harzianum | Sigma | L1412 | |
| Magnesium Chloride | G Bioscience | 24115 | |
| magnetic rack | ThermoFisher | A13346 | |
| microcentrifuge tubes, LoBind 1.5 mL | Eppendorf | 22431021 | |
| microcentrifuge tubes, standard nuclease-free 1.5 mL | Eppendorf | ||
| microcentrifuge, refrigerated | Sorvall | Legend X1R | Or equivalent product, must be capable of reaching at least 18,000 x g with rotors for 50 mL tubes, Oak Ridge tubes, and 1.5 mL tubes |
| microcentrifuge, room temperature | Eppendorf | 5424 | Or equivalent product, must be capable of reaching at least 18,000 x g with rotor for 1.5 mL and 2 mL microcentrifuge tubes |
| Microcon DNA Fast Flow Centrifugal Filter Units | EMD Millipore | MRCFOR100 | |
| Miracloth, 1 square per sample cut to fit funnel | EMD Millipore | 475855 | |
| NEBNext Microbiome DNA Enrichment Kit | New England Biolabs | E2612L | |
| parafilm | Parafilm M | PM992 | |
| plastic pots and trays | |||
| polyvinylpyrrolidone (PVP) | Fisher | BP431-100 | |
| Proteinase K | Qiagen | 19131 | |
| Pulsed-Field Gel Electrophoresis rig (e.g. CHEF DR III) | Bio-Rad | 1703697 | |
| purification beads, Agencourt AMpureXP beads | Beckman Coulter | A63881 | |
| QIAamp DNA Mini Kit | Qiagen | 51304 | |
| Qiagen 20/g Genomic Tip DNA Extraction Kit | Qiagen | 10223 | |
| Qiagen Buffer EB (elution buffer) | Qiagen | 19086 | |
| Qiagen DNA Extraction Buffer Set | Qiagen | 19060 | |
| QiaRack | Qiagen | 19015 | |
| qPCR machine (e.g. Roche Light Cycler 480) | Roche | ||
| qPCR plate sealing film | Roche | 4729757001 | |
| qPCR plate, 96 well plate | Roche | 4729692001 | |
| Qubit assay tubes | Life Technologies | Q32856 | |
| Qubit Broad Spectrum assay kit | Life Technologies | Q32850 | |
| Qubit High Sensitivity assay kit | Life Technologies | Q32851 | |
| RNaseA | Qiagen | 19101 | |
| Serological pipettes (20 mL) and pipet-aid | Fisher | 13-678-11 | |
| Small funnels, 1 per sample | |||
| Sodium Chloride | Ambion | AM9759 | |
| Soft paintbrush, 2 per sample | |||
| SPEX SamplePrep 2010 Geno/Grinder or another type of tissue homogenizer | SPEX SamplePrep | Or another comparable tissue homogenizer. If you do not have access to a tissue homogenizer, then grinding in a pre-chilled mortar and pestle will suffice (see protocol for details). However, a homogenizer will give more consistent results and total homogenization time is reduced. | |
| Sucrose | Omnipure | 8550 | |
| TBE | |||
| thermomixer | |||
| Tris | Sigma | T2819-100ml | |
| Triton X-100 | Promega | H5142 | |
| tube rotater | |||
| tubes, 50 mL conical polypropylene | Corning | 352070 | |
| tubes, 50 mL high-speed polypropylene | ThermoScientific/Nalgene | 3119-0050 | e.g. Nalgene Oakridge tubes or equivalent |
| vermiculite | |||
| water bath | |||
| water, sterile and certified Nuclease-free | Fisher | 1481 | |
| water, sterile milliQ |
References
- Liberatore, K. L., Dukowic-Schulze, S., Miller, M. E., Chen, C., Kianian, S. F. The role of mitochondria in plant development and stress tolerance. Free Radic Biol Med. 100, 238-256 (2016).
- Samaniego Castruita, J. A., Zepeda Mendoza, M. L., Barnett, R., Wales, N., Gilbert, M. T. Odintifier--A computational method for identifying insertions of organellar origin from modern and ancient high-throughput sequencing data based on haplotype phasing. BMC Bioinformatics. 16 (232), 1-13 (2015).
- Zhang, T., Zhang, X., Hu, S., Yu, J. An efficient procedure for plant organellar genome assembly, based on whole genome data from the 454 GS FLX sequencing platform. Plant Methods. 7 (38), 1-8 (2011).
- Wambugu, P. W., Brozynska, M., Furtado, A., Waters, D. L., Henry, R. J. Relationships of wild and domesticated rices (Oryza AA genome species) based upon whole chloroplast genome sequences. Sci Rep. 5 (13957), 1-9 (2015).
- Iorizzo, M., et al. De novo assembly of the carrot mitochondrial genome using next generation sequencing of whole genomic DNA provides first evidence of DNA transfer into an angiosperm plastid genome. BMC Plant Biol. 12 (61), 1-17 (2012).
- Park, S., et al. Complete sequences of organelle genomes from the medicinal plant Rhazya stricta (Apocynaceae) and contrasting patterns of mitochondrial genome evolution across asterids. BMC Genomics. 15 (405), 1-18 (2014).
- Skippington, E., Barkman, T. J., Rice, D. W., Palmer, J. D. Miniaturized mitogenome of the parasitic plant Viscum scurruloideum is extremely divergent and dynamic and has lost all nad genes. Proc Natl Acad Sci U S A. 112 (27), E3515-E3524 (2015).
- Wicke, S., Schneeweiss, G. M. Chapter 1. Next Generation Sequencing in Plant Systematics. Hörandl, E., Appelhans, M. , Koeltz Scientific Books. (2015).
- Sloan, D. B. One ring to rule them all? Genome sequencing provides new insights into the 'master circle' model of plant mitochondrial DNA structure. New Phytol. 200 (4), 978-985 (2013).
- Woloszynska, M. Heteroplasmy and stoichiometric complexity of plant mitochondrial genomes--though this be madness, yet there's method in't. J Exp Bot. 61 (3), 657-671 (2010).
- Ahmed, Z., Fu, Y. B. An improved method with a wider applicability to isolate plant mitochondria for mtDNA extraction. Plant Methods. 11 (56), 1-11 (2015).
- Ejaz, M., et al. Comparison of small scale methods for the rapid and efficient extraction of mitochondrial DNA from wheat crop suitable for down-stream processes. Genet Mol Res. 13 (4), 10320-10331 (2014).
- Eubel, H., Heazlewood, J. L., Millar, A. H. Isolation and subfractionation of plant mitochondria for proteomic analysis. Methods Mol Biol. 355, 49-62 (2007).
- Hao, W., Fan, S., Hua, W., Wang, H. Effective extraction and assembly methods for simultaneously obtaining plastid and mitochondrial genomes. PLoS One. 9 (9), e108291 (2014).
- Pomeroy, M. K. Studies on the respiratory properties of mitochondria isolated from developing winter wheat seedlings. Plant Physiol. 53 (4), 653-657 (1974).
- Taylor, N. L., Stroher, E., Millar, A. H. Arabidopsis organelle isolation and characterization. Methods Mol Biol. 1062, 551-572 (2014).
- Triboush, S. O., Danilenko, N. G., Davydenko, O. G. A method for isolation of chloroplast DNA and mitochondrial DNA from Sunflower. Plant Mol Biol Rep. 16 (2), 183-189 (1998).
- Pinard, R., et al. Assessment of whole genome amplification-induced bias through high-throughput, massively parallel whole genome sequencing. BMC Genomics. 7 (216), 1-21 (2006).
- Lamble, S., et al. Improved workflows for high throughput library preparation using the transposome-based Nextera system. BMC Biotechnol. 13 (104), 1-10 (2013).
- Raley, C., et al. Preparation of next-generation DNA sequencing libraries from ultra-low amounts of input DNA: Application to single-molecule, real-time (SMRT) sequencing on the Pacific Biosciences RS II. bioRxiv. , (2014).
- Tsai, Y. C., et al. Resolving the Complexity of Human Skin Metagenomes Using Single-Molecule Sequencing. MBio. 7 (1), e01948 (2016).
- Feehery, G. R., et al. A method for selectively enriching microbial DNA from contaminating vertebrate host DNA. PLoS One. 8 (10), e76096 (2013).
- Yigit, E., Hernandez, D. I., Trujillo, J. T., Dimalanta, E., Bailey, C. D. Genome and metagenome sequencing: Using the human methyl-binding domain to partition genomic DNA derived from plant tissues. Appl Plant Sci. 2 (11), 1-6 (2014).
- Noyszewski, A. K., et al. Accelerated evolution of the mitochondrial genome in an alloplasmic line of durum wheat. BMC Genomics. 15 (67), 1-16 (2014).
- Qiagen. QIAamp DNA Mini and Blood Mini Handbook. , 5th ed, Available from: https://www.qiagen.com/ch/resources/ (2016).
- E.M. Corporation. User Guide: Microcon Centrifugal Filter Devices. , Available from: http://www.emdmillipore.com/US/en/product/Microcon-DNA-Fast-Flow-Centrifugal-Filter-Unit-with-Ultracel-membrane,MM_NF-MRCF0R100 (2013).
- Qiagen. User developed protocol: Isolation of genomic DNA from plants and filamentous fungi using the QIAGEN Genomic-tip - (EN). , Available from: https://www.qiagen.com/ch/resources/ (2001).
- New England BioLabs, Inc.. NEBNext Microbiome DNA Enrichment Kit: Instruction Manual Version 4.0. , Available from: http://www.neb.com/~/media/Catalog/All-Products/371BCB5A557C462D95D1E45E15BBFEA3/Datacards or Manuals/E2612Manual.pdf (2015).
- Qiagen. QIAGEN Genomic DNA Handbook. , Available from: https://www.qiagen.com/ch/resources/ (2012).
- PacificBiosciences. Guidelines for Using the BIO-RAD® CHEF Mapper® XA Pulsed Field Electrophoresis System. , Available from: http://www.pacb.com/wp-content/uploads/Unsupported-Guidelines-Using-BIO-RAD-CHEFMapper-XA-Pulsed-Field-Electrophoresis.pdf (2016).
- Andrews, S. FastQC: A quality control tool for high throughput sequence data. , Available from: http://www.bioinformatics.babraham.ac.uk/projects/fastqc/ (2016).
- Bolger, A. M., Lohse, M., Usadel, B. Trimmomatic: a flexible trimmer for Illumina sequence data. Bioinformatics. 30 (15), 2114-2120 (2014).
- Ogihara, Y., et al. Structural dynamics of cereal mitochondrial genomes as revealed by complete nucleotide sequencing of the wheat mitochondrial genome. Nucleic Acids Res. 33 (19), 6235-6250 (2005).
- Ogihara, Y., et al. Structural features of a wheat plastome as revealed by complete sequencing of chloroplast DNA. Mol Genet Genomics. 266 (5), 740-746 (2002).
- International Wheat Genome Sequencing Consortium (IWGSC). A chromosome-based draft sequence of the hexaploid bread wheat (Triticum aestivum) genome. Science. 345 (6194), (2014).
- Langmead, B., Salzberg, S. L. Fast gapped-read alignment with Bowtie 2. Nat Methods. 9 (4), 357-359 (2012).
- Bendich, A. J. Why do chloroplasts and mitochondria contain so many copies of their genome? Bioessays. 6 (6), 279-282 (1987).
- Kumar, R. A., Oldenburg, D. J., Bendich, A. J. Changes in DNA damage, molecular integrity, and copy number for plastid DNA and mitochondrial DNA during maize development. J Exp Bot. 65 (22), 6425-6439 (2014).
- Ma, J., Li, X. Q. Organellar genome copy number variation and integrity during moderate maturation of roots and leaves of maize seedlings. Curr Genet. 61 (4), 591-600 (2015).
- Lang, E. G., et al. Simultaneous isolation of pure and intact chloroplasts and mitochondria from moss as the basis for sub-cellular proteomics. Plant Cell Rep. 30 (2), 205-215 (2011).
- Tobin, A. K. Subcellular fractionation of plant tissues. Isolation of chloroplasts and mitochondria from leaves. Methods Mol Biol. 59, 57-68 (1996).
- PacificBiosciences. Procedure & Checklist - 10 kb to 20 kb Template Preparation and Sequencing with Low (100 ng) Input DNA. , Available from: http://www.pacb.com/wp-content/uploads/Procedure-Checklist-10-20kb-Template-Preparation-and-Sequencing-with-Low-Input-DNA.pdf (2015).
- PacificBiosciences. Template Preparation and Sequencing Guide. , Available from: http://www.pacb.com/wp-content/uploads/2015/09/Guide-Pacific-Biosciences-Template-Preparation-and-Sequencing.pdf (2014).



