Summary
この作業では、異常な光透過の原理で動作する高品質センシング アレイを作製するナノイン プリント リソグラフィ法について説明します。バイオ センサーが低コスト、堅牢で、使いやすいと心筋トロポニンを検出することができます私は臨床的に関連性の高い濃度 (99thパーセン タイル カットオフ ∼10 400 pg/mL、アッセイによって) 血清で。
Abstract
ポイント ・ オブ ・ ケア (POC) 設定の臨床的意義を持っているバイオセンシング プラットフォーム、アッセイの感度、再現性、およびひと血清の背景に検体を確実に監視する機能が重要です。
ナノイン プリント (NIL) リソグラフィは、センシン 1.5 mm × 1.5 mm ほど低コストで作製する使用されました。ナノホール各約 140 nm2の領域の忠実度の高い配列のセンサー面をしました。NIL の偉大な再現性では、チップに変化が少なく、12 の個別に製造面 1 チップ、1 測定戦略を採用することが可能。これらのナノイン プリントの局在表面プラズモン共鳴 (LSPR) チップが確実にこのケースでは、人間の血清の流体の複雑な背景中 75 ng/mL に 2.5 から様々 な濃度で bioanalyte を測定する能力を広範囲にわたってテスト。NIL 可能このバイオ センサーは一般に利用できる実験室光源に簡単にインターフェイスできるので、順番、顕微鏡の必要性を排除する大きなセンシング分野の世代の高忠実性。これらのバイオ センサーを検出できます心筋トロポニン血清中 0.55 ng/ml 検出 (LOD) の制限で、感度の高い臨床的に適切であります。彼らはまた低いチップ ・ ツー ・ チップの差異 (作製プロセスの高品質) を示します。結果が広く使われている酵素免疫測定法 (ELISA) とけた違い-基づいた試金が LSPR ベース センシングプラット フォーム (すなわち、こうして小型化、多重化、それを作るの利点を保持する技術現実的な POC アプリケーション)。
Introduction
ナノホール アレイを用いた化学センサー異常な光透過 (EOT) の最初のレポートは Ebbesenら1998年1によって出版されたので多くの捜査の対象とされています。サブ波長サイズのナノホール構造体の周期的な配列に光が入射する、特定の波長の高度な転送が発生します。これには、ブロッホ波表面ポラリトン (BW SPP) および/または局所励起表面プラズモン (LSP)2と入射光のカップルとが発生します。
悪用された場合、このような周期配列を用いた、単純な基になる物理的な原則。または金属製界面近傍の分子の吸着は、ターンではスペクトルの透過帯の場所をシフト、金属との接触媒質の誘電を変更します。スペクトル自体は、ナノ工学、形状、サイズ、および分離距離3,4,5で調整できます。仕様では、EOT に基づくセンサー分子結合イベントの調査の間に特定の割り当て6,7、8を促進するスペクトルに特徴的なバンドがあります。これ市販の表面プラズモン共鳴 (SPR) プラットフォーム上の重要な利点です。
通常 EOT を利用したセンサーには、光源が平行光がセンサー面に入射するように光学的配置が含まれます。共重合体のテンプレートと干渉やナノ粒子リソグラフィーなどの大きなナノホール サーフェスを生成する技術は、再現性に乏しく9を持っています。正確に EOT 現象を示す大きな面を加工でこれらの制限により光学顕微鏡光源と検出器を適切に配置する必要があります。技術、ナノイン プリント高品質・ リソグラフィーを簡素化するには、(NIL)10が採用されました。これはチップにセンサー面を顕微鏡の必要性を削除する大規模なセンサー表面領域11 (mm スケール) の生産が可能。代わりに、このセンサーは、簡単に標準的な光ファイバケーブルと接続する可能性があります。
このナノホール アレイの伝送のピークは、可視近赤外領域 (NIR) に含まれている、ので、生体分子の水溶液環境のバインド イベントを検出に最適です。ナノホール アレイの光動作をシミュレートしました。結果は、標準屈折 (RI) の液体の研究を通じて確認されました。この配列は、心筋トロポニンの濃度を測定する使用された私 (cTnI) ひと血清の複雑背景下で。cTnI は急性心筋梗塞の診断のための臨床のゴールド スタンダードです。
このセンサーを使用して、検出し、臨床的に適切である 0.55 ng/ml 検出 (LOD) の制限でひと血清中 cTnI を定量化することが可能です。検出は、酵素免疫測定法 (ELISA) は、このドメインで最も一般的に使用される技術よりも速いです。さらに、センサー面が簡単に再生され、そのため再利用します。したがって、この作業は複雑な生体内バイオセンシングのための現実的なポイント ・ オブ ・ ケア (POC) 技術としてナノホール アレイの約束を示しています。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. 作製センサーとデータの取得
- ニッケル鋳型の作製
- 負の電子ビームの 220 nm 厚層のコートにシリコンウエハ 4 で 600 μ m 厚に抵抗します。電子ビーム露光システムを用いたウェーハ用に設計されたナノホール配列を記述します。
- フィールド サイズを 300 μ m ごとに 20 k の低 dotmap (N) とパターンの書き方を書いて電子ビームを加速する (A) (すなわち、そこ 4 億ドット各 300 μ m2の領域にマップされている、そしてかどうかは、電子ビームによって各ドットが公開か、パターン設計によって)。110 μ cm− 2レジストの eb レジスト被曝線量を設定および 800 の電流 (I) で書き込みペンシルバニア州
注記: 電子ビーム書面によって計算されたドット (Tドット) ごとに露出時間によって制御されます被曝線量 (D) 。各露出のドットに電子ビーム住居時間は、110 μ cm− 2で被曝線量、0.5 μ s12です。配列をキャプチャ 1.8 mm2の面積は、300 μ m2分野フォーム 1 つ大きな、ゴールドのナノホール アレイに一緒にステッチの 36 パッチの合計があります。
。各露出のドットに電子ビーム住居時間は、110 μ cm− 2で被曝線量、0.5 μ s12です。配列をキャプチャ 1.8 mm2の面積は、300 μ m2分野フォーム 1 つ大きな、ゴールドのナノホール アレイに一緒にステッチの 36 パッチの合計があります。
- フィールド サイズを 300 μ m ごとに 20 k の低 dotmap (N) とパターンの書き方を書いて電子ビームを加速する (A) (すなわち、そこ 4 億ドット各 300 μ m2の領域にマップされている、そしてかどうかは、電子ビームによって各ドットが公開か、パターン設計によって)。110 μ cm− 2レジストの eb レジスト被曝線量を設定および 800 の電流 (I) で書き込みペンシルバニア州
- 10 開発者向けに 4 インチのシリコンウェハーを浸すことによってレジストを開発 s とウェーハの空気で乾燥させます。
- シリコン基板上、金属は、ニッケル、銅、アルミニウムなどのシード層を入金します。
- ニッケル スルファミン酸ニッケル浴のめっきシステムでウェハを電気メッキします。2 つの手順でめっきを行います。最初の手順では、永続的な 95 分で 0.7 A dm− 2; の電流密度を使用して、これは完全にニッケル 28awd-4 を塗りつぶします。2 番目の手順では、125 分を持続させる最終的なニッケル金型厚さ 300 μ m に到達する 12 A dm− 2を使用 (20 nm)。PH 値は 3.5 3.8、52-54 ° C の温度であることを確認します。
- 穏やかな機械的な力を適用することによって、シリコン基板からニッケル金型を区切ります。ポジ型フォトレジスト除去試薬一晩電子線レジスト残渣を洗い流すための約 100 mL でニッケル金型を浸します。
- 3 h の 100 ° C でオーブンと乾燥、ニッケル鋳型をフィード ・ プラズマ エッチング システム 10 sccm で O2ガスと 100 W 3 分でそれをきれいに。
- 負の電子ビームの 220 nm 厚層のコートにシリコンウエハ 4 で 600 μ m 厚に抵抗します。電子ビーム露光システムを用いたウェーハ用に設計されたナノホール配列を記述します。
- 金ナノ構造の作製
- コートでニッケル鋳型上の観察 1,1,2,2 偏光トリクロロシラン (FDT) の 150 μ L、80 ° C の自己組織化単分子膜 (SAM) コーティング マシン
注: これはナノイン プリントのステップの完了後 (「離」) フォトレジストから金型の分離を可能にする付着防止層を形成します。蒸発時間が 180 にする必要があります s、および反応時間は 900 をする必要があります s。 - 28awd-4 の 4-10 バールの圧力、温度 40 ° C で 10 分間ナノ インプリンターを使用して光硬化性 NIL 300 nm 厚層を塗布したガラス基板に抵抗を捺印します。
- 紫外線硬化システムおよび 75 mW cm-2 30 の紫外線露出に photocure ガラス基板上、フォトレジスト、金型を転送 s。
注: すべての手順に正しく従っている場合ニッケル型する必要があります簡単にする demolded フォトレジストから。 - 反応性イオン エッチング (RIE) 装置 2 の 50 W の 10 sccm の O2ガス流れと、ガラス基板上のフォトレジストの空白 etch を実行 s インデント領域にガラスを公開します。
- 電子ビーム蒸着機でガラス基板上にクロム (Cr) 金属接着用の 5 nm 厚層とプラズモン センサーのための金 (Au) の 100 nm 層を入金します。1 成膜速度を使用して、Cr の 2 Å の s− 1 Å s− 1 au。
- 3 分 15 秒音声化ステップ アセトンで続いて用エッチング O2プラズマによるフォトレジストのリフトオフを実行します。
- サンプルを 5 mm × 5 mm チップにサイコロします。ナノホール アレイは、中央 2 mm × 2 mm のチップを占有します。
- コートでニッケル鋳型上の観察 1,1,2,2 偏光トリクロロシラン (FDT) の 150 μ L、80 ° C の自己組織化単分子膜 (SAM) コーティング マシン
- データの取得
- 白色光送信機の光ファイバーの終了を終了のビーム平行光がセンサーの表面 (ナノホール アレイ) に 90 ° で入射、光の測定を行う装置を設定します。
注: 光は全体ナノホール配列を介して送信されます。 - 受信機光ファイバーの伝送信号を収集し、紫外可視分光計 300 に 1,000 の範囲内で動作を記録 nm。
- 測定のノイズが低減する最終的なスペクトルを取得する 20 さん平均 100 フレームにフレームごとに集録時間を設定します。
- 印刷ソフトウェアを使って、以前に識別された伝送のピーク (ローレンツ ベースのメソッドを使用して) に基づくデータを分析します。
- 白色光送信機の光ファイバーの終了を終了のビーム平行光がセンサーの表面 (ナノホール アレイ) に 90 ° で入射、光の測定を行う装置を設定します。
2. センサー一括感度テスト
- 1.39 に 1.31 からさまざまな RI の液晶セルに標準の RI 液体を入金します。
- 標準の RI 液体センサー チップを浸し、白色光のビームに合わせます。透過スペクトルを得る。
- 界面活性洗浄試薬と各データ測定後センサー チップをきれいにし窒素ガスで乾燥します。
3. センサー表面改質
- 前の任意の化学修正連続脱イオン水、アセトン、イソプロパノール浸漬によってセンサー チップをきれい。乾燥窒素ガスのストリームで常温乾燥。
- 0.4 mM 10-カルボキシ-1-複数と 1.6 mM 1-オクタンチ オール室温で 12 h のエタノール溶液にセンサー チップを孵化させなさい。
注: これは形成アミン反応性自己組織化単分子膜 (SAM)。 - 徹底的に洗浄し、室温で乾燥エタノールを使用します。
- 75 mM スルホ-N-ヒドロキシスクシンイミド (スルホ-NHS) と 15 mM 1-ethyl-3-(3-dimethylaminopropyl) カルボジイミド (EDC) の混合物を作る。15 分のこの混合物のチップを浸します。
注: これは SAM のカルボキシルをアクティブになります。 - センサー表面に pH 4.5 酢酸緩衝液で 200 μ g/mL 抗トロポニン抗体溶液 50 μ L をスポットし、30 分間インキュベートします。
- 1 M エタノールアミン HCl 溶液中 15 分間でセンサー チップを浸すことによって未反応のエステルを非アクティブ化します。
- 室温で乾燥窒素ガスのストリームで乾燥して脱イオン水でチップをすすいでください。
4. cTnI アッセイ
- 表面に 1% ウシ血清アルブミン (BSA) 溶液 100 μ L スポッティングして任意の非特異的結合をブロックします。
注: これは参照スペクトルです。
注: これはアフター結合スペクトルです。
5. 表面プラズモン共鳴 (SPR) 測定
- PBS T バッファーを用いた SPR に多重の SPR センサー チップを実行します。
注: PBS T バッファーの組成は 0.05%、150 mM の NaCl、20 mM リン酸 Na トゥイーン 20。PH は 7.4 です。 - 手順 4 の説明に従って cTnI 標準と、抗体を使用します。
- EDC (0.2 M) とスルホ-NHS 5 分 50 μ g/mL の抗体 560 の 5 分の注入を実行 (0.05 M) の混合物との 1 M エタノールアミン HCl 溶液 5 分注入 6 使用可能なチャネルのうち 3 をアクティブにします。
- センサー チップを 90 ° 回転し、異なる濃度で cTnI 基準を注入 (75、30、7.5 2.5 ng/mL)。
- SPR 読み出しを介してリアルタイムでチップ上の相互作用のスポットで抗体の共役を観察します。
- 1 分 50 mM グリシン塩酸 (pH 2) を注入することによりチップを再生成します。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
図 1 aに測定の光のセットアップを示します。実際ナノホール配列のイメージは図 1 bで与えられます。検出プロセスを運転の物理学を理解するため COMSOL シミュレーション ソフトウェアは水溶液環境のプラズモニック フィールド分布をシミュレートするために使用されました。シミュレーションの結果から、実際の測定に関連していた。以前に発行された研究には、仮定しシミュレーション11,13で使用するパラメーターの詳細が含まれています。ナノホール配列は次のように、プラズモニック フィールドをシミュレートするために使用される物理的な寸法: p = 400 nm、D = 150 nm、および T = 100 nm。透過スペクトルを計算するとき、吸収と散乱効果はアカウント14にも取られます。シミュレートされたスペクトルは図 1の実験的に測定されたスペクトルと比較されます。シミュレーションと実測スペクトル 850 450 から 4 つのバンドの存在を伝える nm。495 のバンド金の光学遷移に対応する nm。呼ぶバンド I ~ III、波長の順に 3 つのそれに続くバンドは、560 nm, 645 nm, と 712 nm、それぞれ。558 にある実験的に測定されたバンドに配置が許容する観察されたバンド III 638 nm nm、および 724 nm。作製したナノホールはほぼ円形で、これらのバンドは入射光の偏光状態に敏感なしないでください。また、COMSOL シミュレーションにより周期構造 (図 1) の単位セルに発生する、これらのバンドの近傍電界分布の直接可視化できます。カラー バー上単位は対数スケールで表される光波の電界分布 (V/m) です。観測された最高の強度は、約 4.7 (50,119 V/m) だった。シミュレーション (4,340 V/m) で使用される入射強度と比較して、この大きさは、11.5-fold の電場増強を表します。I と III は、ガラス基板の表面にローカライズされたバンドの電磁フィールド。対照的に、バンド II のナノホールの上部縁に限局していた主と、bioanalyte の検出のために選ばれました。図 1Eナノホール配列既知の屈折を 1.39 に 1.31 から変化の液体の透過スペクトルを示しています。I、II、および III、バンドに対応する 3 つの伝送帯域は、400 〜 900 nm のスペクトル範囲で観察されました。赤い転位は、RI の変化が観察されました。シフトの大きさは続くシーケンス バンド II > 私のバンド > バンド III。図 1 fは I、II、および III、観測された赤の統合はバンドのシフトです。322 nm/リウ、バンド II だった 345 nm/リウとバンドの II だった 202 nm/リウ、バンドの一括感度が計算されます。
図 2 aには、アクションでリモートセンシング現象の模式図が含まれています。図 2 bは、心筋トロポニン分子機能チップ表面に結合した後、透過スペクトルの変化を示します。低濃度でトロポニン レベル帯における線形シフトがあります。バンド位置でシフトは、0.995 の R2値の結合等温線によく合うことができます。よく観察時 30 ng/mL よう吸着等温線が飽和 (図 2) の発症を示します濃度です。
図 3 aは、XPR36 セットアップで血清変更された GLC チップのチップ表面との相互作用から sensorgram を示しています。信号の上昇によって cTnI のキャプチャが表示されます。CTnI PBST 培地 (1 x PBS、0.05% tween 20) での解離が観察できる 120 660 s. 注入するグリシン (再生ソリューション) 1 分から信号が減少を 0、センサー面の再生を示す信号に縮小の後、を介して cTnI の完全な解放。図 3 aのはめ込み式でその後再生成されたチップの表面に cTnI 協会の sensorgram が表示されます。ナノホール アレイ表面を再生成に使用された (すなわち、 1 分のグリシン溶液中浸漬) 同じプロトコル。図 3Bそれにより再生手順の成否を確認する元の位置に戻るバンド 2 の位置がずれることを示しています。

図 1: ナノホール アレイの特性。(A) 簡易実験装置の概略図。(B) ナノホール アレイの走査型電子顕微鏡画像。(C) シミュレートされたスペクトルと水溶液環境下で実験的に測定した伝送スペクトルの比較(D) 近傍界分布 I と III、断面図で見られるバンドのため COMSOL でシミュレートされました。赤は強い近傍電界分布を表します。カラー バーに表示される単位は |E |、対数スケールでの撮影場光分布。(E) 実験的屈折率標準液 (1.39 に 1.31) の環境でナノホール アレイの透過スペクトルを測定しました。(F) の可視 〜 近赤外領域測定 RI の変化に 3 つの伝送帯域 (- 3 世) の感度を一括します。黒い正方形: 私は、赤丸のバンド: II、青い三角形のバンド: III のバンドします。図は、鼎らから変更されています。14 CC BY ライセンスの下で。この図の拡大版を表示するのにはここをクリックしてください。
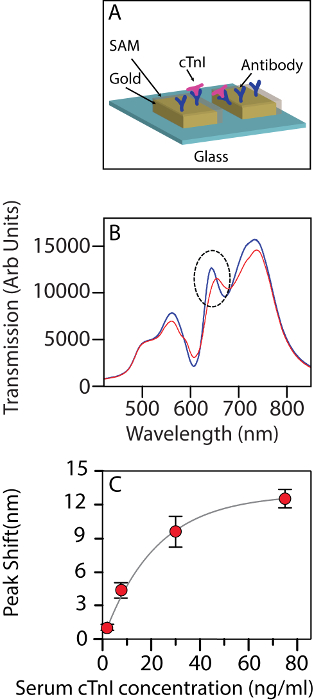
図 2: バイオ センサーとして使用されるナノホール配列。(A) cTnI を検出するバイオ センサーとして使用されるナノホール配列の模式図。血清の背景で 30 ng/mL の濃度でひと cTnI との対話時にバイオ センサーの伝送に変更 (B) スペクトル。青: 前に相互作用、赤: 相互作用の後。点線の円では、追跡されている帯域を示します。(C) バンド II トロポニン (2.5 ng/mL、7.5 ng/mL、30 ng/mL、75 ng/mL) の異なる濃度での波長のシフト。誤差範囲を示す標準偏差、n の中で 3 チップで各測定を =。図は、鼎らから変更されています。14 CC BY ライセンスの下で。この図の拡大版を表示するのにはここをクリックしてください。

図 3: センサーの表面の再生します。(A) グリシン投与が続く (cTnI) 試料の注入を示す XPR36 から SPR sensorgram センサー表面を再生成します。その後検出 cTnI 血清背景の異なる濃度の測定は、はめ込みに表示されます。赤色のバーは初期値を表し、黒いバーがテキストに記載されているプロトコルと表面の再生の後測定を示しています。(B) バンド波長シフト ナノホール バイオ センサー チップの再生後に観察。Σ: バンド位置の波長の変化の標準偏差。図は、鼎らから変更されています。14 CC BY ライセンスの下で。この図の拡大版を表示するのにはここをクリックしてください。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
入射光とナノ構造の相互作用をシミュレートすると、試料の濃度の関数としてのシフトを記録できる (透過スペクトル) の適切なピークを識別することが可能になります。センサーの構造に関してバンドのローカリゼーションは試料を意味するそのシフトを追跡ことができます右のバンドを選択することが重要に注意してくださいすることが重要です。シミュレーションにより可視化を実現できます。これはまた analytes のバイオセンシングを可能にする最適構造の設計に重要です。ご覧のとおり、バンド I と III ゴールド ガラス インターフェイスのローカライズされ、したがって、バイオセンシングのため有用ではないです。著名な LSPR コンポーネントはバンド II 内部で観察できます。短いディケイの長さを示し、ナノホールの縁にローカライズされます。など、これは濃度の検出に使用されているにも適しています。全体の配列を介して作製したナノ構造体の品質が収集したスペクトルの質にも欠かせません。非一様構造は、工芸品をご紹介いたします。
散乱とやむを得ない吸収水性測定で工芸品を作成します。全体の信号雑音比も、水性媒体の存在によって妨げられます。バイオセンシングがシフトを監視する複数の適切なバンドがある場合は、次の点を考慮されなければなりません。サブ 600 nm の波長では、観測された透過スペクトル著しく蛋白質を吸着と粒子散乱に影響されます。その一方で、900 を超える波長を使用して nm 吸収波長と水の増加によってこの地域のように、イベント バインドから発せられる重要な基になる信号を隠すことにより、混乱を作成します。水溶液環境で検体を感知、したがって、バンド II は波長の面で最適配置です。バンド位置の測定の小さい偏差を観察できます。これは、大規模なセンサーのサイズが原因です。大規模なセンサーは集録時間の短縮に最終的に変換し検出画素は今光子の通常よりも大きくなるフラックスを見るので、それも否定的ノイズに影響します。実際には、信号収集は適切に実行されません、データをご利用いただけますがない最適設計、多くのノイズが観察できます。フレーム15の平均することによって収集された信号の以上 100、騒音レベルを下げることができます。特に金ナノ粒子16からの LSPR 信号を生成する他の方法がありますナノホール アレイはマイクロとポータブルな形式での実装も可能。全体のプロセスの自動化と検出面を再生の可能性の容易さのため POC 用デバイス全体を使用できます。
この実験的なプロトコルは、反射ではなく伝送モードを用いた実験的なエラーを最小限に抑えるために設計されています。これは、カット入射角度変更から可能な工芸品です。また、抗体センサー表面に架橋は、ステップ 3.4 の重要性を指摘することが重要です。それはスルホ NHS と EDC の両方の反応を維持するために不可欠です。また、NHS からスルホ NHS への切り替えだった安定性の向上のために重要なことが分かった。サンプルを再利用する場合は、液体窒素貯蔵をお勧めします。ここで示されるプラットフォーム技術は、適切な表面改質と他の臨床バイオ マーカーをモニターに使用できます。
これまで LSPR センサーの浸透は、半導体産業のような再現性と広範囲を越えて応答サーフェスを作成する能力の制限によって制限されています。大規模なリモートセンシング表面は標準とコスト効率の高い光学系に簡単にインターフェイスできるのでいます。製造工程中の精度ともチップ ・ ツー ・ チップの差異、臨床の現場で非常に重要である、測定の信頼性を向上させるための重要なボトルネックを軽減します。シリアル測定が必要な医療機器において、表面再生の再現性も重要です。検出面を再生成するための最適なプロトコルを市販の SPR プラットフォームの確立およびその後ナノホール アレイに正常に変換できることも実証されています。ナノホール アレイの再生効率を簡単に計算でき、繰り返し測定の再表面の適合性を評価できます。堅牢な表面化学改質と再生処理のプロトコルが確立される、LSPR センサーは、リアルタイム bioanalyte 検出のための繊細でシンプルなプラットフォームをすることができます。患者ケアへの重要な影響を予見する簡単です。センサーの絶対感度が最も高度な elisa 法を用いたテストを一致ことはできません注意されるべきです。いくつか増幅戦略は感度を上げるように設計する必要があります。伝送系を用いた心血管バイオ マーカーの無標識検出のための新しい下限を定義として、確立されたナノイン プリント LSPR のプロトコルに対する大幅な改善を表しますこの技術も現在の形で光セットアップ。技術は、複数の臨床的に重要な生物指標のリアルタイム モニタ リングの実施に向けて進化しています。データ集録 (例えば、解像度の良い検出器) および信号処理のさらなる改良は、LSPR センサーがこれを達成するを助けることができます。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
著者は競合する金融興味を持ってないです。
Acknowledgments
AP には、教授 T Venkatesan、ディレクター、NUS ナノサイエンス ・ ナノテクノロジー ・ イニシアティブ副大統領 (シンガポールの国民大学) (R-398-000-084-646) のオフィスのサポートが認めています。CLD は、サポートのシンガポール省の保健医療研究評議その臨床医科学者資金調達スキームの下でナノ材研/CSA/035/2012, とシンガポール国立大学を認めています。資金提供者には、研究デザイン、データ収集と分析、意思決定を発行し、または原稿の準備の役割はなかった。
Materials
| Name | Company | Catalog Number | Comments |
| Electron Beam Lithography setup | Elionix ELS 700 | ||
| o-Xylene | Sigma Aldrich | 95662 | |
| EB resist | Sumitomo | NEB-22A2 | |
| Developer reagent | Shipley Company | Microposit MF 321 | |
| Electroplating machine | Technotrans AG RD 50 | ||
| Photoresist stripper | Rohm and Haas Electronic Materials LLC | Microposit Remover 1165 | |
| Etching System | Trion Phantom | ||
| Heptadecafluoro-1,1,2,2-tetrahydrodecyl)trichlorosilane | Gelest (PA, USA) | 78560-44-8 | |
| SAM coater | Sorona Inc. | AVC 150M | |
| Photo-curable NIL resist | micro resist technology GmbH | mr-UVCur21-300nm | |
| Light Curing System | Dymax | Model 2000 Flood | |
| E-beam deposition machine | Denton Explorer | ||
| UV-visible spectrometer | Ocean optic HR2000+ (Dunedin, FL, USA) | ||
| Standard refractive index liquids | Cargill Inc (Cedar Grove, USA) | 18032 | |
| Plotting software | Origin | Origin Pro 9 | |
| 10-carboxy-1-decanethiol | Dojindo Laboratories (Japan) | C385-10 | |
| 1-octanethiol | Sigma-Aldrich, MO, USA | 471386 | |
| Sulfo-N-hydroxysuccinimide and 1-ethyl-3-(3-dimethylaminopropyl) carbodiimide | BioRad (CA, USA) | 1762410 | |
| Anti-troponin antibody 560 | Hytest (Finland) | 4T21 | |
| Ethanolamine-HCl solution | BioRad (CA, USA) | 1762450 | |
| Surface Plasmon Resonance setup | BioRad XPR36 (Haifa, Israel) | ||
| Multiplexed SPR chip | BioRad | GLC | |
| Human cTnI standard | Phoenix Pharmaceuticals | EK -311-05 | |
| Glycine-HCl | BioRad (CA, USA) | 1762221 |
References
- Ebbesen, T. W., Lezec, H. J., Ghaemi, H., Thio, T., Wolff, P. Extraordinary optical transmission through sub-wavelength hole arrays. Nature. 391 (6668), 667-669 (1998).
- Krishnan, A., et al. Evanescently coupled resonance in surface plasmon enhanced transmission. Optics Comm. 200 (1), 1-7 (2001).
- Yang, J. -C., et al. Enhanced optical transmission mediated by localized plasmons in anisotropic, three-dimensional nanohole arrays. Nano letters. 10 (8), 3173-3178 (2010).
- Kim, J. H., Moyer, P. J. Transmission characteristics of metallic equilateral triangular nanohole arrays. Appl Phys Lett. 89 (12), 121106 (2006).
- Liu, H., Lalanne, P. Microscopic theory of the extraordinary optical transmission. Nature. 452 (7188), 728-731 (2008).
- Shon, Y. -S., Choi, H. Y., Guerrero, M. S., Kwon, C. Preparation of nanostructured film arrays for transmission localized surface plasmon sensing. Plasmonics. 4 (2), 95-105 (2009).
- Xiang, G., Zhang, N., Zhou, X. Localized surface plasmon resonance biosensing with large area of gold nanoholes fabricated by nanosphere lithography. Nanoscale Res Lett. 5 (5), 818 (2010).
- Valsecchi, C., Brolo, A. G. Periodic metallic nanostructures as plasmonic chemical sensors. Langmuir. 29 (19), 5638-5649 (2013).
- Gates, B. D., et al. New approaches to nanofabrication: molding, printing, and other techniques. Chem Rev. 105 (4), 1171-1196 (2005).
- Guo, L. J. Nanoimprint lithography: methods and material requirements. Adv Mater. 19 (4), 495-513 (2007).
- Wong, T. I., et al. High throughput and high yield nanofabrication of precisely designed gold nanohole arrays for fluorescence enhanced detection of biomarkers. Lab on a Chip. 13 (12), 2405-2413 (2013).
- Deng, J., Wong, T. I., Sun, L. L., Quan, C., Zhou, X. Acceleration of e-beam lithography by minimized resist exposure for large scale nanofabrication. Microelect Eng. 166, 31-38 (2016).
- Wu, L., Bai, P., Li, E. P. Designing surface plasmon resonance of subwavelength hole arrays by studying absorption. JOSA B. 29 (4), 521-528 (2012).
- Ding, T., et al. Quantification of a cardiac biomarker in human serum using extraordinary optical transmission (EOT). PloS one. 10 (3), 0120974 (2015).
- Im, H., Sutherland, J. N., Maynard, J. A., Oh, S. -H. Nanohole-based surface plasmon resonance instruments with improved spectral resolution quantify a broad range of antibody-ligand binding kinetics. Anal Chem. 84 (4), 1941-1947 (2012).
- Bhagawati, M., You, C., Piehler, J. Quantitative real-time imaging of protein-protein interactions by LSPR detection with micropatterned gold nanoparticles. Anal Chem. 85 (20), 9564-9571 (2013).



 。各露出のドットに電子ビーム住居時間は、110 μ cm− 2で被曝線量、0.5 μ s12です。配列をキャプチャ 1.8 mm2の面積は、300 μ m2分野フォーム 1 つ大きな、ゴールドのナノホール アレイに一緒にステッチの 36 パッチの合計があります。
。各露出のドットに電子ビーム住居時間は、110 μ cm− 2で被曝線量、0.5 μ s12です。配列をキャプチャ 1.8 mm2の面積は、300 μ m2分野フォーム 1 つ大きな、ゴールドのナノホール アレイに一緒にステッチの 36 パッチの合計があります。