Summary
Detta arbete beskriver en nanoimprinting litografi metod att tillverka högkvalitativa fjärranalys matriser som fungerar på principen om extraordinära optisk överföring. Biosensor är låg kostnad, robust, lätt att använda, och kan upptäcka hjärt troponin I serum vid kliniskt relevanta koncentrationer (99: e percentilen cutoff ∼10-400 pg/mL, beroende på analysen).
Abstract
För en biosensing plattformen att ha klinisk relevans i point-of-care (POC) inställningar, är analysens känslighet, reproducerbarhet och förmåga att på ett tillförlitligt sätt övervaka analyter mot bakgrund av humant serum avgörande.
Nanoimprinting litografi (NIL) användes för att tillverka, till en låg kostnad, avkänning områden stora som 1,5 x 1,5 mm. Fjärranalys ytan var gjord av HiFi-matriser av nanoholes, var och en med en yta på cirka 140 nm2. Bra reproducerbarhet av NIL gjort det möjligt att anställa en one-chip, en-mätning strategi på 12 individuellt tillverkade ytor, med minimal chip-till-chip variation. Dessa nanoimprinted lokaliserade ytan plasmon resonans (LSPR) marker testades utförligt på deras förmåga att tillförlitligt mäta en bioanalyte vid koncentrationer varierar från 2,5 till 75 ng/mL mitt i bakgrunden av en komplex kroppsvätskemetabolomik-i detta fall, humant serum. Hög trohet NIL möjliggör generering av stora fjärranalys områden, som i sin tur eliminerar behovet av Mikroskop, som denna biosensor kan vara enkelt gränssnitt med en allmänt tillgänglig laboratorium ljuskälla. Dessa biosensorer kan upptäcka hjärt troponin i serum med en hög känslighet, på en detektionsgräns (LOD) 0,55 ng/ml, vilket är kliniskt relevant. De visar också låg chip-till-chip varians (på grund av den höga kvaliteten i tillverkningsprocessen). Resultaten är jämförbara med utbredda enzyme-linked immunosorbent assay (ELISA)-baserade analyser, men tekniken behåller fördelarna med en LSPR-baserad fjärranalys plattform (dvs föredragandens miniatyrisering och multiplexering, vilket gör det mer genomförbart för POC program).
Introduction
Kemiska sensorer baserade på nanohole matriser har varit föremål för många undersökningar sedan den första rapporten om extraordinära optisk överföring (EOT) publicerades av Ebbesen et al. 19981. När ljus inkräktar på periodiska matriser av nanohole strukturerar av sub våglängd dimensioner, sker förbättrad överföring på specifika våglängder. Detta inträffar när incidentet lätt par med Bloch-wave surface polariton (BW-SPP) eller lokaliserad surface plasmons (LSP)2.
Den underliggande fysiska principen utnyttjas när biosensing med sådana periodiska matriser är enkel. Adsorption av molekyler på eller nära gränssnittet för metall ändrar dielektrisk konstant av medlet kommer i kontakt med metallen, i sin tur skiftande platsen för överföring banden i spektrumet. Spektrumet själv kan justeras med nano-teknik form, storlek och separation avståndet3,4,5. Av design har sensorer baserat på EOT karakteristiska band i deras spektra som underlättar särskilda uppdrag6,7,8 under utredningen av molekylär bindande händelser. Detta är en avgörande fördel jämfört med kommersiellt tillgängliga ytan plasmon resonans (SPR) plattformar.
Sensorer som använder EOT vanligtvis innebära en ljuskälla som optiskt anpassas så att en kollimerad stråle är incident på fjärranalys ytan. Tekniker för att generera stora nanohole ytor, såsom kopolymer mallar och störningar och nanosphere litografi, har dålig reproducerbarhet9. På grund av dessa begränsningar i noggrant tillverka stora ytor som visar fenomenet EOT, var ett optiskt mikroskop skyldig att korrekt placera ljuskällan och detektor. För att förenkla den teknik, hög kvalitet nanoimprinting litografi (NIL)10 var anställd. Detta gjorde det möjligt för produktion av stora sensorn ytan11 (mm-skala), undanröja behovet av ett mikroskop för att leta efter fjärranalys ytan på ett chip. I stället kan denna sensor vara enkelt gränssnitt med en standard fiberoptisk kabel.
Eftersom överföringen topparna för denna nanohole array finns i den synliga nära infraröda området (NIR), är det perfekt att avkänning bindande händelser för biomolekyler i vattenlösning miljö. Optiska normalt nanohole matrisens simulerades. Resultatet var sedan verifieras genom studier med vätskor av standard refractive index (RI). Denna matris användes sedan för att mäta koncentrationen av hjärt troponin I (cTnI) i komplexa bakgrund av humant serum. cTnI är kliniska guldmyntfoten för diagnos av akut hjärtinfarkt.
Med denna sensor, är det möjligt att påvisa och kvantifiera cTnI i humant serum på en detektionsgräns (LOD) 0,55 ng/ml, vilket är kliniskt relevant. Upptäckt är mycket snabbare än den vanligaste tekniken i den här domänen, enzyme-linked immunosorbent assay (ELISA). Dessutom tvättmaskinens ytan kan enkelt kan regenereras och därför återanvändas. Därför visar detta verk löfte om nanohole matriser som en livskraftig point-of-care (POC) teknik för biosensing inom komplexa kroppsvätskor.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. tillverkning av sensorn och förvärvet av Data
- Förberedelse av nickel mögel
- Coat en 220 nm-tjockt lager av negativa elektronstråle motstå på en 600 µm tjock 4-i silicon wafer. Skriv arrayen designade nanohole på denna wafer använder ett electron beam litografi system.
- För att påskynda den e-beam skriva, skriva mönster med en låg dotmap (N) för 20k för varje 300 µm Fältstorlek (A) (dvs. det är 0,4 miljarder prickar mappas på varje 300 µm2 -område, och varje punkt kommer antingen att utsättas av e-balken eller inte beroende på mönsterdesign). Ange den e-beam motstå exponering dosen för resist till 110 µC cm−2 och skriver på en ström (I) 800 pA.
Obs: E-beam skriftligen, exponering dosen (D) styrs av exponeringstiden för varje punkt (Tprick), beräknas av . För exponering dosen 110 µC cm−2är e-beam bostaden tiden på varje exponerade dot 0,5 µs12. Eftersom matrisen fångar ett område av 1,8 mm2, finns det sammanlagt 36 fläckar av 300 µm2 fältet områden sys ihop till form en stor, guld nanohole matris.
. För exponering dosen 110 µC cm−2är e-beam bostaden tiden på varje exponerade dot 0,5 µs12. Eftersom matrisen fångar ett område av 1,8 mm2, finns det sammanlagt 36 fläckar av 300 µm2 fältet områden sys ihop till form en stor, guld nanohole matris.
- För att påskynda den e-beam skriva, skriva mönster med en låg dotmap (N) för 20k för varje 300 µm Fältstorlek (A) (dvs. det är 0,4 miljarder prickar mappas på varje 300 µm2 -område, och varje punkt kommer antingen att utsättas av e-balken eller inte beroende på mönsterdesign). Ange den e-beam motstå exponering dosen för resist till 110 µC cm−2 och skriver på en ström (I) 800 pA.
- Utveckla resist genom nedsänkning 4 tum kisel rånet i utvecklare lösning för 10 s och låta rånet torka i luften.
- Deponera ett frö lager av en metall, såsom nickel, koppar eller aluminium, på kisel rånet.
- Elektroplätera rånet i en plattsystem i ett nickel sulfamate bad. Genomföra electroplatingen i två steg. I det första steget, varaktig 95 min, använda en strömtäthet av 0,7 A dm−2; Detta fyller helt i nanopatterns med nickel. I det andra steget, varaktig 125 min, Använd 12 A dm−2 för att nå 300 µm som slutliga nickel mögel tjockleken (20 nm). Säkerställa att pH-värdet är på 3.5-3.8 och att temperaturen är på 52-54 ° C.
- Separata nickel mögel från silicon underlaget genom att tillämpa mild mekanisk kraft. Blötlägg nickel mögel i ca 100 mL positiv fotoresist borttagning reagens över natten för att tvätta bort rester från den e-beam-resist.
- Feed nickel mögel i ugn och torr den vid 100 ° C för 3 h. ren det i plasma etsning system med O2 naturgas 10 sccm och 100 W för 3 min.
- Coat en 220 nm-tjockt lager av negativa elektronstråle motstå på en 600 µm tjock 4-i silicon wafer. Skriv arrayen designade nanohole på denna wafer använder ett electron beam litografi system.
- Tillverkning av guld nanostrukturen
- Coat 150 µL av heptadecafluoro-1,1,2,2-tetrahydrodecyl trichlorosilane (FDTS) på nickel mögel i en självmontering enskiktslager (SAM) bestrykningsmaskin vid 80 ° C.
Obs: Detta kommer att utgöra en anti självhäftande skikt, som möjliggör separation av mögel från fotoresist (”demolding”) efter slutförandet av det nanoimprinting steget. Den förångning tid bör vara 180 s, och reaktionstiden bör 900 s. - Imprint nanopatterns på en 4 - in glas wafer som har belagts med ett 300 nm tjocka lager av foto-botas NIL motstå med en nano-imprinter vid ett tryck av 10 bar och en temperatur över 40 ° C i 10 min.
- Överföra mögel, fotoresist och glas rånet till en UV-ljus bota system och photocure med 75 mW cm-2 av UV-exponering för 30 s.
Obs: Om alla steg har följts korrekt, nickel mögel bör enkelt vara demolded från fotoresist. - I ett reactive ion etsning (RIE) system, utför en tom etch av fotoresist på glassubstrat, med en O2 gasflödet av 10 sccm, på 50 W för 2 s att exponera glaset på de indragna områdena.
- Deponera ett 5 nm tjocka lager av krom (Cr) för metall vidhäftning och ett 100-nm lager av guld (Au) för plasmoniska sensorn på glas rånet i en elektronstråle nedfall maskin. Använda en beläggningshastighet 1 Å s−1 för Cr och 2 Å s−1 för Au.
- Utföra lyft av fotoresist O2 plasma etsning för 3 min följt av en 15-s placera mätkolven steg i aceton.
- Tärna provet i 5 mm × 5 mm spån. Nanohole matrisen kommer att sysselsätta den centrala 2 mm × 2 mm av chip.
- Coat 150 µL av heptadecafluoro-1,1,2,2-tetrahydrodecyl trichlorosilane (FDTS) på nickel mögel i en självmontering enskiktslager (SAM) bestrykningsmaskin vid 80 ° C.
- Förvärv av data
- Sätt upp utrustningen att göra de optiska mätningarna så att en stråle av vitt ljus spännande genom slutet av sändaren optisk fiber är parallellt och är incident på sensorn ytan (nanohole array) i 90°.
Obs: Ljuset är transmitterat igenom hela nanohole matrisen. - Samla in den överförda signalen med mottagaren optisk fiber och registrera det med en UV-synliga spektrometer verksamma inom spänna av 300 till 1000 nm.
- Ange förvärv tid för varje bildruta till 20 ms. genomsnitt 100 ramar att erhålla de slutliga spektrumet för att sänka bullret i mätningarna.
- Använda plotting programvara för att analysera data baserat på de tidigare identifierade överföring topparna (med en Lorentz-baserade metod).
- Sätt upp utrustningen att göra de optiska mätningarna så att en stråle av vitt ljus spännande genom slutet av sändaren optisk fiber är parallellt och är incident på sensorn ytan (nanohole array) i 90°.
2. sensor Bulk känslighetstest
- Sätta in standard RI vätskan på flytande cellen, med den RI varierande från 1,31 till 1.39.
- Doppa sensorn chip i standard RI vätskan och justera det mot strålen av vitt ljus. Hämta transmission spektrumet.
- Ren sensorn chip efter varje mätning med en ytaktiva rengöring reagens och torka den med kvävgas.
3. sensor ytmodifiering
- Före eventuella kemiska modifieringar, ren sensorn marker genom sekventiell nedsänkning i isopropanol, aceton och avjoniserat vatten. Torrt i rumstemperatur i en ström av torr kvävgas.
- Inkubera sensorn chips i en etanollösning av 0,4 mM 10-karboxi-1-decanethiol och 1,6 mM 1-octanethiol för 12 timmar vid rumstemperatur.
Obs: Detta kommer att utgöra en amine-reaktivt självmontering enskiktslager (SAM). - Använda etanol skölj och torka i rumstemperatur.
- Gör en blandning av 75 mM sulfo-N-hydroxysuccinimide (sulfo-NHS) och 15 mM 1-ethyl-3-(3-dimethylaminopropyl) carbodiimide (EDC). Fördjupa markerna i denna blandning i 15 min.
Obs: Detta kommer att aktivera karboxyl gruppen av SAM. - Plats 50 µL av 200 µg/mL anti troponin antikropp lösning gjord i en pH 4.5 acetatbuffert på sensorn ytan och inkubera i 30 min.
- Inaktivera de oreagerade estrar av doppa sensorn chip i 1 M etanolamin-HCl-lösning för 15 min.
- Skölj chipet med avjoniserat vatten och torka den i en ström av torr kvävgas vid rumstemperatur.
4. cTnI Assay
- Blockera någon icke-specifik bindning av tubkikare 100 µL av 1% bovint serumalbumin (BSA) lösning på ytan.
Obs: Detta är spektrumet som referens.
Obs: Detta är efter bindande spektrumet.
5. ytan Plasmon resonans (SPR) mätning
- Kör den multiplexade SPR Sensorchipet på SPR systemet med PBS-T buffert.
Obs: Sammansättningen av PBS-T buffert är 20 mM Na-fosfat, 150 mM NaCl och 0,05% Tween-20. PH är 7,4. - Använd cTnI standard och antikroppen, som beskrivs i steg 4.
- Aktivera 3 av de 6 tillgängliga kanalerna med en blandning av EDC (0,2 M) och sulfo-NHS (0,05 M) för 5 min. utför en 5 min injektion av 50 µg/mL antikroppar 560 och en 5-minuters injektion 1 M etanolamin-HCl-lösning.
- Rotera Sensorchipet 90 ° och injicera cTnI standarderna på olika koncentrationer (75, 30, 7,5 och 2,5 ng/mL).
- Iaktta konjugationen till antikroppen på ställen av interaktion på chip i realtid genom SPR utläsningen.
- Regenerera chip genom att injicera 50 mM glycin-HCl (pH 2) för 1 min.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Den optiska setup för att företa mätningar visas i figur 1A. En bild av den faktiska nanohole arrayen ges i figur 1B. För att förstå fysiken körning fjärranalys processen, användes COMSOL simulering programvaran för att simulera distribution av fältet plasmoniska i en vattenlösning miljö. Resultaten från simuleringen var sedan relaterade till den faktiska mätningen. En tidigare publicerad studie innehåller uppgifter om de antaganden som gjorts och de parametrar som används i simulering11,13. De fysiska dimensionerna som används för att simulera fältet plasmoniska för arrayen nanohole var följande: p = 400 nm, D = 150 nm och T = 100 nm. Absorption och spridning effekter tas också in i konto14 vid beräkning av överföring spektrumet. Det simulerade spektrumet jämförs med de experimentellt uppmätta spektrumet i figur 1 c. Både den simulerade och uppmätta spektra förmedla förekomsten av fyra band från 450 till 850 nm. Bandet vid 495 nm motsvarar interband övergången av guld. De tre efterföljande banden, hädanefter kallade band I-III i stigande ordning efter våglängd, finns på 560 nm, 645 nm och 712 nm, respektive. Band I-III observerades för att ha godtagbar anpassning till de experimentellt uppmätta banden, ligger på 558 nm, 638 nm och 724 nm. De påhittade nanoholes är nästan cirkulär form, bör dessa band inte vara känsliga för polarisering av infallande ljus. COMSOL simuleringen kan dessutom direkt visualisering av nära-fält distribution av dessa band som de skulle inträffa i en enhet cell periodisk struktur (figur 1 d). Enheten på stapeln är optiska fältet distribution (V/m) uttryckt i en log-skala. Den högsta stödnivå som observerades var cirka 4,7 (50,119 V/m). Denna storleksordning jämfört med intensiteten av incidensen används i simuleringen (4 340 V/m), och representerar en förbättring av 11.5-fold fältet. De elektromagnetiska fälten för band I och III var lokaliserade på ytan av glassubstrat. Däremot band II var huvudsakligen lokaliserad vid övre kanten av nanohole och valdes för detektion av bioanalyte. Figur 1E illustrerar överföring spektra av nanohole matrisen i vätskor av kända refractive index, som varierade från 1,31 till 1.39. Tre överföring band, motsvarande band I, II och III, observerades spektrum mellan 400-900 nm. En red shift observerades med en förändring i RI. Omfattningen av skiftet följt sekvens bandet II > bandet jag > band III. Figur 1F är en konsolidering av den observerade röda förskjutningar av band I, II och III. Bulk känsligheten beräknas för bandet jag var 322 nm/RIU, för band II var 345 nm/RIU och för band II var 202 nm/RIU.
Figur 2A innehåller schematiskt av fenomenet fjärranalys i aktion. Figur 2B visar förändringen i överföring spektra efter hjärt troponin Molekylerna binder till functionalized chip ytan. Vid låga koncentrationer finns det en linjär förskjutning i bandet med troponin nivån. Skiftet i bandet position kan monteras väl till en bindande isotherm med ett R2 värde på 0,995. Vid närmare observation verkar 30 ng/mL vara den koncentration vid vilken isotherm indikerar uppkomsten av mättnad (figur 2 c).
Figur 3A visar sensorgram från samspelet mellan serum med en modifierad GLC chip chip yta i en XPR36 konfiguration. Tillfångatagandet av cTnI framgår av ökningen av signalen. Därefter kan dissociationen av cTnI i PBST medium (1 x PBS, 0,05% tween 20) observeras då de signalen minskar från 120-660 s. Injecting glycin (regenerering lösningen) för 1 min minskar signalen till 0, vilket indikerar regenerering av fjärranalys ytan genom på komplett tillbakadragandet av cTnI. Sensorgram för efterföljande associering av cTnI regenererad chip yta visas i infällt i figur 3A. Samma protokoll (dvs, doppa i glycin lösning för 1 min) användes för att regenerera nanohole array ytan. Figur 3B visar att placeringen av band 2 skiftar tillbaka till sin ursprungliga plats, vilket bekräftar framgången för steget regenerering.

Figur 1 : Karakterisering av matrisen nanohole. (A) förenklad Schematisk av den experimentella setup. (B) svepelektronmikroskop bild av matrisen nanohole. (C) jämförelse mellan simulerade spektrumet och experimentellt uppmätta överföring spektrumet i vattenlösning miljö. (D), nära fältet distribution som simuleras i COMSOL för band I och III, sett i ett tvärsnittsvyn. Rött representerar starkare nära-fält distribution. Den enhet som visas i färgfältet är | E |, fördelningen av optiska fältet tas i logaritmisk skala. (E) mätas experimentellt överföring spektra av matrisen nanohole i miljöer med standard brytningsindex vätskor (1.31 till 1,39). (F) Bulk känslighet av de tre överföring band (I-III) förändringar i RI mätt i det synliga till NIR utbud. Svart fyrkant: band I, röd cirkel: band II, blå triangel: band III. Figuren har ändrats från Ding o.a. 14 under en CC BY-licens. Klicka här för att se en större version av denna siffra.
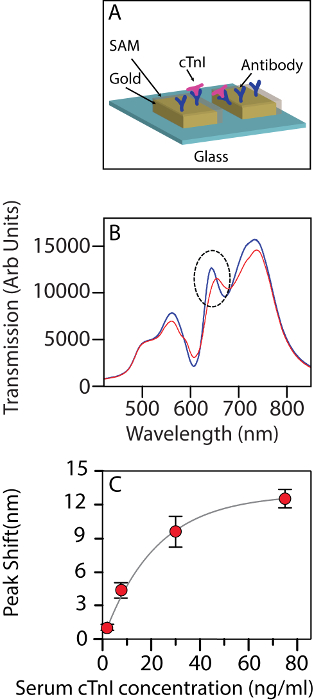
Figur 2 : Nanohole matrisen används som en biosensor. (A) Schematisk bild av nanohole matrisen som används som en biosensor för att upptäcka cTnI. (B) ändringen i överföringen spectrum av biosensor vid interagerar med mänskliga cTnI i en 30 ng/mL koncentration i en bakgrund av serum. Blå: innan interaktion, röd: efter interaktion. Den streckade cirkeln visar bandet spåras. (C) förskjutningen i våglängd för band II vid olika koncentrationer av troponin (2,5 ng/mL, 7,5 ng/mL, 30 ng/mL och 75 ng/mL).Felstaplar visar standardavvikelsen bland n = 3 chips som används för varje mätning. Figuren har ändrats från Ding o.a. 14 under en CC BY-licens. Klicka här för att se en större version av denna siffra.

Figur 3 : Förnyelse av sensorn ytan. (A) en SPR sensorgram från XPR36 visar den injektion av analyten (cTnI) följt av en injektion av glycin att regenerera sensorn ytan. Efterföljande upptäckt mätningar av olika koncentrationer av cTnI mot serum bakgrunden visas i infällt. Den röda stapeln representerar det initiala värdet, medan det svarta fältet visar mätningen efter regenerering av ytan med protokollet beskrivs i texten. (B) förändring i band våglängder observerades efter regenerering av ett nanohole biosensor chip. Σ: standardavvikelsen för förändringar i våglängd band ståndpunkt. Figuren har ändrats från Ding o.a. 14 under en CC BY-licens. Klicka här för att se en större version av denna siffra.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Simulera samspelet mellan infallande ljus och nanostrukturerna gör det möjligt att identifiera lämpliga toppen (i överföring spektrum), vars SKIFT kan registreras som en funktion av koncentrationen av analyten. Det är viktigt att notera att lokaliseringen av banden med avseende på strukturen på sensorn är avgörande för valet av rätt bandet, vars SKIFT kan spåras till känna analyten. Visualisering kan uppnås genom simuleringar. Detta är också kritiska till utformningen av en optimal struktur som gör att biosensing av analyter. Som kan ses här, band I och III är lokaliserade i glas-guld-gränssnittet och därför är inte användbart för biosensing. En framstående LSPR komponent kan observeras i band II. Det visar en kort decay längd och är lokaliserad på kanten av nanoholes. Som sådan, lämpar detta sig väl för som används för avkänning analyten koncentrationer. Kvaliteten på den påhittade nanostrukturer över hela utbud är också viktigt att kvaliteten på spectra samlas in. Icke-enhetlig strukturer kommer att införa artefakter.
Ytspridning och oundvikliga absorption skapa artefakter i en vattenlösning mätning. Övergripande signal-brus-förhållandet störs också av närvaron av vattenhaltigt medium. Om det finns flera lämpliga band vars förskjutningar kan övervakas för biosensing, måste följande punkter beaktas. Sub 600 nm våglängder påverkas markant observerade överföring spektrumet av protein absorption och partikel spridning. Däremot, med våglängder större än 900 nm kan skapa förvirring genom att dölja de viktiga underliggande signaler som kommer från bindande händelserna, som i denna region, absorptionen av vatten ökar med våglängd. För avkänning analyter i vattenlösning miljö, därför, ligger band II optimalt i termer av våglängd. En liten avvikelse vid mätning av bandet position kunde observeras. Detta orsakas av stora sensorstorlek. Medan den stora sensorn översätter så småningom till kortare anskaffningstid eftersom varje upptäckt pixel nu se en större-än-vanligt flux av fotoner, påverkar det också negativt buller. I själva verket om samlingen signal inte utförs korrekt och data konditionering inte optimalt utformad, kan en hel del buller observeras. Från i genomsnitt insamlade signalen över 100 frames15, ljudnivån kan sänkas. Medan det finns andra sätt att producera LSPR signaler, särskilt från Guldnanopartiklar16, är nanohole matrisen mycket mer genomförbart att genomföra i ett bärbart format med mikrofluidik. Hela enheten kan användas för POC-program på grund av en enkel automatisering av hela processen och möjligheten att regenerera fjärranalys ytan.
Detta experimentellt protokoll har utformats för att minimera experimentella fel genom att använda sändningsteknik i stället för reflektans. Detta minskar möjligt artefakter från meta-av-förekomsten förändringar. Det är också viktigt att påpeka hur kritiska steg 3,4, när antikroppen är tvärbundna till sensorn ytan. Det är viktigt att bevara Reaktiviteten hos både sulfo-NHS och EDC. Det konstaterades också att byta från NHS till sulfo-NHS var kritiska för förbättrad stabilitet. Om proverna skall återanvändas, rekommenderas förvaring i flytande kväve. Den plattform teknik som visas här kan användas för att övervaka andra kliniska biomarkörer, med lämpliga ytmodifiering.
Genomträngningen av LSPR sensorer har hittills begränsats av begränsningarna av möjligheten att skapa lyhörd ytor över stora områden med en reproducerbarhet liknande den i halvledarindustrin. Stora fjärranalys ytor kan vara enkelt gränssnitt med standard och kostnadseffektiva optik. Precision i tillverkningsprocessen skulle också minska chip-till-chip variansen, en kritisk flaskhals för att förbättra tillförlitligheten i mätningar, vilket är avgörande i en klinisk miljö. I samband med en medicinteknisk produkt, där seriella mätningar krävs, är reproducerbarheten för surface regenerering också avgörande. Det har också visats att optimal protokollet för regenerering fjärranalys ytan kan etablerade i en kommersiellt tillgänglig SPR-plattform och sedan framgångsrikt översatt till arrayen nanohole. Effektiviteten av regenerering kan enkelt beräknas för nanohole matrisen, och lämpligheten av regenererad ytan för upprepade mätningar kan bedömas. Vid robust ytkemi ändring och förnyelse protokoll som fastställer kan LSPR sensorer vara en känslig men enkel plattform för realtid bioanalyte upptäckt. Det är lätt att förutse dess betydande inverkan på patientvård. Det ska noteras att den absoluta känsligheten på sensorn inte kan matcha de mest avancerade ELISA-testerna. Några förstärkning strategier behöver utformas för att öka känsligheten. Även i sin nuvarande form, denna teknik innebär en betydande förbättring i förhållande till etablerade nanoimprinted LSPR protokoll, eftersom det definierar en ny lägre gräns för etikett-fri detektion av en kardiovaskulär biomarkör med en överföring-baserade optisk Setup. Tekniken utvecklas mot genomförandet av övervakning i realtid av flera kliniskt viktiga biomarkörer. Ytterligare förbättringar i datainsamling (t.ex. detektorer med bättre upplösning) och efterföljande signalbehandling kan hjälpa LSPR-baserade sensorer uppnå detta.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Författarna har ingen konkurrerande finansiella intressen.
Acknowledgments
AP erkänner stöd av Prof T Venkatesan, direktör, NUS nanovetenskap och nanoteknik initiativ och Office som vice ordförande (National University of Singapore) (R-398-000-084-646). CLD erkänner stöd av Singapore ministeriet för hälsa nationella medicinska forskningsrådet under dess klinikern vetenskapsman finansieringsordningen, NMRC/CSA/035/2012, och National University of Singapore. Finansiärerna hade ingen roll i studiedesign, datainsamling och analys, beslut om att offentliggöra eller beredning av manuskriptet.
Materials
| Name | Company | Catalog Number | Comments |
| Electron Beam Lithography setup | Elionix ELS 700 | ||
| o-Xylene | Sigma Aldrich | 95662 | |
| EB resist | Sumitomo | NEB-22A2 | |
| Developer reagent | Shipley Company | Microposit MF 321 | |
| Electroplating machine | Technotrans AG RD 50 | ||
| Photoresist stripper | Rohm and Haas Electronic Materials LLC | Microposit Remover 1165 | |
| Etching System | Trion Phantom | ||
| Heptadecafluoro-1,1,2,2-tetrahydrodecyl)trichlorosilane | Gelest (PA, USA) | 78560-44-8 | |
| SAM coater | Sorona Inc. | AVC 150M | |
| Photo-curable NIL resist | micro resist technology GmbH | mr-UVCur21-300nm | |
| Light Curing System | Dymax | Model 2000 Flood | |
| E-beam deposition machine | Denton Explorer | ||
| UV-visible spectrometer | Ocean optic HR2000+ (Dunedin, FL, USA) | ||
| Standard refractive index liquids | Cargill Inc (Cedar Grove, USA) | 18032 | |
| Plotting software | Origin | Origin Pro 9 | |
| 10-carboxy-1-decanethiol | Dojindo Laboratories (Japan) | C385-10 | |
| 1-octanethiol | Sigma-Aldrich, MO, USA | 471386 | |
| Sulfo-N-hydroxysuccinimide and 1-ethyl-3-(3-dimethylaminopropyl) carbodiimide | BioRad (CA, USA) | 1762410 | |
| Anti-troponin antibody 560 | Hytest (Finland) | 4T21 | |
| Ethanolamine-HCl solution | BioRad (CA, USA) | 1762450 | |
| Surface Plasmon Resonance setup | BioRad XPR36 (Haifa, Israel) | ||
| Multiplexed SPR chip | BioRad | GLC | |
| Human cTnI standard | Phoenix Pharmaceuticals | EK -311-05 | |
| Glycine-HCl | BioRad (CA, USA) | 1762221 |
References
- Ebbesen, T. W., Lezec, H. J., Ghaemi, H., Thio, T., Wolff, P. Extraordinary optical transmission through sub-wavelength hole arrays. Nature. 391 (6668), 667-669 (1998).
- Krishnan, A., et al. Evanescently coupled resonance in surface plasmon enhanced transmission. Optics Comm. 200 (1), 1-7 (2001).
- Yang, J. -C., et al. Enhanced optical transmission mediated by localized plasmons in anisotropic, three-dimensional nanohole arrays. Nano letters. 10 (8), 3173-3178 (2010).
- Kim, J. H., Moyer, P. J. Transmission characteristics of metallic equilateral triangular nanohole arrays. Appl Phys Lett. 89 (12), 121106 (2006).
- Liu, H., Lalanne, P. Microscopic theory of the extraordinary optical transmission. Nature. 452 (7188), 728-731 (2008).
- Shon, Y. -S., Choi, H. Y., Guerrero, M. S., Kwon, C. Preparation of nanostructured film arrays for transmission localized surface plasmon sensing. Plasmonics. 4 (2), 95-105 (2009).
- Xiang, G., Zhang, N., Zhou, X. Localized surface plasmon resonance biosensing with large area of gold nanoholes fabricated by nanosphere lithography. Nanoscale Res Lett. 5 (5), 818 (2010).
- Valsecchi, C., Brolo, A. G. Periodic metallic nanostructures as plasmonic chemical sensors. Langmuir. 29 (19), 5638-5649 (2013).
- Gates, B. D., et al. New approaches to nanofabrication: molding, printing, and other techniques. Chem Rev. 105 (4), 1171-1196 (2005).
- Guo, L. J. Nanoimprint lithography: methods and material requirements. Adv Mater. 19 (4), 495-513 (2007).
- Wong, T. I., et al. High throughput and high yield nanofabrication of precisely designed gold nanohole arrays for fluorescence enhanced detection of biomarkers. Lab on a Chip. 13 (12), 2405-2413 (2013).
- Deng, J., Wong, T. I., Sun, L. L., Quan, C., Zhou, X. Acceleration of e-beam lithography by minimized resist exposure for large scale nanofabrication. Microelect Eng. 166, 31-38 (2016).
- Wu, L., Bai, P., Li, E. P. Designing surface plasmon resonance of subwavelength hole arrays by studying absorption. JOSA B. 29 (4), 521-528 (2012).
- Ding, T., et al. Quantification of a cardiac biomarker in human serum using extraordinary optical transmission (EOT). PloS one. 10 (3), 0120974 (2015).
- Im, H., Sutherland, J. N., Maynard, J. A., Oh, S. -H. Nanohole-based surface plasmon resonance instruments with improved spectral resolution quantify a broad range of antibody-ligand binding kinetics. Anal Chem. 84 (4), 1941-1947 (2012).
- Bhagawati, M., You, C., Piehler, J. Quantitative real-time imaging of protein-protein interactions by LSPR detection with micropatterned gold nanoparticles. Anal Chem. 85 (20), 9564-9571 (2013).



 . För exponering dosen 110 µC cm−2är e-beam bostaden tiden på varje exponerade dot 0,5 µs12. Eftersom matrisen fångar ett område av 1,8 mm2, finns det sammanlagt 36 fläckar av 300 µm2 fältet områden sys ihop till form en stor, guld nanohole matris.
. För exponering dosen 110 µC cm−2är e-beam bostaden tiden på varje exponerade dot 0,5 µs12. Eftersom matrisen fångar ett område av 1,8 mm2, finns det sammanlagt 36 fläckar av 300 µm2 fältet områden sys ihop till form en stor, guld nanohole matris.