Summary
这项工作描述了 nanoimprinting 光刻方法, 制造高质量的传感阵列的工作原理, 非凡的光传输。该生物传感器成本低廉, 健壮, 易于使用, 并能检测血清心肌肌钙蛋白 i 在临床相关浓度 (99th百分比截止∼10-400 pg/毫升, 取决于化验)。
Abstract
对于一个传感平台具有临床相关性的点 (POC) 的设置, 化验灵敏度, 重现性, 并能够可靠地监测分析的背景下, 人血清是至关重要的。
Nanoimprinting 光刻 (零) 被用来制造, 在低成本, 传感面积高达1.5 毫米 x 1.5 毫米。传感面是由高保真阵列的 nanoholes, 每一个面积约 140 nm2。零的巨大再现性使得在12个单独制造的表面上使用一个单芯片的单测量策略成为可能, 最小的芯片变化。这些 nanoimprinted 的局部表面等离子体共振 (LSPR) 芯片被广泛测试的能力, 以可靠地测量 bioanalyte 在浓度变化, 从2.5 到 75 ng/毫升在一个复杂的背景 biofluid-in 这种情况下, 人血清。零的高保真度使产生大的传感区, 这反过来又消除了对显微镜的需要, 因为这种生物传感器可以很容易地与一个普通的实验室光源接口。这些生物传感器可以检测高灵敏度的血清心肌肌钙蛋白, 在 0.55 ng/毫升的检测限度 (LOD), 这是临床相关的。它们也显示出低的芯片方差 (由于制造过程的高质量)。结果是相称与广泛使用的酶联免疫吸附试验 (ELISA) 的基础上, 但该技术保留了 LSPR-based 传感平台的优势 (即,可的小型化和多路复用, 使其更适合于 POC 应用程序)。
Introduction
基于纳米阵列的化学传感器一直是许多调查的主题, 因为在 1998年1中, Ebbesen et al.发布了第一份关于特殊光传输 (EOT) 的报告。当光撞击波长维纳米结构的周期阵列时, 增强的透射在特定波长上发生。当入射光与极化 (BW) 和/或局部表面等离子体 (LSP)2时发生。
当与这样的周期数组传感时, 所利用的底层物理原理很简单。分子在金属界面上的吸附, 改变了介质在接触金属时的介电常数, 反过来又转移了光谱中传输波段的位置。频谱本身可以通过纳米工程来调整形状、大小和分离距离3,4,5。根据设计, 基于 EOT 的传感器在其光谱中具有特征波段, 在分子结合事件的调查过程中, 它能促进特定的赋值6、7、8 。这是一个关键的优势比商业可用表面等离子共振 (SPR) 平台。
使用 EOT 的传感器通常涉及光源的光学对准, 使准直光束在传感表面发生入射。生成大型纳米表面的技术 (如共聚模板和干涉和纳米光刻) 的重现性较差,9。由于这些限制在精确地制造出显示 EOT 现象的大表面, 需要光学显微镜来正确定位光源和探测器。为了简化技术, 采用了高质量的 nanoimprinting 光刻 (零)10 。这使得大的传感器表面区域的生产11 (毫米级), 消除了需要显微镜来寻找传感表面上的芯片。相反, 这种传感器可以很容易地与标准的光缆连接。
由于此纳米阵列的传输峰值包含在可见光近红外区域 (近红外线), 因此它非常适合于在水环境中感知生物分子的结合事件。模拟了纳米阵的期望光学行为。通过对标准折射率 (RI) 液体的研究, 验证了实验结果的正确性。该阵列用于测定心肌肌钙蛋白 i (cTnI) 在人血清复杂背景下的浓度。cTnI 是诊断急性心肌梗死的临床金标准。
使用该传感器, 可以检测和量化的 cTnI 在人血清中的检测限度 (LOD) 的 0.55 ng/毫升, 这是临床相关的。该检测比最常用的技术在这个领域, 酶联免疫吸附试验 (ELISA) 快得多。此外, 传感表面可以很容易地再生, 因此可重复使用。因此, 这项工作表明, 纳米阵列的承诺, 作为一个可行的点 (POC) 技术的传感在复杂的 biofluids。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. 传感器的制造和数据的获取
- 镍模的制备
- 将一层220纳米厚的负电子束阻挡在600µm 厚的4的硅片上。使用电子束光刻系统编写该晶片上设计的纳米阵列。
- 为了加速电子束写入, 请为每个300µm 字段大小 (a) (即,在每个300µm2区域上映射4亿点, 并将每个点都由电子束或不显示, 以低 dotmap (N) 为20k 写入模式。, 具体取决于图案设计)。设置抗电子束抗照射剂量为抵抗到110µC cm2并且写在当前 (I) 800 pA。
注意: 在电子束写入时, 曝光剂量 (D) 由每个点 (T点) 的曝光时间控制, 由计算. 对于暴露剂量在110µC cm2, 电子束的居住时间在每个暴露的点是0.5 µs12。由于数组捕获的区域为 1.8 mm2, 因此总共有36块 300-µm2字段区域缝合在一起, 形成一个大的金纳米阵列。
对于暴露剂量在110µC cm2, 电子束的居住时间在每个暴露的点是0.5 µs12。由于数组捕获的区域为 1.8 mm2, 因此总共有36块 300-µm2字段区域缝合在一起, 形成一个大的金纳米阵列。
- 为了加速电子束写入, 请为每个300µm 字段大小 (a) (即,在每个300µm2区域上映射4亿点, 并将每个点都由电子束或不显示, 以低 dotmap (N) 为20k 写入模式。, 具体取决于图案设计)。设置抗电子束抗照射剂量为抵抗到110µC cm2并且写在当前 (I) 800 pA。
- 开发的抵抗, 浸泡4英寸硅片在开发商的解决方案, 十年代, 让硅片干燥在空气中。
- 在硅片上沉积金属的种子层, 如镍、铜或铝。
- 在镀镍氨基镀液中电镀晶片。两步进行电镀。在第一步, 持续95分钟, 使用电流密度为0.7 的 dm2;这完全填补了 nanopatterns 与镍。在第二步, 持续125分钟, 使用 12 dm2达到300µm 作为最终的镍模具厚度 (20 nm)。确保 pH 值在 3.5-3.8, 温度在 52-54 ° c。
- 使用柔和的机械力将镍模与硅基体分离。将镍模浸泡在约100毫升的正光刻胶去除剂中过夜, 清洗掉电子束的残留物。
- 将镍模放入烤箱中, 在100° c 的3小时内将其晾干. 在等离子蚀刻系统中, 用 O2气体在 10 sccm 和 100 W 处清洁它, 3 分钟。
- 将一层220纳米厚的负电子束阻挡在600µm 厚的4的硅片上。使用电子束光刻系统编写该晶片上设计的纳米阵列。
- 金纳米结构的制备
- 在80° c 的自组装单层 (SAM) 涂层机上, 在镍模上涂150µL heptadecafluoro-1,1,2,2-tetrahydrodecyl 硅 (FDTS)。
注: 这将形成一个粘层, 这将使模具分离的光刻胶 ("脱模") 后完成的 nanoimprinting 步骤。气化时间应 180s, 反应时间应900s。 - 印记的 nanopatterns 4 在玻璃晶片已被涂上300纳米厚的光固化无抵抗使用纳米印刷机在压力的 10 bar 和温度40° c 为10分钟。
- 将模具、光刻胶和玻璃晶片转换为 uv 光固化系统, 并在三十年代使用 75 mW cm-2的 uv 曝光 photocure。
注: 如果所有步骤都被正确地遵循, 镍模具应该很容易 demolded 从光刻胶。 - 在反应离子蚀刻系统中, 对玻璃基板上的光刻胶进行一个空白蚀刻, 用 O2气体流量为 10 sccm, 在 50 W 处为 2 s, 在缩进区域中暴露玻璃。
- 在电子束沉积机的玻璃晶片上沉积一层5纳米厚的铬 (Cr), 用于金属附着力和100纳米金 (Au) 的浆传感器。为 Au 使用1Å s1的沉积速率, 用于 Cr 和2Å的− 1 。
- 用 O2等离子蚀刻进行3分钟的光刻, 然后在丙酮中进行15秒的可步骤。
- 将样品切成5毫米 x 5 毫米的筹码。该纳米阵列将占据中央2毫米 x 2 毫米的芯片。
- 在80° c 的自组装单层 (SAM) 涂层机上, 在镍模上涂150µL heptadecafluoro-1,1,2,2-tetrahydrodecyl 硅 (FDTS)。
- 数据的承购
- 设置该仪器, 使光学测量, 使得通过发射器光纤的一端的白光光束是准直的, 是入射到传感器表面 (纳米阵列) 在90°。
注意: 光通过整个纳米阵列传输。 - 收集传输信号与接收器光纤和记录它与紫外可见光谱仪操作在范围300到1000毫微米之内。
- 将每个帧的获取时间设置为20毫秒平均100帧, 以获得最终频谱以降低测量中的噪音。
- 使用绘图软件根据先前确定的传输峰值 (使用 Lorentz-based 方法) 分析数据。
- 设置该仪器, 使光学测量, 使得通过发射器光纤的一端的白光光束是准直的, 是入射到传感器表面 (纳米阵列) 在90°。
2. 传感器体积灵敏度测试
- 将标准 ri 液体存入液体细胞, ri 的变化从1.31 到1.39。
- 将传感器芯片浸入标准 RI 液体中, 并将其与白光光束对齐。获得传输频谱。
- 在每次测量后用 surface-active 清洗剂清洗传感器芯片, 并用氮气将其烘干。
3. 传感器表面改性
- 在任何化学修饰之前, 通过依次浸入异丙醇、丙酮和去离子水来清洗传感器芯片。在干燥的氮气流中室温干燥。
- 在室温下, 在 0.4 mm 10-羧基-1-癸和 1.6 mm 1-硫的乙醇溶液中孵育传感器芯片。
注: 这将形成一个胺反应自组装单层 (SAM)。 - 使用乙醇在室温下彻底冲洗和干燥。
- 做一个75毫米磺 n-羟基琥珀酰亚胺 (磺-NHS) 和15毫米 1-乙基 3-(3-dimethylaminopropyl) 二的混合物。将此混合物中的筹码浸泡15分钟。
注意: 这将激活 SAM 的羧酸组。 - 斑点50µL 的200µg/毫升 anti-troponin 抗体溶液在 pH 值4.5 醋酸酯缓冲液中的传感器表面和孵化30分钟。
- 将传感器芯片浸入1米乙醇胺-HCl 溶液中15分钟, 使未酯钝化。
- 用去离子水冲洗芯片, 在室温下在干氮气的气流中干燥。
4. cTnI 测定
- 通过在表面上发现100µL 1% 牛血清白蛋白 (BSA) 溶液, 阻止任何非特异性结合。
注: 这是参考光谱。
注: 这是 after-binding 频谱。
5. 表面等离子体共振 (SPR) 测量
- 用 PBS t 缓冲器在 spr 系统上运行复用 spr 传感器芯片。
注: PBS t 缓冲液的组成为20毫米钠磷酸盐, 150 毫米氯化钠, 0.05% 吐温20。pH 值为7.4。 - 使用 cTnI 标准和抗体, 如步骤4所述。
- 激活3出6可用通道与混合的0.2 米和磺-NHS (0.05 米) 为5分钟. 执行5分钟注射50µg/毫升抗体560和5分钟注射1米乙醇胺盐酸溶液。
- 将传感器芯片旋转90度, 并在不同浓度 (75、30、7.5 和 2.5 ng/毫升) 中注入 cTnI 标准。
- 通过 SPR 读出, 观察芯片上的相互作用点上的抗体的共轭。
- 通过注射50毫米甘氨酸盐酸盐 (pH 2) 来再生芯片, 1 分钟。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
用于测量的光学设置显示在图 1A中。在图 1B中给出了实际纳米数组的图像。为了了解物理驱动传感过程, 利用 COMSOL 仿真软件模拟了浆场在水环境中的分布。模拟结果与实测值有关。先前发布的研究包含了所做假设的详细信息和模拟1113中使用的参数。用于模拟纳米阵列的浆场的物理尺寸如下: p = 400 nm, D = 150 nm, T = 100 nm。在计算传输频谱时, 还考虑了14的吸收和散射效应。将模拟光谱与图 1C中的实验测量光谱进行比较。模拟和被测量的光谱传达四条带的存在从450到850毫微米。在 495 nm 的波段对应于黄金的带过渡。三随后带, 以后被叫的波段 I III 在增加的波长顺序, 分别位于560毫微米, 645 毫微米和712毫微米。观察到的波段 I-III 有可接受的对准实验测量带, 位于 558 nm, 638 nm, 和 724 nm。由于制作的 nanoholes 是几乎圆形的形状, 这些波段不应该对入射光的偏振敏感。此外, COMSOL 模拟可以直接可视化这些频带的近场分布, 因为它们会出现在周期性结构的单元单元中 (图 1D)。颜色条上的单位是以对数刻度表示的光场分布 (V/m)。观察到的最高强度约为 4.7 (50119 伏/米)。与模拟 (4340 伏/米) 的入射强度相比, 这个震级代表了11.5 倍的磁场增强。第一和第三波段的电磁场被定位在玻璃基板的表面。相比之下, 第二波段主要是在纳米的顶端边缘, 并被选择用于检测 bioanalyte。图 1E说明了已知折射率液体中纳米阵列的透射谱, 其变化从1.31 到1.39。在 400-900 nm 的光谱范围内观察到三传输带, 对应于 I、II 和 III 波段。随着 RI 的变化, 观察到了一个红色的转变。变化的大小跟随了序列带 II 和 #62; 乐队 I 和 #62; 乐队 III。图 1F是对带 I、II 和 III. 的观察到的红色移位的合并第一波段的体积灵敏度计算为 322 nm/情报, 第二波段为 345 nm/情报, 第二波段为 202 nm/情报。
图 2A包含了行动中的传感现象的示意图。图 2B显示了心肌肌钙蛋白分子与功能化芯片表面结合后透射光谱的变化。在低浓度, 有一个线性变化的波段与肌钙蛋白水平。带位置的移位可以很好地安装到具有 R2值0.995 的绑定等温线。仔细观察后, 30 ng/mL 似乎是等温线表示饱和的起始浓度 (图 2C)。
图 3A显示了在 XPR36 设置中, 从血清与修饰 GLC 芯片的芯片表面的相互作用中 sensorgram。信号的上升显示了 cTnI 的捕获。此后, cTnI 在 PBST 介质 (1x PBS, 0.05% 吐温 20) 的离解可以观察到信号从 120-660s 的下降. 注射甘氨酸 (再生溶液) 为 1 min 减少信号到 0, 表示传感表面的再生通过完全脱离 cTnI。随后将 cTnI 与再生芯片表面关联的 sensorgram 显示在图 3A的插图中。同样的协议 (即浸泡在甘氨酸溶液中1分钟) 被用来再生纳米阵列表面。图 3B显示了带2的位置移回其原始位置, 从而确认了再生步骤的成功。

图 1: 纳米数组的特性.(A) 实验装置的简化示意图。(B) 扫描电子显微镜图像的纳米阵列。(C) 模拟光谱和实验测量的透射光谱在水环境中的比较。(D) 在横截面视图中的 COMSOL I 和 III 波段的模拟的近场分布。红色代表更强的近场分布。颜色栏中显示的单位是 |E、光场的分布, 在对数尺度下拍摄。(E) 在具有标准折射率液体 (1.31 到 1.39) 的环境中测量纳米阵列的透射光谱。(F) 三传输带 (I-III) 的大容量灵敏度, 以在可见到近红外波段测量的 RI 变化。黑方块: I 波段, 红色圆圈: II 波段, 蓝色三角形: 带 III。该图已从丁et al.中修改14在 "抄送人" 的许可下。请单击此处查看此图的较大版本.
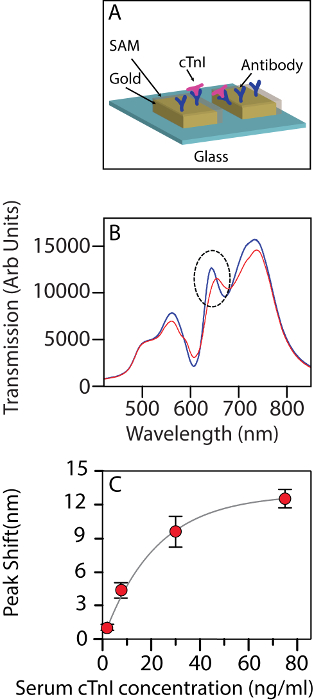
图 2: 用作生物传感器的纳米数组.(A) 纳米阵列示意图被用作检测 cTnI 的生物传感器。(B) 生物传感器的透射谱在与人类 cTnI 的交互作用下, 在血清背景中的 30 ng/毫升浓度的变化。蓝色: 在交互之前, 红色: 在交互之后。虚线圆圈表示正在跟踪的带区。(C) 在不同浓度的肌钙蛋白 (2.5 ng/毫升, 7.5 ng/毫升, 30 ng/毫升, 75 ng/毫升) 波长的变化。误差线显示每个测量所用的 n = 3 芯片之间的标准偏差。该图已从丁et al.中修改14在 "抄送人" 的许可下。请单击此处查看此图的较大版本.

图 3: 传感器曲面的再生.(A) 来自 XPR36 的 SPR sensorgram 显示分析物 (cTnI) 的注入, 然后注射甘氨酸以重新生成传感器表面。随后的检测测量不同浓度的 cTnI 对血清背景显示在插页。红色条形图表示初始值, 而黑色条形图则在曲面再生后显示的度量与文本中描述的协议相同。(B) 纳米生物传感器芯片再生后观察到的波段波长的变化。σ: 在波段位置的波长上的移位的标准偏差。该图已从丁et al.中修改14在 "抄送人" 的许可下。请单击此处查看此图的较大版本.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
通过模拟入射光和纳米结构之间的相互作用, 可以识别出合适的峰值 (在透射谱中), 其位移可记录为分析物浓度的函数。重要的是要注意, 对传感器结构的波段的本地化是至关重要的选择正确的波段, 其转移可以跟踪, 以感知分析物。可视化可以通过仿真实现。这也是关键的设计一个优化结构, 使传感的分析。正如这里所看到的, 第一和第三波段是在玻璃金色的界面上定位的, 因此对传感是无用的。在带 II. 中可以观察到一个突出的 LSPR 成分它显示了一个短的衰变长度和本地化的边缘的 nanoholes。因此, 这很适于用于检测分析物的浓度。在整个阵列上制备的纳米结构的质量对采集到的光谱质量也至关重要。非统一结构将引进文物。
散射和不可避免的吸收在水的测量中创造了人工制品。总的信噪比也被水介质的存在所干扰。如果有多个合适的波段可以监测传感的变化, 必须考虑以下几点。在亚 600 nm 波长上, 观察到的透射光谱受到蛋白质吸收和粒子散射的显著影响。另一方面, 使用大于 900 nm 的波长可以通过隐藏来自绑定事件的重要潜在信号而产生混淆, 就像在这个区域, 水的吸收随波长的增加而增大。因此, 对于在水环境中传感分析, 波段 II 在波长方面是最佳的。在测量波段位置可以观察到微小的偏差。这是由较大的传感器大小引起的。虽然大型传感器最终会转换为较短的捕获时间, 因为每个检测像素现在都看到比通常更大的光子通量, 但它也会对噪音产生负面影响。事实上, 如果信号采集没有正确地执行, 数据调理没有得到最佳的设计, 那么就可以观察到大量的噪声。通过将收集的信号平均超过100帧15, 可以降低噪音级别。虽然有其他的方法来产生 LSPR 信号, 特别是从金纳米粒子16, 纳米阵列是更可行的实现以便携格式的微。整个装置可用于 POC 的应用, 因为整个过程的自动化程度很容易, 并可能使传感面再生。
该实验协议的目的是利用传输模式而不是反射率来减少实验误差。这削减了可能的文物从 angle-of-incidence 的变化。当抗体与传感器表面交联时, 指出步骤3.4 的临界性质也很重要。重要的是要保持磺的反应性-NHS 和。还发现, 从 nhs 转向磺-nhs 对改善稳定性至关重要。如果样品被重复使用, 建议在液氮下储存。此处显示的平台技术可用于监视其他临床生物标志物, 并进行适当的表面修饰。
到目前为止, LSPR 传感器的渗透受到限制的能力, 以创造响应的表面在大面积的重复性类似于半导体工业。大的传感表面可以很容易地与标准和 cost-effective 光学接口。制造过程中的精确度也会降低芯片方差, 这是提高测量可靠性的关键瓶颈, 在临床环境中至关重要。在医疗设备的情况下, 在需要进行串行测量时, 表面再生的重现性也是至关重要的。还证明了在商用的 SPR 平台上可以建立可用于再生传感表面的最佳协议, 然后成功地将其转换为纳米阵列。可以很容易地计算纳米阵列的再生效率, 并且可以评估再生表面对重复测量的适用性。在建立强大的表面化学修饰和再生协议, LSPR 传感器可以是一个敏感而简单的平台, real-time bioanalyte 检测。它很容易预见它对病人护理的重大影响。值得注意的是, 传感器的绝对灵敏度不能与最先进的 ELISA-based 测试相匹配。一些放大策略需要设计来提高灵敏度。即使在目前的形式, 这项技术是一个显着的改进相对于既定的 nanoimprinted LSPR 协议, 因为它定义了一个新的下限, 无标签检测心血管生物标志物使用 transmission-based 光学安装.技术正在朝着实施 real-time 监测多个临床重要的生物标志物的方向发展。数据获取的进一步改进 (例如,具有更好分辨率的检测器) 和后续的信号处理可以帮助 LSPR-based 传感器实现这一点。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
作者没有相互竞争的金融利益。
Acknowledgments
美联社感谢文卡特山教授、新加坡国立大学纳米和纳米技术倡议和副校长办公室 (R-398-000-084-646) 的支持。CLD 承认新加坡卫生部国家医学研究理事会在其临床科学家资助计划 NMRC/CSA/035/2012 和新加坡国立大学的支持。资助者在研究设计、数据收集和分析、决定出版或准备原稿方面没有作用。
Materials
| Name | Company | Catalog Number | Comments |
| Electron Beam Lithography setup | Elionix ELS 700 | ||
| o-Xylene | Sigma Aldrich | 95662 | |
| EB resist | Sumitomo | NEB-22A2 | |
| Developer reagent | Shipley Company | Microposit MF 321 | |
| Electroplating machine | Technotrans AG RD 50 | ||
| Photoresist stripper | Rohm and Haas Electronic Materials LLC | Microposit Remover 1165 | |
| Etching System | Trion Phantom | ||
| Heptadecafluoro-1,1,2,2-tetrahydrodecyl)trichlorosilane | Gelest (PA, USA) | 78560-44-8 | |
| SAM coater | Sorona Inc. | AVC 150M | |
| Photo-curable NIL resist | micro resist technology GmbH | mr-UVCur21-300nm | |
| Light Curing System | Dymax | Model 2000 Flood | |
| E-beam deposition machine | Denton Explorer | ||
| UV-visible spectrometer | Ocean optic HR2000+ (Dunedin, FL, USA) | ||
| Standard refractive index liquids | Cargill Inc (Cedar Grove, USA) | 18032 | |
| Plotting software | Origin | Origin Pro 9 | |
| 10-carboxy-1-decanethiol | Dojindo Laboratories (Japan) | C385-10 | |
| 1-octanethiol | Sigma-Aldrich, MO, USA | 471386 | |
| Sulfo-N-hydroxysuccinimide and 1-ethyl-3-(3-dimethylaminopropyl) carbodiimide | BioRad (CA, USA) | 1762410 | |
| Anti-troponin antibody 560 | Hytest (Finland) | 4T21 | |
| Ethanolamine-HCl solution | BioRad (CA, USA) | 1762450 | |
| Surface Plasmon Resonance setup | BioRad XPR36 (Haifa, Israel) | ||
| Multiplexed SPR chip | BioRad | GLC | |
| Human cTnI standard | Phoenix Pharmaceuticals | EK -311-05 | |
| Glycine-HCl | BioRad (CA, USA) | 1762221 |
References
- Ebbesen, T. W., Lezec, H. J., Ghaemi, H., Thio, T., Wolff, P. Extraordinary optical transmission through sub-wavelength hole arrays. Nature. 391 (6668), 667-669 (1998).
- Krishnan, A., et al. Evanescently coupled resonance in surface plasmon enhanced transmission. Optics Comm. 200 (1), 1-7 (2001).
- Yang, J. -C., et al. Enhanced optical transmission mediated by localized plasmons in anisotropic, three-dimensional nanohole arrays. Nano letters. 10 (8), 3173-3178 (2010).
- Kim, J. H., Moyer, P. J. Transmission characteristics of metallic equilateral triangular nanohole arrays. Appl Phys Lett. 89 (12), 121106 (2006).
- Liu, H., Lalanne, P. Microscopic theory of the extraordinary optical transmission. Nature. 452 (7188), 728-731 (2008).
- Shon, Y. -S., Choi, H. Y., Guerrero, M. S., Kwon, C. Preparation of nanostructured film arrays for transmission localized surface plasmon sensing. Plasmonics. 4 (2), 95-105 (2009).
- Xiang, G., Zhang, N., Zhou, X. Localized surface plasmon resonance biosensing with large area of gold nanoholes fabricated by nanosphere lithography. Nanoscale Res Lett. 5 (5), 818 (2010).
- Valsecchi, C., Brolo, A. G. Periodic metallic nanostructures as plasmonic chemical sensors. Langmuir. 29 (19), 5638-5649 (2013).
- Gates, B. D., et al. New approaches to nanofabrication: molding, printing, and other techniques. Chem Rev. 105 (4), 1171-1196 (2005).
- Guo, L. J. Nanoimprint lithography: methods and material requirements. Adv Mater. 19 (4), 495-513 (2007).
- Wong, T. I., et al. High throughput and high yield nanofabrication of precisely designed gold nanohole arrays for fluorescence enhanced detection of biomarkers. Lab on a Chip. 13 (12), 2405-2413 (2013).
- Deng, J., Wong, T. I., Sun, L. L., Quan, C., Zhou, X. Acceleration of e-beam lithography by minimized resist exposure for large scale nanofabrication. Microelect Eng. 166, 31-38 (2016).
- Wu, L., Bai, P., Li, E. P. Designing surface plasmon resonance of subwavelength hole arrays by studying absorption. JOSA B. 29 (4), 521-528 (2012).
- Ding, T., et al. Quantification of a cardiac biomarker in human serum using extraordinary optical transmission (EOT). PloS one. 10 (3), 0120974 (2015).
- Im, H., Sutherland, J. N., Maynard, J. A., Oh, S. -H. Nanohole-based surface plasmon resonance instruments with improved spectral resolution quantify a broad range of antibody-ligand binding kinetics. Anal Chem. 84 (4), 1941-1947 (2012).
- Bhagawati, M., You, C., Piehler, J. Quantitative real-time imaging of protein-protein interactions by LSPR detection with micropatterned gold nanoparticles. Anal Chem. 85 (20), 9564-9571 (2013).



 对于暴露剂量在110µC cm2, 电子束的居住时间在每个暴露的点是0.5 µs12。由于数组捕获的区域为 1.8 mm2, 因此总共有36块 300-µm2字段区域缝合在一起, 形成一个大的金纳米阵列。
对于暴露剂量在110µC cm2, 电子束的居住时间在每个暴露的点是0.5 µs12。由于数组捕获的区域为 1.8 mm2, 因此总共有36块 300-µm2字段区域缝合在一起, 形成一个大的金纳米阵列。