Summary
Este trabalho descreve um método de litografia de nanoimprinting para fabricar matrizes de sensoriamento de alta qualidade que funcionam no princípio de transmissão óptica extraordinária. O biosensor é de baixo custo, robusto e fácil de usar e pode detectar troponina cardíaca eu no soro em concentrações clinicamente relevantes (99th percentil corte ∼10-400 pg/mL, dependendo do ensaio).
Abstract
Uma plataforma de biosensing ter relevância clínica em configurações de point-of-care (POC), ensaio de sensibilidade, reprodutibilidade e capacidade de monitorar confiantemente analitos no contexto de soro humano são cruciais.
Litografia de Nanoimprinting (NIL) foi usada para fabricar, a um custo baixo, sensoriamento áreas tão grandes quanto 1,5 x 1,5 mm. A superfície de detecção foi feita de matrizes de alta-fidelidade de nanoholes, cada um com uma área de cerca de 140 nm2. A grande reprodutibilidade de NIL tornou possível empregar uma estratégia de um chip, um-medição em 12 superfícies fabricadas individualmente, com variação mínima de chip-a-chip. Esses chips de ressonância (LECC) de plasmon de superfície nanoimprinted localizada foram testados extensivamente em sua capacidade de medir confiavelmente um bioanalyte em concentrações variando entre 2,5 e 75 ng/mL em meio de fundo de um complexo biofluid-neste soro humano, caso. A alta fidelidade de NIL permite a geração de grandes áreas de sensoriamento, que por sua vez, elimina a necessidade de um microscópio, como este biosensor pode ser facilmente ligado com uma fonte de luz de laboratório comumente disponíveis. Estes biosensores podem detectar troponina cardíaca no soro, com uma alta sensibilidade, com um limite de detecção (LOD) de 0,55 ng/mL, que é clinicamente relevante. Eles também mostram baixa variação de chip-a-chip (devido a alta qualidade do processo de fabricação). Os resultados são comensuráveis com ensaio imunoenzimático amplamente utilizado (ELISA)-com base em ensaios, mas a técnica mantém as vantagens de uma plataforma sensoriamento LECC-based (ou seja, acessibilidade a miniaturização e multiplexação, tornando-se mais viável para aplicações de POC).
Introduction
Sensores químicos baseados em matrizes de nanohole tem sido objecto de numerosas investigações desde o primeiro relatório sobre transmissão óptica extraordinária (EOT) foi publicado por Ebbesen et al . em 19981. Quando a luz colide com as matrizes periódicas de nanohole estruturas de dimensões de comprimento de onda secundário, reforçada a transmissão ocorre em comprimentos de onda específicos. Isso ocorre quando a luz incidente casais com Bloch-onda de superfície polariton (BW-SPP) e/ou localizadas plasmons de superfície (LSP)2.
O princípio físico subjacente explorado quando biosensing com tais matrizes periódicas é simples. Adsorção de moléculas sobre ou perto da interface de metal muda a constante dielétrica do meio em contato com o metal, por sua vez, mudando a localização das bandas no espectro de transmissão. O espectro em si pode ser ajustado por nano-engenharia da forma, tamanho e separação distância3,4,5. Por design, sensores com base em EOT têm bandas características em seus espectros que facilitam tarefas específicas6,7,8 durante a investigação de eventos de ligação molecular. Esta é uma vantagem crucial sobre plataformas de ressonância (SPR) de plasmon de superfície disponível comercialmente.
Sensores usando EOT normalmente envolvem uma fonte de luz alinhada opticamente tal que um feixe colimado é incidente na superfície de sensoriamento. Técnicas para gerar nanohole grandes superfícies, tais como modelos de co-polímero e interferência e nanosphere litografia, tem pobre reprodutibilidade9. Devido a essas limitações na fabricação com precisão as grandes superfícies que mostram o fenômeno EOT, microscópio óptico era necessário para posicionar corretamente a fonte de luz e o detector. Para simplificar a técnica, litografia de alta qualidade nanoimprinting (NIL)10 foi empregado. Isso possibilitou a produção de sensor de grandes áreas de superfície11 (mm-escala), eliminando a necessidade de um microscópio procurar a superfície de detecção em um chip. Em vez disso, este sensor pode facilmente ser interfaceado com um padrão de fibra óptica cabo.
Desde que os picos de transmissão para essa matriz de nanohole estão contidos no visível a região do infravermelho próximo (NIR), é perfeitamente adequado para detecção de eventos de ligação de biomoléculas em um ambiente aquoso. O comportamento esperado de óptico da matriz nanohole foi simulado. O resultado foi verificado através de estudos com líquidos de padrão índices de refração (RI). Esta matriz foi então usada para medir a concentração de troponina cardíaca I (cTnI) em segundo plano complexo de soro humano. cTnI é clínico padrão-ouro para o diagnóstico de infarto agudo do miocárdio.
Usando este sensor, é possível detectar e quantificar a cTnI no soro humano em um limite de detecção (LOD) de 0,55 ng/mL, que é clinicamente relevante. A detecção é muito mais rápida do que o mais comumente utilizado tecnologia neste domínio, ensaio imunoenzimático (ELISA). Além disso, a superfície de detecção pode facilmente ser regenerada e, por conseguinte, reutilizados. Portanto, este trabalho demonstra a promessa de matrizes de nanohole como tecnologia viável (POC) point-of-care para biosensing dentro do complexo biofluids.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. a fabricação do Sensor e aquisição dos dados
- Preparação do molde de níquel
- Casaco um 220 nm-grossa camada de feixe de elétrons negativos resistir até uma bolacha de 600 µm de espessura 4-em silicone. Escreva a matriz nanohole projetado nesta bolacha usando um sistema de litografia de feixe de elétrons.
- Para acelerar o feixe e a escrever, escrever os padrões com uma baixa dotmap (N) de 20k para cada tamanho de campo 300 µm (A) (ou seja, lá são 0,4 bilhões pontos mapeados em cada área de2 300 µm, e cada ponto será também exposto pelo e-feixe ou não dependendo do projeto do teste padrão). Definir a dose de exposição de resistir e-feixe para a resistir a 110 µC cm− 2 e escrever em uma corrente (I) de 800 PA.
Nota: Por escrito e-feixe, a dose de exposição (D) é controlada pelo tempo de exposição para cada ponto (Tponto), calculado pela . Da dose de exposição em 110 µC cm− 2, o tempo de moradia e-feixe em cada ponto exposto é de 0,5 µs12. Desde que a matriz capta uma área de 1,8 mm2, há um total de 36 patches de áreas de campo de2 300 µm costuradas juntos para uma matriz de nanohole grande, ouro formulário.
. Da dose de exposição em 110 µC cm− 2, o tempo de moradia e-feixe em cada ponto exposto é de 0,5 µs12. Desde que a matriz capta uma área de 1,8 mm2, há um total de 36 patches de áreas de campo de2 300 µm costuradas juntos para uma matriz de nanohole grande, ouro formulário.
- Para acelerar o feixe e a escrever, escrever os padrões com uma baixa dotmap (N) de 20k para cada tamanho de campo 300 µm (A) (ou seja, lá são 0,4 bilhões pontos mapeados em cada área de2 300 µm, e cada ponto será também exposto pelo e-feixe ou não dependendo do projeto do teste padrão). Definir a dose de exposição de resistir e-feixe para a resistir a 110 µC cm− 2 e escrever em uma corrente (I) de 800 PA.
- Desenvolver a resistir imergindo a bolacha de silicone de 4 polegadas na solução de desenvolvedor para 10 s e deixando a bolacha secar no ar.
- Deposite uma camada de sementes de um metal, como níquel, cobre ou alumínio, o wafer de silício.
- Galvaniza a bolacha em um sistema em um banho de sulfamate de níquel. Realize a galvanoplastia em duas etapas. Na primeira etapa, 95min duradoura, usar uma densidade de corrente de 0,7 A dm− 2; Isso preenche completamente o nanopatterns com níquel. Na segunda etapa, duração 125 min, use 12 A dm− 2 para chegar a 300 µm como a espessura do molde final níquel (20 nm). Certifique-se de que o valor de pH é em 3,5-3,8 e que a temperatura está a 52-54 ° C.
- Separe o molde de níquel o substrato de silício, aplicando uma força mecânica suave. Mergulhe o molde de níquel em cerca de 100 mL de reagente positivo fotorresiste remoção durante a noite para lavar o resíduo de resistir o e-feixe.
- Alimentar o molde de níquel em um forno e seca-a 100 ° C por 3 h. limpá-lo em um plasma gravura sistema com gás de2 O no sccm 10 e 100 W por 3 min.
- Casaco um 220 nm-grossa camada de feixe de elétrons negativos resistir até uma bolacha de 600 µm de espessura 4-em silicone. Escreva a matriz nanohole projetado nesta bolacha usando um sistema de litografia de feixe de elétrons.
- Fabricação do ouro nanostructure
- Casaco de 150 µ l de heptadecafluoro-1,1,2,2-tetrahydrodecyl triclorosilano (FDTS) sobre o molde de níquel em um self-assembly máquina de revestimento monocamada (SAM) a 80 ° C.
Nota: Isto irá formar uma camada de anti-adesiva, que permitirá a separação do molde do fotorresiste ("desmoldagem") após a conclusão da etapa de nanoimprinting. O tempo de vaporização deve ser 180 s e o tempo de reação devem ser 900 s. - Imprimi o nanopatterns em um 4 - em vidro bolacha que foi revestida com uma camada de espessura nm 300 de foto-curável NIL resistir usando um nano-impressora a uma pressão de 10 bar e temperatura de 40 ° C por 10 min.
- Transferir o molde, o fotorresiste e a bolacha de vidro para uma luz de UV curar o sistema e photocure com 75 mW cm-2 de exposição aos raios UV por 30 s.
Nota: Se todos os passos foram seguidos corretamente, o molde de níquel deve facilmente ser desenformado do fotorresiste. - Em um íon reativo gravura sistema (RIE), executar um ataque ácido em branco do fotorresiste sobre o substrato de vidro, com um fluxo de gás de2 O do sccm 10, 50 W para 2 s para expor o vidro nas áreas recuados.
- Deposite uma 5 nm de espessura camada de cromo (Cr) para a adesão de metal e uma camada de 100 nm de ouro (Au), para o sensor plasmônico da pastilha de vidro em uma máquina de deposição de feixe de elétrons. Usar uma taxa de deposição de 1 Å s− 1 para Cr e 2 Å s− 1 para Au.
- Realizar lançamento do fotorresiste por plasma de2 O condicionamento por 3 min, seguido por uma etapa de sonorização 15-s em acetona.
- Dados da amostra em fichas de 5 × 5 mm. A matriz de nanohole vai ocupar o central 2 mm × 2 milímetros do chip.
- Casaco de 150 µ l de heptadecafluoro-1,1,2,2-tetrahydrodecyl triclorosilano (FDTS) sobre o molde de níquel em um self-assembly máquina de revestimento monocamada (SAM) a 80 ° C.
- Aquisição dos dados
- Configure o aparelho para fazer as medições ópticas, tal que um feixe de luz branca saindo através da extremidade da fibra óptica transmissor é colimado e é incidente na superfície do sensor (matriz nanohole) em 90°.
Nota: Luz é transmitida através da matriz de todo nanohole. - Coletar o sinal transmitido com a fibra óptica do receptor e gravá-la com um espectrômetro UV-visível, operando dentro da faixa de 300 a 1.000 nm.
- Defina o tempo de aquisição de cada quadro de 20 ms. média 100 frames para obter o espectro final para reduzir o ruído nas medições.
- Use software de plotagem para analisar os dados com base em picos de transmissão identificados anteriormente (usando um método baseado em Lorentz).
- Configure o aparelho para fazer as medições ópticas, tal que um feixe de luz branca saindo através da extremidade da fibra óptica transmissor é colimado e é incidente na superfície do sensor (matriz nanohole) em 90°.
2. teste de sensibilidade do sensor Bulk
- Deposite o líquido padrão do RI para a célula de líquido, com o RI varia de 1,31 a 1.39.
- Mergulhe o chip do sensor no líquido padrão do RI e alinhá-lo com o feixe de luz branca. Obter o espectro de transmissão.
- Limpe o chip sensor após cada medição com um reagente de limpeza tensoactivos e secá-lo com gás nitrogênio.
3. sensor modificação da superfície
- Antes de qualquer modificação química, limpe os chips sensores por imersão sequencial em isopropanol, acetona e água deionizada. Seco à temperatura ambiente em um fluxo de gás nitrogênio seco.
- Incube os chips sensores em uma solução etanólica de 0,4 mM 10-carboxi-1-decanethiol e 1,6 mM 1-octanethiol para 12 h à temperatura ambiente.
Nota: Isto irá formar uma amina-reativa Self-assembly monolayer (SAM). - Use álcool etílico para enxaguar e secar à temperatura ambiente.
- Faça uma mistura de 75mm sulfo-N-Hidroxisuccinimida (sulfo-NHS) e 15 mM 1-ethyl-3-(3-dimethylaminopropyl) carbodiimida (EDC). Mergulhe as fichas nesta mistura durante 15 min.
Nota: Isto irá activar o grupo carboxílico do SAM. - Local 50 µ l de solução de anticorpo antitroponina 200 µ g/mL em um tampão de acetato pH 4.5 na superfície do sensor e incube por 30 min.
- Desative os ésteres não tenha reagidos, imergindo o chip sensor em solução de etanolamina-HCl 1 M por 15 min.
- Enxágue o chip com água desionizada e seque-o em um fluxo de gás nitrogênio seco à temperatura ambiente.
4. ensaio de cTnI
- Bloquear qualquer inespecificas por manchar a 100 µ l de solução de albumina de soro bovino (BSA) 1% para a superfície.
Nota: Este é o espectro de referência.
Nota: Este é o espectro depois da ligação.
5. superfície Plasmon ressonância (SPR) medição
- Execute o chip de sensor SPR multiplexado no sistema SPR com tampão PBS-T.
Nota: A composição do tampão PBS-T é at-fosfato de 20 mM, 150 mM NaCl e 0,05% Tween 20. O pH é de 7,4. - Usar padrão de cTnI e o anticorpo, conforme descrito na etapa 4.
- Ative 3 das 6 canais disponíveis com uma mistura de EDC (0,2 M) e sulfo-NHS (0,05 M) 5 min. realizar uma injeção de 5 min de 50 anticorpo µ g/mL 560 e uma injeção de 5 min de solução de etanolamina-HCl 1 M.
- Gire o chip sensor de 90º e injetar os cTnI padrões em diferentes concentrações (75, 30, 7.5 e 2,5 ng/mL).
- Observe a conjugação ao anticorpo em pontos de interação no chip em tempo real através da leitura do SPR.
- Regenere o chip injetando glicina 50mm-HCl (pH 2) por 1 min.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
A configuração óptica durante a medição é mostrada na figura 1A. Uma imagem da matriz real nanohole é dada na figura 1B. Para compreender a física de condução do processo de detecção, o software de simulação de COMSOL foi usado para simular a distribuição do campo plasmônico em um ambiente aquoso. Os resultados da simulação então estavam relacionados com a medição real. Um estudo publicado anteriormente contém detalhes sobre as suposições feitas e os parâmetros utilizados na simulação11,13. As dimensões físicas, usadas para simular o campo plasmônico para a matriz de nanohole foi a seguinte: p = 400 nm, D = 150 nm e T = 100 nm. Absorção e espalhamento efeitos também são levados em conta14 cálculo do espectro de transmissão. O espectro simulado é comparado com o espectro medido experimentalmente na Figura 1. O simulado e os espectros medidos transmitem a existência de quatro bandas de 450 a 850 nm. A banda em 495 nm corresponde a transição interband de ouro. As três bandas subsequentes, doravante chamadas bandas I a III em ordem crescente de comprimento de onda, estão localizadas em 560 nm, 645 nm e 712 nm, respectivamente. Observaram-se bandas-III ter alinhamento aceitável para as bandas medidos experimentalmente, localizado em 558 nm, 638 nm e 724 nm. Como os nanoholes fabricados são quase circulares em forma, essas bandas não devem ser sensíveis à polarização da luz incidente. Além disso, a simulação de COMSOL permite a visualização directa da distribuição do campo próximo dessas bandas como eles ocorreria em uma célula unitária da estrutura periódica (Figura 1). A unidade na barra de cor é a distribuição de campo óptico (V/m), expressada em uma escala logarítmica. A intensidade máxima observada foi cerca de 4.7 (50.119 V/m). Em comparação com a intensidade da incidência usada na simulação (4.340 V/m), desta magnitude representa um aprimoramento do 11.5-fold campo. Os campos eletromagnéticos para bandas que i e III foram localizados na superfície do substrato de vidro. Em contraste, a banda II era predominantemente localizada na borda superior da nanohole e foi escolhida para a detecção do bioanalyte. 1E figura ilustra os espectros de transmissão da matriz nanohole em líquidos de índices de refração conhecidos, que variou de 1,31 a 1.39. Três bandas de transmissão, correspondente à bandas I, II e III, observaram-se na faixa de 400-900 nm de espectro. Observou-se um desvio para o vermelho com uma mudança em RI. A magnitude da mudança acompanhou a banda de sequência II > banda eu > banda III. Figura 1F é uma consolidação do vermelho observado desloca das bandas I, II e III. A sensibilidade do volume calculado para banda era 322 nm/RIU, banda II tinha 345 nm/RIU, e para banda II foi 202 nm/RIU.
Figura 2A contém o esquema do sensoriamento fenômeno em ação. Figura 2B mostra a mudança em espectros de transmissão depois que as moléculas de troponina cardíaca vincular à superfície microplaqueta funcionalizados. Em baixas concentrações, há um deslocamento linear da banda com o nível de troponina. A mudança na posição de banda pode ser cabida bem para uma isoterma de vinculação com um valor de2 R de 0.995. Em uma observação mais de perto, 30 ng/mL parece ser a concentração na qual a isotérmica indica o início da saturação (Figura 2).
A figura 3A mostra a sensorgram a partir da interação do soro com a superfície do chip de um chip GLC em uma configuração de XPR36. A captura de cTnI é mostrada pelo aumento do sinal. Depois disso, a dissociação de cTnI em um meio PBST (1X PBS, 0,05% tween 20) pode ser observada como o sinal diminui de 120-660 s. injetando glicina (a solução de regeneração) por 1 min reduziu o sinal para 0, indicando a regeneração da superfície de detecção através da retirada completa de cTnI. O sensorgram para a associação subsequente de cTnI à superfície microplaqueta regenerada é mostrada a inserção da Figura 3A. O mesmo protocolo (ou seja, imersão em solução de glicina por 1 min) foi usado para regenerar a superfície da matriz nanohole. Figura 3B mostra que a posição de banda 2 turnos de volta para sua posição original, desse modo, confirmando o sucesso da etapa de regeneração.

Figura 1 : Caracterização da matriz nanohole. (A) simplificado esquemática da instalação experimental. Imagem de microscópio eletrônico de varredura (B) da matriz nanohole. (C) a comparação entre o espectro simulado e o espectro de transmissão experimentalmente medido em um ambiente aquoso. (D) o próximo campo distribuição como simulado em COMSOL para bandas I e III, visto em uma vista de corte transversal. Vermelho representa a distribuição de campo próximo mais forte. É a unidade mostrada na barra de cor | E |, a distribuição do campo ótico, tomada em escala logarítmica. (E) medido experimentalmente espectros de transmissão da matriz nanohole em ambientes com índice de refração padrão líquidos (1.31 para 1.39). (F) sensibilidades das bandas três transmissão (I-III) a mudanças em RI medido no visível a gama NIR a granel. Quadrado preto: eu, o círculo vermelho da banda: banda II, triângulo azul: banda III. A figura foi modificada de Ding et al . 14 sob uma licença CC-BY. Clique aqui para ver uma versão maior desta figura.
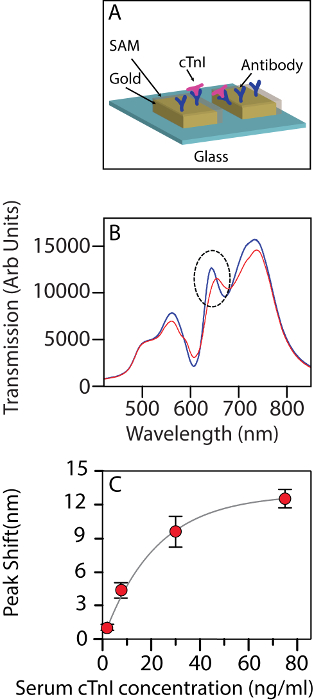
Figura 2 : A matriz de nanohole usada como um biossensor. (A) diagrama esquemático da matriz nanohole sendo usado como um biosensor para a detecção de cTnI. (B) a mudança na transmissão de espectro do biosensor mediante interagindo com cTnI humana em uma concentração de 30 ng/mL em um fundo de soro. Azul: antes de interação, vermelha: depois da interação. O círculo pontilhado indica a banda sendo controlada. (C) a mudança no comprimento de onda para banda II em diferentes concentrações de troponina (2,5 ng/mL, 7,5 ng/mL, 30 ng/mL e 75 ng/mL).As barras de erro mostram o desvio-padrão entre a n = 3 fichas destinadas cada medição. A figura foi modificada de Ding et al . 14 sob uma licença CC-BY. Clique aqui para ver uma versão maior desta figura.

Figura 3 : Regeneração da superfície do sensor. (A) um sensorgram SPR de XPR36 mostrando a injeção do analito (cTnI) seguida pela injeção de glicina para regenerar a superfície do sensor. Medições posteriores deteção de diferentes concentrações de cTnI no contexto de soro são mostradas no baixo-relevo. A barra vermelha representa o valor inicial, enquanto a barra preta mostra a medição após a regeneração da superfície com o protocolo descrito no texto. (B) a mudança nos comprimentos de onda de banda observada após a regeneração de um chip de biosensor nanohole. Σ: desvio padrão das mudanças no comprimento de onda da posição de banda. A figura foi modificada de Ding et al . 14 sob uma licença CC-BY. Clique aqui para ver uma versão maior desta figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Simulando a interação entre a luz incidente e as nanoestruturas torna possível identificar o pico apropriado (no espectro de transmissão), cujo turno pode ser gravado como uma função da concentração do analito. É importante notar que a localização das bandas com relação a estrutura do sensor é crucial para a escolha da banda direita, cuja mudança pode ser rastreada para sentir o analito. A visualização pode ser conseguida através de simulações. Isto também é fundamental para a concepção de uma estrutura ideal que permite a biosensing de analitos. Como pode ser visto aqui, bandas I e III são localizadas na interface vidro-ouro e, portanto, não são úteis para biosensing. Um componente de LECC proeminente pode ser observado na banda II. Ele mostra um decaimento curto comprimento e está localizado na borda do nanoholes. Como tal, isto se presta bem para ser usado para detecção de concentrações de analito. A qualidade das nanoestruturas fabricadas sobre a matriz inteira é também essencial para a qualidade dos espectros coletados. O non-uniform estruturas irão introduzir artefatos.
Absorção de espalhamento e inevitável criar artefatos em uma medição aquosa. A relação sinal-para-ruído também é perturbado pela presença do meio aquoso. Caso haja várias bandas apropriadas cujos turnos podem ser monitorados para biosensing, os seguintes pontos devem ser considerados. Em sub 600 nm comprimentos de onda, o espectro de transmissão observadas marcadamente é afetado pela absorção de proteína e a dispersão de partículas. Por outro lado, usando comprimentos de onda superiores a 900 nm poderia criar confusão por esconder os sinais subjacentes importantes emana os eventos de ligação, como nesta região, a absorção de água aumenta com o comprimento de onda. Para detecção de analitos em um ambiente aquoso, portanto, a banda II é otimamente localizada em termos de comprimento de onda. Um pequeno desvio na medição de posição de banda podia ser observado. Isso é causado pelo tamanho do sensor grande. Enquanto o grande sensor eventualmente se traduz em tempos mais curtos de aquisição, porque cada um dos pixels deteção agora ver um maior do que o normal fluxo de fótons, impacta negativamente também ruído. Na verdade, se a coleção de sinal não é executada corretamente e o condicionamento de dados não otimamente projetado, um monte de ruído pode ser observado. Calculando a média do sinal coletado mais de 100 quadros15, o nível de ruído pode ser reduzido. Embora existam outras maneiras de produzir sinais de LECC, particularmente a partir de nanopartículas de ouro16, a matriz de nanohole é muito mais viável implementar em um formato portátil com microfluídica. O dispositivo pode ser usado para aplicações de POC, devido à facilidade de automação de todo o processo e a possibilidade de regenerar a superfície de detecção.
Este protocolo experimental foi concebido para minimizar o erro experimental usando o modo de transmissão em vez de reflectância. Isso corta possíveis artefactos do ângulo de incidência alterações. É também importante salientar a natureza crítica da etapa 3.4, quando o anticorpo é quitosana para a superfície do sensor. É essencial para preservar a reatividade de sulfo-NHS e EDC. Verificou-se também que a passagem de NHS para sulfo-NHS foi fundamental para melhor estabilidade. Se as amostras devem ser reutilizados, recomenda-se armazenamento sob nitrogênio líquido. A tecnologia de plataforma que é mostrada aqui pode ser usada para monitorar outros biomarcadores clínicos, com modificação da superfície adequada.
Até então, a penetração dos sensores de LECC foi restringida pelas limitações da capacidade de criar superfícies sensíveis em grandes áreas com uma reprodutibilidade semelhante da indústria de semicondutores. Grandes superfícies de sensoriamento podem ser facilmente ligadas com óptica padrão e custo-benefício. Precisão no processo de fabricação também diminuiria a variância de chip-a-chip, um afunilamento crítico em aumentar a confiabilidade das medições, que é fundamental em um ambiente clínico. No contexto de um dispositivo médico, onde as medições seriais são necessárias, a reprodutibilidade da regeneração de superfície também é crucial. Também demonstrou que o protocolo ideal para regenerar a superfície de detecção pode ser criado em uma plataforma SPR comercialmente disponível e com êxito será traduzido para a matriz de nanohole. A eficiência de regeneração pode ser facilmente calculada para a matriz de nanohole, e a adequação da superfície regenerada para medições de repetição pode ser avaliada. Mediante o estabelecimento de protocolos de modificação e regeneração química de superfície robusta, sensores de LECC podem ser uma plataforma sensível mas simples para a deteção de bioanalyte em tempo real. É fácil de prever seu impacto significativo no tratamento do paciente. É de notar que a sensibilidade absoluta do sensor não pode coincidir com os mais avançados testes baseados em ELISA. Algumas estratégias de amplificação precisam ser projetado para aumentar a sensibilidade. Mesmo na sua forma atual, esta tecnologia representa uma melhoria significativa em relação ao nanoimprinted estabelecidos protocolos de LECC, como ele define um novo limite inferior para a detecção de etiqueta-livre de um biomarcador cardiovascular usando uma transmissão baseada óptico instalação. A tecnologia evolui no sentido da implementação de monitoramento em tempo real de vários biomarcadores clinicamente importantes. Melhorias na aquisição de dados (por exemplo, detectores com melhor resolução) e processamento de sinais subsequentes poderiam ajudar sensores baseados em LECC alcançar este objectivo.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Os autores têm sem interesses financeiros concorrentes.
Acknowledgments
AP reconhece o apoio do Prof T Venkatesan, diretor, NUS nanociência e nanotecnologia iniciativa e escritório do presidente adjunto (Universidade Nacional de Cingapura) (R-398-000-084-646). CID reconhece o apoio de Singapura Ministério de saúde médica Conselho de pesquisa nacional sob seu médico cientista regime de financiamento, NMRC/CSA/035/2012 e a Universidade Nacional de Cingapura. Os financiadores não tinham qualquer papel no projeto de estudo, coleta de dados e análise, a decisão de publicar ou preparação do manuscrito.
Materials
| Name | Company | Catalog Number | Comments |
| Electron Beam Lithography setup | Elionix ELS 700 | ||
| o-Xylene | Sigma Aldrich | 95662 | |
| EB resist | Sumitomo | NEB-22A2 | |
| Developer reagent | Shipley Company | Microposit MF 321 | |
| Electroplating machine | Technotrans AG RD 50 | ||
| Photoresist stripper | Rohm and Haas Electronic Materials LLC | Microposit Remover 1165 | |
| Etching System | Trion Phantom | ||
| Heptadecafluoro-1,1,2,2-tetrahydrodecyl)trichlorosilane | Gelest (PA, USA) | 78560-44-8 | |
| SAM coater | Sorona Inc. | AVC 150M | |
| Photo-curable NIL resist | micro resist technology GmbH | mr-UVCur21-300nm | |
| Light Curing System | Dymax | Model 2000 Flood | |
| E-beam deposition machine | Denton Explorer | ||
| UV-visible spectrometer | Ocean optic HR2000+ (Dunedin, FL, USA) | ||
| Standard refractive index liquids | Cargill Inc (Cedar Grove, USA) | 18032 | |
| Plotting software | Origin | Origin Pro 9 | |
| 10-carboxy-1-decanethiol | Dojindo Laboratories (Japan) | C385-10 | |
| 1-octanethiol | Sigma-Aldrich, MO, USA | 471386 | |
| Sulfo-N-hydroxysuccinimide and 1-ethyl-3-(3-dimethylaminopropyl) carbodiimide | BioRad (CA, USA) | 1762410 | |
| Anti-troponin antibody 560 | Hytest (Finland) | 4T21 | |
| Ethanolamine-HCl solution | BioRad (CA, USA) | 1762450 | |
| Surface Plasmon Resonance setup | BioRad XPR36 (Haifa, Israel) | ||
| Multiplexed SPR chip | BioRad | GLC | |
| Human cTnI standard | Phoenix Pharmaceuticals | EK -311-05 | |
| Glycine-HCl | BioRad (CA, USA) | 1762221 |
References
- Ebbesen, T. W., Lezec, H. J., Ghaemi, H., Thio, T., Wolff, P. Extraordinary optical transmission through sub-wavelength hole arrays. Nature. 391 (6668), 667-669 (1998).
- Krishnan, A., et al. Evanescently coupled resonance in surface plasmon enhanced transmission. Optics Comm. 200 (1), 1-7 (2001).
- Yang, J. -C., et al. Enhanced optical transmission mediated by localized plasmons in anisotropic, three-dimensional nanohole arrays. Nano letters. 10 (8), 3173-3178 (2010).
- Kim, J. H., Moyer, P. J. Transmission characteristics of metallic equilateral triangular nanohole arrays. Appl Phys Lett. 89 (12), 121106 (2006).
- Liu, H., Lalanne, P. Microscopic theory of the extraordinary optical transmission. Nature. 452 (7188), 728-731 (2008).
- Shon, Y. -S., Choi, H. Y., Guerrero, M. S., Kwon, C. Preparation of nanostructured film arrays for transmission localized surface plasmon sensing. Plasmonics. 4 (2), 95-105 (2009).
- Xiang, G., Zhang, N., Zhou, X. Localized surface plasmon resonance biosensing with large area of gold nanoholes fabricated by nanosphere lithography. Nanoscale Res Lett. 5 (5), 818 (2010).
- Valsecchi, C., Brolo, A. G. Periodic metallic nanostructures as plasmonic chemical sensors. Langmuir. 29 (19), 5638-5649 (2013).
- Gates, B. D., et al. New approaches to nanofabrication: molding, printing, and other techniques. Chem Rev. 105 (4), 1171-1196 (2005).
- Guo, L. J. Nanoimprint lithography: methods and material requirements. Adv Mater. 19 (4), 495-513 (2007).
- Wong, T. I., et al. High throughput and high yield nanofabrication of precisely designed gold nanohole arrays for fluorescence enhanced detection of biomarkers. Lab on a Chip. 13 (12), 2405-2413 (2013).
- Deng, J., Wong, T. I., Sun, L. L., Quan, C., Zhou, X. Acceleration of e-beam lithography by minimized resist exposure for large scale nanofabrication. Microelect Eng. 166, 31-38 (2016).
- Wu, L., Bai, P., Li, E. P. Designing surface plasmon resonance of subwavelength hole arrays by studying absorption. JOSA B. 29 (4), 521-528 (2012).
- Ding, T., et al. Quantification of a cardiac biomarker in human serum using extraordinary optical transmission (EOT). PloS one. 10 (3), 0120974 (2015).
- Im, H., Sutherland, J. N., Maynard, J. A., Oh, S. -H. Nanohole-based surface plasmon resonance instruments with improved spectral resolution quantify a broad range of antibody-ligand binding kinetics. Anal Chem. 84 (4), 1941-1947 (2012).
- Bhagawati, M., You, C., Piehler, J. Quantitative real-time imaging of protein-protein interactions by LSPR detection with micropatterned gold nanoparticles. Anal Chem. 85 (20), 9564-9571 (2013).



 . Da dose de exposição em 110 µC cm− 2, o tempo de moradia e-feixe em cada ponto exposto é de 0,5 µs12. Desde que a matriz capta uma área de 1,8 mm2, há um total de 36 patches de áreas de campo de2 300 µm costuradas juntos para uma matriz de nanohole grande, ouro formulário.
. Da dose de exposição em 110 µC cm− 2, o tempo de moradia e-feixe em cada ponto exposto é de 0,5 µs12. Desde que a matriz capta uma área de 1,8 mm2, há um total de 36 patches de áreas de campo de2 300 µm costuradas juntos para uma matriz de nanohole grande, ouro formulário.