Summary
Questo lavoro descrive un metodo di Litografia nanoimprinting per fabbricare matrici di sensori di alta qualità che funzionano sul principio della trasmissione ottica straordinaria. Il biosensore è basso costo, robusto, facile da usare e in grado di rilevare la troponina cardiaca I nel siero a concentrazioni clinicamente rilevanti (99th percentile taglio ∼10-400 pg/mL, a seconda del dosaggio).
Abstract
Per una piattaforma di biosensori avere rilevanza clinica nelle impostazioni di point-of-care (POC), sensibilità, riproducibilità e capacità di monitorare in modo affidabile analiti contro lo sfondo di siero umano sono cruciali.
Nanoimprinting Litografia (NIL) è stato usato per fabbricare, a basso costo, rilevamento aree grandi come 1,5 x 1,5 mm. La superficie di rilevamento è stata effettuata di matrici ad alta fedeltà di nanoholes, ciascuno con una superficie di circa 140 nm2. La grande riproducibilità di NIL ha permesso di impiegare una strategia one-chip, misura di uno su 12 superfici fabbricate singolarmente, con minime variazioni di truciolo-truciolo. Questi chip di (LSPR) risonanza plasmonica di superficie nanoimprinted localizzato sono stati ampiamente testati sulla loro capacità di misurare in modo affidabile un bioanalyte alle concentrazioni che variano da 2,5 a 75 ng/mL in mezzo sullo sfondo di un complesso biofluid-in questo caso siero umano. L'alta fedeltà del NIL consente la generazione di grandi aree di rilevamento, che a sua volta elimina la necessità di un microscopio, come questo biosensore è facilmente interfacciabile con una sorgente di luce di laboratorio comunemente disponibili. Questi biosensori in grado di rilevare troponina cardiaca nel siero con un'alta sensibilità, a un limite di rilevabilità (LOD) di 0,55 ng/mL, che è clinicamente rilevante. Essi mostrano anche bassa varianza di truciolo-truciolo (grazie all'alta qualità del processo di fabbricazione). I risultati sono commensurabili con ampiamente usato enzima-collegata dell'immunosorbente (ELISA)-base di saggi, ma la tecnica mantiene i vantaggi di una piattaforma di rilevamento basata su LSPR (cioè, disponibilità alla miniaturizzazione e multiplexing, che lo rende più fattibile per le applicazioni POC).
Introduction
Sensori chimici basati su matrici ordinata sono stati oggetto di numerose indagini dato che la prima relazione sulla trasmissione ottica straordinaria (EOT) è stata pubblicata da Ebbesen et nel 19981. Quando la luce incide sulle matrici periodiche di ordinata strutture di dimensioni sub-lunghezza d'onda, la trasmissione avanzata avviene alle lunghezze d'onda specifiche. Ciò si verifica quando la luce incidente coppie con Bloch-onda superficiale polaritone (BW-SPP) e/o i plasmoni di superficie localizzata (LSP)2.
Il principio fisico sottostante sfruttato quando biosensoristica con tali matrici periodiche è semplice. Adsorbimento di molecole su o vicino all'interfaccia di metallo cambia la costante dielettrica del mezzo a contatto con il metallo, a sua volta spostando la posizione delle bande di trasmissione nello spettro. Lo spettro di sé può essere regolato da nano-ingegneria la forma, dimensione e separazione distanza3,4,5. Per impostazione predefinita, sensori basati su EOT hanno bande caratteristici nei loro spettri che facilitano le assegnazioni specifiche6,7,8 durante l'inchiesta di associazione molecolare di eventi. Si tratta di un vantaggio cruciale sopra le piattaforme di resonance (SPR) del plasmone di superficie disponibili in commercio.
Sensori utilizzando EOT in genere coinvolgono una sorgente di luce otticamente allineata a tale che un fascio collimato è incidente sulla superficie del sensore. Tecniche per generare ordinata di grandi superfici, quali modelli di co-polimero e interferenza e Litografia nanosphere, hanno scarsa riproducibilità9. A causa di queste limitazioni nella fabbricazione accuratamente grandi superfici che presentano il fenomeno EOT, un microscopio ottico è stato richiesto per posizionare correttamente la sorgente luminosa ed il rivelatore. Per semplificare la tecnica, l'alta qualità nanoimprinting Litografia (NIL)10 è stato impiegato. Questo ha permesso la produzione di grandi dimensioni sensore superfici11 (mm-scala), eliminando la necessità di un microscopio cercare la superficie di rilevamento su un chip. Invece, questo sensore potrebbe essere facilmente interfacciato con una fibra ottica standard.
Poiché i picchi di trasmissione per questa matrice ordinata sono contenuti nella parte visibile alla regione di vicino infrarosso (NIR), è perfettamente adatto per gli eventi di associazione per biomolecole in ambiente acquoso di rilevamento. È stato simulato il comportamento ottico previsto della matrice ordinata. Il risultato è stata poi verificato attraverso studi con liquidi di indici di rifrazione standard (RI). Questa matrice è stata poi utilizzata per misurare la concentrazione di troponina cardiaca I (cTnI) nel complesso background di siero umano. cTnI è il gold standard clinici per la diagnosi di infarto miocardico acuto.
Utilizzando questo sensore, è possibile rilevare e quantificare la cTnI in siero umano a un limite di rilevabilità (LOD) di 0,55 ng/mL, che è clinicamente rilevante. La rilevazione è molto più veloce di quanto il più comunemente usato tecnologia in questo settore, analisi enzima-collegata dell'immunosorbente (ELISA). Inoltre, la superficie di rilevamento può facilmente essere rigenerato e quindi riutilizzato. Quindi, questo lavoro dimostra la promessa di matrici ordinata come una valida tecnologia di (POC) point-of-care per biosensori all'interno del complesso biofluidi.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. montaggio del sensore e acquisizione dei dati
- Preparazione dello stampo nichel
- Cappotto uno strato di 220 nm di spessore del fascio di elettroni negativi resistere su un wafer di 600 µm di spessore 4-in silicio. Scrivere la matrice ordinata progettato su questo wafer utilizzando un sistema di Litografia del fascio di elettroni.
- Per accelerare la trave e scrivere, scrivere i modelli con un basso dotmap (N) di 20k per ogni dimensione di campo di 300 µm (A) (cioè, ci sono mappati su ogni zona di2 300 µm 0,4 miliardi di punti, e ogni punto o sarà esposti dal e-fascio o non a seconda del design del modello). Impostata la dose di esposizione di resistere e-fascio per il resist 110 µC cm− 2 e scrivere ad una corrente (I) di 800 PA.
Nota: Nella scrittura del fascio elettronico, la dose di esposizione (D) è controllata dal tempo di esposizione per ogni punto (Tdot), calcolato da . Per la dose di esposizione alle 110 µC cm− 2, il tempo di abitazione del fascio elettronico su ogni punto esposto è 0,5 µs12. Poiché la matrice consente di acquisire un'area di 1.8 mm2, ci sono un totale di 36 patch delle zone di campo2 300 µm cuciti insieme a una matrice ordinata di oro, grande forma.
. Per la dose di esposizione alle 110 µC cm− 2, il tempo di abitazione del fascio elettronico su ogni punto esposto è 0,5 µs12. Poiché la matrice consente di acquisire un'area di 1.8 mm2, ci sono un totale di 36 patch delle zone di campo2 300 µm cuciti insieme a una matrice ordinata di oro, grande forma.
- Per accelerare la trave e scrivere, scrivere i modelli con un basso dotmap (N) di 20k per ogni dimensione di campo di 300 µm (A) (cioè, ci sono mappati su ogni zona di2 300 µm 0,4 miliardi di punti, e ogni punto o sarà esposti dal e-fascio o non a seconda del design del modello). Impostata la dose di esposizione di resistere e-fascio per il resist 110 µC cm− 2 e scrivere ad una corrente (I) di 800 PA.
- Sviluppare il resistere immergendo la lastra di silicio 4 pollici nella soluzione di sviluppatore per 10 s e lasciando la cialda asciugare all'aria.
- Deposito di uno strato di seme di un metallo, quali nichel, rame o alluminio, sul wafer di silicio.
- Placcare la cialda in un sistema di placcatura in un bagno di nichel sulfamate. Svolgere l'elettrodeposizione in due passaggi. Nella prima fase, durata 95 min, utilizzare una densità di corrente di 0,7 A dm− 2; questo riempie completamente la nanopatterns con nichel. Nella seconda fase, durata 125 min, utilizzare 12 A dm− 2 per raggiungere 300 µm come lo spessore di stampo finale nichel (20 nm). Assicurarsi che il valore di pH è a 3,5-3,8 e che la temperatura sia a 52-54 ° C.
- Separare lo stampo di nichel dal substrato di silicio mediante l'applicazione di forza meccanica delicata. Immergere lo stampo di nichel in circa 100 mL di reagente rimozione photoresist positivo durante la notte per lavare via il residuo da resistere il fascio elettronico.
- Alimentare lo stampo di nichel in un forno e secco a 100 ° C per 3 h. pulirlo in un plasma etching sistema con O2 gas alle 10 sccm e 100 W per 3 min.
- Cappotto uno strato di 220 nm di spessore del fascio di elettroni negativi resistere su un wafer di 600 µm di spessore 4-in silicio. Scrivere la matrice ordinata progettato su questo wafer utilizzando un sistema di Litografia del fascio di elettroni.
- Fabbricazione della nanostruttura oro
- Cappotto di 150 µ l di triclorosilano heptadecafluoro-1,1,2,2-tetrahydrodecyl (FDTS) sul calco di nichel in una macchina di rivestimento di autoassemblaggio monostrato (SAM) a 80 ° C.
Nota: Questo formerà uno strato anti-adesivo, che permetterà la separazione dello stampo dal photoresist ("sformatura") dopo il completamento del passaggio nanoimprinting. Il tempo di vaporizzazione dovrebbe essere 180 s e il tempo di reazione dovrebbe essere 900 s. - Imprimere la nanopatterns su un 4 - in wafer di vetro che è stato rivestito con uno strato di 300 nm di spessore di foto-curabile NIL resistere utilizzando un nano-imprinter ad una pressione di 10 bar e una temperatura di 40 ° C per 10 min.
- Trasferire lo stampo, il photoresist e la cialda di vetro di una lampada a luce UV sistema e photocure con 75 mW cm-2 di esposizione ai raggi UV per 30 s.
Nota: Se tutti i passaggi siano stati eseguiti correttamente, la muffa di nichel dovrebbe essere estarre facilmente da photoresist. - In un ione reattivo acquaforte sistema (RIE), eseguire un vuoto etch di photoresist sul substrato di vetro, con un flusso di gas di2 O di 10 sccm, a 50 W per 2 s per esporre il vetro sulle zone frastagliate.
- Depositare uno strato di 5 nm di spessore di cromo (Cr) per adesione metallo e uno strato di 100 nm di oro (Au) per il sensore plasmonico sul wafer di vetro in una macchina di deposizione del fascio di elettroni. Utilizzare una velocità di deposizione di 1 Å s− 1 per Cr e 2 Å s− 1 per Au.
- Eseguire a sollevamento di photoresist di incisione per 3 min seguita da una fase di sonificazione 15-s in acetone al plasma di O2 .
- Tagliare a dadini il campione nei circuiti integrati di 5 × 5 mm. La matrice ordinata occuperà il centrale 2 × 2 mm del chip.
- Cappotto di 150 µ l di triclorosilano heptadecafluoro-1,1,2,2-tetrahydrodecyl (FDTS) sul calco di nichel in una macchina di rivestimento di autoassemblaggio monostrato (SAM) a 80 ° C.
- Acquisizione dei dati
- Impostare l'apparecchio per fare le misurazioni ottiche, tale che un fascio di luce bianca uscendo attraverso l'estremità della fibra ottica trasmettitore è collimato e incide sulla superficie del sensore (matrice ordinata) a 90°.
Nota: La luce è trasmessa attraverso la matrice ordinata tutta. - Raccogliere il segnale trasmesso con la fibra ottica ricevitore e registrarlo con uno spettrometro UV-visibile di funzionamento nell'intervallo da 300 a 1.000 nm.
- Impostare il tempo di acquisizione per ogni fotogramma di 20 ms media 100 fotogrammi per ottenere lo spettro finale per abbassare il rumore nelle misurazioni.
- Utilizzare software di tracciato per analizzare i dati basati sui picchi di trasmissione precedentemente identificato (utilizzando un metodo basato su Lorentz).
- Impostare l'apparecchio per fare le misurazioni ottiche, tale che un fascio di luce bianca uscendo attraverso l'estremità della fibra ottica trasmettitore è collimato e incide sulla superficie del sensore (matrice ordinata) a 90°.
2. Test di sensibilità di massa sensore
- Depositare il liquido RI standard nella cellula liquida, con il RI varia da 1.31 a 1,39.
- Immergere il chip sensore nel liquido RI standard e allinearla con il fascio di luce bianca. Ottenere lo spettro di trasmissione.
- Pulire il chip del sensore dopo ogni misurazione con un reagente pulizia tensioattivo e asciugarlo con gas azoto.
3. sensore modificazione superficiale
- Prima di eventuali modificazioni chimiche, pulire i chip sensore ad immersione sequenziale in isopropanolo, acetone e acqua deionizzata. Asciugare a temperatura ambiente in un flusso di gas di azoto secco.
- Incubare i chip del sensore in una soluzione etanolica di 0,4 mM 10-carboxy-1-decanethiol e 1,6 mM 1-octanethiol per 12 h a temperatura ambiente.
Nota: Questo si formerà un'ammina-reattivo autoassemblaggio monostrato (SAM). - Utilizzare etanolo per sciacquare bene e asciugare a temperatura ambiente.
- Fare un miscuglio di 75mm sulfo-N-Idrossisuccinimide (sulfo-NHS) e 15 mM 1-ethyl-3-(3-dimethylaminopropyl) carbodiimide (EDC). Immergere i chip in questa miscela per 15 min.
Nota: Questo attiverà il gruppo carbossilico del SAM. - Spot di 50 µ l di soluzione di anticorpo anti-troponina µ g/mL 200 realizzata in un tampone di acetato pH 4,5 sulla superficie del sensore e incubare per 30 min.
- Disattivare gli esteri non reagiti immergendo il chip sensore nella soluzione di etanolammina-HCl 1 M per 15 min.
- Sciacquare il chip con acqua deionizzata e asciugare in un flusso di gas di azoto secco a temperatura ambiente.
4. cTnI Assay
- Bloccare qualsiasi legame aspecifico spotting 100 µ l di soluzione di albumina di siero bovino (BSA) 1% sulla superficie.
Nota: Questo è lo spettro di riferimento.
Nota: Questo è lo spettro di After-associazione.
5. surface Plasmon Resonance (SPR) misura
- Eseguire il multiplex chip sensore SPR sul sistema SPR con tampone PBS-T.
Nota: La composizione del tampone PBS-T è Na-fosfato di 20 mM, 150 mM NaCl e 0.05% Tween 20. Il pH di 7,4. - Utilizzare la cTnI standard e l'anticorpo, come descritto nel passaggio 4.
- Attivare 3 su 6 canali disponibili con una miscela di EDC (0,2 M) e sulfo-NHS (0,05 M) per 5 min, eseguire un'iniezione di 5 min di 50 µ g/mL di un anticorpo 560 e un'iniezione di 5 min di 1 M etanolammina-HCl soluzione.
- Ruotare il chip sensore di 90° e iniettare gli standard di cTnI alle concentrazioni differenti (75, 30, 7.5 e 2,5 ng/mL).
- Osservare la coniugazione per l'anticorpo in punti di interazione sul chip in tempo reale attraverso la lettura SPR.
- Rigenerare il chip iniettando 50 mM glicina-HCl (pH 2) per 1 min.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
L'installazione di ottica per le misurazioni è mostrato in Figura 1A. Un'immagine della matrice ordinata effettivo è dato in Figura 1B. Per capire la fisica che guida il processo di rilevamento, il software di simulazione COMSOL era utilizzato per simulare la distribuzione del campo plasmonica in ambiente acquoso. I risultati della simulazione sono stati collegati quindi la misura reale. Uno studio pubblicato in precedenza contiene dettagli di ipotesi fatte e i parametri utilizzati nella simulazione11,13. Le dimensioni fisiche utilizzate per simulare il campo plasmonico per la matrice ordinata era come segue: p = 400 nm, D = 150 nm e T = 100 nm. Assorbimento ed effetti di dispersione sono anche presi in conto14 durante il calcolo dello spettro di trasmissione. Lo spettro simulato viene confrontato con lo spettro misurato sperimentalmente in Figura 1. Le simulazioni e gli spettri misurati trasmettono l'esistenza di quattro bande da 450 a 850 nm. La band a 495 nm corrisponde alla transizione interbanda d'oro. Tre fasce successive, d'ora in poi chiamate bande III in ordine crescente di lunghezza d'onda, si trovano a 560 nm, 645 nm e 712 nm, rispettivamente. Bande III sono stati osservati per avere un allineamento accettabile per le bande misurate sperimentalmente, localizzato a 558 nm, 638 nm e 724 nm. Come il fabbricato nanoholes sono di forma quasi circolare, queste bande non dovrebbero essere sensibili alla polarizzazione della luce incidente. La simulazione COMSOL consente inoltre la visualizzazione diretta della distribuzione di campo vicino di queste bande, come si verificherebbe in una cella unitaria della struttura periodica (Figura 1). L'unità sulla barra del colore è la distribuzione di campo ottico (V/m) espressa in scala logaritmica. L'intensità massima osservata era circa 4.7 (50.119 V/m). Rispetto all'intensità dell'incidenza utilizzato nella simulazione (4.340 V/m), questa grandezza rappresenta un miglioramento di 11.5-fold campo. I campi elettromagnetici per le bande che i e III hanno localizzato sulla superficie del substrato di vetro. Al contrario, band II principalmente è stato localizzato sul bordo superiore dell'ordinata e fu scelto per la rilevazione della bioanalyte. Figura 1E illustra gli spettri di trasmissione della matrice ordinata in liquidi di noti indici di rifrazione, che varia da 1.31 a 1,39. Tre bande di trasmissione, corrispondenti a gruppi I, II e III, sono stati osservati nella gamma dello spettro di 400-900 nm. Un spostamento verso il rosso è stato osservato con un cambiamento nel RI. L'entità dello spostamento ha seguito la band di sequenza II > banda I > banda III. Figura 1F è un consolidamento del rosso osservato spostamenti delle fasce I, II e III. La sensibilità di massa calcolata per band ero 322 nm/RIU, Band II era 345 nm/RIU, e per la band II era 202 nm/RIU.
Figura 2A contiene lo schema del fenomeno rilevamento in azione. Figura 2B Mostra la variazione negli spettri di trasmissione dopo le molecole di troponina cardiaca si legano alla superficie del chip funzionalizzati. A basse concentrazioni, c'è uno spostamento lineare nella banda con il livello di troponina. Lo spostamento nella posizione di banda può essere montato anche su un'isoterma di associazione con un valore di2 R di 0.995. Su una più stretta osservazione, 30 ng/mL sembra essere la concentrazione a cui l'isoterma indica l'inizio della saturazione (Figura 2).
Figura 3A Mostra il sensorgram dall'interazione del siero con la superficie del chip di un chip di cromatografia gaseoliquido modificata in un'installazione di XPR36. La cattura della cTnI è dimostrata dall'aumento del segnale. Da allora in poi, la dissociazione della cTnI in un mezzo PBST (1x PBS, 0.05% tween 20) può essere osservata come il segnale diminuisce da 120-660 s. iniezione glicina (la soluzione di rigenerazione) per 1 min ridotto il segnale a 0, che indica la rigenerazione della superficie di rilevamento attraverso il completo disinnesto della cTnI. La sensorgram per l'associazione successiva della cTnI alla superficie del chip rigenerata è mostrato nella rientranza della Figura 3A. Lo stesso protocollo (cioè, immergendo nella soluzione di glicina per 1 min) è stato utilizzato per rigenerare la superficie di matrice ordinata. Figura 3B Mostra che la posizione della banda 2 sposta indietro nella sua posizione originale, confermando così il successo della fase di rigenerazione.

Figura 1 : Caratterizzazione della matrice ordinata. (A) semplificato schematica dell'apparato sperimentale. (B) immagine microscopio elettronico a scansione della matrice ordinata. (C) confronto tra lo spettro simulato e lo spettro di trasmissione misurate sperimentalmente in ambiente acquoso. (D) campo vicino distribuzione come simulato in COMSOL per bande I e III, visto in una vista di sezione trasversale. Rosso rappresenta il più forte campo vicino distribuzione. È l'unità visualizzata nella barra di colore | E |, la distribuzione del campo ottico, preso in scala logaritmica. (E) misurata sperimentalmente gli spettri di trasmissione della matrice ordinata in ambienti con indice di rifrazione standard liquidi (1.31 a 1,39). (F) sensibilità delle bande di tre trasmissione (I-III) ai cambiamenti nella RI misurato nel visibile alla gamma NIR di massa. Quadrato nero: banda I, cerchio rosso: II, triangolo blu di banda: banda III. La figura è stata modificata da Ding et al. 14 sotto una licenza CC BY. Clicca qui per visualizzare una versione più grande di questa figura.
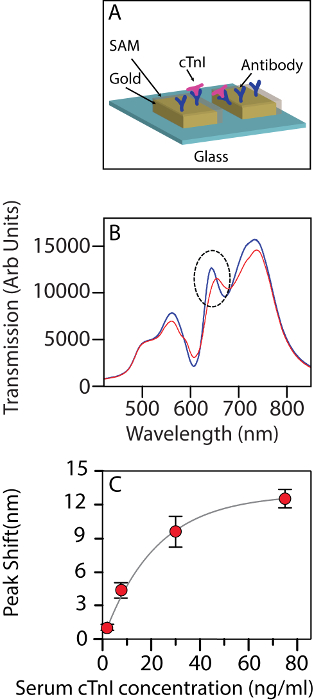
Figura 2 : Matrice di ordinata come un biosensore. (A) schema della matrice ordinata viene utilizzata come un biosensore per la rilevazione di cTnI. (B) il cambiamento nella trasmissione spettro del biosensore su interazione con cTnI umana ad una concentrazione di 30 ng/mL in una priorità bassa del siero. Blu: prima interazione, rosso: dopo interazione. Il cerchio tratteggiato indica la banda monitorata. (C) il cambiamento di lunghezza d'onda per band II a differenti concentrazioni di troponina (2,5 ng/mL, 7,5 ng/mL, 30 ng/mL e 75 ng/mL).Le barre di errore indicano la deviazione standard tra la n = 3 chip utilizzati per ogni misurazione. La figura è stata modificata da Ding et al. 14 sotto una licenza CC BY. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3 : Rigenerazione della superficie del sensore. (A) un sensorgram SPR da XPR36 mostrando l'iniezione dell'analita (cTnI) seguita dall'iniezione di glicina per rigenerare la superficie del sensore. Le dimensioni di successivo rilevamento delle concentrazioni differenti di cTnI sullo sfondo del siero sono presentate nella rientranza. La barra rossa rappresenta il valore iniziale, mentre la barra nera Mostra la misurazione dopo la rigenerazione della superficie con il protocollo descritto nel testo. (B) il turno di lunghezze d'onda banda osservata dopo la rigenerazione di un chip di biosensore ordinata. Σ: deviazione standard degli spostamenti nella lunghezza d'onda di quella banda. La figura è stata modificata da Ding et al. 14 sotto una licenza CC BY. Clicca qui per visualizzare una versione più grande di questa figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Simulando l'interazione tra luce incidente e nanostrutture permette di identificare il picco appropriato (nello spettro di trasmissione), cui spostamento può essere registrato come una funzione della concentrazione dell'analita. È importante notare che la localizzazione delle bande rispetto alla struttura del sensore è fondamentale la scelta della fascia destra, cui MAIUSC possono essere monitorati per rilevare l'analita. La visualizzazione può essere raggiunto attraverso simulazioni. Questo è anche fondamentale per la progettazione di una struttura ottima che consente la biosensoristica degli analiti. Come si vede qui, bande I e III sono localizzati sull'interfaccia vetro-oro e quindi non sono utili per biosensori. Un componente LSPR prominente può essere osservato nella banda II. Mostra una lunghezza di decadimento breve ed è localizzato sul bordo della nanoholes. Come tale, questo si presta bene ad essere utilizzato per il rilevamento di concentrazioni di analita. La qualità delle nanostrutture fabbricato sopra l'intera matrice è anche essenziale per la qualità degli spettri raccolti. Strutture non uniforme introdurrà artefatti.
Assorbimento di scattering e inevitabile creare manufatti in una misurazione acquosa. Il rapporto nel complesso segnale-rumore è anche disturbato dalla presenza del mezzo acquoso. Nel caso in cui ci sono più bande adatti cui turni possono essere monitorati per biosensori, devono essere considerati i seguenti punti. A sub 600 nm, lo spettro di trasmissione osservato risente marcatamente proteina assorbimento e scattering di particelle. D'altra parte, utilizzando lunghezze d'onda superiori a 900 nm potrebbe creare confusione celando i segnali sottostanti importanti provenienti dall'associazione di eventi, come in questa regione, l'assorbimento di acqua aumenta con la lunghezza d'onda. Per il rilevamento di analiti in un ambiente acquoso, di conseguenza, band II è situato in maniera ottimale in termini di lunghezza d'onda. Una piccola deviazione nella misurazione della posizione di banda potrebbe essere osservata. Questo è causato dalle dimensioni del sensore di grandi dimensioni. Mentre il sensore di grandi dimensioni alla fine si traduce in tempi di acquisizione perché ciascuno dei pixel rilevamento ora vedere un più grande del solito flusso di fotoni, questo impatta negativamente anche rumore. Infatti, se la raccolta di segnale non viene eseguita correttamente e il condizionamento di dati non ottimamente progettato, un sacco di rumore può essere osservato. Calcolando il segnale raccolto oltre 100 fotogrammi15, può essere abbassato il livello di rumore. Mentre ci sono altri modi per produrre segnali LSPR, specialmente da nanoparticelle di oro16, la matrice ordinata è molto più fattibile per implementare in un formato portatile con microfluidica. L'intero dispositivo può essere utilizzato per applicazioni POC a causa della facilità di automazione dell'intero processo e la possibilità di rigenerare la superficie di rilevamento.
Questo protocollo sperimentale è stato progettato per minimizzare l'errore sperimentale utilizzando la modalità di trasmissione invece di riflettanza. Questo tagli possibili artefatti da variazioni di angolo di incidenza. È anche importante sottolineare la natura critica del punto 3.4, quando l'anticorpo è reticolato la superficie del sensore. È essenziale per preservare la reattività di sulfo-NHS e di EDC. È stato anche trovato che il passaggio da NHS a sulfo-NHS era critico per una migliore stabilità. Se i campioni devono essere riutilizzate, si raccomanda di conservare in azoto liquido. La piattaforma tecnologica che è illustrato di seguito consente di monitorare altri biomarker clinici, con appropriata modifica superficiale.
Finora, la penetrazione dei sensori LSPR è stata limitata dalle limitazioni sulla capacità di creare superfici reattive su vaste aree con una riproducibilità simile a quello dell'industria dei semiconduttori. Grandi superfici di rilevamento facilmente interfacciabile con ottica standard e conveniente. Precisione nel processo di fabbricazione sarebbe anche diminuire la varianza di truciolo-truciolo, un collo di bottiglia critico nel migliorare l'affidabilità delle misurazioni, che è fondamentale in una regolazione clinica. Nel contesto di un dispositivo medico, quando sono necessarie misurazioni seriali, la riproducibilità della rigenerazione superficiale è anche cruciale. Inoltre è stato dimostrato che il protocollo ottimale per rigenerare la superficie di rilevamento può essere stabilito in una piattaforma SPR commercialmente disponibile e poi correttamente tradotto nella matrice ordinata. L'efficienza di rigenerazione può essere facilmente calcolato per la matrice ordinata, e l'idoneità della superficie rigenerata per misure di ripetizione può essere valutato. Dopo aver stabilito i protocolli di modifica e rigenerazione chimica di superficie robusta, sensori LSPR possono essere una piattaforma semplice ma sensibile per il rilevamento in tempo reale bioanalyte. È facile prevedere il suo impatto significativo sulla cura del paziente. Deve essere notato che la sensibilità assoluta del sensore non può corrispondere i test più avanzati basati su ELISA. Alcune strategie di amplificazione devono essere progettate per aumentare la sensibilità. Anche nella sua forma attuale, questa tecnologia rappresenta un miglioramento significativo rispetto a protocolli di LSPR nanoimprinted stabilito, come definisce un nuovo limite inferiore per la rilevazione di privo di etichetta di un biomarcatore cardiovascolare utilizzando una base di trasmissione ottica programma di installazione. La tecnologia si sta evolvendo verso l'implementazione del monitoraggio in tempo reale dei biomarcatori multipli clinicamente importanti. Ulteriori miglioramenti nell'acquisizione di dati (ad es., rivelatori con una migliore risoluzione) ed elaborazione del segnale successivo potrebbero aiutare sensori basati su LSPR raggiungere questo obiettivo.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Gli autori non hanno nessun concorrenti interessi finanziari.
Acknowledgments
AP riconosce il sostegno della Prof T Venkatesan, direttore, NUS nanoscienza e nanotecnologia iniziativa e ufficio del Vice Presidente (National University of Singapore) (R-398-000-084-646). CLD riconosce il sostegno di Singapore Ministero della salute National Medical Research Council sotto suo medico scienziato meccanismo di finanziamento, NMRC/CSA/035/2012 e la National University of Singapore. I finanziatori non avevano alcun ruolo nel disegno dello studio, raccolta dati e analisi, decisione di pubblicare o preparazione del manoscritto.
Materials
| Name | Company | Catalog Number | Comments |
| Electron Beam Lithography setup | Elionix ELS 700 | ||
| o-Xylene | Sigma Aldrich | 95662 | |
| EB resist | Sumitomo | NEB-22A2 | |
| Developer reagent | Shipley Company | Microposit MF 321 | |
| Electroplating machine | Technotrans AG RD 50 | ||
| Photoresist stripper | Rohm and Haas Electronic Materials LLC | Microposit Remover 1165 | |
| Etching System | Trion Phantom | ||
| Heptadecafluoro-1,1,2,2-tetrahydrodecyl)trichlorosilane | Gelest (PA, USA) | 78560-44-8 | |
| SAM coater | Sorona Inc. | AVC 150M | |
| Photo-curable NIL resist | micro resist technology GmbH | mr-UVCur21-300nm | |
| Light Curing System | Dymax | Model 2000 Flood | |
| E-beam deposition machine | Denton Explorer | ||
| UV-visible spectrometer | Ocean optic HR2000+ (Dunedin, FL, USA) | ||
| Standard refractive index liquids | Cargill Inc (Cedar Grove, USA) | 18032 | |
| Plotting software | Origin | Origin Pro 9 | |
| 10-carboxy-1-decanethiol | Dojindo Laboratories (Japan) | C385-10 | |
| 1-octanethiol | Sigma-Aldrich, MO, USA | 471386 | |
| Sulfo-N-hydroxysuccinimide and 1-ethyl-3-(3-dimethylaminopropyl) carbodiimide | BioRad (CA, USA) | 1762410 | |
| Anti-troponin antibody 560 | Hytest (Finland) | 4T21 | |
| Ethanolamine-HCl solution | BioRad (CA, USA) | 1762450 | |
| Surface Plasmon Resonance setup | BioRad XPR36 (Haifa, Israel) | ||
| Multiplexed SPR chip | BioRad | GLC | |
| Human cTnI standard | Phoenix Pharmaceuticals | EK -311-05 | |
| Glycine-HCl | BioRad (CA, USA) | 1762221 |
References
- Ebbesen, T. W., Lezec, H. J., Ghaemi, H., Thio, T., Wolff, P. Extraordinary optical transmission through sub-wavelength hole arrays. Nature. 391 (6668), 667-669 (1998).
- Krishnan, A., et al. Evanescently coupled resonance in surface plasmon enhanced transmission. Optics Comm. 200 (1), 1-7 (2001).
- Yang, J. -C., et al. Enhanced optical transmission mediated by localized plasmons in anisotropic, three-dimensional nanohole arrays. Nano letters. 10 (8), 3173-3178 (2010).
- Kim, J. H., Moyer, P. J. Transmission characteristics of metallic equilateral triangular nanohole arrays. Appl Phys Lett. 89 (12), 121106 (2006).
- Liu, H., Lalanne, P. Microscopic theory of the extraordinary optical transmission. Nature. 452 (7188), 728-731 (2008).
- Shon, Y. -S., Choi, H. Y., Guerrero, M. S., Kwon, C. Preparation of nanostructured film arrays for transmission localized surface plasmon sensing. Plasmonics. 4 (2), 95-105 (2009).
- Xiang, G., Zhang, N., Zhou, X. Localized surface plasmon resonance biosensing with large area of gold nanoholes fabricated by nanosphere lithography. Nanoscale Res Lett. 5 (5), 818 (2010).
- Valsecchi, C., Brolo, A. G. Periodic metallic nanostructures as plasmonic chemical sensors. Langmuir. 29 (19), 5638-5649 (2013).
- Gates, B. D., et al. New approaches to nanofabrication: molding, printing, and other techniques. Chem Rev. 105 (4), 1171-1196 (2005).
- Guo, L. J. Nanoimprint lithography: methods and material requirements. Adv Mater. 19 (4), 495-513 (2007).
- Wong, T. I., et al. High throughput and high yield nanofabrication of precisely designed gold nanohole arrays for fluorescence enhanced detection of biomarkers. Lab on a Chip. 13 (12), 2405-2413 (2013).
- Deng, J., Wong, T. I., Sun, L. L., Quan, C., Zhou, X. Acceleration of e-beam lithography by minimized resist exposure for large scale nanofabrication. Microelect Eng. 166, 31-38 (2016).
- Wu, L., Bai, P., Li, E. P. Designing surface plasmon resonance of subwavelength hole arrays by studying absorption. JOSA B. 29 (4), 521-528 (2012).
- Ding, T., et al. Quantification of a cardiac biomarker in human serum using extraordinary optical transmission (EOT). PloS one. 10 (3), 0120974 (2015).
- Im, H., Sutherland, J. N., Maynard, J. A., Oh, S. -H. Nanohole-based surface plasmon resonance instruments with improved spectral resolution quantify a broad range of antibody-ligand binding kinetics. Anal Chem. 84 (4), 1941-1947 (2012).
- Bhagawati, M., You, C., Piehler, J. Quantitative real-time imaging of protein-protein interactions by LSPR detection with micropatterned gold nanoparticles. Anal Chem. 85 (20), 9564-9571 (2013).



 . Per la dose di esposizione alle 110 µC cm− 2, il tempo di abitazione del fascio elettronico su ogni punto esposto è 0,5 µs12. Poiché la matrice consente di acquisire un'area di 1.8 mm2, ci sono un totale di 36 patch delle zone di campo2 300 µm cuciti insieme a una matrice ordinata di oro, grande forma.
. Per la dose di esposizione alle 110 µC cm− 2, il tempo di abitazione del fascio elettronico su ogni punto esposto è 0,5 µs12. Poiché la matrice consente di acquisire un'area di 1.8 mm2, ci sono un totale di 36 patch delle zone di campo2 300 µm cuciti insieme a una matrice ordinata di oro, grande forma.