ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
示了流基于流式细胞仪的方法定量地确定人类自然杀手细胞的细胞毒活性。
Abstract
先天免疫系统内效应器淋巴细胞称为自然杀伤 (NK) 细胞在宿主防御对异常细胞,专门消除肿瘤和病毒感染细胞发挥了重要的作用。大约 30 已知的单基因缺陷,一大批其他的病理状况,导致功能或经典 NK 细胞缺陷,表现在减少或缺失细胞毒活性。历史上,还用放射性方法,它是繁琐、 昂贵和有潜在危险的方法研究了细胞毒性。这篇文章描述了一个精简、 临床适用流流式细胞仪基于方法量化 NK 细胞杀伤活性。这种测定方法,外周血单个核细胞 (外周血) 或纯化的 NK 细胞制剂在不同比例共同孵育与已知为 NK 细胞介导的细胞毒性 (NKCC) 对敏感目标肿瘤细胞系。靶细胞是预先标记荧光的荧光染料,使他们从效应器细胞 (NK 细胞) 的歧视。后潜伏期,杀死的靶细胞核酸染色,具体地渗透到死细胞由标识。此方法是服从既诊断研究和应用,得益于多参数流式细胞的能力,有好处,有可能使 NK 细胞表型和功能的更深入的分析。
Introduction
自然杀伤 (NK) 细胞是人类先天淋巴细胞批判地参与消除病毒感染的细胞,转化的细胞和其他致病性威胁1,2的复杂的子集。NK 细胞裂解颗粒房子像穿孔素和 granzymes 细胞毒性蛋白质。激活后,NK 细胞形成复杂的互动关系,与他们的目标称为免疫突触,藉以本地释放这些细胞毒性分子,造成的直接目标细胞裂解和细胞凋亡与细胞因子和趋化因子的释放,并最终在诱导炎症状态1,,34。
NK 细胞活化涉及复杂的字符串的激活和抑制相互作用 NK 细胞受体与配体形成严格监管的系统的靶细胞表面表达。NK 细胞活化的研究最机制之一是"缺少自我"。事实上,缺乏检测类我主要组织相容性复合物 (MHC) 上或人类白细胞抗原 (HLA) 分子的感染或转化细胞触发器 NK 细胞毒性。肿瘤和病毒感染的细胞普遍下调这些抗原逃避 T 细胞介导的免疫功能,从而成为初级 NK 细胞目标1,,34。
NK 细胞功能的评估主要分为肥大或细胞毒性检测方法。然而,脱颗粒含量测定,如 CD107a,肥大关联标记流流式细胞术检测仅仅是功能的指示性的 NK 细胞活化而不是功能的其最终,直接杀死目标细胞5,,67,8的。因此,这种限制已经提请调查人员细胞毒性试验作为一种更生动、 更直接的替代。
长期的"金本位"评估细胞介导的细胞毒活性的 T 和 NK 细胞是铬释放检测 (CRA)。CRA 涉及放射性标记的靶细胞与51Cr 和效应器细胞共同孵育他们。这种测定方法被沉浸在那细胞裂解结果中释放的蛋白质绑定51Cr 到上清液,可以通过伽玛计数测量的原理。这种测定方法,同时有效,是有问题的各种原因: 材料成本高、 处理和处置放射性51Cr、 51Cr,自发释放和困难标准化-使它完全不切实际9,10。
大量的非放射性检测,涉及荧光标记、 酶释放和甚至生物发光,已经得到发展,作为 CRA 11,,1213,14的替代品。在这里,我们可以描述流测量的 NK 细胞杀伤活性对 k562 细胞的靶细胞,是简单、 灵敏,基于流式细胞仪的方法。K562 细胞是人类 erythroleukemic 细胞线与 HLA 类表达减少第一和配体的活化 NK 受体,这使得它们特别容易受到 NK 细胞介导的细胞毒性15高度的表达。在这种测定方法,K562 细胞前带有羧基荧光素二乙酸琥珀酰亚胺酯 (CFSE) 和共培养在各种比率与任一外周血单个核细胞 (外周血) 或纯化 NK 细胞1。CFSE 是稳定、 蛋白结合的荧光染料,允许歧视的靶细胞效应器 NK 细胞16,17日。共同孵育后, 核酸染色,具体渗透膜的死细胞,用于标识被杀死的靶细胞 (见材料表)。样品上流式细胞仪来确定死 (即,染色 +) 的百分比,得出 CFSE + 靶细胞。
这种测定方法可以用作常规的诊断筛查,为单基因缺陷影响 NK 细胞隔间,其中有大约 30 已知的缺陷导致功能或经典 NK 细胞缺乏症,并为原发性或继发性噬血细胞综合征。它也是用于调查患者反复发作,严重的疱疹病毒感染,评价免疫重建造血细胞移植或邮政免疫调节治疗18,,1920后, 为基本研究应用程序宿主 NK 细胞活性。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
在设置前检测,强烈建议 NK 细胞内容会在选择的效应器人口评估。图 1显示了典型 CD56 沾色 (浅蓝色) 之前和之后 (红色) NK 细胞富集。NK 细胞组成达 15%的外周血和浓缩后应至少 80%的纯。
流式细胞术分析这种测定方法中的涉及的两个参数的检测: CFSE,检出相同的通道作为 FITC;和死细胞染色,在相同的通道作为 APC (图 2A、 B) 检测。后数据采集,在图 2中的浇注策略用于分析数据。死者 (即,死细胞染色 +) 细胞株 K562 目标细胞闸 CFSE + 人口,提供死亡细胞内目标人口的 %。
控制条件是确保检测的有效性本身和其单独的组件的关键。为了使检测才被视为有效,以下应在控制条件下 (6-8): 靶的细胞只有 (条件6) 应最终导致细胞死亡 < 15%(图 3A)。应检测到没有 CFSE 信号,为免疫效应细胞只有 (条件7),和细胞死亡应该是 < 5%(图 3B)。对于补间介导靶细胞 (条件8) 杀害,细胞死亡应该是 > 85%(图 3)。
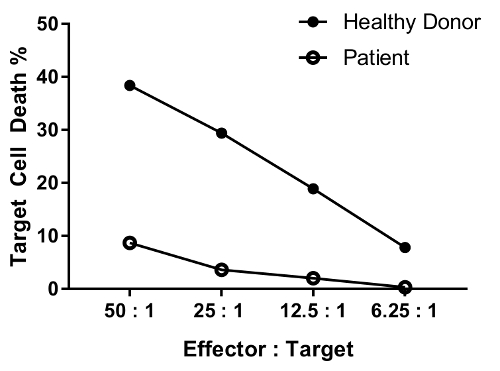
NK 细胞功能缺陷的患者预计有最减少杀伤活性或所有比率都测试与一个健康的个体。健康献血者和病人的细胞,在图 4 中的并行显示目标细胞死亡随效应器目标细胞比减小微分的显着减少。

图 1: NK 细胞内的内容效应器人口评估。代表直方图后染色共外周血 (浅蓝色) 或净化 CD56 NK 细胞 (红色)。请点击这里查看此图的大版本。

图 2: 浇注的靶细胞的检测策略。A)在 FITC A SSC 的情节中设置初始的门。K562 细胞闸作为 CFSE + 事件。B)死 K562 细胞 (即为死细胞阳性染色) 封闭入 CFSE + 目标细胞群体内随后的 APC A SSC 的情节。请点击这里查看此图的大版本。

图 3: 控制条件的代表数据。 A) 百分比的死细胞染色 + K562 细胞内 (浇注策略如图 2 所示) 的门 CFSE + 条件6 (只有靶细胞)-阴性对照的 K562 细胞死亡。B) CFSE 与死细胞染色检测条件7 (免疫效应细胞只有-总外周血)。C)百分比的死细胞染色 + K562 细胞内 (浇注策略如图 2 所示) 的门 CFSE + 条件8 (靶细胞 + 补间)-阳性对照的 K562 细胞死亡。请点击这里查看此图的大版本。

图 4: 各种效应目标细胞比率的稀释效应的代表数据。测试的效应: 目标细胞比率如下: 50: 1、 25: 1;12.5: 1;6.25:1.数据是背景 (条件 #6)-删除。请点击这里查看此图的大版本。
| 示例 | 条件 | 效应器 (E): 目标 (T) |
| 外周血 | 1-阳性对照为 NK 细胞毒性的 | 50:1 + 白细胞介素-2 |
| 2 | 50:1 | |
| 3 | 25:1 | |
| 4 | 12.5: 1 | |
| 5 | 6.25: 1 | |
| 6 | 只有 T | |
| 7-阴性对照的 k562 细胞死亡 | E 只 | |
| 8-阳性对照的 k562 细胞死亡 | T + 补间 | |
| NK 细胞 (纯) | 1-阳性对照为 NK 细胞毒性的 | 5:1 + 白细胞介素-2 |
| 2 | 5:1 | |
| 3 | 2.5: 1 | |
| 4 | 1.25: 1 | |
| 5 | 0.625: 1 | |
| 6 | 只有 T | |
| 7-阴性对照的 k562 细胞死亡 | E 只 | |
| 8-阳性对照的 k562 细胞死亡 | T + 补间 |
表 1
Subscription Required. Please recommend JoVE to your librarian.
Discussion
这里介绍的方法提供了一个简单和具有成本效益的替代传统51铬释放检测评估 NK 细胞杀伤活性。此方法是灵敏、 重现性好,比以前的标准方法,像 cra 法案,耗时少,可以用于临床和研究应用程序。
同时测定工程与总外周血和浓缩的 NK 细胞,而无需使用外周血净化细胞群体的选项是极大的好处与小卷收集的血或少或质量差细胞来自病人的样本打交道时。这种测定方法利用只有 CFSE 和死细胞排除可行性污点。看着这两个参数仅用于诊断目的,与不需要进一步在流式细胞术分析补偿的额外好处提供简洁和足够的信息。
此方法还可以用于研究基本 NK 细胞生物学和测试新 NK 细胞靶向疗法。在这方面,流式细胞仪的不断扩展功能的多功能性,这种测定方法,允许多参数分析的 NK 细胞和他们的活动不像 CRA 的检测方法与以前可能引入宝贵。跟踪的替代细胞活力染料,荧光在其他渠道,并可应付调查人员的需要。
本议定书是为使用而优化与原型的 NK 细胞靶细胞 K562 细胞株。然而,它可以适应不同程度的敏感性对 NK 细胞毒性、 HL 60、 达乌迪、 U937 和 Raji 等替代悬浮目标细胞系。在这方面,它是重要的是请注意浓度的荧光染料和血清用于在目标单元格贴标过程中可能需要为每个目标单元格的行,优化作为不同的细胞株可能会占用荧光标签,以不同的方式,并为每个流式细胞仪。虽然它通常建议避免使用血清在贴标过程中,我们选择轻微淬火与 0.5%胎牛血清的原因有两个。首先,它有助于减少目标细胞应力,因此背景染色;第二,它带来我们流式细胞仪检测适当范围 CFSE 信号无需日常的设置调整,从而帮助测定的重现性。附加议定书 》 的变化可能包括测试不同 E:T 比率和孵育时间,以适应不同的活化条件对测定。共同文化效应与靶细胞 NK 细胞毒性测试的持续时间从历史上看已从 4-16 个小时,虽然长时间往往会导致增加自发释放9,16。在我们的方法,较长的潜伏期可能也导致丢失的荧光标记的靶细胞因杀害或扩散,由于这些荧光染料稀释后细胞分裂。因此,孵化时间窗口下端是首选,他们不应超过一夜孵化6,,1622。
它是重要的是注意到其中变量可以潜在地影响这种测定方法的结果。K562 细胞靶细胞在我们的经验,对温度变化特别敏感。因此,K562 细胞应该不是冷藏而是室温保存或放在湿润的 CO2培养箱,在其使用前 37 ° C。为同样的原因,所有试剂都应至适当的温度下议定书 》 所示。影响这些细胞的另一个参数是离心速度,应该降低细胞的压力减至最低。此外,限制效应/靶制备工艺和共同孵化到少于 30 分钟的开始之间的滞后时间是必须确保最大的杀伤活性和含量测定的重现性。同样,因为 CFSE 信号是一般鲁棒,准确滴管,适当搅拌的细胞和精确的孵化时间标签和淬火时确保染色的一致性的关键。最后,NK 细胞的杀伤能力是高度可变的即使在健康的个体,受很多因素,包括发育阶段、 性别、 年龄和体重23,24,25。此外,起到 30%的健康对照大幅度减少或完全丧失细胞毒能力如果显示测试超过 24 小时后血画。因此,它被建议使用新鲜纯化外周血或 NK 细胞只要有可能。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
作者宣称没有的财务上的利益冲突。
Acknowledgments
我们要感谢吉尔纳西索,加州大学洛杉矶分校免疫遗传学中心,她求助与手稿的准备。
Materials
| Name | Company | Catalog Number | Comments |
| Phosphate-buffered Saline (1x, w/o Ca2+ and Mg2+) | Corning (Cellgro) | 21-040-CM | |
| Ficoll-Paque PLUS | GE Healthcare | 17-1440-02 | |
| Tween-20 | Sigma | BP337-100 | |
| RPMI 1640 Media | Corning (Cellgro) | 10-040-CV | |
| Heat-inactivated Fetal Bovine Serum | Omega Scientific | FB-02 | |
| Penicillin Streptomycin | Life Technologies | 15140-163 | Stock solution at 10,000 U/mL |
| IL-2 | R&D Systems | 202-IL-050 | Lyophilized from a 0.2 μm filtered solution in Acetonitrile and TFA with BSA as a carrier protein. Reconstitute with 500 ul at 100 μg/mL in sterile 100 mM Acetic Acid containing at least 0.1% bovine serum albumin (2.1x10E6 IU/ml) |
| K562 Cells | ATCC | CCL-243 | Cancer cell line |
| T-75 cell culture flasks | Corning | 431464 | |
| CFSE cell proliferation kit | Life Technologies (CellTrace) | C34554 | Reconstitute I vial with 18 ul DMSO to prepare a 5mM stock solution. Do not freeze/thaw. |
| Sytox Red | Life Technologies | S34859 | Stock solution is provided at 5 μM in 1 mL DMSO. The DMSO solution may be subjected to multiple freeze-thaw cycles without reagent degradation. |
| Sodium/lithium heparin blood collection tubes | BD | 02-687-95 | |
| U-bottom 96-well plate | Corning | CLS3897 | |
| Serological pipettes | BD Falcon | ||
| Polystyrene round-bottom tubes (5mL) | BD Falcon | 14959-5 | |
| 50 mL polypropylene conical tube | BD Falcon | 352070 | |
| 15 mL polypropylene conical tube | BD Falcon | 352097 | |
| Reagent reservoir | USA Scientific | 2321-2230 | |
| Human NK cell enrichment cocktail | StemCell Technologies (RosetteSep) | 15065 |
References
- Iannello, A., Debbeche, O., Samarani, S., Ahmad, A. Antiviral NK cell responses in HIV infection: I. NK cell receptor genes as determinants of HIV resistance and progression to AIDS. J Leukoc Biol. 84 (1), 1-26 (2008).
- Caligiuri, M. A. Human natural killer cells. Blood. 112 (3), 461-469 (2008).
- Topham, N. J., Hewitt, E. W. Natural killer cell cytotoxicity: how do they pull the trigger? Immunology. 128 (1), 7-15 (2009).
- Warren, H. S., Smyth, M. J. NK cells and apoptosis. Immunol Cell Biol. 77 (1), 64-75 (1999).
- Tognarelli, S., Jacobs, B., Staiger, N., Ullrich, E. Flow Cytometry-based Assay for the Monitoring of NK Cell Functions. J Vis Exp. (116), (2016).
- Somanchi, S. S., McCulley, K. J., Somanchi, A., Chan, L. L., Lee, D. A. A Novel Method for Assessment of Natural Killer Cell Cytotoxicity Using Image Cytometry. PLoS One. 10 (10), e0141074 (2015).
- Alter, G., Malenfant, J. M., Altfeld, M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods. 294 (1-2), 15-22 (2004).
- Atkinson, E. A., Gerrard, J. M., Hildes, G. E., Greenberg, A. H. Studies of the mechanism of natural killer (NK) degranulation and cytotoxicity. J Leukoc Biol. 47 (1), 39-48 (1990).
- Kim, G. G., Donnenberg, V. S., Donnenberg, A. D., Gooding, W., Whiteside, T. L. A novel multiparametric flow cytometry-based cytotoxicity assay simultaneously immunophenotypes effector cells: comparisons to a 4 h 51Cr-release assay. J Immunol Methods. 325 (1-2), 51-66 (2007).
- Kane, K. L., Ashton, F. A., Schmitz, J. L., Folds, J. D. Determination of natural killer cell function by flow cytometry. Clin Diagn Lab Immunol. 3 (3), 295-300 (1996).
- Jang, Y. Y., et al. An improved flow cytometry-based natural killer cytotoxicity assay involving calcein AM staining of effector cells. Ann Clin Lab Sci. 42 (1), 42-49 (2012).
- Korzeniewski, C., Callewaert, D. M. An enzyme-release assay for natural cytotoxicity. J Immunol Methods. 64 (3), 313-320 (1983).
- Karimi, M. A., et al. Measuring cytotoxicity by bioluminescence imaging outperforms the standard chromium-51 release assay. PLoS One. 9 (2), e89357 (2014).
- Oppenheim, D. E., et al. Glyco-engineered anti-EGFR mAb elicits ADCC by NK cells from colorectal cancer patients irrespective of chemotherapy. Br J Cancer. 110 (5), 1221-1227 (2014).
- West, W. H., Cannon, G. B., Kay, H. D., Bonnard, G. D., Herberman, R. B. Natural cytotoxic reactivity of human lymphocytes against a myeloid cell line: characterization of effector cells. J Immunol. 118 (1), 355-361 (1977).
- Jedema, I., van der Werff, N. M., Barge, R. M., Willemze, R., Falkenburg, J. H. New CFSE-based assay to determine susceptibility to lysis by cytotoxic T cells of leukemic precursor cells within a heterogeneous target cell population. Blood. 103 (7), 2677-2682 (2004).
- Lecoeur, H., Fevrier, M., Garcia, S., Riviere, Y., Gougeon, M. L. A novel flow cytometric assay for quantitation and multiparametric characterization of cell-mediated cytotoxicity. J Immunol Methods. 253 (1-2), 177-187 (2001).
- Carotta, S. Targeting NK Cells for Anticancer Immunotherapy: Clinical and Preclinical Approaches. Front Immunol. 7, 152 (2016).
- Mandal, A., Viswanathan, C. Natural killer cells: In health and disease. Hematol Oncol Stem Cell Ther. 8 (2), 47-55 (2015).
- Rezvani, K., Rouce, R. H. The Application of Natural Killer Cell Immunotherapy for the Treatment of Cancer. Front Immunol. 6, 578 (2015).
- Angelo, L. S., et al. Practical NK cell phenotyping and variability in healthy adults. Immunol Res. 62 (3), 341-356 (2015).
- Zons, P., et al. Comparison of europium and chromium release assays: cytotoxicity in healthy individuals and patients with cervical carcinoma. Clin Diagn Lab Immunol. 4 (2), 202-207 (1997).
- Yovel, G., Shakhar, K., Ben-Eliyahu, S. The effects of sex, menstrual cycle, and oral contraceptives on the number and activity of natural killer cells. Gynecol Oncol. 81 (2), 254-262 (2001).
- Laue, T., et al. Altered NK cell function in obese healthy humans. BMC Obes. 2, 1 (2015).
- Hazeldine, J., Lord, J. M. The impact of ageing on natural killer cell function and potential consequences for health in older adults. Ageing Res Rev. 12 (4), 1069-1078 (2013).
Tags
免疫学、 细胞毒性,问题 126、 NK 细胞,自然杀手细胞裂解,细胞杀伤,K562、 流式细胞仪、 铬释放、 NK 细胞毒性,CFSEErratum
Formal Correction: Erratum: A Flow Cytometry-Based Cytotoxicity Assay for the Assessment of Human NK Cell Activity
Posted by JoVE Editors on 09/10/2017.
Citeable Link.
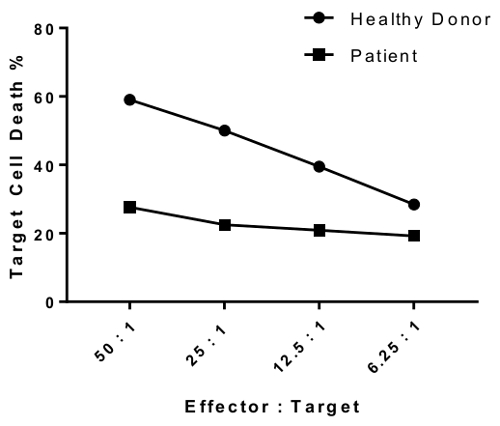
An erratum was issued for: A Flow Cytometry-Based Cytotoxicity Assay for the Assessment of Human NK Cell Activity. Figure 4 has been corrected to show background-corrected data.
Figure 4 was corrected from:
to: