ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Een stroom cytometry gebaseerde methode om kwantitatief de cytotoxische activiteit van menselijke natural killer cellen wordt hier weergegeven.
Abstract
Binnen het ingeboren immune systeem spelen effector lymfocyten bekend als de natural killer (NK) cellen een essentiële rol in de verdediging van de gastheer tegen afwijkende cellen, specifiek elimineren tumoraal en viraal geïnfecteerde cellen. Ongeveer 30 bekende monogeen gebreken, samen met een gastheer van andere pathologische condities, veroorzaken functionele of klassieke NK-cel-deficiëntie, manifesteren verminderd of afwezig cytotoxische activiteit. Historisch, is cytotoxiciteit onderzocht met radioactieve methoden, die omslachtig, duur en mogelijk gevaarlijk zijn. Dit artikel beschrijft een gestroomlijnde, klinisch toepasselijke stroom cytometry gebaseerde methode om te kwantificeren NK cel cytotoxische activiteit. In deze test zijn perifere bloed mononucleaire cellen (PBMCs) of gezuiverde NK cel preparaten mede bebroede op verschillende verhoudingen met een doel tumor cellijn bekend te zijn gevoelig voor NK cel-gemedieerde cytotoxiciteit (NKCC). De doelcellen zijn vooraf gelabelde met een fluorescente kleurstof toe hun discriminatie uit de effector cellen (NK-cellen). Na de incubatieperiode, worden gedood doelcellen aangeduid met een vlek van nucleic zuur, die specifiek dode cellen doordringt. Deze methode is vatbaar voor zowel diagnose en onderzoek toepassingen en dankzij de mogelijkheden van de Multi-parameter van stroom cytometry, heeft het toegevoegde voordeel potentieel in staat te stellen een diepere analyse van NK-cel fenotype en functie.
Introduction
Natural killer (NK) cellen zijn een verfijnde subset van menselijke aangeboren lymfocyten kritisch die betrokken zijn bij de eliminatie van viraal geïnfecteerde cellen, getransformeerde cellen, en andere pathogene bedreigingen 1,2. NK-cel lytische korrels huis cytotoxische eiwitten, zoals Perforine en granzymes. Na activatie, NK-cellen vormen een complexe interactie met hun doelen bekend als immunologische synapse, waarbij deze cytolytische moleculen lokaal vrijgegeven zijn, wat resulteert in de lysis van de cel van de directe doel en apoptosis, samen met cytokine en chemokine release en uiteindelijk in de inductie van een inflammatoire staat 1,3,4.
NK-cel-activatie gaat om een complexe reeks van activeren en remmende interacties tussen NK cel receptoren en liganden uitgedrukt op het oppervlak van doelcellen, vormen een strak gereguleerde systeem. Een van de meest bestudeerde mechanismen van NK cel activatie is het "ontbrekende zelf". Inderdaad, gebrek aan opsporing van klasse die ik major histocompatibility complex (MHC) of human leukocyte antigeen (HLA) moleculen, op geïnfecteerd of cellen triggers NK cel cytotoxiciteit worden omgezet. Tumor en virus-geïnfecteerde cellen in het algemeen downregulate deze antigenen te ontsnappen van T-cel-gemedieerde immuniteit, zo wordend primaire NK cel doelstellingen 1,3,4.
Beoordeling van NK-cel functie is hoofdzakelijk onderverdeeld in degranulatie of cytotoxiciteit testen. Degranulatie testen, zoals stroom cytometrische detectie van de degranulatie-geassocieerde markering CD107a, zijn echter slechts indicatief van NK-cel activatie en niet van hun uiteindelijke functie, de directe moord op target cellen 5,6,7,8. Vandaar heeft deze beperking getrokken onderzoekers cytotoxiciteit testen als een meer vertellen en meer directe alternatief.
De lange tijd "gouden standaard" voor de beoordeling van cel-gemedieerde cytotoxische activiteit van zowel T en NK-cellen is de chroom release assay (CRA). CRA omvat het radioactief labelen van doelcellen met 51Cr en broeden ze samen met effector cellen. Deze test is doordrenkt van het beginsel dat lysis van de cel resulteert in het vrijkomen van eiwit-gebonden 51Cr in de bovendrijvende substantie, die kan worden gemeten door het tellen van de gamma. Deze assay, terwijl effectief, is problematisch voor een verscheidenheid van redenen: hoge materiaalkosten, behandeling en verwijdering van radioactieve 51Cr, spontane release van 51Cr en moeilijk standaardisering - waardoor het totaal onpraktisch 9,10.
Een aantal niet-radioactieve testen, met fluorescerende labeling, enzym release en zelfs bioluminescentie, zijn sindsdien ontwikkeld als alternatief voor CRA 11,12,13,14. Hier beschrijven we een stroom cytometry gebaseerde methode voor meting van de NK-cel cytotoxische activiteit op K562 doelcellen thats eenvoudig, gevoelige en reproduceerbaar. K562 cellen zijn een menselijke erythroleukemic cel lijn met verminderde expressie van HLA-klasse I en verhoogde expressie van liganden voor activatory NK receptoren, waardoor ze bijzonder vatbaar voor NK cel-gemedieerde cytotoxiciteit 15. In deze test, K562 cellen worden vooraf aangeduid met carboxyfluorescein DIACETAAT succinimidyl ester (CFSE) en mede gekweekt in verschillende verhoudingen met beide perifere bloed mononucleaire cellen (PBMCs) of gezuiverd van NK cellen 1. CFSE is een stabiele, binding aan eiwitten fluorescerende kleurstof waarmee discriminatie van doelcellen van effector NK cellen 16,17. Na de co incubatie, wordt een nucleïnezuur vlek, specifiek doordringt het membraan van dode cellen, gebruikt voor het identificeren van gedode doelcellen (zie tabel van materialen). De monsters worden vervolgens verworven op een cytometer van de stroom om te bepalen van het percentage van doden (dat wil zeggen, vlek +) CFSE + doelcellen.
Deze test kan worden gebruikt als een routinematige diagnostische screening voor monogeen gebreken op het gebied van het NK cel compartiment, waarvan er ongeveer 30 bekende gebreken veroorzaakt functionele of klassieke NK-cel-deficiëntie, aanwezig zijn en voor primaire of secundaire hemophagocytic lymphohistiocytosis. Het is ook nuttig NK cel activiteiten bij patiënten met terugkerende, ernstige herpes virale infecties, te evalueren immuunsysteem reconstitutie na transplantatie van hematopoïetische cel of post immunomodulerende therapie 18,19,20, en voor een heleboel applicaties van fundamenteel onderzoek te onderzoeken.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Voordat u de test, is het sterk aanbevolen dat de inhoud van de cel van de NK worden beoordeeld bij de effector populatie van keuze. Figuur 1 toont een typische CD56 kleuring vóór (lichtblauw) en na (rood) NK cel verrijking. NK cellen bestaan uit maximaal 15% van PBMCs en moeten ten minste 80% zuiver na verrijking.
Flow analyse van de cytometrische in deze bepaling impliceert detectie van twee parameters: CFSE, aantoonbaar in hetzelfde kanaal als FITC; en een dode cel vlek, in hetzelfde kanaal als APC (figuur 2AB) worden opgespoord. Na de data-acquisitie, wordt het gating strategie in Figuur 2 gebruikt om gegevens te analyseren. Doden (dat wil zeggen, dode cel vlek +) K562 doelcellen zijn omheinde uit de CFSE + bevolking, met de % van gedode cellen binnen de doelgroep.
Controlevoorwaarden zijn cruciaal in het waarborgen van de doeltreffendheid van de bepaling zelf en de afzonderlijke onderdelen. Om de test te worden als geldig beschouwd, de volgende mag worden verwacht dat in de omstandigheden van de controle (6-8): Target cellen slechts (voorwaarde 6) leiden celdood tot moet < 15% (figuur 3A). Geen CFSE-signaal moet worden gevonden voor effector alleen (voorwaarde 7 cellen), en celdood moet < 5% (figuur 3B). Voor Tween-gemedieerde doden van doelcellen (voorwaarde 8), de dood van de cel moet > 85% (Figuur 3 c).
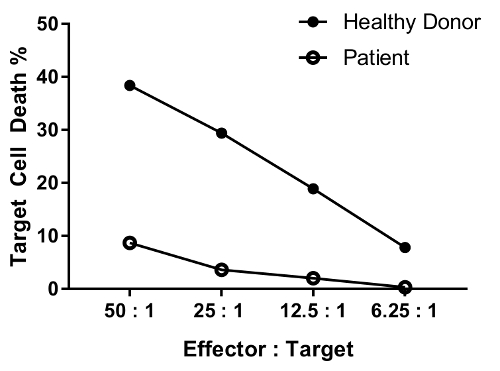
Een patiënt met defect in functie van de cel NK verwachting hebben verminderd doden activiteit op de meeste of alle ratio's getest ten opzichte van een gezonde persoon. De parallel op gezonde donor en patiënt cellen in Figuur 4 toont differentiële, significante vermindering in de dood van de cel van de doelgroep met afnemende effector-target cel verhouding.

Figuur 1: beoordeling van de inhoud van de cel van de NK binnen de bevolking effector. Representatieve histogram na kleuring total PBMCs (lichtblauw) of gezuiverd van NK-cellen (rood) voor CD56. Klik hier voor een grotere versie van dit cijfer.

Figuur 2: strategie voor de detectie van doelcellen Gating. A) de eerste poort is ingesteld in een FITC-A/SSC-A plot. K562 cellen zijn omheinde als CFSE + evenementen. B) dode K562 cellen (bijvoorbeeld positief voor dode cel vlek) zijn gated in de daaropvolgende APC-A/SSC-A plot binnen de CFSE + cel doelgroep. Klik hier voor een grotere versie van dit cijfer.

Figuur 3: representatieve gegevens voor controlevoorwaarden. A) Percentage van dode cel vlek + K562 cellen binnen de poort CFSE + (gating-strategie zoals in Figuur 2) in voorwaarde 6 (doelcellen alleen) - negatieve controle voor de dood van de cel van de K562. B) CFSE en dode cel vlek detectie in voorwaarde 7 (effector cellen alleen - totale PBMCs). C) Percentage van dode cel vlek + K562 cellen binnen de poort CFSE + (gating-strategie zoals in Figuur 2) in voorwaarde 8 (doelcellen + Tween) - positieve controle voor de dood van de cel van de K562. Klik hier voor een grotere versie van dit cijfer.

Figuur 4: representatieve gegevens voor het verwateringseffect van verschillende effector-target cel verhouding. De effector: target cel ratio's getest zijn als volgt: 50: 1, 25:1; 12.5:1; 6.25:1. gegevens zijn achtergrond (voorwaarde #6)-verwijderd. Klik hier voor een grotere versie van dit cijfer.
| Monster | Voorwaarde | Effector (E): Target (T) |
| PBMCs | 1 - positieve controle voor NK cel cytotoxiciteit | 50:1 + IL-2 |
| 2 | 50: 1 | |
| 3 | 25: 1 | |
| 4 | 12,5: 1 | |
| 5 | 6,25: 1 | |
| 6 | T alleen | |
| 7 - negatieve controle voor K562 dood | E alleen | |
| 8 - positieve controle voor K562 dood | T + Tween | |
| NK-cellen (gezuiverd) | 1 - positieve controle voor NK cel cytotoxiciteit | 5:1 + IL-2 |
| 2 | 5: 1 | |
| 3 | 2.5: 1 | |
| 4 | 1,25: 1 | |
| 5 | 0.625: 1 | |
| 6 | T alleen | |
| 7 - negatieve controle voor K562 dood | E alleen | |
| 8 - positieve controle voor K562 dood | T + Tween |
Tabel 1
Subscription Required. Please recommend JoVE to your librarian.
Discussion
De hier beschreven methode biedt een eenvoudige en rendabele alternatief voor de traditionele 51Cr release assay te beoordelen van de NK-cel cytotoxische activiteit. Deze methode is de gevoelig, reproduceerbaar zijn, en minder tijd in beslag dan de vorige standaard methoden, zoals CRA, en kan worden gebruikt voor zowel klinische en onderzoek toepassingen.
Terwijl de test met zowel totale PBMCs en verrijkte NK-cellen werkt, is de optie PBMCs gebruiken zonder de noodzaak voor het zuiveren van cel populaties een groot voordeel bij de behandeling van kleine hoeveelheden van het verzamelde bloed of weinig of slechte kwaliteit cellen van patiëntenverenigingen monsters. Deze test maakt gebruik van alleen de CFSE en de dode cel uitsluiting levensvatbaarheid vlek. Kijken naar deze twee parameters alleen informatie beknopt en voldoende voor diagnostische doeleinden, met het extra voordeel van geen vereisen verdere compensatie in flow cytometrische analyse.
Deze methode kan ook worden gebruikt om te bestuderen van de fundamentele biologie van de cel van het NK en testen nieuwe NK-cel-gerichte therapieën. In dit verband voeren de groeiende mogelijkheden van flow cytometers een onschatbare waarde element van veelzijdigheid aan deze bepaling, waardoor multiparameter p.a. van NK-cellen en hun activiteit niet eerder mogelijk met assays zoals CRA. Alternatieve cel bijhouden en levensvatbaarheid kleurstoffen, oplichtende in andere kanalen, zijn beschikbaar voor de onderzoekers behoeften.
Dit protocol is geoptimaliseerd voor gebruik met de prototypische NK cel doelgroep cellijn van K562. Het kan echter aangepast aan alternatieve schorsing doel cellijnen met variërende mate van gevoeligheid naar NK-cel cytotoxiciteit, zoals HL-60, Daudi, U937 en Raji. In dit verband is het belangrijk op te merken dat de concentratie van fluorescente kleurstof en serum gebruikt tijdens het labelen van target cel worden geoptimaliseerd voor elke target cel regel, moet mogelijk zoals verschillende cellijnen de fluorescerende label anders, en voor elke stroom cytometer duurt. Terwijl het meestal aangeraden om te voorkomen dat met behulp van serum tijdens het labelen, hebben we gekozen voor lichte blussen met 0,5% van het FBS om twee redenen. Ten eerste helpt het verminderen van target cel spanning en dus de achtergrond vlek; Ten tweede, het CFSE signaal binnen het juiste bereik van detectie van onze stroom cytometer brengt zonder dagelijkse aanpassingen van de instellingen, daarmee helpend in de reproduceerbaarheid van de test. Aanvullend protocol variaties zijn bijvoorbeeld verschillende E:T ratio's en incubatie tijden aan te passen van de bepaling op de activering van de verschillende voorwaarden testen. De duur van de co cultuur van effector en doelcellen testen NK cytotoxiciteit heeft historisch varieerden van 4-16 h, al langere tijd de neiging om te resulteren in verhoogde spontane versie 9,16. In onze werkwijze, langere incubatietijd kan ook leiden tot verlies van TL labelen door de doelcellen doden en grof proliferatie, zoals deze fluorescente kleurstoffen worden verdund bij de celdeling. Dus, incubations in de onderkant van het venster van de tijd zijn over het algemeen de voorkeur en ze mag niet hoger zijn dan overnachting incubatie 6,16,22.
Het is belangrijk om kennis van die variabelen kunnen mogelijk invloed hebben op de uitkomst van deze test te nemen. In onze ervaring zijn de K562 target cellen vooral gevoelig voor temperatuurveranderingen. Dus moeten de K562 cellen niet worden gekoeld maar eerder bewaard bij kamertemperatuur of in een bevochtigde CO2 incubator bij 37 ° C vóór hun gebruik. Om dezelfde reden, moeten alle reagentia aan de vereiste temperatuur worden gebracht zoals aangegeven in het protocol. Een andere parameter die van deze cellen is de snelheid van centrifugeren, die moet worden teruggebracht tot een minimum beperken van cellulaire spanning. Bovendien is beperken de vertragingstijd tussen effector/target voorbereiding en het begin van de co incubatie aan minder dan 30 min essentieel om te zorgen voor maximale doden activiteit en reproduceerbaarheid assay. Ook als CFSE signaal in het algemeen robuust is, nauwkeurig pipetteren, juiste mixen van cellen en precieze incubatie tijd bij het labelen en blussen zijn van cruciaal belang te zorgen voor samenhang in de kleuring. Ten slotte, NK cel cytotoxische vermogen is zeer variabel zelfs in gezonde individuen en wordt beïnvloed door een aantal factoren, waaronder ontwikkelingsstadium, geslacht, leeftijd en gewicht 23,24,25. Daarnaast, omhoog tot 30% van de gezonde controles weergegeven een significante vermindering of volledig verlies van cytotoxische vermogen als getest van meer dan 24 uur na bloed trekken. Daarom is het aanbevolen om gebruik vers gezuiverd PBMCs of NK cellen zo veel mogelijk.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
De auteurs verklaren geen conflicten van belangen.
Acknowledgments
Wij wil Jill Narciso, UCLA Immunogenetica Center, bedanken voor haar hulp bij de voorbereiding van de manuscript.
Materials
| Name | Company | Catalog Number | Comments |
| Phosphate-buffered Saline (1x, w/o Ca2+ and Mg2+) | Corning (Cellgro) | 21-040-CM | |
| Ficoll-Paque PLUS | GE Healthcare | 17-1440-02 | |
| Tween-20 | Sigma | BP337-100 | |
| RPMI 1640 Media | Corning (Cellgro) | 10-040-CV | |
| Heat-inactivated Fetal Bovine Serum | Omega Scientific | FB-02 | |
| Penicillin Streptomycin | Life Technologies | 15140-163 | Stock solution at 10,000 U/mL |
| IL-2 | R&D Systems | 202-IL-050 | Lyophilized from a 0.2 μm filtered solution in Acetonitrile and TFA with BSA as a carrier protein. Reconstitute with 500 ul at 100 μg/mL in sterile 100 mM Acetic Acid containing at least 0.1% bovine serum albumin (2.1x10E6 IU/ml) |
| K562 Cells | ATCC | CCL-243 | Cancer cell line |
| T-75 cell culture flasks | Corning | 431464 | |
| CFSE cell proliferation kit | Life Technologies (CellTrace) | C34554 | Reconstitute I vial with 18 ul DMSO to prepare a 5mM stock solution. Do not freeze/thaw. |
| Sytox Red | Life Technologies | S34859 | Stock solution is provided at 5 μM in 1 mL DMSO. The DMSO solution may be subjected to multiple freeze-thaw cycles without reagent degradation. |
| Sodium/lithium heparin blood collection tubes | BD | 02-687-95 | |
| U-bottom 96-well plate | Corning | CLS3897 | |
| Serological pipettes | BD Falcon | ||
| Polystyrene round-bottom tubes (5mL) | BD Falcon | 14959-5 | |
| 50 mL polypropylene conical tube | BD Falcon | 352070 | |
| 15 mL polypropylene conical tube | BD Falcon | 352097 | |
| Reagent reservoir | USA Scientific | 2321-2230 | |
| Human NK cell enrichment cocktail | StemCell Technologies (RosetteSep) | 15065 |
References
- Iannello, A., Debbeche, O., Samarani, S., Ahmad, A. Antiviral NK cell responses in HIV infection: I. NK cell receptor genes as determinants of HIV resistance and progression to AIDS. J Leukoc Biol. 84 (1), 1-26 (2008).
- Caligiuri, M. A. Human natural killer cells. Blood. 112 (3), 461-469 (2008).
- Topham, N. J., Hewitt, E. W. Natural killer cell cytotoxicity: how do they pull the trigger? Immunology. 128 (1), 7-15 (2009).
- Warren, H. S., Smyth, M. J. NK cells and apoptosis. Immunol Cell Biol. 77 (1), 64-75 (1999).
- Tognarelli, S., Jacobs, B., Staiger, N., Ullrich, E. Flow Cytometry-based Assay for the Monitoring of NK Cell Functions. J Vis Exp. (116), (2016).
- Somanchi, S. S., McCulley, K. J., Somanchi, A., Chan, L. L., Lee, D. A. A Novel Method for Assessment of Natural Killer Cell Cytotoxicity Using Image Cytometry. PLoS One. 10 (10), e0141074 (2015).
- Alter, G., Malenfant, J. M., Altfeld, M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods. 294 (1-2), 15-22 (2004).
- Atkinson, E. A., Gerrard, J. M., Hildes, G. E., Greenberg, A. H. Studies of the mechanism of natural killer (NK) degranulation and cytotoxicity. J Leukoc Biol. 47 (1), 39-48 (1990).
- Kim, G. G., Donnenberg, V. S., Donnenberg, A. D., Gooding, W., Whiteside, T. L. A novel multiparametric flow cytometry-based cytotoxicity assay simultaneously immunophenotypes effector cells: comparisons to a 4 h 51Cr-release assay. J Immunol Methods. 325 (1-2), 51-66 (2007).
- Kane, K. L., Ashton, F. A., Schmitz, J. L., Folds, J. D. Determination of natural killer cell function by flow cytometry. Clin Diagn Lab Immunol. 3 (3), 295-300 (1996).
- Jang, Y. Y., et al. An improved flow cytometry-based natural killer cytotoxicity assay involving calcein AM staining of effector cells. Ann Clin Lab Sci. 42 (1), 42-49 (2012).
- Korzeniewski, C., Callewaert, D. M. An enzyme-release assay for natural cytotoxicity. J Immunol Methods. 64 (3), 313-320 (1983).
- Karimi, M. A., et al. Measuring cytotoxicity by bioluminescence imaging outperforms the standard chromium-51 release assay. PLoS One. 9 (2), e89357 (2014).
- Oppenheim, D. E., et al. Glyco-engineered anti-EGFR mAb elicits ADCC by NK cells from colorectal cancer patients irrespective of chemotherapy. Br J Cancer. 110 (5), 1221-1227 (2014).
- West, W. H., Cannon, G. B., Kay, H. D., Bonnard, G. D., Herberman, R. B. Natural cytotoxic reactivity of human lymphocytes against a myeloid cell line: characterization of effector cells. J Immunol. 118 (1), 355-361 (1977).
- Jedema, I., van der Werff, N. M., Barge, R. M., Willemze, R., Falkenburg, J. H. New CFSE-based assay to determine susceptibility to lysis by cytotoxic T cells of leukemic precursor cells within a heterogeneous target cell population. Blood. 103 (7), 2677-2682 (2004).
- Lecoeur, H., Fevrier, M., Garcia, S., Riviere, Y., Gougeon, M. L. A novel flow cytometric assay for quantitation and multiparametric characterization of cell-mediated cytotoxicity. J Immunol Methods. 253 (1-2), 177-187 (2001).
- Carotta, S. Targeting NK Cells for Anticancer Immunotherapy: Clinical and Preclinical Approaches. Front Immunol. 7, 152 (2016).
- Mandal, A., Viswanathan, C. Natural killer cells: In health and disease. Hematol Oncol Stem Cell Ther. 8 (2), 47-55 (2015).
- Rezvani, K., Rouce, R. H. The Application of Natural Killer Cell Immunotherapy for the Treatment of Cancer. Front Immunol. 6, 578 (2015).
- Angelo, L. S., et al. Practical NK cell phenotyping and variability in healthy adults. Immunol Res. 62 (3), 341-356 (2015).
- Zons, P., et al. Comparison of europium and chromium release assays: cytotoxicity in healthy individuals and patients with cervical carcinoma. Clin Diagn Lab Immunol. 4 (2), 202-207 (1997).
- Yovel, G., Shakhar, K., Ben-Eliyahu, S. The effects of sex, menstrual cycle, and oral contraceptives on the number and activity of natural killer cells. Gynecol Oncol. 81 (2), 254-262 (2001).
- Laue, T., et al. Altered NK cell function in obese healthy humans. BMC Obes. 2, 1 (2015).
- Hazeldine, J., Lord, J. M. The impact of ageing on natural killer cell function and potential consequences for health in older adults. Ageing Res Rev. 12 (4), 1069-1078 (2013).
Tags
Immunologie kwestie 126 natuurlijke moordenaar NK-cel cytotoxiciteit de lysis van de cel cel doden K562 chroom vrijlating stroom cytometry en NK-cel cytotoxiciteit CFSEErratum
Formal Correction: Erratum: A Flow Cytometry-Based Cytotoxicity Assay for the Assessment of Human NK Cell Activity
Posted by JoVE Editors on 09/10/2017.
Citeable Link.
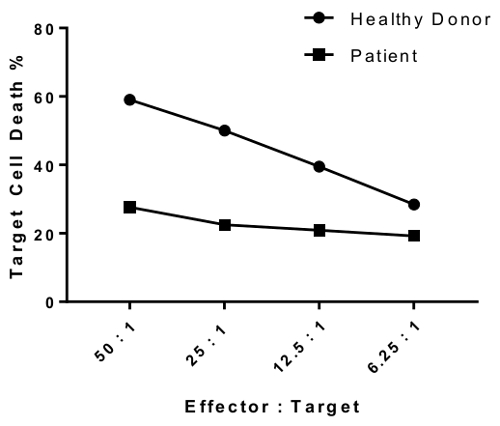
An erratum was issued for: A Flow Cytometry-Based Cytotoxicity Assay for the Assessment of Human NK Cell Activity. Figure 4 has been corrected to show background-corrected data.
Figure 4 was corrected from:
to: