ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Une méthode axée sur la cytométrie de flux pour déterminer quantitativement l’activité cytotoxique des humains les cellules tueuses naturelles est montrée ici.
Abstract
Au sein du système immunitaire inné, lymphocytes effecteurs natural killer (NK) cellules jouent un rôle essentiel dans la défense de l’hôte contre les cellules anormales, éliminant notamment tumoraux et virale des cellules infectées. Environ 30 anomalies monogéniques connus, ainsi qu’une foule d’autres pathologies, causent soit fonctionnelle ou classique carence cellulaire NK, se manifestant dans réduite ou absente une activité cytotoxique. Historiquement, la cytotoxicité a été étudiée avec les méthodes radioactives, qui sont encombrants, coûteux et potentiellement dangereux. Cet article décrit une méthode d’axée sur la cytométrie de flux rationalisé, cliniquement applicables afin de quantifier l’activité cytotoxique des cellules NK. Dans ce test, les cellules mononucléaires de sang périphérique (PBMC) ou des préparations de cellules NK purifiées sont conjointement incubées à différentes proportions avec une lignée de cellules tumorales de cible qui sont sensibles à la cytotoxicité des cellules NK (NKCC). Les cellules cibles sont préalablement étiquetées avec un colorant fluorescent pour permettre leur discrimination des cellules effectrices (cellules NK). Après la période d’incubation, les cellules cibles tués sont identifiés par une tache d’acide nucléique, qui imprègne spécifiquement les cellules mortes. Cette méthode se prête à la fois diagnostique et des applications de recherche et, grâce aux capacités multiparamétriques de la cytométrie en flux, a l’avantage supplémentaire de permettre éventuellement une analyse plus approfondie du phénotype des cellules NK et la fonction.
Introduction
Cellules tueuses naturelles de (NK) sont un sous-ensemble sophistiqué des lymphocytes humains d’innée critique impliqués dans l’élimination des cellules infectées virally, cellules transformées et autres menaces pathogènes 1,2. Granules lytiques de cellules NK maison cytotoxiques protéines, comme la perforine et granzymes. Lors de leur activation, les cellules NK forment une interaction complexe avec leurs cibles appelées synapse immunologique, auquel cas ces molécules cytotoxiques sont localement libérés, ce qui entraîne la lyse des cellules cibles directes et l’apoptose, ainsi que de la libération de cytokines et de chimiokines et finalement dans l’induction d’un inflammatoire état 1,3,4.
Activation des cellules NK implique une chaîne complexe de l’activation et inhibitrices interactions entre NK cellules récepteurs et ligands exprimés à la surface des cellules cibles, formant un système étroitement réglementé. Un des mécanismes plus étudiés de l’activation des cellules NK est le « soi manquant ». En effet, absence de détection de classe sur que j’ai major complexe d’histocompatibilité (CMH) ou human leucocyte antigen (HLA) molécules, infectés ou transformé la cytotoxicité des cellules NK cellules déclencheurs. Tumeur et les cellules infectées par le virus en général régulent ces antigènes pour échapper l’immunité cellulaire T, devenant ainsi le principal NK cellules cibles 1,3,4.
Évaluation de la fonction des cellules NK principalement dans la catégorie dégranulation ou la cytotoxicité des essais. Cependant, les essais de dégranulation, telles que la détection de cytométrie en flux du marqueur dégranulation associée à CD107a, ne sont qu’indicatifs d’activation des cellules NK et non de leur fonction ultime, la mort directe de cible les cellules 5,6,7,8. Par conséquent, cette limitation a attiré enquêteurs aux analyses de cytotoxicité comme une alternative plus éloquent et plus directe.
La longue date « gold standard » pour évaluer l’activité cytotoxique à médiation cellulaire des cellules T et NK est le test de libération chrome (ARC). L’arc implique radiologiquement marquage de cellules cibles avec 51Cr et incuber conjointement avec les cellules effectrices. Ce dosage est ancré dans le principe que la lyse cellulaire entraîne la libération de protéinique 51Cr dans le surnageant, qui peut être mesuré en comptant les gamma. Ce test, bien qu’efficace, est problématique pour plusieurs raisons : des coûts élevés de matière, manipulation et élimination des radioactifs 51Cr, libération spontanée de 51Cr et normalisation difficile - ce qui en fait tout à fait irréaliste 9,10.
Un certain nombre d’essais non radioactif, impliquant le marquage fluorescent, la libération de l’enzyme et même bioluminescence, ont depuis été développé comme solution de rechange à l’arc 11,12,13,14. Nous décrivons ici une méthode axée sur la cytométrie de flux pour la mesure des NK cellule cytotoxique sur les cellules K562 cible qui est simple, sensible et reproductible. Les cellules K562 sont une cellule humaine érythroleucémiques line avec une expression réduite des molécules HLA de classe I et expression accrue des ligands pour des récepteurs NK activatrices, ce qui les rend particulièrement sensibles à la cytotoxicité à médiation cellulaire NK 15. Dans cet essai, cellules K562 sont préalablement étiquetées avec carboxyfluorescéine diacétate succinimidyl ester (CFSE) et co cultivées à divers rapports avec deux cellules mononucléaires de sang périphérique (PBMC) ou purifiée de cellules NK 1. CFSE est un colorant fluorescent stable, protéine liant qui permet à la discrimination des cellules cibles de l’effecteur NK cellules 16,17. Après l’incubation Co, une tache d’acide nucléique, spécifiquement imprégnant la membrane des cellules mortes, est utilisée pour identifier les cellules de cible tuée (voir table des matières). Les échantillons sont ensuite acquis sur un cytomètre en flux pour déterminer le pourcentage de morts (c.-à-d., tache +) CFSE + cellules cibles.
Ce dosage peut servir d’un dépistage systématique pour monogéniques défauts affectant le compartiment de cellules NK, dont il existe environ 30 défauts connus provoquant le déficit de cellules NK soit fonctionnelle ou classique, et familiale hémophagocytique primaire ou secondaire. Il est également utile d’examiner l’activité des cellules NK chez les patients souffrant d’infections virales herpès récurrent, sévère, d’évaluer la reconstitution immunitaire après greffe de cellules hématopoïétiques ou post immunomodulatrices thérapie 18,19,20et pour une foule d’applications de la recherche fondamentale.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Avant de configurer le dosage, il est fortement recommandé que la teneur en cellules NK s’évaluer selon la population de l’effecteur de choix. La figure 1 montre une coloration typique de CD56 avant (bleu clair) et après (rouge) enrichissement de cellules NK. Les cellules NK représentent jusqu'à 15 % de PBMC et doivent être au moins 80 % de pur après enrichissement.
Cytométrie en ce test consiste à détection de deux paramètres : CFSE, détectable dans le même canal que FITC ; et une tache de cellules mortes, détectable dans le même canal que l’APC (Figure 2 aB). Après l’acquisition de données, la stratégie de blocage à la Figure 2 est utilisée pour analyser les données. Les cellules K562 cible de morts (c.-à-d., cellule morte tache +) sont bloquées sur la CFSE + population, fournissant le % de cellules tuées au sein de la population cible.
Conditions de contrôle sont indispensables pour assurer l’efficacité du test lui-même et ses composants séparés. Afin que le test soit considérée valide, ce qui suit devrait être prévu dans les conditions de contrôle (6-8) : cibler seulement (condition 6) devrait aboutir à la mort cellulaire des cellules < 15 % (Figure 3 a). Aucun signal CFSE devrait être détecté pour effecteur des cellules seulement (condition 7), et la mort cellulaire devrait être < 5 % (Figure 3 b). Pour meurtre Tween-négociée des cellules cibles (condition 8), mort cellulaire devrait être > 85 % (Figure 3).
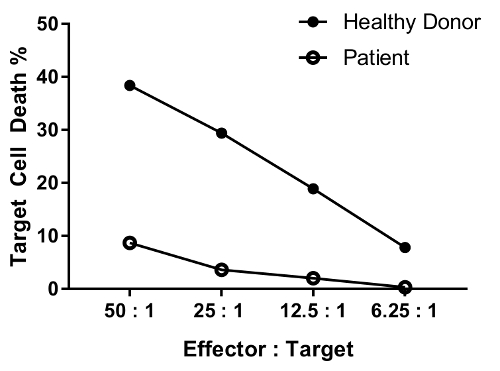
Un patient présentant une défectuosité de la fonction des cellules NK est censé avoir réduit l’activité de mise à mort dans la plupart ou tous les ratios testé par rapport à un individu sain. Le parallèle de donneur sain et cellules de patients dans la Figure 4 montre différentielle, importante réduction mort cellulaire cible avec une diminution de ratio de cellules effectrices-cible.

Figure 1 : évaluation du contenu de la cellule NK au sein de la population d’effecteur. Histogramme représentant après coloration total des PBMC (bleu clair) ou purifiée cellules NK (rouges) pour CD56. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : blocage de stratégie pour la détection des cellules cibles. A) la porte initiale est situe dans une parcelle de FITC-A/SSC-A. Les cellules K562 sont bloquées en tant qu’événements CFSE +. B) cellules K562 Dead (c.-à-d., positif à la cellule morte stain) sont bloquées dans l’intrigue de APC-A/SSC-A ultérieur au sein de la population de cellules de cible CFSE +. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : données représentatives pour les conditions de la commande. A) pourcentage de cellules mortes tache + K562 cellules au sein de la CFSE + porte (Gate stratégie comme dans la Figure 2) à la condition 6 (cellules cibles uniquement) - contrôle négatif pour la mort de cellules K562. B) CFSE et la cellule morte tachent de détection à la condition 7 (effecteur cellules seulement - PBMC total). C) pourcentage de cellules mortes tache + K562 cellules au sein de la CFSE + porte (Gate stratégie comme dans la Figure 2) à la condition 8 (cellules cibles + Tween) - contrôle positif pour la mort de cellules K562. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : données représentatives pour l’effet de dilution de ratio de cellules effectrices-cible divers. Les ratios de cellules effectrices : cible testés sont les suivants : 50 : 1, 25 : 1 ; 12.5 : 1 ; 6.25:1. données sont arrière-plan (condition #6)-supprimé. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Échantillon | Condition | Effecteur (E) : Cible (T) |
| PBMC | 1 - témoin positif de la cytotoxicité des cellules NK | 50:1 + IL-2 |
| 2 | 50 : 1 | |
| 3 | 25 : 1 | |
| 4 | 12.5 : 1 | |
| 5 | 6,25 : 1 | |
| 6 | T seulement | |
| 7 - contrôle négatif pour la mort de cellules K562 | E seulement | |
| 8 - positive control pour la mort de cellules K562 | T + Tween | |
| Cellules NK (purifiés) | 1 - témoin positif de la cytotoxicité des cellules NK | 5:1 + IL-2 |
| 2 | 5 : 1 | |
| 3 | 2.5 : 1 | |
| 4 | 1.25 : 1 | |
| 5 | 0,625 : 1 | |
| 6 | T seulement | |
| 7 - contrôle négatif pour la mort de cellules K562 | E seulement | |
| 8 - positive control pour la mort de cellules K562 | T + Tween |
Tableau 1
Subscription Required. Please recommend JoVE to your librarian.
Discussion
La méthode décrite ici offre une alternative simple et rentable pour le test de libération traditionnel 51Cr pour évaluer l’activité cytotoxique des cellules NK. Cette méthode est sensible, reproductible et moins de temps que les méthodes standards précédents, comme l’arc et peut être utilisée à la fois clinique et les applications de recherche.
Alors que le test fonctionne avec les PBMC total et enrichi les cellules NK, la possibilité d’utiliser des PBMC sans avoir besoin de purifier des populations de cellules présente un gros avantage lorsqu’ils traitent de petits volumes de sang ou de cellules rares ou de mauvaise qualité provenant d’échantillons de patients. Ce test utilise seulement CFSE et tache de viabilité exclusion des cellules mortes. En regardant ces deux paramètres seuls fournit des informations succinctes et suffisantes pour des fins de diagnostic, avec l’avantage supplémentaire de ne pas exiger davantage de compensation en cytométrie.
Cette méthode peut également être utilisée pour étudier la biologie fondamentale des cellules NK et tester de nouveaux traitements axés sur les cellules NK. À cet égard, les capacités en constante expansion des cytomètres introduisent un élément précieux de la polyvalence de cet essai, permettant une analyse multiparamétrique des cellules NK et leur activité ne pas précédemment possible avec des essais comme l’arc. Autre cellule de suivi et des colorants de viabilité, réagissant dans les autres canaux, sont disponibles pour répondre aux besoins des enquêteurs.
Ce protocole est optimisé pour une utilisation avec l’objectif de cellules NK prototypique lignée cellulaire K562. Toutefois, il peut être adapté aux lignées de cellules de cible alternative suspension avec des degrés de sensibilité à la cytotoxicité des cellules NK, comme HL-60, Daudi, U937 et Raji. À cet égard, il est important de noter que la concentration du colorant fluorescent et de sérum utilisé lors de l’étiquetage de la cellule cible peut-être avoir à être optimisé pour chaque ligne de cellule cible, comme différentes lignées cellulaires pourraient prendre jusqu'à l’étiquette fluorescent différemment et pour chaque cytomètre de flux. Alors qu’il est généralement recommandé d’éviter l’utilisation de sérum au cours de l’étiquetage, nous avons opté pour la trempe légère avec 0,5 % de FBS pour deux raisons. Tout d’abord, il aide à réduire le stress cellulaire cible et donc fond tache ; Deuxièmement, il apporte signal CFSE dans la plage appropriée de détection de nos cytomètre de flux sans nécessiter des ajustements de paramètres quotidienne, aidant ainsi à la reproductibilité du dosage. Variantes de protocole additionnel pourraient inclure test E:T différents ratios et temps d’incubation pour adapter le dosage à conditions d’activation différents. La durée de la co-culture d’effecteur et cellules cibles à tester la cytotoxicité NK a historiquement variait de 4 à 16 h, si des périodes plus longues ont tendance à entraîner une augmentation de la libération spontanée 9,16. Dans notre méthode, plus longue incubation pourrait également causer perte de fluorescent étiquetage par les cellules cibles en raison de la mise à mort ou de la prolifération, que ces colorants fluorescents sont dilués à la division cellulaire. Ainsi, dans la partie inférieure de la fenêtre de temps des incubations sont généralement préférées et ils ne devraient pas dépasser une nuit d’incubation 6,16,22.
Il est important de prendre note dont variables peuvent potentiellement affecter le résultat de ce test. Dans notre expérience, les cellules K562-cibles sont particulièrement sensibles aux changements de température. Donc, les cellules K562 ne devraient pas être réfrigérés mais plutôt conservés à température ambiante ou placés dans un incubateur à2 CO humidifié à 37 ° C avant leur utilisation. Pour la même raison, les tous les réactifs doivent être portés à la température appropriée comme indiqué dans le protocole. Un autre paramètre qui affectent ces cellules est la vitesse de centrifugation, ce qui devrait être ramenée à minimiser le stress cellulaire. En outre, limitant le temps de latence entre la préparation de l’effecteur/cible et le début de l’incubation Co à moins de 30 min est essentielle pour assurer une activité maximale de meurtre et de test de reproductibilité. De même, comme signal CFSE est généralement robuste, pipetage précis, un bon mélange de cellules et d’incubation précise temps étiquetage et trempe sont essentiels pour assurer la cohérence de la coloration. Enfin, la capacité cytotoxique de la cellule NK est très variable, même chez les individus sains et est influencée par un certain nombre de facteurs, notamment le stade de développement, sexe, âge et poids 23,24,25. En outre, jusqu'à 30 % des sujets sains affiche une réduction significative ou une perte complète de la capacité cytotoxique si testé plus de 24 heures après la prise de sang. Par conséquent, il est recommandé de PBMC utilisation fraîchement purifiée ou NK cellules lorsque cela est possible.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Les auteurs ne déclarent aucun conflit d’intérêt financier.
Acknowledgments
Nous tenons à remercier Jill Narciso, UCLA immunogénétique Center, pour son aide avec la préparation du manuscrit.
Materials
| Name | Company | Catalog Number | Comments |
| Phosphate-buffered Saline (1x, w/o Ca2+ and Mg2+) | Corning (Cellgro) | 21-040-CM | |
| Ficoll-Paque PLUS | GE Healthcare | 17-1440-02 | |
| Tween-20 | Sigma | BP337-100 | |
| RPMI 1640 Media | Corning (Cellgro) | 10-040-CV | |
| Heat-inactivated Fetal Bovine Serum | Omega Scientific | FB-02 | |
| Penicillin Streptomycin | Life Technologies | 15140-163 | Stock solution at 10,000 U/mL |
| IL-2 | R&D Systems | 202-IL-050 | Lyophilized from a 0.2 μm filtered solution in Acetonitrile and TFA with BSA as a carrier protein. Reconstitute with 500 ul at 100 μg/mL in sterile 100 mM Acetic Acid containing at least 0.1% bovine serum albumin (2.1x10E6 IU/ml) |
| K562 Cells | ATCC | CCL-243 | Cancer cell line |
| T-75 cell culture flasks | Corning | 431464 | |
| CFSE cell proliferation kit | Life Technologies (CellTrace) | C34554 | Reconstitute I vial with 18 ul DMSO to prepare a 5mM stock solution. Do not freeze/thaw. |
| Sytox Red | Life Technologies | S34859 | Stock solution is provided at 5 μM in 1 mL DMSO. The DMSO solution may be subjected to multiple freeze-thaw cycles without reagent degradation. |
| Sodium/lithium heparin blood collection tubes | BD | 02-687-95 | |
| U-bottom 96-well plate | Corning | CLS3897 | |
| Serological pipettes | BD Falcon | ||
| Polystyrene round-bottom tubes (5mL) | BD Falcon | 14959-5 | |
| 50 mL polypropylene conical tube | BD Falcon | 352070 | |
| 15 mL polypropylene conical tube | BD Falcon | 352097 | |
| Reagent reservoir | USA Scientific | 2321-2230 | |
| Human NK cell enrichment cocktail | StemCell Technologies (RosetteSep) | 15065 |
References
- Iannello, A., Debbeche, O., Samarani, S., Ahmad, A. Antiviral NK cell responses in HIV infection: I. NK cell receptor genes as determinants of HIV resistance and progression to AIDS. J Leukoc Biol. 84 (1), 1-26 (2008).
- Caligiuri, M. A. Human natural killer cells. Blood. 112 (3), 461-469 (2008).
- Topham, N. J., Hewitt, E. W. Natural killer cell cytotoxicity: how do they pull the trigger? Immunology. 128 (1), 7-15 (2009).
- Warren, H. S., Smyth, M. J. NK cells and apoptosis. Immunol Cell Biol. 77 (1), 64-75 (1999).
- Tognarelli, S., Jacobs, B., Staiger, N., Ullrich, E. Flow Cytometry-based Assay for the Monitoring of NK Cell Functions. J Vis Exp. (116), (2016).
- Somanchi, S. S., McCulley, K. J., Somanchi, A., Chan, L. L., Lee, D. A. A Novel Method for Assessment of Natural Killer Cell Cytotoxicity Using Image Cytometry. PLoS One. 10 (10), e0141074 (2015).
- Alter, G., Malenfant, J. M., Altfeld, M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods. 294 (1-2), 15-22 (2004).
- Atkinson, E. A., Gerrard, J. M., Hildes, G. E., Greenberg, A. H. Studies of the mechanism of natural killer (NK) degranulation and cytotoxicity. J Leukoc Biol. 47 (1), 39-48 (1990).
- Kim, G. G., Donnenberg, V. S., Donnenberg, A. D., Gooding, W., Whiteside, T. L. A novel multiparametric flow cytometry-based cytotoxicity assay simultaneously immunophenotypes effector cells: comparisons to a 4 h 51Cr-release assay. J Immunol Methods. 325 (1-2), 51-66 (2007).
- Kane, K. L., Ashton, F. A., Schmitz, J. L., Folds, J. D. Determination of natural killer cell function by flow cytometry. Clin Diagn Lab Immunol. 3 (3), 295-300 (1996).
- Jang, Y. Y., et al. An improved flow cytometry-based natural killer cytotoxicity assay involving calcein AM staining of effector cells. Ann Clin Lab Sci. 42 (1), 42-49 (2012).
- Korzeniewski, C., Callewaert, D. M. An enzyme-release assay for natural cytotoxicity. J Immunol Methods. 64 (3), 313-320 (1983).
- Karimi, M. A., et al. Measuring cytotoxicity by bioluminescence imaging outperforms the standard chromium-51 release assay. PLoS One. 9 (2), e89357 (2014).
- Oppenheim, D. E., et al. Glyco-engineered anti-EGFR mAb elicits ADCC by NK cells from colorectal cancer patients irrespective of chemotherapy. Br J Cancer. 110 (5), 1221-1227 (2014).
- West, W. H., Cannon, G. B., Kay, H. D., Bonnard, G. D., Herberman, R. B. Natural cytotoxic reactivity of human lymphocytes against a myeloid cell line: characterization of effector cells. J Immunol. 118 (1), 355-361 (1977).
- Jedema, I., van der Werff, N. M., Barge, R. M., Willemze, R., Falkenburg, J. H. New CFSE-based assay to determine susceptibility to lysis by cytotoxic T cells of leukemic precursor cells within a heterogeneous target cell population. Blood. 103 (7), 2677-2682 (2004).
- Lecoeur, H., Fevrier, M., Garcia, S., Riviere, Y., Gougeon, M. L. A novel flow cytometric assay for quantitation and multiparametric characterization of cell-mediated cytotoxicity. J Immunol Methods. 253 (1-2), 177-187 (2001).
- Carotta, S. Targeting NK Cells for Anticancer Immunotherapy: Clinical and Preclinical Approaches. Front Immunol. 7, 152 (2016).
- Mandal, A., Viswanathan, C. Natural killer cells: In health and disease. Hematol Oncol Stem Cell Ther. 8 (2), 47-55 (2015).
- Rezvani, K., Rouce, R. H. The Application of Natural Killer Cell Immunotherapy for the Treatment of Cancer. Front Immunol. 6, 578 (2015).
- Angelo, L. S., et al. Practical NK cell phenotyping and variability in healthy adults. Immunol Res. 62 (3), 341-356 (2015).
- Zons, P., et al. Comparison of europium and chromium release assays: cytotoxicity in healthy individuals and patients with cervical carcinoma. Clin Diagn Lab Immunol. 4 (2), 202-207 (1997).
- Yovel, G., Shakhar, K., Ben-Eliyahu, S. The effects of sex, menstrual cycle, and oral contraceptives on the number and activity of natural killer cells. Gynecol Oncol. 81 (2), 254-262 (2001).
- Laue, T., et al. Altered NK cell function in obese healthy humans. BMC Obes. 2, 1 (2015).
- Hazeldine, J., Lord, J. M. The impact of ageing on natural killer cell function and potential consequences for health in older adults. Ageing Res Rev. 12 (4), 1069-1078 (2013).
Tags
Numéro 126 tueuses naturelles les cellules NK cytotoxicité immunologie lyse cellulaire cellule tuant la cytotoxicité des cellules NK CFSE version chrome cytométrie en flux K562Erratum
Formal Correction: Erratum: A Flow Cytometry-Based Cytotoxicity Assay for the Assessment of Human NK Cell Activity
Posted by JoVE Editors on 09/10/2017.
Citeable Link.
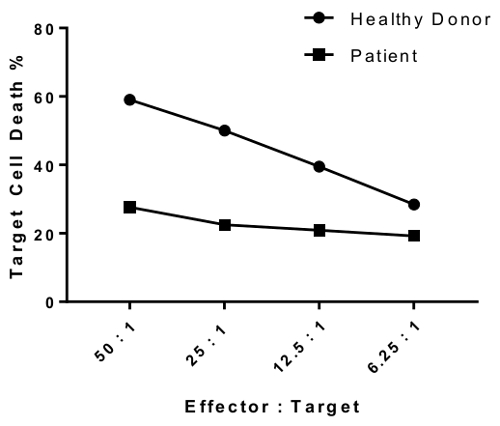
An erratum was issued for: A Flow Cytometry-Based Cytotoxicity Assay for the Assessment of Human NK Cell Activity. Figure 4 has been corrected to show background-corrected data.
Figure 4 was corrected from:
to: