ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Här visas en flöde flödescytometri-baserad metod för att kvantitativt bestämma cytotoxiska aktiviteten av människors naturliga mördarceller.
Abstract
Inom det medfödda immunsystemet spelar ljudeffektläget lymfocyter kallas naturliga killer (NK) celler en viktig roll i värd försvar mot avvikande celler, speciellt eliminera tumoral och viralt infekterade celler. Cirka 30 kända monogena defekter, tillsammans med en mängd andra sjukdomstillstånd, orsaka antingen funktionella eller klassiska NK cell brist, manifesterar sig i minskad eller frånvarande cytotoxisk aktivitet. Historiskt sett har cytotoxicitet undersökts med radioaktiva metoder, som är besvärliga, dyra och potentiellt farliga. Denna artikel beskriver en strömlinjeformad, kliniskt gällande flöde flödescytometri-baserad metod för att kvantifiera NK cell cytotoxisk aktivitet. I denna analys är perifera mononukleära blodceller (PBMC) eller renat NK cell preparat samtidig ruvade på olika nyckeltal med en tumör cell mållinjen kända för att vara känsliga för NK cellmedierad cytotoxicitet (NKCC). Målceller är pre märkta med ett fluorescerande färgämne till tillåta deras diskriminering från effektor celler (NK-celler). Efter inkubationstiden identifieras dödade målceller av en nukleinsyra fläck, som specifikt genomsyrar döda celler. Denna metod är mottagliga för både diagnostik och forskningsansökningar och tack vare multi-parameter funktionerna i flödescytometri, har fördelen av potentiellt möjliggör en djupare analys av NK cell fenotyp och funktion.
Introduction
Natural killer (NK) celler är en sofistikerad delmängd av människans medfödda lymfocyter kritiskt inblandade i elimineringen av viralt infekterade celler, celler och andra patogena hot 1,2. NK cell lytisk granulat hus cytotoxiska proteiner, såsom perforin och granzymes. Vid aktivering, NK-celler bildar ett komplext samspel med sina mål som kallas immunologisk synaps, whereby dessa cytolytisk molekyler frigörs lokalt, vilket resulterar i direkta målet cell lysis och apoptos, tillsammans med cytokin och chemokine frige och slutligen i induktion av en inflammatorisk statligt 1,3,4.
NK cellaktivering innebär en komplex sträng av aktivera och hämmande interaktioner mellan NK cell receptorer och ligander som uttrycks på ytan av målceller, bildar ett hårt reglerat system. En av de mest studerade mekanismerna av NK cellaktivering är ”saknas jaget”. Faktiskt, brist på detektion av klass jag major histocompatibility complex (MHC) eller humant leukocyt antigen (HLA) molekyler, på infekterade eller omvandlas celler utlösare NK cell cytotoxicitet. Tumör och virusinfekterade celler generellt downregulate dessa antigener fly T cell-medierad immunitet, blir därmed primära NK cell mål 1,3,4.
Bedömning av NK cellens funktion är primärt kategoriseras in i degranulering eller cytotoxicitet analyser. Degranulering analyser, såsom flöde flödescytometrisk detektion av degranulering-associerade markören CD107a, är emellertid endast vägledande NK cellaktivering och inte deras slutliga funktion, direkta dödandet av mål celler 5,6,7,8. Därför har denna begränsning dras utredarna till cytotoxicitet analyser som en mer träffande och mer direkt alternativ.
Den långvariga ”gold standarden” för att bedöma cellmedierad cytotoxisk aktivitet av både T- och NK-celler är det krom release assay (CRA). CRA innebär radioactively märkning av målceller med 51Cr och samtidig inkubering med effektor celler. Denna analys är genomsyrad av principen att cellys resulterar i utgåvan proteinbundet 51Cr i supernatanten, som kan mätas genom gamma räkning. Denna analys, medan effektiva, är problematisk för en mängd skäl: höga materialkostnader, hantering och destruktion av radioaktivt 51Cr, spontana utgåvan 51Cr och svårt standardisering - gör det alldeles opraktiskt 9,10.
Ett antal icke-radioaktiva analyser, som inbegriper fluorescerande märkning enzym release och även Mareld, har sedan dess utvecklats som alternativ till CRA 11,12,13,14. Här beskriver vi ett flöde flödescytometri-baserad metod för mätning av NK celler cytotoxisk aktivitet på K562 målceller som är enkla, känsliga och reproducerbara. K562 celler är en mänsklig erythroleukemic cell linje med minskat uttryck av HLA klass I och ökad expression av ligander för activatory NK-receptorer, vilket gör dem särskilt känsliga för NK cellmedierad cytotoxicitet 15. I denna analys, K562 celler är pre märkta med carboxyfluorescein diacetat succinimidyl ester (CFSE) och samtidig odlade på olika nyckeltal med antingen perifera mononukleära blodceller (PBMC) eller renat NK celler 1. CFSE är en stabil, proteinbindning fluorescerande färgämne som tillåter diskriminering av målceller från effektor NK celler 16,17. Efter samtidig inkubering, används en nukleinsyra fläck, specifikt genomsyrar membranet av döda celler, för att identifiera dödade målcellerna (se tabell material). Proverna är sedan förvärvade på en flödescytometer att bestämma andelen döda (dvs fläcken +) CFSE + målceller.
Denna analys kan användas som en rutinmässig diagnostisk screening för monogena defekter som påverkar NK cell facket, av vilka det finns cirka 30 kända defekter som orsakar antingen funktionella eller klassiska NK cell brist, och för primära eller sekundära hemofagocyterande Lymfohistiocytos. Det är också användbart att undersöka NK cellsaktivitet hos patienter med recidiverande, svår herpes virusinfektioner, att utvärdera immun beredning efter hematopoetisk stamcellstransplantation eller post immunmodulerande terapi 18,19,20, och för en mängd grundforskning applikationer.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Innan du konfigurerar analysen, rekommenderas det starkt att NK cellinnehållet bedömas i effektor befolkningen av val. Figur 1 visar en typisk CD56 färgning innan (ljusblå) och efter (röd) NK cell anrikning. NK-celler utgör upp till 15% av PBMC och bör vara minst 80% ren efter anrikning.
Flöde flödescytometrisk analys i denna analys innebär identifiering av två parametrar: CFSE, detekterbart i samma kanal som FITC; och en död cell fläck, detekterbart i samma kanal som APC (figur 2AB). Efter datainsamling används Usenets strategin i figur 2 för att analysera data. Döda (dvs döda cellen fläcken +) K562 målceller är gated ur CFSE + befolkningen, som tillhandahåller % av dödade celler inom målgruppen.
Villkor kontroll är avgörande för att säkerställa att analysen själv och dess separata komponenter. För analysens anses vara giltig, bör följande förväntas hos de kontroll (6-8): rikta celler bara (villkor 6) bör leda till celldöd < 15% (figur 3A). Ingen CFSE signal ska identifieras för effektor celler endast (villkor 7), och celldöd bör vara < 5% (figur 3B). För interpoleringen-medierad dödandet av målceller (skick 8), celldöd bör vara > 85% (figur 3 c).
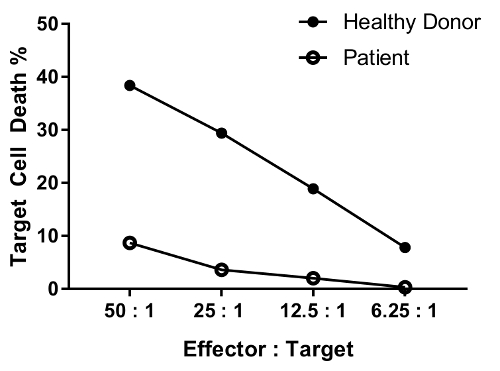
En patient med defekt i NK cellens funktion förväntas ha minskad dödande aktivitet på de flesta eller alla nyckeltal testas jämfört med en frisk individ. Parallellen för friska givare och patientens celler i figur 4 visar differential, betydande minskning i målet celldöd med minskande effektor-målet cellen baserat.

Figur 1: bedömning av NK cellinnehåll inom befolkningens effektor. Representativa histogram efter färgning Summa PBMC (ljusblå) eller renat NK-celler (röd) för CD56. Klicka här för att se en större version av denna siffra.

Figur 2: Gating strategi för detektion av målceller. A) första porten ligger i en FITC-A/SSC-A tomt. K562 celler är gated som CFSE + händelser. B) döda K562 celler (dvs positiv för döda cellen fläcken) är gated i efterföljande APC-A/SSC-A tomten inom CFSE + cell målpopulationen. Klicka här för att se en större version av denna siffra.

Figur 3: representativa uppgifter för kontroll villkor. (A) andelen döda cellen fläcken + K562 celler inom CFSE + grinden (gating strategi som i figur 2) i villkor 6 (endast målceller) - negativ kontroll för K562 celldöd. B) CFSE och döda cellen fläcken upptäckt i villkor 7 (effektor celler endast - totala PBMC). C) andelen döda cellen fläcken + K562 celler inom CFSE + grinden (gating strategi som i figur 2) i villkor 8 (målceller + interpolering) - positiv kontroll för K562 celldöd. Klicka här för att se en större version av denna siffra.

Figur 4: representativa uppgifter för utspädningseffekten av olika effektor-målet cellen baserat. Effector: målet cellen nyckeltalen testade är följande: 50: 1, 25: 1; 12.5:1; 6.25:1. Data är bakgrunden (villkor #6)-bort. Klicka här för att se en större version av denna siffra.
| Prov | Villkor | Effektor (E): Mål (T) |
| PBMC | 1 - positiv kontroll för NK cell cytotoxicitet | 50:1 + IL-2 |
| 2 | 50: 1 | |
| 3 | 25: 1 | |
| 4 | 12.5: 1 | |
| 5 | 6.25: 1 | |
| 6 | T bara | |
| 7 - negativ kontroll för K562 död | E endast | |
| 8 - positiv kontroll för K562 död | T + interpolering | |
| NK-celler (renas) | 1 - positiv kontroll för NK cell cytotoxicitet | 5:1 + IL-2 |
| 2 | 5: 1 | |
| 3 | 2.5: 1 | |
| 4 | 1,25: 1 | |
| 5 | 0,625: 1 | |
| 6 | T bara | |
| 7 - negativ kontroll för K562 död | E endast | |
| 8 - positiv kontroll för K562 död | T + interpolering |
Tabell 1
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Den metod som beskrivs här ger ett enkelt och kostnadseffektivt alternativ till den traditionella 51Cr release assay att bedöma NK cell cytotoxisk aktivitet. Denna metod är känsliga, reproducerbar och mindre tidskrävande än tidigare standardmetoder, som CRA, och kan användas för både kliniska och forskningsansökningar.
Medan analysen fungerar med både totala PBMC och berikade NK-celler, är alternativet att använda PBMC utan behovet för att rena cellpopulationer en stor fördel när man behandlar små volymer av insamlade blod eller några eller dålig kvalitet celler från patienternas prover. Denna analys använder bara CFSE och döda cellen utslagning livskraft fläcken. Tittar på dessa två parametrar som ensam ger kortfattade och tillräcklig information för diagnostiska ändamål, med fördelen att inte kräva ytterligare ersättning i flödet flödescytometrisk analys.
Denna metod kan också användas för att studera grundläggande NK cellbiologi och testa nya NK cell-riktade terapier. I detta avseende, införa ständigt växande kapacitet flöde cytometers en ovärderlig del av mångsidighet för att denna analys, vilket möjliggör multiparameteranalyser av NK celler och deras aktivitet inte tidigare varit möjligt med analyser som CRA. Alternativa cell tracking och livskraft färgämnen, fluorescerande i andra kanaler, finns att möta utredarnas behov.
Detta protokoll är optimerad för användning med prototypiska NK cell målet K562 cellinje. Men kan det anpassas till alternativa suspension mål cellinjer med varierande grad av känslighet för NK cell cytotoxicitet, såsom HL-60, Daudi, U937 och Raji. I detta sammanhang är det viktigt att notera att koncentrationen av fluorescerande färgämne och serum används under målet cellen märkning kan behöva optimeras för varje mål cell fodrar, som olika cellinjer kan ta upp den fluorescerande etiketten annorlunda, och för varje flödescytometer. Även om det är normalt rekommenderas att undvika att använda serum under märkning, valde vi liten snabbkylning med 0,5% av FBS av två skäl. Först, det hjälper att minska mål cell stress och därmed bakgrunden fläcken; andra, det ger CFSE signal inom intervallet lämpliga för påvisande av våra flödescytometer utan att kräva daglig inställningar justeringar, thus medhjälp i reproducerbarheten för analysen. Tilläggsprotokollet variationer kan innehålla tester olika E:T nyckeltal och inkubationstider att anpassa analysens olika aktivering villkor. Varaktigheten av effektor och målceller att testa NK cytotoxicitet samtidig kultur har historiskt varierat från 4-16 h, men längre perioder tenderar att resultera i ökad spontan pressmeddelande 9,16. I vår metod, kan längre inkubation också leda till förlust av fluorescerande märkning av målceller på grund av döda eller spridning, eftersom dessa fluorescerande färgämnen späds vid celldelning. Således, inkubationer i den nedre delen av tidsfönstret är generellt att föredra och de bör inte överstiga natten inkubation 6,16,22.
Det är viktigt att notera vilka variabler kan potentiellt påverka resultatet av denna analys. Vår erfarenhet är K562 målceller särskilt känsliga för temperaturförändringar. Därför bör K562 cellerna inte kyld men ganska vid rumstemperatur eller placeras i en fuktad CO2 inkubator vid 37 ° C före användning. Av samma anledning, bör alla reagens bringas till temperaturerna som anges i protokollet. En annan parameter som påverkar dessa celler är den centrifugering hastighet, som bör minskas för att minimera cellulär stress. Dessutom är begränsar fördröjning mellan effektor/target förberedelser och början av samtidig inkubering till mindre än 30 min avgörande för att säkerställa maximal dödande aktivitet och assay reproducerbarhet. Jämväl, som CFSE signal är allmänt robust, korrekt pipettering, korrekt blandning av celler och precisa inkubation tid när märkning och snabbkylning är avgörande för att säkerställa enhetlighet i färgningen. Slutligen, NK cell cytotoxiska förmåga är mycket variabel även hos friska individer och påverkas av ett antal faktorer, inklusive utvecklingsstadier, kön, ålder och vikt 23,24,25. Dessutom upp till 30% av friska kontroller Visa en betydande minskning eller total förlust av cytotoxiska förmåga om testas mer än 24 timmar efter blod rita. Därför, det rekommenderas att använda färska renat PBMC eller NK celler när det är möjligt.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Författarna förklarar inga konflikter av ekonomiskt intresse.
Acknowledgments
Vi vill tacka Jill Narciso, UCLA immunogenetik Center, för hennes hjälp med manuskriptet förberedelse.
Materials
| Name | Company | Catalog Number | Comments |
| Phosphate-buffered Saline (1x, w/o Ca2+ and Mg2+) | Corning (Cellgro) | 21-040-CM | |
| Ficoll-Paque PLUS | GE Healthcare | 17-1440-02 | |
| Tween-20 | Sigma | BP337-100 | |
| RPMI 1640 Media | Corning (Cellgro) | 10-040-CV | |
| Heat-inactivated Fetal Bovine Serum | Omega Scientific | FB-02 | |
| Penicillin Streptomycin | Life Technologies | 15140-163 | Stock solution at 10,000 U/mL |
| IL-2 | R&D Systems | 202-IL-050 | Lyophilized from a 0.2 μm filtered solution in Acetonitrile and TFA with BSA as a carrier protein. Reconstitute with 500 ul at 100 μg/mL in sterile 100 mM Acetic Acid containing at least 0.1% bovine serum albumin (2.1x10E6 IU/ml) |
| K562 Cells | ATCC | CCL-243 | Cancer cell line |
| T-75 cell culture flasks | Corning | 431464 | |
| CFSE cell proliferation kit | Life Technologies (CellTrace) | C34554 | Reconstitute I vial with 18 ul DMSO to prepare a 5mM stock solution. Do not freeze/thaw. |
| Sytox Red | Life Technologies | S34859 | Stock solution is provided at 5 μM in 1 mL DMSO. The DMSO solution may be subjected to multiple freeze-thaw cycles without reagent degradation. |
| Sodium/lithium heparin blood collection tubes | BD | 02-687-95 | |
| U-bottom 96-well plate | Corning | CLS3897 | |
| Serological pipettes | BD Falcon | ||
| Polystyrene round-bottom tubes (5mL) | BD Falcon | 14959-5 | |
| 50 mL polypropylene conical tube | BD Falcon | 352070 | |
| 15 mL polypropylene conical tube | BD Falcon | 352097 | |
| Reagent reservoir | USA Scientific | 2321-2230 | |
| Human NK cell enrichment cocktail | StemCell Technologies (RosetteSep) | 15065 |
References
- Iannello, A., Debbeche, O., Samarani, S., Ahmad, A. Antiviral NK cell responses in HIV infection: I. NK cell receptor genes as determinants of HIV resistance and progression to AIDS. J Leukoc Biol. 84 (1), 1-26 (2008).
- Caligiuri, M. A. Human natural killer cells. Blood. 112 (3), 461-469 (2008).
- Topham, N. J., Hewitt, E. W. Natural killer cell cytotoxicity: how do they pull the trigger? Immunology. 128 (1), 7-15 (2009).
- Warren, H. S., Smyth, M. J. NK cells and apoptosis. Immunol Cell Biol. 77 (1), 64-75 (1999).
- Tognarelli, S., Jacobs, B., Staiger, N., Ullrich, E. Flow Cytometry-based Assay for the Monitoring of NK Cell Functions. J Vis Exp. (116), (2016).
- Somanchi, S. S., McCulley, K. J., Somanchi, A., Chan, L. L., Lee, D. A. A Novel Method for Assessment of Natural Killer Cell Cytotoxicity Using Image Cytometry. PLoS One. 10 (10), e0141074 (2015).
- Alter, G., Malenfant, J. M., Altfeld, M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods. 294 (1-2), 15-22 (2004).
- Atkinson, E. A., Gerrard, J. M., Hildes, G. E., Greenberg, A. H. Studies of the mechanism of natural killer (NK) degranulation and cytotoxicity. J Leukoc Biol. 47 (1), 39-48 (1990).
- Kim, G. G., Donnenberg, V. S., Donnenberg, A. D., Gooding, W., Whiteside, T. L. A novel multiparametric flow cytometry-based cytotoxicity assay simultaneously immunophenotypes effector cells: comparisons to a 4 h 51Cr-release assay. J Immunol Methods. 325 (1-2), 51-66 (2007).
- Kane, K. L., Ashton, F. A., Schmitz, J. L., Folds, J. D. Determination of natural killer cell function by flow cytometry. Clin Diagn Lab Immunol. 3 (3), 295-300 (1996).
- Jang, Y. Y., et al. An improved flow cytometry-based natural killer cytotoxicity assay involving calcein AM staining of effector cells. Ann Clin Lab Sci. 42 (1), 42-49 (2012).
- Korzeniewski, C., Callewaert, D. M. An enzyme-release assay for natural cytotoxicity. J Immunol Methods. 64 (3), 313-320 (1983).
- Karimi, M. A., et al. Measuring cytotoxicity by bioluminescence imaging outperforms the standard chromium-51 release assay. PLoS One. 9 (2), e89357 (2014).
- Oppenheim, D. E., et al. Glyco-engineered anti-EGFR mAb elicits ADCC by NK cells from colorectal cancer patients irrespective of chemotherapy. Br J Cancer. 110 (5), 1221-1227 (2014).
- West, W. H., Cannon, G. B., Kay, H. D., Bonnard, G. D., Herberman, R. B. Natural cytotoxic reactivity of human lymphocytes against a myeloid cell line: characterization of effector cells. J Immunol. 118 (1), 355-361 (1977).
- Jedema, I., van der Werff, N. M., Barge, R. M., Willemze, R., Falkenburg, J. H. New CFSE-based assay to determine susceptibility to lysis by cytotoxic T cells of leukemic precursor cells within a heterogeneous target cell population. Blood. 103 (7), 2677-2682 (2004).
- Lecoeur, H., Fevrier, M., Garcia, S., Riviere, Y., Gougeon, M. L. A novel flow cytometric assay for quantitation and multiparametric characterization of cell-mediated cytotoxicity. J Immunol Methods. 253 (1-2), 177-187 (2001).
- Carotta, S. Targeting NK Cells for Anticancer Immunotherapy: Clinical and Preclinical Approaches. Front Immunol. 7, 152 (2016).
- Mandal, A., Viswanathan, C. Natural killer cells: In health and disease. Hematol Oncol Stem Cell Ther. 8 (2), 47-55 (2015).
- Rezvani, K., Rouce, R. H. The Application of Natural Killer Cell Immunotherapy for the Treatment of Cancer. Front Immunol. 6, 578 (2015).
- Angelo, L. S., et al. Practical NK cell phenotyping and variability in healthy adults. Immunol Res. 62 (3), 341-356 (2015).
- Zons, P., et al. Comparison of europium and chromium release assays: cytotoxicity in healthy individuals and patients with cervical carcinoma. Clin Diagn Lab Immunol. 4 (2), 202-207 (1997).
- Yovel, G., Shakhar, K., Ben-Eliyahu, S. The effects of sex, menstrual cycle, and oral contraceptives on the number and activity of natural killer cells. Gynecol Oncol. 81 (2), 254-262 (2001).
- Laue, T., et al. Altered NK cell function in obese healthy humans. BMC Obes. 2, 1 (2015).
- Hazeldine, J., Lord, J. M. The impact of ageing on natural killer cell function and potential consequences for health in older adults. Ageing Res Rev. 12 (4), 1069-1078 (2013).
Tags
Immunologi fråga 126 naturliga mördarceller NK cell cytotoxicitet cellys cell döda K562 flödescytometri krom release NK cell cytotoxicitet CFSEErratum
Formal Correction: Erratum: A Flow Cytometry-Based Cytotoxicity Assay for the Assessment of Human NK Cell Activity
Posted by JoVE Editors on 09/10/2017.
Citeable Link.
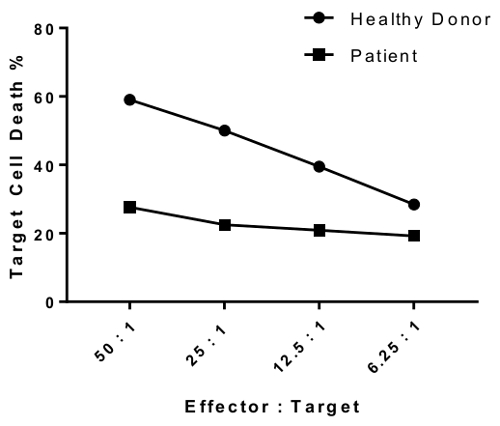
An erratum was issued for: A Flow Cytometry-Based Cytotoxicity Assay for the Assessment of Human NK Cell Activity. Figure 4 has been corrected to show background-corrected data.
Figure 4 was corrected from:
to: