Summary
Wir präsentieren eine Methodik zur Quantifizierung des Stärkegehalts in den Eierstock Primordia in Süßkirsche (Prunus Avium L.) während der Winterruhe, mithilfe einer Bild-Analyse-System mit histochemische Techniken kombiniert.
Abstract
Veränderungen in Stärke in kleinen Strukturen sind verbunden mit wichtigen Ereignissen während mehreren Pflanze Entwicklungsprozesse, einschließlich der reproduktiven Phase von der Bestäubung zur Befruchtung und das Einsetzen der Fruchtkörper. Jedoch sind Abweichungen in der Stärke während der Blüte Differenzierung nicht vollständig, vor allem auf die Schwierigkeiten bei der Quantifizierung des Stärkegehalts in den besonders kleinen Strukturen der Blume Primordia bekannt. Hier beschreiben wir eine Methode zur Quantifizierung der Stärke in den Eierstock Primordia der Süßkirsche (Prunus Avium L.) mithilfe einer Bildanalysesystem angeschlossen an das Mikroskop, wodurch im Zusammenhang mit den Veränderungen im Stärkegehalt mit den verschiedenen Phasen der Vegetationsruhe vom Herbst bis zum Frühling. Zu diesem Zweck wird die Dormanz Blütenknospen Statusermittlung durch die Auswertung der Knospe Wachstum der Triebe, die zu verschiedenen Zeitpunkten in der Winterzeit in kontrollierten Bedingungen übertragen. Für die Quantifizierung der Stärke in den Eierstock Primordia Blütenknospen sind sequentiell gesammelt, fixiert, eingebettet in Paraffinwachs, geschnitten und gefärbt mit I2Kl (Kaliumjodid-Jod). Die Vorbereitungen sind unter dem Mikroskop beobachtet und analysiert, indem ein Bild-Analysator, der Stärke deutlich vom Hintergrund unterscheidet. Inhaltswerte Stärke erhält man durch Messung der optischen Dichte des Bildes, die die gefärbten Stärke entspricht, unter Berücksichtigung der sich aus der optischen Dichte der einzelnen Pixel als eine Schätzung des Stärkegehalts des Rahmens studierte.
Introduction
Gemäßigte waldige Stauden passen sich den Jahreszeiten durch die Modulation, ihr Wachstum und ihre Entwicklung. Während sie im Frühling und Sommer zu entwickeln, aufhören sie zu wachsen im Herbst, im Winter1schlafend gehen. Obwohl Dormanz bei niedrigen Temperaturen im Winter überleben kann, ist chillen Voraussetzung für eine ordnungsgemäße Knospenaustrieb im Frühjahr2. Die wichtigen Implikationen der Vegetationsruhe in gemäßigten Obstproduktion und Forstwirtschaft führten zu vielfältigen Bemühungen zu bestimmen und Vorhersage der Dormanz Periode3. In Obst-Baum-Spezies, empirischer Experimente Übertragung Triebe zu zwingen, Bedingungen und statistische Vorhersagen basierend auf Daten der Blüte sind aktuelle Ansätze feststellen, das Datum für das Brechen der Keimruhe, wodurch Forscher schätzen die Chillen Anforderungen für jede Sorte. So erkennen Sie die Dormanz Status basierend auf biologische Prozesse bleibt jedoch unklar3.
Blüte im gemäßigten Obstbäume wie Süßkirsche (Prunus Avium L.), tritt einmal im Jahr und dauert etwa zwei Wochen. Allerdings beginnen Blumen zu differenzieren und rund 10 Monate früher, während der vergangenen Sommer4zu entwickeln. Blume Primordia aufhören zu wachsen im Herbst ruhend innerhalb der Knospen im Winter zu bleiben. In dieser Zeit muss jeder Sorte eine besondere kühle Voraussetzung für richtige Blüte4ansammeln. Trotz des Fehlens der phänologischen Veränderungen in den Knospen im Winter Blume Primordia sind physiologisch aktiv während der Vegetationsruhe und die Anhäufung von kühlen Temperaturen wurde vor kurzem assoziiert mit der Dynamik der Stärke Anhäufung oder verringern innerhalb der Zellen von der Eierstock Primordium bietet einen neuen Ansatz für Dormanz Bestimmung5. Die geringe Größe und die Position des Eierstocks Primordium erfordern jedoch eine spezielle Methodik.
Stärke ist das große Speicher-Kohlenhydrat im Gehölz Arten6. So haben Veränderungen in Stärke auf die physiologische Aktivität der Blume Gewebe, die brauchen Kohlenhydrate zur Unterstützung ihrer Entwicklung7,8in Verbindung gebracht. Andere wichtige Ereignisse während der reproduktiven Prozesses beziehen sich auch auf Variationen in Stärkegehalt in verschiedenen floralen Strukturen, z. B. Anthere Meiose9, das Wachstum der Pollenschläuche durch den Stil oder Ovulum Befruchtung10. Histochemische Techniken ermöglichen die Erkennung von Stärke in jedem bestimmten Gewebe Blume Primordia während der Vegetationsruhe. Allerdings bleibt die Schwierigkeit bei der Quantifizierung dieser Stärke, im Anschluss an ihre Muster der Akkumulation/Abnahme über die Zeit oder die Stärke zu vergleichen zwischen Gewebe, Sorten oder Jahre Inhalte zulassen. Dies ist aufgrund der kleinen Menge an Gewebe für die analytische Techniken11zur Verfügung. Als Alternative ermöglicht Bildanalyse, Mikroskopie12 verbunden die Quantifizierung der Stärke in sehr kleine Proben von pflanzlichen Gewebe13.
Ansätze, die Kombination von Mikroskopie und Bildanalyse wurden zur quantifizieren des Inhalts der verschiedenen Komponenten in pflanzlichen Geweben, wie Kallose14, Mikroröhrchen15, oder16, durch Messung der Größe des Bereichs gefärbt durch spezifische Stärke Flecken. Für Stärke, kann leicht erkannt werden mit Kaliumiodid-Jod (ich2KI) Reaktion17. Diese Methode ist sehr spezifisch; Ich2KI Plasmamembrane innerhalb der laminaren Struktur der Stärke Körner und bildet eine dunkle blaue oder rötlich-braune Farbe, abhängig von der Amylosegehalt Stärke18. Abschnitte mit ich befleckt2KI Fleck zeigen ausreichenden Kontrast zwischen Stärke und dem Hintergrund Gewebe, so dass eine eindeutige Stärke-Erkennung und der anschließenden Quantifizierung durch die Bild-Analyse-System19. Obwohl dieser Farbstoff nicht stöchiometrischen ist, ist die Anhäufung von Jod proportional zur Länge des Stärke-Moleküls, die17stark variieren kann. So kann die Größe des verschmutzten Bereich ausgedrückt als die Anzahl der Pixel nicht genau den Inhalt der Stärke, da hohe Unterschiede im Stärkegehalt zwischen Feldern mit gefärbten Bereiche ähnlicher Größe gefunden werden konnte. Als Alternative kann der Stärkegehalt ausgewertet werden durch die Messung der optischen Dichte der gefärbten Körnchen auf schwarz / weiß Bilder von dem Mikroskop ausgewiesen in verschiedenen Geweben in Apricot8,13 , 19, Avocado10,20und Olive21.
Hier beschreiben wir eine Methodik, die die experimentelle Bestimmung der Dormanz Status mit der Quantifizierung der Stärkegehalt in Primordium Eierstockgewebe vom Herbst kombiniert bis zum Frühling in süßen Kirschen, bietet ein neues Tool für das Verständnis und die Vorhersage der Vegetationsruhe basierend auf der Studie der biologischen Mechanismen im Zusammenhang mit Keimruhe.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
(1) Dormanz Entschlossenheit und Pflanze Materialkollektion
- Probieren Sie die Blütenknospen im Feld. Dormanz Studien sind Langzeitexperimente und benötigen Erwachsene groß genug Bäume Knospen zu sammeln und schießt den ganzen Winter ohne die Bäume Entwicklung im nächsten Frühjahr. Spezielle Obstgarten Management könnte je nach dem Trainingssystem erforderlich; so kann Beschneidung weniger schwerwiegend als für Produktionszwecke Obst sein.
- Jede Woche von Anfang Herbst bis zum Beginn des austreiben, sammeln Sie und wiegen Sie 10 Blütenknospen.
- Beheben Sie die Blütenknospen zu, indem man sie in ein 10 mL Glasrohr mit einer Kappe und genießen Sie die Proben in einer Fixativ Lösung von Ethanol/Essigsäure Säure (3:1) für mindestens 24 Stunden bei 4 ° c Dann verwerfen Sie das Fixiermittel und fügen Sie 75 % Ethanol, großzügig um sicherzustellen, dass die Proben deckt. Die Proben können bis zur Verwendung in dieser Lösung bei 4 ° C aufbewahrt werden.
Hinweis: Vakuum eindringen lässt sich die Luftblasen im Inneren Keim entfernen und verhindern, dass sie schweben. Dies erleichtert das Eindringen von das Fixiermittel in den Geweben, aber beschädigen die Struktur des Gewebes. Versuchen Sie es ggf. nicht zu vermeiden.
- Probieren Sie die Triebe im Feld.
- Nehmen Sie jede Woche von Anfang Herbst bis zum Beginn des austreiben, drei Triebe von 15-30 cm lang und 5 mm im Durchmesser, mit mindestens 10 Blütenknospen. Legen Sie sie auf Wasser getränkten Florist Schaum in einer Kammer Wachstum bei 22 ± 1 ° C mit einer 12 h Licht Photoperiode.
- Wählen Sie nach 10 Tagen in der Wachstums-Kammer und wiegen Sie 10 Blütenknospen aus der Triebe.
- Bewerten der Knospe-Wachstum und den Dormanz-Status zu bestimmen. Die Abfrageperiode muss an die Gegebenheiten des Standortes angepasst werden. In den Obstgarten-Bedingungen (Zaragoza, Spanien, 41 ° 44'30 "N, 0 ° 47'00" W und 220 m über dem Meeresspiegel), die Probenahme der Triebe wurde vom 30. November bis Ende Februar oder Anfang März durchgeführt.
- Wöchentlich bewerten Sie die Reaktion der die Blütenknospen, die geeignete Wachstumsbedingungen der Kammer, von Anfang Herbst bis zum Austrieb im Frühjahr, durch den Vergleich des Gewichts der 10 Knospen aus dem Feld gepflückt.
- Wenn es keine Unterschiede gibt, diese Unterschiede weniger als 30 sind % der Ansicht, dass die Knospen ihre abschreckenden Anforderungen nicht erfüllt und sind Endodormant22. Wenn die Unterschiede mehr als 30 sind % der Ansicht, dass die Knospen ihre abschreckenden Anforderungen erfüllt haben und sind Ecodormant22.
2. technische Anlagen Vorbereitung des Materials für die Quantifizierung der Stärke
- Wählen Sie etwa sechs feste Knospen aus jeder Probenahme Datum (siehe Punkt 1.1). Je nach Sorten enthält jedes Süßkirsche Blütenknospe bis zu fünf Blume Primordia.
- Entfernen Sie die äußere Knospenschuppen und legen Sie die Knospe auf einem Uhrmacher Glas mit 75 % Ethanol zu verhindern Austrocknung.
- Keim zu sezieren und mindestens eine Blume Primordium pro Bud mit Hilfe von Präzisions-Pinzetten und eine ophthalmologische Skalpell unter eine stereoskopische Mikroskop zu extrahieren. Die Blume Primordium kann in einer 10 mL Glasröhre mit 75 % Ethanol bei 4 ° C aufbewahrt werden oder sofort mit dem nächsten Schritt fortfahren.
- Die Proben in einer tertiären Butyl Alkohol-Serie zu entwässern.
- Ersetzen Sie die 75 % ige Ethanol-Lösung mit 10 mL 75 % tertiären Butyl-Alkohol (TBA) großzügig bedecken die Proben und inkubieren sie 1,5 h. Eine Pasteurpipette kann um die Lösung zu verwerfen.
- Wiederholen Sie Schritt 2.2.1, Hinzufügen von TBA mit steigenden Konzentrationen (85 %, 95 % und 100 % V/V; und 3 X mit reinen TBA) in einem trocknen Ofen bei 30 ° C mit Entlüftung, da reine TBA bei Raumtemperatur (< 20 ° C kristallisiert) und sehr flüchtig und giftig ist. Wenn TBA mit der Probe sprechen, würde es das Gewebe schädigen.
- Die Proben in Paraffin18einbetten.
- Schmelzen Sie das Paraffin durch die Einführung der Paraffin-Perlen im trocknen Ofen bei 60 ° C mit Luftabsaugung am Vortag. Paraffin-Perlen können auch auf eine Heizplatte geschmolzen werden, aber dafür sorgen, dass das flüssige Paraffin bei 60 ° C und nicht bei einer höheren Temperatur, um Gewebeschäden zu vermeiden ist.
- Ersetzen Sie die TBA mit einer Mischung aus TBA und Paraffin-Öl (1:1) und inkubieren Sie für 24 h in einem trocknen Ofen bei 60 ° C. Ersetzen Sie dann die Mischung aus TBA und Paraffinöl mit reinem Paraffin schmilzt und inkubieren Sie für mindestens 6 h in einem trocknen Ofen bei 60 ° C. Wiederholen Sie es 2 X und inkubieren Sie die letzte Änderung für mindestens 4-6 d.
- Legen Sie jede Probe auf eine kleine Basis Metallform über eine Wärme-Oberfläche, eingebettet in Paraffinwachs und Tempo der einbettenden Kassette. Legen Sie es über eine kalte Oberfläche und entfernen Sie den Block zu, sobald das Wachs erstarrt ist.
- Abschnitt und die Vorbereitungen rehydrieren.
- Bereiten Sie Haupts-Klebstoff: lösen Sie 1 g schlicht Knox Gelatine in 100 mL destilliertem Wasser bei 30 ° C; Fügen Sie 2 g Phenol lose Kristalle (C6H5OH) und 15 mL Glycerin. Einen Objektträger mit einer Bürste bestreichen Sie die Haupt-Kleber und Tropfen Sie einen einer 1 % igen Formaldehyd-Lösung.
- Abschnitt jedes Paraffin bei 10 µm in eine rotatorische Mikrotom blockieren und legen Sie in den Abschnitten auf dem Objektträger mit Haupt Klebstoff bedeckt.
- Legen Sie die Glas-Objektträger mit den Abschnitten über eine Wärme-Oberfläche bei 35-40 ° C bis trocken; fahren Sie die Glas-Folien zu einem Dia-Rack.
- Bereiten Sie die Dewax und Rehydratation Lösungen. Legen Sie 200 mL Histoclear II in drei Glas-Färbung Gerichte, einen mit Histoclear II:ethanol (1:1, V/V), eine Ethanol-Serie (100 %, 70 %, 40 % V/V), und eine endgültige waschen mit destilliertem Wasser.
- Wachsentfernung die Abschnitte mit drei Wäschen, jede 5 min, in Histoclear II und Histoclear II:ethanol (1:1, V/V). Platzieren Sie Folie-Rack in die Glas-Färbung Gerichte, um sicherzustellen, dass die Lösung vollständig die Folien bedeckt und verschieben Sie dann die Folie Rack aus einer Lösung zur nächsten.
- Rehydrieren die Abschnitte durch die folgende Reihe von 2 min Wäschen: eine Ethanol-Serie (100 %, 70 %, 40 % V/V) und eine endgültige waschen mit destilliertem Wasser. Schließlich trocknen Sie die Objektträger bei Raumtemperatur.
- Färben Sie die Abschnitte18.
- Bereite ich2KI Fleck: lösen Sie 2 g Kaliumjodid (KI) und 0,2 g Jod (ich2) in 100 mL destilliertem Wasser. Geben Sie einen Tropfen frisch ich2KI über die Abschnitte für 5 min und verwerfen Sie die überschüssige Beize mit einem Löschpapier absorbieren. Schnell fahren Sie mit dem nächsten Schritt fort.
- Tropfen Sie einen kleinen eine synthetische Montage-Medien, legen Sie einen kleinen Deckglas darauf und drücken Sie fest. Sobald die Montage Medien trocknet, unter dem Hellfeld Mikroskop für eine vorläufige Einschätzung der Eierstock Stärke beobachten.
Hinweis: Dieser Schritt ist nicht zwingend erforderlich, obwohl ein besserer Kontrast zwischen der Stärke und dem Hintergrund gewonnen wird. Wenn der Abschnitt hat mit anderen Flecken nach Stärke Quantifizierung wiederverwendet werden, platzieren Sie das Deckglas über die Tropfen Fleck und verwerfen den Überschuss mit einem Löschpapier absorbieren (siehe 2.5.1). Dann, nach Stärke Quantifizierung, waschen, das ich2KI Fleck mit destilliertem Wasser und Stelle die Vorbereitungen Hitze bei 35-40 ° C trocknen Oberfläche.
3. Quantifizierung des Stärkegehalts
- Kalibrieren Sie die optischen Bedingungen.
Hinweis: Die Erfassungsebenen von Image Analyzer verwendet, um die gefärbten Stärke zu erkennen sind direkt abhängig von Lichtverhältnissen und Vergrößerung des Mikroskops; so befestigen Sie diese Bedingungen für alle Präparate ausgewertet. Anzupassen Sie die Einstellung hier vorgeschlagen, um die verfügbaren Mikroskop und Lichtverhältnissen.- Passen Sie die Aperturblende um die 20 X Vergrößerung und der Helligkeit oder Intensität des Lichts.
- Stellen Sie sicher, dass es keine Filter auf den Filterhalter, und wählen Sie eine Hellfeld Bedingung im Mikroskop. Wählen Sie eine geeignete Vergrößerung (z.B.40 X für Süßkirsche Eierstock Primordium).
- Steuern Sie die Bild Erwerb. Passen Sie die Kameraeinstellungen mit einem gefärbten Präparat ohne Gewebe über Bild | Erwerb | Pre-View.
- Beheben Sie die Helligkeit auf 50 %, der Gewinn bei 1,0 x und die Histogramm-Indikatoren der Gamma value-at-1,00 und der Kontrast bei 0 - 100, mit den Grenzen der Helligkeit Verteilung Histogramm Schlange.
- Aktivieren Sie die Funktion der Überbelichtung/Unterbelichtung und passen Sie die Belichtungszeit an der Grenze zur Überbelichtung.
- Gelten Sie die Weißabgleich-Funktion für das gesamte Bild alle Null-farbigen Komponenten des Bildes ohne jeden Farbton und Schattierung Korrektur, das komplette Bild erstelle ich eine korrigierte und homogenere Bild anzuzeigen.
- Kalibrieren Sie die Bild-Analyse-System die Kontrollwerte der grauen Ebene (0, schwarz, 255, weiße) unterschiedlicher optischer Dichte (OD) zu erhalten, die durch die Transmission (T) Werte erhalten werden.
- Erwerben Sie ein Bild einer gefärbten Zubereitung ohne Gewebe, als Kontrolle weiß, und Messen Sie die graue Ebene der schwarz / weiß Bild über Maßnahme | Graue Maßnahme | Kalibrieren, grau | Sollwert = 0 | Maßnahme | Kalibrieren | OK. Dies entspricht einem 100 % Transmission; so eine optische Dichte von 0, nach OD = 2 - Anmeldung T.
- Erwerben Sie ein Bild der gleichen Vorbereitung mit einem 4N-Filter, das reduziert die Menge an Licht 4 X und messen die graue Ebene der schwarz / weiß Bild über Maßnahme | Graue Maßnahme | Kalibrieren, grau | Sollwert = 0,6 | Maßnahme | Kalibrieren | OK. Dies entspricht einer 25 % Durchlässigkeit; so eine Extinktion von 0,6 nach OD = 2 - Anmeldung T.
- Ein Bild der gleichen Zubereitung ohne Licht, als schwarz zu erwerben, und Messen Sie die graue Ebene der schwarz / weiß Bild über Maßnahme | Graue Maßnahme | Kalibrieren, grau | Sollwert = 1 | Maßnahme | Kalibrieren | OK. Dies entspricht einer 0 % Transmission; so eine optische Dichte von 1 nach OD = 2 - Anmeldung T.
- Stärke zu erkennen.
- Erwerben Sie ein Farbbild des Feldes im TIFF-Format mit einer Auflösung von mindestens 300 Punkte pro Zoll (dpi) gemessen.
- Erstellen Sie ein binäres Bild entspricht der Gegend gebeizt. Die drei Farben Schwellenwerte festgelegt (Werte zwischen 0 - 255 für jeden) bis binäre Bild genau gefärbten Stärkekörner beobachtet spiegelt, über Bild | Erkennen | Wählen Sie die Schwellen von rot, blau und grün | OK. Immer wieder visuelle Vergleiche in verschiedenen Zubereitungen und Geweben zu tune up die endgültige Erfassungsebenen. Speichern Sie und verwenden Sie diese Werte für alle Vorbereitungen.
- Quantifizierung der Stärke. Umwandeln Sie das ursprüngliche Farbbild in ein Schwarzweißbild mit dem Bild-Analyse-System. Verwenden Sie das binäre Bild als überlagerten Maske auf der schwarz / weiß Bild über Bild | Binäre bearbeiten. Die Summe der optischen Dichte der jedes Pixel unter der Maske über Maßnahme messen | Graue Ebene | OK und dieser Wert als der Stärkegehalt im gemessenen Bereich betrachten.
- Wiederholen Sie die Schritte 3.4.1 - 3.4.3 in vier Orten der Eierstock Primordia einen repräsentativen Wert des Stärkegehalts in den Eierstöcken der Blume Primordia zu erhalten.
- Wiederholen Sie die Schritte 3.4.1 - 3.4.3 und Schritt 3.4.5 in verschiedenen Blumen jeder sammeln Datum.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Dormanz Studien erfordern die Festlegung des Zeitpunkts, wann die abschreckenden Voraussetzungen erfüllt sind. Trotz des Fehlens der phänologischen Veränderungen während des Winters unter Feldbedingungen (Abbildung 1A) wiederherstellen Kirschbäume nicht die Kapazität des Wachstums unter geeigneten Bedingungen, bis sie einen bestimmten Zeitraum unter niedrigen Temperaturen passieren. Die regelmäßige Übertragung der Triebe zu einer kontrollierten Bedingungen Kammer (Abbildung 1 b) während der Winterzeit erlaubt die Beurteilung des Zustands der Blütenknospen Dormanz. Die Auswertung der Blütenknospe Wachstum erfolgte durch die Zunahme der Knospe Gewicht zu messen. Während während der Vegetationsruhe, keine Änderungen konnte nach 10 Tagen geeigneter Rahmenbedingungen (Abbildung 1), beobachtet werden sobald Keimruhe überwunden war, die Knospen schwollen und platzen in der Wachstums-Kammer (Abbildung 1). Die Ergebnisse dieser Analyse erlaubt den Dormanz Status der Knospen hergestellt werden. Durch die unterschiedlichen Temperaturen im Winter auftreten wurde Dormanz zu unterschiedlichen Terminen, je nach Jahr überwinden. Während im ersten Jahr der Studie, das Brechen der Keimruhe ereignete sich im Januar, im zweite Jahr einen milderen Winter vorgestellt; So trat die abschreckende Erfüllung etwa drei Wochen nach, im Februar.
Süßkirsche trägt Blütenknospen in Sporen, wo die apikale Knospe ist eine vegetative Knospe und die seitlichen Knospen sind Blütenknospen (Abbildung 1 und 1 D). Undifferenzierte Knospen begann in Blume oder vegetativen Knospen am Ende des Sommers zu unterscheiden, und beim Betreten der Vegetationsruhe im Winter mehrere Blume Primordia bleiben im Inneren der Knospe, von zahlreichen grünen Schuppen geschützt und von braunen äußeren Skalen (abgedeckt Abbildung 1 und Abbildung 2A). Die Zerlegung der Blütenknospe zeigte die kleine Blume Primordia innen (Abbildung 2A). Jede Knospe enthalten ein bis fünf einzelne Blume Primordia (Abb. 2 b). Trotz der geringen Größe der einzelnen Blume Primordium, alle Teile einer Blume unterscheiden und können unterschieden werden: der Stempel, die Staubbeutel, die Blütenblätter und die Kelchblätter (Abbildung 2). Die Verwendung von histochemische Techniken (Alkohol: Essigsäure [3:1] Fixierung, Paraffin Wachs einbetten, Mikrotom schneiden und jodhaltiges Stärke Färbung) erlaubt die Verteilung der Stärke innerhalb der Blume Primordium Gewebe (Abb. 2D einzuhalten ).
Stärke in den Eierstock Primordium wurde in den einzelnen Abschnitten quantifiziert. Vier Maßnahmen von 1337 µm2, bei 40 X Vergrößerung, vertreten die allgemeine Anordnung der Stärke in der Süßkirsche Eierstock Primordium (Abb. 3A). Stärkekörner waren deutlich vom Hintergrund unterscheiden, nachdem ich2KI Färbung (Abb. 3 b). Die Stärke wurde durch die Bild-Analyse-System identifiziert, durch Anpassen der Farbe bedeckte Schwellen von rot, grün und blau bis alle Stärkekörner beobachtet durch das binäre Bild vom System anhand der definierten Farbe Parameter (Abbildung 3) erstellt wurden. Die Werte der Stärkegehalt gewonnen waren das Ergebnis der Maßnahme von der optischen Dichte der jedes Pixel unter der Maske auf die schwarz / weiß Bild (Abbildung 3D).
Die Quantifizierung der Stärke offenbart ein einheitliches Muster von Stärke dynamisch während des Winters (Abbildung 4). Konsequent, präsentiert die Menge der Stärke im Frühwinter einen optische Dichte-Wert von weniger als 40.0003, während die maximale Anzahl einen Wert zwischen 120.000 und 140.000 in beiden Jahren erreicht. Während im Januar während des ersten Jahres (Abb. 4A) der Maximalwert erreicht wurde, kam es im Februar im zweiten Jahr (Abbildung 4 b). Gegenüberstellung dieser Ergebnisse mit den Teint der Keimruhe, ist die maximale Menge an Stärke damit auch mit der Kühlung Erfüllung in beiden Jahren aufgetreten.
Dieser Ansatz erfordert die Festlegung des Status Dormanz (Abb. 5A) begleitend mit der Stärke Quantifizierung auf Eierstockgewebe (Abb. 5 b) um die Änderungen in der Stärkegehalt in Bezug auf die Keimruhe zu gestalten.

Abbildung 1: Versuchsaufbau zur Bestimmung der Dormanz-Status der Blütenknospen von Süßkirsche. (A) Zweige, im Winter zeigen die schlafenden Knospen geschlossen und durch dunkle braune Schuppen bedeckt. (B) dieses Panel zeigt Triebe auf Wachstum Kammer übertragen. Mitte Januar geschlossen, einige Sorten blieb ruhend mit den Knospen noch (weißen Pfeil), während andere in der Lage waren zu wachsen, schwoll an Knospen (schwarzer Pfeil) zeigt. (C) dieses Panel zeigt einen Ausschnitt aus einem Shooting mit ruhenden Blütenknospen befindet sich seitlich und einer einzigen vegetativen Knospe befindet sich in der apikalen Position in den Sporn. (D) dieses Panel zeigt ein Detail eines Triebes sobald Keimruhe überwunden wurde, nach 10 Tagen in der wachsenden Kammer Knospe Schwellung. Bitte klicken Sie hier für eine größere Version dieser Figur.
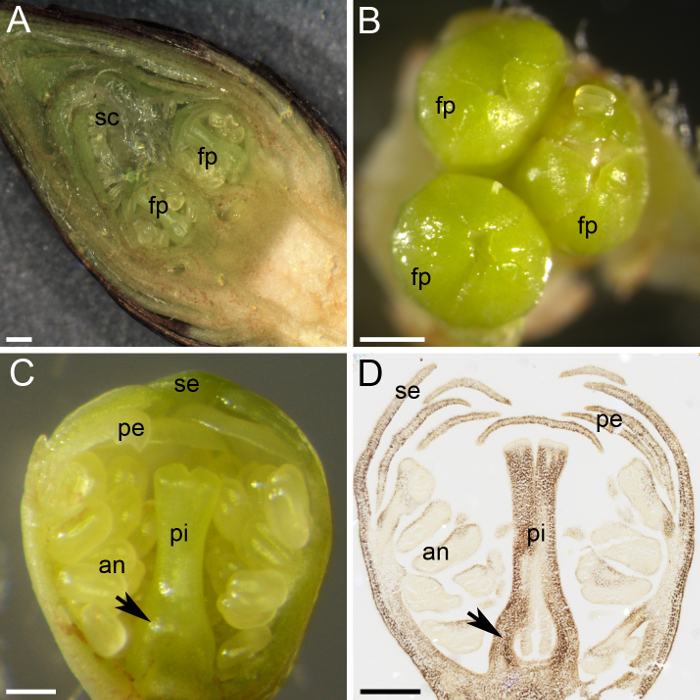
Abbildung 2: Vorbereitung des Materials für die Quantifizierung der Stärke zu Pflanzen. (A) dieses Panel zeigt ein transversaler Teil eine Blütenknospe zeigt zwei Blume Primordia (fp) durch zahlreiche Skalen (sc) geschützt. (B) drei Blume Primordia (fp) versammeln sich in eine Blütenknospe. (C) dieses Panel zeigt einen transversalen Teil einer Blume Primordium differenziert mit den Quirlen: Kelchblätter (Se), Blütenblätter (Pe), Antheren (ein) und Stempel (Pi). Der Eierstock Primordium zeichnet sich an der Basis des Stempels (Pfeil). (D) ein Mittelteil eine Blume Primordium wurde gesammelt und fest im Januar, eingebettet in Paraffin Wachs geschnitten und gefärbt mit I2KI (dunkelbraun) für Stärke. Dieses Fenster zeigt den Eierstock Primordium (Pfeil). Der Maßstabsbalken sind Seitenteile A und B 500 µm und 200 µm in Platten C und D. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3: Stärke-Quantifizierung in Süßkirsche Eierstock Primordium. (A) dieses Panel zeigt einen Mittelteil ein Eierstock Primordium gebeizt mit I2KI, zeigen die vier Frames in welcher Stärke Inhalt gemessen wurde. (B) dieses Panel zeigt einen Ausschnitt aus dem Eierstock Primordium. Die Stärkekörner sind in dunkelbraun gefärbt. (C) dieses Panel zeigt verschiedene Schattierungen von Blau ein Pseudofarben Bild in welcher Stärke entspricht. (D) dieses Panel zeigt eine binäres Bild-Maske für ich2KI-gefärbten Stärke im schwarzen und weißen Originalbild (blau). Die optische Dichte wird nur in den Pixeln des ursprünglichen Bildes bedeckt durch die Maske gemessen. Die Skala-Bars sind in zentrale A 100 µm und 20 µm in B - D-Panels. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4: repräsentative Ergebnisse für die Quantifizierung der Stärke in Süßkirsche Eierstock Primordia gesammelt monatlich vom Herbst bis zum Frühjahr in zwei Jahren von verschiedenen Winter Temperaturbedingungen. (A) dieses Panel zeigt die Ergebnisse aus den Jahren 2010-2011, die einen kalten Winter hatten. Die schaurige Erfüllung (Schneeflocke) ereignete sich im Januar, damit auch mit der maximalen Stärke. (B) dieses Panel zeigt die Ergebnisse aus den Jahren 2011-2012, die einen milden Winter hatten. Die schaurige Erfüllung (Schneeflocke) ereignete sich im Februar, damit auch die maximale Menge an Stärke. Die Werte sind der Mittelwert ± Standardfehler des Mittelwerts. Bitte klicken Sie hier für eine größere Version dieser Figur.
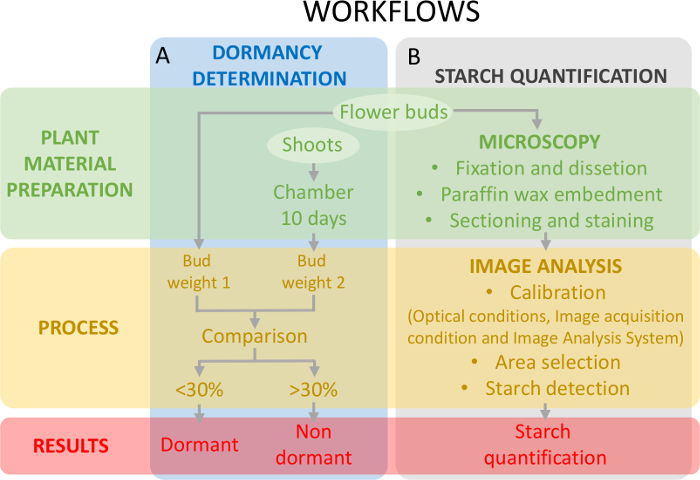
Abbildung 5: Schema der Versuchsanordnung zur Beurteilung des Zustands der Dormanz der Knospen und die Quantifizierung der Stärke in den Eierstock Primordia in Süßkirsche. (A) dieses Panel zeigt die Workflows der Dormanz Statusermittlung: die Pflanze Materialvorbereitung, den Prozess und die Ergebnisse. (B) dieses Panel zeigt die Workflows für die Quantifizierung der Stärke: die histochemische Vorbereitung eine mikroskopische Beobachtung der Stärke, die Bild-Analyse-Erkennung von Stärke und die Stärke Quantifizierung der Knospen. Bitte klicken Sie hier für eine größere Version dieser Figur.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Dormanz in holzigen Stauden stellt deutliche Auswirkungen im Obstbau und Forstwirtschaft im Klimawandel, obwohl der biologische Prozess hinter Dormanz unklar bleibt. Dormanz Studien aus verschiedenen Blickwinkeln angegangen werden können, aber die Forschung auf der Suche nach einer biologischen Marker für die Winterruhe hat in den letzten Jahren intensiviert. Allerdings wurden die meisten Versuche, eine eindeutige Kennzeichen, wenn eine Knospe Dormanz gebrochen hat zu finden erfolglos3. Die hierin beschriebene Methodik histochemische Techniken18 mit Analyse Bild kombinieren ist sehr nützlich, um die Beziehung zwischen Kohlenhydrat Reserven von einem bestimmten Gewebe und seine physiologische Aktivität in Süßkirsche Knospen untersuchen gewesen während der verschiedenen Phasen der Dormanz5 und kann auch auf andere Spezies und Geweben10,13,20angewendet werden.
Kohlenhydrat-Reserven in Form von Stärke spielen eine wichtige Rolle sowohl in der Blütenentwicklung und die Fortpflanzung7,10,13,20,21,23 und in der Saisonalität der gemäßigten waldigen Stauden-6. Verschiedene Studien zur Keimruhe haben auf die Stärke innerhalb der Knospen24geachtet. Jedoch aufgrund ihrer geringen Größe mehrere ganze Knospen sind erforderlich für die Nutzung der quantitativen Analysemethoden und die Erkennung von quantitativen Unterschiede in bestimmten Geweben oder Zellen wird durch den Maskierungseffekt der umliegenden Zellen begrenzt. Die Kombination von histochemische Techniken mit dem Bild-Analyse-System bietet eine gute Gelegenheit, Veränderungen in der Stärkegehalt der verschiedenen Strukturen im Inneren der Knospe zu studieren.
Diese Methode hat die Begrenzung die Quantifizierung des genauen Inhalts der Stärke im Gewebe zu verhindern aber ermöglicht die relative Stärkegehalt, quantitative Stärke Änderungen über Zeit25 folgen und die Stärke vergleichen quantifiziert werden Inhalte von verschiedenen Geweben13,20, Sorten oder Jahre5. Damit kann die korrekten Vergleich der Werte der optischen Dichte zwischen Feldern, Gewebe und Knospen, die Kalibrierung des Systems (Lichtverhältnisse, Färbung Intensität und Vergrößerung) und die Einstellung der Farbe, die Schwellenwerte genau festgelegt werden müssen , gespeichert und verwendet für alle Vorbereitungen.
Stärke zu beflecken und Quantifizierung basierend auf Kalium Jod ermöglicht die spätere Verwendung der anderen Flecken nach dem Waschen des Abschnitts. So können verschiedene Analysen durchgeführt werden, ohne zusätzliche Vorbereitungen und synthetischen Montage sind Medien nicht verwendet,5,20. Ebenso kann nach den gleichen Vorbereitungen, so dass das Muster der Stärke Akkumulation in Bezug auf das Wachstum der verschiedenen Strukturen5,13gerahmt werden morphometrische Maße26 erfolgen. Die Methode kann auf andere Strukturen oder Arten mit der Anpassung der Farbwerte, die den Analyzer verwenden, um die Stärke zu erkennen, die die Studie von anderen Entwicklungsprozessen ermöglichen können, bei denen Änderungen im Stärkegehalt in kleinen Gruppen von Zellen angepasst werden.
Die Beziehung zwischen Dormanz Veröffentlichung und Stärke Akkumulation in den Eierstock Primordia enthüllt durch die Verwendung dieser Methode bietet eine solide Grundlage zum Verständnis der biologischen Grundlagen der Dormanz und abschreckende Anforderungen5. Jedoch konnte Stärke Quantifizierung von Bildanalyse auf Paraffin-eingebetteten Abschnitte erweisen sich als sehr umständlich und zeitraubend, die abschreckenden Anforderungen an eine große Anzahl von Sorten zu schätzen. Zukünftige Bemühungen müssen darauf konzentrieren, Studium zuverlässige biologische Indikatoren, die leicht die Dormanz Status des Baumes angeben können. Unterdessen das Muster unterschiedlicher Stärke während der Vegetationsruhe kann verwendet werden, um weiteren physiologischen und genetischen Studien zu umrahmen, und die Kombination von histochemische Techniken mit Bildanalyse, die hierin beschriebenen genutzt werden, in anderen holzigen Dauerkulturen der Stärkegehalt von verschiedenen Geweben in Bezug auf die Keimruhe zu quantifizieren.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Die Autoren haben nichts preisgeben.
Acknowledgments
Die Autoren danken dankbar Maria Herrero und Eliseo Rivas für ihre hilfreiche Diskussion und Beratung. Diese Arbeit wurde unterstützt durch das Ministerio de Economía y Competitividad – europäischer Fonds für regionale Entwicklung, Europäische Union [Grant-Nummer BES-2010-037992, E. F.]; Das Instituto Nacional de Investigación y Tecnología Agraria y Alimentaria [Grant-Nummern RFP2015-00015-00, RTA2014-00085-00, RTA2017-00003-00]; und des Gobierno de Aragón – Europäische Sozialfonds, Europäische Union [Grupo Consolidado A12-17R].
Materials
| Name | Company | Catalog Number | Comments |
| Precision scale | Sartorius | CP225D | |
| Stereoscopic microscope | Leica Microsystems | MZ-16 | |
| Drying-stove | Memmert | U15 | |
| Paraffin Embedding station | Leica Microsystems | EG1140H | |
| Rotatory microtome | Reichert-Jung | 1130/Biocut | |
| Microtome blade | Feather | S35 | Stainless steel |
| Bright field microscope | Leica Microsystems | DM2500 | |
| Digital Camera | Leica Microsystems | DC-300 | |
| Image Analysis System | Leica Microsystems | Quantiment Q550 |
References
- Kurokura, T., Mimida, N., Battey, N. H., Hytönen, T. The regulation of seasonal flowering in the Rosaceae. Journal of Experimental Botany. 64 (14), 4131-4141 (2013).
- Rohde, A., Bhalerao, R. P. Plant dormancy in the perennial context. Trends in Plant Science. 12 (5), 217-223 (2007).
- Fadón, E., Rodrigo, J. Unveiling winter dormancy through empirical experiments. Environmental and Experimental Botany. 152, 28-36 (2018).
- Fadón, E., Rodrigo, J., Herrero, M. Is there a specific stage to rest? Morphological changes in flower primordia in relation to endodormancy in sweet cherry (Prunus avium L.). Trees - Structure and Function. , In Press (2018).
- Fadón, E., Herrero, M., Rodrigo, J. Dormant flower buds actively accumulate starch over winter in sweet cherry. Frontiers in Plant Science. 9 (171), (2018).
- Loescher, W. H., Mccamant, T., Keller, J. D. Carbohydrate reserves, translocation and storage in woody plant roots. HortScience. 25 (3), 274-281 (1990).
- Hedhly, A., et al. Starch turnover and metabolism during flower and early embryo development. Plant Physiology. , (2016).
- Rodrigo, J., Hormaza, J. I., Herrero, M. Ovary starch reserves and flower development in apricot (Prunus armeniaca). Physiologia Plantarum. 108 (1), 35-41 (2000).
- Julian, C., Rodrigo, J., Herrero, M. Stamen development and winter dormancy in apricot (Prunus armeniaca). Annals of Botany. 108 (4), 617-625 (2011).
- Alcaraz, M. L., Hormaza, J. I., Rodrigo, J. Pistil starch reserves at anthesis correlate with final flower fate in avocado (Persea americana). PLoS One. 8 (10), e78467 (2013).
- Smith, A. M., Zeeman, S. C. Quantification of starch in plant tissues. Nature Protocols. 1 (3), 1342-1345 (2006).
- Eliceiri, K. W., et al. Biological Imaging Software Tools. Nature Methods. 9 (7), (2013).
- Rodrigo, J., Herrero, M. Influence of intraovular reserves on ovule fate in apricot (Prunus armeniaca L.). Sexual Plant Reproduction. 11, 86-93 (1998).
- Zhou, J., Spallek, T., Faulkner, C., Robatzek, S. CalloseMeasurer: A novel software solution to measure callose deposition and recognise spreading callose patterns. Plant Methods. 8 (1), (2012).
- Faulkner, C., et al. An automated quantitative image analysis tool for the identification of microtubule patterns in plants. Traffic. 18 (10), 683-693 (2017).
- Kuhn, B. F. Determination of starch in ovules of the sour cherry cv. "Stevnsbaer.". European Journal of Horticultural Science. 71 (3), 120-124 (2006).
- Johansen, D. A. Plant microtechnique. , McGraw-Hill. New York, NY. (1940).
- Ruzin, S. E. Plant microtechnique and microscopy. , Oxford University Press. New York, NY. (1999).
- Rodrigo, J., Rivas, E., Herrero, M. Starch determination in plant tissues using a computerized image analysis system. Physiologia Plantarum. 99 (1), 105-110 (1997).
- Alcaraz, M. L., Hormaza, J. I., Rodrigo, J. Ovary starch reserves and pistil development in avocado (Persea americana). Physiologia Plantarum. 140 (4), 395-404 (2010).
- Suarez, C., Castro, A. J., Rapoport, H. F., Rodriguez-García, M. I. Morphological, histological and ultrastructural changes in the olive pistil during flowering. Sexual Plant Reproduction. 25, 133-146 (2012).
- Lang, G. A., Early, J. D., Martin, G. C., Darnell, R. L. Endodormancy, paradormancy, and ecodormancy - Physiological terminology and classification for dormancy research. HortScience. 22 (3), 371-377 (1987).
- Hedhly, A., Vogler, H., Eichenberger, C., Grossniklaus, U. Whole-mount clearing and staining of arabidopsis flower organs and siliques. Journal of Visualized Experiments. 2018 (134), 1-10 (2018).
- Kaufmann, H., Blanke, M. Changes in carbohydrate levels and relative water content (RWC) to distinguish dormancy phases in sweet cherry. Journal of Plant Physiology. 218 (July), 1-5 (2017).
- Herrero, M., Dickinson, H. G. Pollen-pistil incompatibility in Petunia hybrida: changes in the pistil following compatible and incompatible intraspecific crosses. Journal of Cell Science. 36, 1-18 (1979).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biology. 7 (10), R100 (2006).



