Summary
Здесь мы представляем собой протокол для индукции левого желудочка cryoinjury следуют имплантации патч сердечной мышцы, производные от кардиомиоцитов iPS клеток человека в морской свинки модели.
Abstract
Благодаря способности ограничены регенерации сердца у взрослых млекопитающих инфаркт миокарда приводит к необратимой потере кардиомиоцитов. Эта потеря соответствующих сумм сердечной мышцы массы может привести к сердечной недостаточности. Помимо трансплантация сердца существует никакой вариант лечения для конечной стадии сердечной недостаточности. Во времена нехватки доноров орган орган самостоятельного лечения условия необходимы. Слева желудочковая assist устройств являются перспективный вариант терапии, однако, особенно в качестве назначения терапии, ограничена его побочные эффекты, как инсульт, инфекции и кровотечения. В последние годы были исследованы несколько сердечных ремонта стратегий, включая инъекции стволовых клеток, сердечной прародителями или миокарда тканевой инженерии. Недавние усовершенствования в клеточной биологии позволяют для дифференциации большого количества кардиомиоцитов, производный от человека индуцированных плюрипотентных стволовых клеток (iPSC). Одной из стратегий сердца ремонт в настоящее время предметом оценки является пересадка ткани искусственного сердца. Инженерии сердечной ткани (EHT) представляет собой трехмерный в пробирке создан cardiomyocyte сеть с функциональными свойствами ткани собственного сердца. Мы создали EHT-патчи от hiPSC производные кардиомиоцитов. Здесь мы представляем протокол для индукции левого желудочка миокарда cryoinjury в морской свинки, следуют имплантации hiPSC производных EHT на стенке левого желудочка.
Introduction
Количество больных с сердечной недостаточностью увеличивается в нашей старения населения. Для конечной стадии сердечной недостаточности ортотопическая трансплантация сердца является параметр только курс лечения. Однако особенно в европейских странах, существует растущая нехватка доноров орган. Таким образом необходимы альтернативные варианты лечения. Последние достижения в механическую поддержку кровообращения являются многообещающими, но особенно в долгосрочной перспективе запустить, ограничивается ее побочные эффекты, как кровотечение, насос тромбоза и инфекционных осложнений1.
Эндогенные регенеративная способность сердца взрослого человека является крайне ограниченным. Таким образом сердца регенерации терапии может стать альтернативное лечение вариант для конечной стадии сердечной недостаточности больных2,3. Различные методы, включая инъекций на основе стволовых клеток клеток или тканей, инженерные подходы были описаны3,4,5.
Человеческое индуцированных плюрипотентных стволовых клеток (hiPSC), а также человеческих эмбриональных стволовых клеток (Госкомсанэпиднадзором) может быть эффективно дифференцирована в спонтанно избиение человека кардиомиоцитов6, который был крупным достижением в области регенеративной сердечной терапии.
Чтобы заменить миокарда после инфаркта миокарда и улучшению функции сердца, выживание подходящее количество кардиомиоцитов и их механические и электрические соединения с родной сердца имеет важное значение. Исследовать потенциал сердечной регенеративной терапии с iPS человеческих клеток, полученных кардиомиоцитов, необходима модель подходящих исследований. Идеальная модель должны быть экономически эффективными и физиология человека как и электрофизиологии. Крупные животные модели как свиньи бы идеально с этой точки зрения, однако, эти эксперименты являются очень дорогими и большое количество кардиомиоцитов необходимо будет заменить соответствующие количество кардиомиоцитов, чтобы увидеть эффекты на левого желудочка функции в модели миокарда свиньи.
Например, чтобы ответить элементарных биологических вопросы к человека на основе клеток сердечной регенерации, выживание клетки, васкуляризации и электрические соединения, малые животные модели являются более подходящими. От имеющихся небольших животных моделей морская свинка является наиболее полезных видов, по сравнению с крыс и мышей, как их электрофизиологии больше напоминает ситуацию в людей7. В этой модели морской свинки мы индуцированной Трансмуральное cryoinjury левого желудочка. Через одну неделю после индукции инфаркт миокарда имплантации трехмерных, спонтанно избиение бедра клеток, полученных cardiomyocyte патч была выполнена. Выживание клетки cardiomyocyte был оценен гистологическом 28 дней после имплантации.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Животных получил гуманной помощи в соответствии с руководство по принципам лабораторных животных, подготовленный Институтом ресурсов лабораторных животных и публикуемых национальными институтами здравоохранения. Все животные протоколы были одобрены ответственным местным органом власти ('' Amt für Gesundheit und Verbraucherschutz, Hansestadt Гамбург '' / животных протокол # 109/16).
1. получить животных
- Коммерчески получите женский морских свинок, массой 500-600 г.
- Дом их в обычных условиях в животных клетках. Канал стандартных крыс Чоу и автоклавного воды объявление libidum.
2. Трансторакальная эхокардиография
- Морская свинка в камеру всасывание и анестезировать животное с изофлюрановая (2-3%). Проверка глубины анестезии, отсутствие реакции на мыс пинча.
- Место осознающие свинки на потепление платформе (40-42 ° C) в лежачем положении. Продолжать анестезии через носовой конус (изофлюрановая 1,5-2%)
- Бритье и депилировать грудной клетки pig´s Гвинея, с помощью бритвы электрические волос животных.
- Применение геля датчика УЗИ подогретую (~ 25 ° C). Используйте систему эхокардиографии, которая оборудована с преобразователем частоты выше 15 МГц.
- Приобрести двумерных парастернальной длинной оси просмотров, поместив датчик на грудной клетки свиней guinea´s, сталкивается с правом шеи к левой ноге и записи длинной оси B-режим изображения на плоскости аортального клапана с параллельной визуализации LV Апекс. Исследуйте функцию предоперационное левого желудочка.
- Поверните преобразователя на 90° градусов для получения короткой оси B-режим представления на уровне середины папиллярная.
Примечание: Животное сразу переводятся или таблицу. Животное постоянно под наркозом с 3% изофлюрановая. чтобы избежать повышенной бронхиальной секреции при искусственной вентиляции легких вводят 0,05 мг/кг атропина (и.м.).
3. хирургия
-
Индукция инфаркта миокарда
- Придать carprofen 4 – 5 мг/кг и бупренорфина 0,05 мг/кг для обезболивания подкожно с иглой 21 G и шприц 10 мл. Атропин 0,5 мг/кг вводят подкожно с иглой 21 G и шприц 10 мл.
- Место свинки на спине и держать анестезии с маску, охватывающий рот и нос. Проверка глубины анестезии, щипать лапы (отсутствие педали рефлекс).
- Распространение морских свинок ноги и исправить положение с помощью липкой ленты.
- Бритье груди и трахеи региона наркотизированных животного с электробритвы. Лечить области, широко используя на основе йода скраб, а затем 80% этанола. Повторите этот дезинфекции дважды.
- Выполните 1,5 см вертикальный разрез в области трахеи и тупо рассечь мышцы, охватывающих трахеи до тех пор, пока вы видите трахеи. Прокол трахеи с 18 G Внутривенный катетер и вставьте гибкий часть канюля как трахеи трубку.
- Подключите трахеи трубку к животных респиратор постоянно проветривать морскую свинку во время процедуры.
Примечание: Теперь с 3% изофлюрановая через трахеи трубку поддерживается анестезии (вдохновение помощь вентиляции с максимальной вдохновение давление, частота дыхания: 100 – 120/мин, пик вдохновения давление: 18-22 см Hg с помощью Пип вентиляция при открытом груди ). - Определите 5й межреберное пространство путем подсчета запрещено ребра, начиная с первого межреберное пространство. Выполняйте горизонтальный разрез 2 см на 5 межреберное пространство на левой стороне морской свинки, используя ножницы, пинцет. Вставьте маленький животное втягивающего устройства. Рассечь мышцы с electrocautery пока не достигнуто межреберные мышцы, которые могут рассматриваться после удаления подкожной клетчатки, достигаются.
- Аккуратно вскрыть межреберные мышцы с помощью пинцета, вплоть до плевральную полость можно увидеть левого легкого в передней. Вставьте втягивающего устройства между ребрами и открыть его тщательно, пока не получается хороший вид сердца.
- Откройте перикарда примерно 1 см в регионе передней стенки левого желудочка с помощью ножниц. Место компресс на левое легкое, чтобы защитить его от повреждений при вызывая cryoinjury левого желудочка.
- Место кончике эродированных металлическим штампом (алюминий) с поперечного сечения диаметром 0,5 см в жидкий азот за 3 мин.
- Пресс азот охлажденный зонд на левой передней стенки сердца для 30 s. Затем отделяют его от всего сердца с помощью электропаяльника (250 ° C) который помещается внутри отметку, чтобы согреть. Повторите эту процедуру 3 раза для получения Трансмуральное миокардиального ушиба. Наблюдать, бланширования миокарда.
- Надуть легких с максимальное давление (путем зажима отток трубу вентилятора 2 s), чтобы избежать ателектаз легких. Удалите из межреберное пространство втягивающего устройства.
- Закройте ребер с двумя швами 3-0. Закрыть шов мышц над ребер с управлением 4-0. Для закрытия кожи используйте 5-0 шва одной строчки.
- Уменьшите изофлюрановая до 1%. Когда животное дышит спонтанно, удалите трахеи трубку и продолжить анестезии с маску (изофлюрановая 2-3%).
- Обеспечить отсутствие рефлексов, щипать задние конечности, чтобы следить за достаточной глубины анестезии. Затем используйте один 8-0 Шовный материал для закрытия места проколов на трахею. Закройте рану швы трех один стежок 4-0.
- Для боль лекарства на следующие 5 дней использовать бупренорфин (0,05 мг/кг в сут) и carprofen (5 мг/кг в сутки).
-
Имплантация EHT (7 дней после cryoinjury)
- Морская свинка в камеру всасывание и анестезировать животное с изофлюрановая проверки глубины анестезии, отсутствие реакции на мыс пинча.
- Придать carprofen 4 – 5 мг/кг и бупренорфина 0,05 мг/кг подкожно с иглой 21 G и 10 мл шприц после индукции анестезии. Место свинки на спине и держать анестезии с маску, охватывающий рот и нос.
Примечание: Достаточность анестезии должны проверяться путем сжимать лапы. - Распространение ноги морской свинки и исправить положение с помощью липкой ленты.
- Выполните дооперационного препараты, как описано в шаге 3.1.4–3.1.6. Выполните 2 см горизонтальный разрез в области рубца левой боковой стороны, используя ножницы и щипчики.
- Аккуратно вскрыть extrapleural спайки с помощью электрокаутер. Осторожно откройте плевральной полости с ножницами. Вставьте ребро разбрасыватель подвергать сердце.
- Визуально Определите области миокарда по его бледный цвет по сравнению со здоровыми окружающие миокарда. Поместите патч инженерии сердца ткани миокарда региона.
- Закрепите его с двух 8-0 швы с обеих сторон. Убедитесь в том обеспечить патч в не infarcted области сердца (рис. 1). Надуйте легких с давлением, чтобы избежать ателектаз легких. Удалите из межреберное пространство втягивающего устройства.
- Закройте ребер с двумя швами 3-0. Закрыть шов мышц над ребер с управлением 4-0. Для закрытия кожи используйте 5-0 шва одной строчки.
- Уменьшите изофлюрановая до 1%. Когда животное дышит спонтанно, удалите трахеи трубку и продолжить анестезии с маску (изофлюрановая 2-3%).
- Обеспечить отсутствие рефлексов, щипать задние конечности, чтобы следить за достаточной глубины анестезии. Затем используйте один 8-0 Шовный материал для закрытия места проколов на трахею. Закрыть рану с тремя сингл сшить швы 4-0.
- Для боль лекарства на следующие 5 дней использовать бупренорфин (0,05 мг/кг в сут) и carprofen (5 мг/кг в сутки).
- Через четыре недели после вживления EHT выполняют Трансторакальная эхокардиография (как описано в шаге 2) для контроля функции LV с течением времени.
Примечание: LV функция контролируется до имплантации EHT и 4 недель после имплантации для мониторинга для улучшения сердечной функции путем вживления EHT - Усыпить животных протокол IACUC утверждения и хирургическим explant сердца для дальнейшего анализа.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Эта модель морских свинок является подходящей модели для изучения сердца регенерации после имплантации hiPSC производные EHT-патчи. Можно воспроизвести это приводит к большой Трансмуральное миокарда травм. Шрам размер оценивается по гистологии через четыре недели после cryoinjury. Мейсон trichrome окрашивание показывает большой Трансмуральное шрамы (рис. 2). Размер шрам был похож на большое количество раненых животных, что отражает высокий уровень воспроизводимости8. В среднем 25% миокарда левого желудочка был заменён рубцовой ткани. Пятнать делеций продемонстрировал большой миокарда имплантатов, которые частично remuscularized шрам (рис. 3a). Пятнать для человека Ku80 оказалось человеческого происхождения этой недавно сформированной миокарда (Рисунок 3b). Увеличение показали, что эти трансплантаты состоит из плотно упакованных миоцитов. Функции левого желудочка контролируется с помощью Трансторакальная эхокардиография. Успешной имплантации EHT характеризуется улучшение ФИЛЖ, дробные области сокращения и сокращение левого желудочка конечного диастолического диаметр (рис. 4).
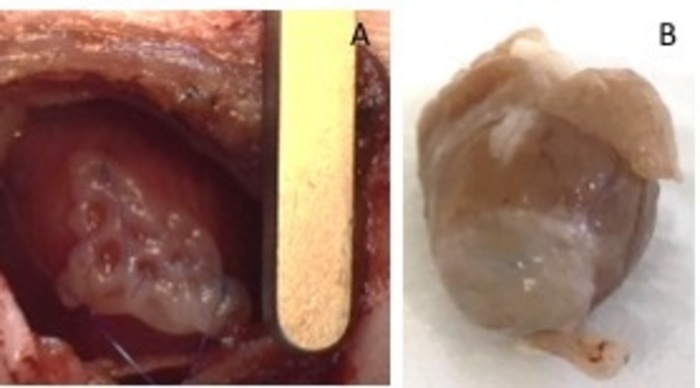
Рисунок 1: hEHT патчи после имплантации. (A) патч сразу после имплантации. (B) патч через четыре недели после имплантации. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
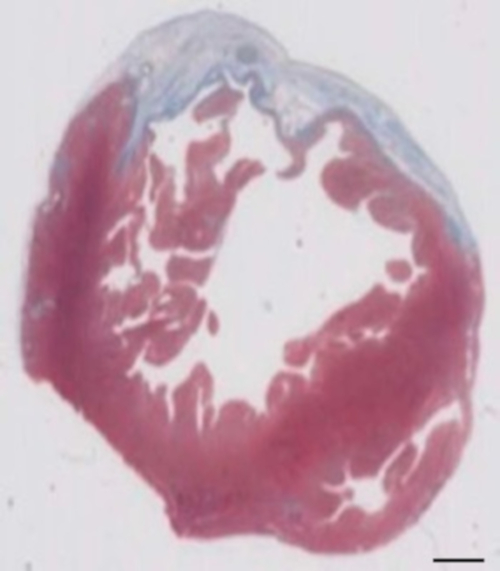
Рисунок 2: определение миокарда на Masson trichrome окрашенных парафин раздела 28 дней после cryoinjury. Миокарда определяется синим цветом в Masson trichrome окрашивание, представляющие фиброзных тканей. Шкалы бар = 2 mm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
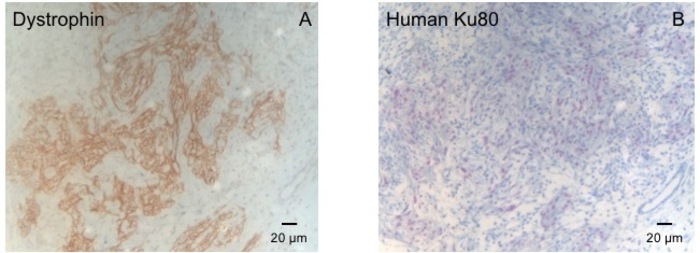
Рисунок 3: окрашивание с делеций и человека Ku80. (A) делеций пятнать показывает большие мышцы острова (коричневый) в районе шрам (B) ку-окрашивание парафиновых секционного сердце. Ку-80 является человека специфические антитела. Таким образом положительно окрашенных клеток (коричневый цвет), от человеческого происхождения. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
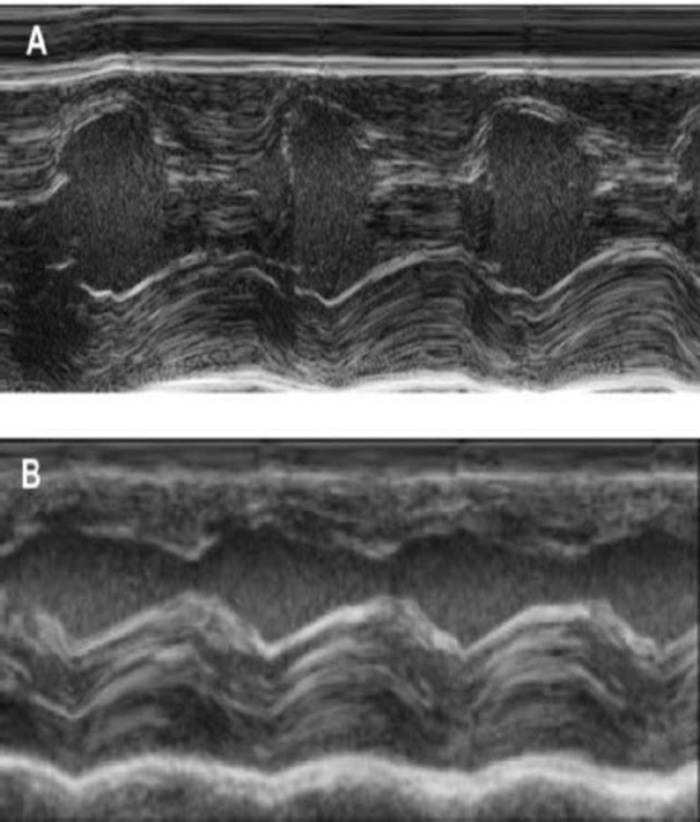
Рисунок 4: M-режим измерения левого желудочка с помощью Трансторакальная эхокардиография. (A) на базовых и (B) через неделю после cryoinjury. (IVS: внутрижелудочкового септум, LV: левого желудочка, PW: задняя стена). Измерения проводятся 3 раза. В начале исследования, 1 неделю после cryoinfarction и 4 недель после имплантации EHT пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Целый ряд мелких животных моделей доступны для изучения эффекта, что трансплантация клеток оказывает раненых сердец9,10,11. Мы выбрали модель свинки из-за всех мелких животных моделей его (электро) физиологии напоминает наиболее тесно людей. Преимущества малых животных моделей являются простые жилище, управляемые затраты и несколько трудовых ресурсов. По сравнению с мышей и крыс Гвинея pigs´ сердца (электро) физиологии больше похожи на людей. В частности частота сердца является нижняя (~250/min), желудочковая действий потенциальных шоу фаза плато и калия текущий яКР имеет важное значение для реполяризации7. Кроме того больший размер животных облегчает хирургических операций, что особенно важно, как ре торакотомия требуется через одну неделю после индукции травмы. Однако морских свинок, чувствительны к анестезии, требующих некоторый опыт.
Shiba et al., описано использование кетамина и 2 мг/кг Ксилазина 50 мг/кг (и.п.) чтобы анестезировать guinea pig для сердечной cryoinjury4. Мы также оценили этот полк анестезии. Одним из недостатков является тот факт, что это невозможно приостановить наркотических эффект Ксилазина и кетамин из-за пропавшего мощным противоядием. Учитывая, что морские свинки на высокий риск гипогликемии во время хирургических процедур, мы решили использовать наркотические газ, действие которого легко контроля и поэтому приводит к очень короткое обезболивающее восстановительного этапа. Трахеостомия используется для обеспечения безопасных вентиляционные во всей процедуре. Оро-интубация является технически очень требовательных в морских свинок, как визуализация открытия трахеи часто является сложным и не может быть гарантировано безопасное интубации.
Хотя крио травмы вызывает серьезные повреждения миокарда она точно не зеркало коронарной болезни / инфаркт миокарда в организме человека. В этом отношении лигирование лад или даже модель травмы ишемии реперфузии более тесно резюмирует человека патофизиологии. Однако коронарной анатомии в морских свинок характеризуется обширной обеспечение. Таким образом перевязка левой передней нисходящей коронарной артерии не результат можно воспроизвести в больших миокарда травм в морских свинок12,13. ЛАД перевязка мышей и крыс приводит к обширной реконструкции и в конечном итоге истончение передней стенки, характерно, что не видел в людях этой степени. Свинка крио травмы модель индуцирует процессы ремоделирования и истончение стенок желудочков, но до такой степени, что больше напоминает миокарда травмы, видели в организме человека. Таким образом модель cryoinjury, что приводит к более надежной миокардиального ушиба был выбран13. Periprocedural смертность является одной из основных проблем с этой моделью. Первоначально около 30% животных погибли во время первой операции или в течение 7 дней после травмы сердца. Еще 30% умер во время учета EHT имплантации для общей смертности на 60%. Несколько изменения приводят к значительным снижением смертности. Изофлюрановая вызывает тяжелые слюноотделение и бронхиальную секрецию. Атропин уменьшает бронхиальную секрецию и является важным фактором для снижения смертности. Второй фактор, сильно уменьшилась смертность является использование паяльник выпустить холодное металлическим штампом из сердца. Теплая вода изначально предназначался для отсоединения отметку от миокарда. Однако было трудно удалить воду из грудной полости. Остальные воды отрицательно сказалось на дыхание и привести к развитию сцепления, что ухудшило прогноз animal´s. Другой модификации, которые положительно повлияли на процедура была защита левого легкого от холодной металлическим штампом с компресс. После того, как эти изменения были реализовано смертности снизился до ~ 20% для операции сердца травмы (включая первую неделю послеоперационных) и еще 25% EHT трансплантации. Индукции крио травмы представляет технически проще операцию и последовательной результаты могут быть достигнуты после 5-10 животных действовали под наблюдением. EHT-трансплантация является более требовательным и около 20 операций под руководством рекомендуются до тех пор, пока можно получить воспроизводимые результаты.
В начале, мы использовали теплого физиологического раствора для полоскания сердце и, следовательно, отсоединить замороженных зонд из стенке левого желудочка. Эта процедура проще в обращении, но несколько миллилитров физраствора остаются в грудной клетке, увеличивая риск развития дыхательной недостаточности.
В заключение изображены морской свинки модель воспроизводимость, недорогой и приводит к последовательные результаты. Трансторакальная эхокардиография предлагает осуществимым и неинвазивные инструмент для оценки присутствия сердца травмы перед повторной операции и трансплантата имплантация производится.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Никто из авторов имеет конкурирующих финансовых интересов или другие конфликты интересов объявить.
Acknowledgments
Финансирование не было получено для этого исследования
Materials
| Name | Company | Catalog Number | Comments |
| Ventilator (VetFlo Dual Mode) | Kent Scientific | ||
| Forene | abbvie | 1000009819 | |
| Carprofen | Zoetis | 256692 | |
| Atropin | Braun | PZN 00648037 | |
| Buprenorphin | Sigma | ||
| Metal stamp | |||
| Electric soldering iron | Claytools | ||
| 3-0 prolene suture | Ethicon | ||
| 4-0 prolene suture | Ethicon | 662SLH | |
| 5-0 prolene suture | Ethicon | 8710H | |
| 8-0 prolene suture | Ethicon | 8841H | |
| Tungsten Carbide Scissor | FST | No. 14568-12 | |
| Stainless sterilization Container | FST | No. 20890-51 | |
| Graefe Forceps | FST | No.11652-10 | |
| Extra fine Graefe Forceps | FST | No.11150-10 | |
| Forceps | FST | No. 11022-15 | |
| Halsted- Mosquito | FST | No. 13009-12 | |
| Forceps | FST | No.13003-10 | |
| Baby Mixter | FST | No. 13013-14 | |
| Needle holder (Castroviejo with Tungsten Casbide Jaws) | FST | No. 12565-14 | |
| Needle Holder (Halsey) | FST | No. 12501-13 | |
| Alm Retractor with Blumt Teeth | FST | No. 17008-07 | |
| Spring Scissor | FST | No. 15000-00 | |
| Compress 5x5 | Fink + Walter | PZN 08821417 | |
| Venflon Pro Safety | Becton Dickinson | PZN11123964 | |
| Cautery High Temp 2" | Bovie Medical Corporation | 0100607151011055 |
References
- Kirklin, J. K., et al. Seventh INTERMACS annual report: 15,000 patients and counting. The Journal of heart and lung transplantation: the official publication of the International Society for Heart Transplantation. 34, 1495-1504 (2015).
- Soonpaa, M. H., Field, L. J. Survey of studies examining mammalian cardiomyocyte DNA synthesis. Circulation research. 83, 15-26 (1998).
- Shiba, Y., Hauch, K. D., Laflamme, M. A. Cardiac applications for human pluripotent stem cells. Current pharmaceutical design. 15, 2791-2806 (2009).
- Shiba, Y., et al. Human ES-cell-derived cardiomyocytes electrically couple and suppress arrhythmias in injured hearts. Nature. 489, 322-325 (2012).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510, 273-277 (2014).
- Kattman, S. J., et al. Stage-specific optimization of activin/nodal and BMP signaling promotes cardiac differentiation of mouse and human pluripotent stem cell lines. Cell stem cell. 8, 228-240 (2011).
- Watanabe, T., Rautaharju, P. M., McDonald, T. F. Ventricular action potentials, ventricular extracellular potentials, and the ECG of guinea pig. Circulation research. 57, 362-373 (1985).
- Weinberger, F., et al. Cardiac repair in guinea pigs with human engineered heart tissue from induced pluripotent stem cells. Science translational medicine. 8, 363ra148 (2016).
- Shiba, Y., et al. Electrical Integration of Human Embryonic Stem Cell-Derived Cardiomyocytes in a Guinea Pig Chronic Infarct Model. Journal of Cardiovascular Pharmacology and Therapy. 19, 368-381 (2014).
- van Laake, L. W., et al. Human embryonic stem cell-derived cardiomyocytes survive and mature in the mouse heart and transiently improve function after myocardial infarction. Stem cell research. 1, 9-24 (2007).
- Zimmermann, W. H., et al. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature medicine. 12, 452-458 (2006).
- Johns, T. N., Olson, B. J. Experimental myocardial infarction. I. A method of coronary occlusion in small animals. Annals of surgery. 140, 675-682 (1954).
- van den Bos, E. J., Mees, B. M., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. Heart and circulatory physiology. , H1291-H1300 (2005).



