Summary
Her presenterer vi en protokoll for induksjon av venstre ventrikkel cryoinjury etterfulgt av implantering av en Hjertemuskel patch, avledet fra menneskelige iPS-celle cardiomyocytes i en guinea gris modell.
Abstract
På grunn av begrenset gjenfødelse kapasitet på hjertet i voksen pattedyr, hjerteinfarkt resultater i en permanent tap av cardiomyocytes. Dette tapet av relevante mengder hjertemuskelen masse kan føre til hjerte svikt. Foruten hjertet transplantasjon er det ingen helbredende behandlingsalternativet for sluttstadiet hjertesvikt. I tider med orgel donor mangel, er orgel uavhengig behandlingsmetoder nødvendig. Venstre ventrikkel bistå enheter er en lovende behandling alternativet, men spesielt som mål terapi, begrenset av bivirkninger som slag, infeksjoner og bleedings. De siste årene, har flere cellebiologi strategier inkludert stamcelleforskningen injeksjon, hjerte progenitors eller hjerteinfarkt tissue engineering blitt undersøkt. Siste forbedringer i cellebiologi tillate differensiering av store mengder cardiomyocytes avledet fra menneskelige indusert pluripotent stamceller (iPSC). En av de cellebiologi strategiene for tiden under evaluering er å transplantere kunstig hjerte vev. Foretatt hjertet vev (EHT) er en tredimensjonal i vitro opprettet cardiomyocyte nettverket, med funksjonelle egenskaper av innfødte hjertet vev. Vi har opprettet EHT-flekker hiPSC avledet cardiomyocytes. Her presenterer vi en protokoll for induksjon av venstre ventrikkel hjerteinfarkt cryoinjury i et marsvin, etterfulgt av implantasjon av hiPSC avledet EHT på den venstre ventrikkel veggen.
Introduction
Antall pasienter med hjertesvikt øker i våre aldrende befolkning. For sluttstadiet hjertesvikt er orthotopic hjertet transplantasjon alternativet bare helbredende behandling. Men særlig i europeiske land er det en økende orgel donor mangel. Derfor er alternative behandlingstilbud nødvendig. Nylige prestasjoner i mekanisk sirkulasjons støtte er lovende, men særlig på lang sikt kjøre, begrenset av bivirkninger som blødning, pumpe blodpropp og smittsomme komplikasjoner1.
Endogene gjenfødelse kapasitet voksen menneskehjertet er svært begrenset. Cardiac regenerasjon terapi kan derfor bli et alternativ behandlingsalternativ for sluttstadiet hjertesvikt pasienter2,3. Ulike teknikker inkludert stilk cellen-basert celle injeksjon eller vev engineering tilnærminger har vært beskrevet3,4,5.
Menneskelige indusert pluripotent stamceller (hiPSC), samt menneskelige embryonale stamceller (hESC) kan differensieres effektivt å spontant slo menneskelige cardiomyocytes6, som har vært en stor prestasjon i feltet av cardiac regenerativ terapier.
Erstatte myokard etter et hjerteinfarkt og forbedre funksjonen av et sviktende hjerte, er overlevelse av et passende antall cardiomyocytes og deres mekaniske og elektriske kobling med innfødt hjertet viktig. Undersøke potensialet i cardiac regenerativ Therapy med menneskelige iPS celle avledet cardiomyocytes, kreves en passende forskning modell. Den ideelle modellen bør være kostnadseffektivt og har menneskelignende fysiologi og elektrofysiologi. Store dyr modeller som griser ville være ideelt fra dette synspunkt, men disse eksperimentene er svært dyrt og store mengder cardiomyocytes ville være nødvendig å erstatte en relevant rekke cardiomyocytes for å se til venstre ventrikkel funksjonen i en gris hjerteinfarkt modell.
For å svare elementære biologiske spørsmål mot menneskelig cellebasert cardiac gjenfødelse, f.eks er celle overlevelse, endometrial blodkar og elektriske kobling, små dyr modeller mer egnet. Fra de tilgjengelige lite dyr modellene er marsvin nyttigst arter, sammenlignet med rotter og mus, som deres elektrofysiologi mer ligner situasjonen i mennesker7. I denne marsvin modellen fikk vi en transmuralt cryoinjury av venstre ventrikkel. En uke etter induksjon av hjerteinfarkt implantering av en tredimensjonal, ble spontant slo hiPS-cellers avledet cardiomyocyte oppdateringen utført. Cardiomyocyte celle overlevelse ble evaluert 28 dager etter implantasjon av histologiske eksamen.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Dyr mottatt Human omsorg i samsvar med veiledningen for prinsipper i forsøksdyr, utarbeidet av Institute of laboratorium dyr Resources og publisert av National Institutes of Health. Alle dyr protokoller ble godkjent av ansvarlige lokale myndigheter ('' Amt für Gesundheit und Verbraucherschutz, Hansestadt Hamburg'' / dyr protokollen # 109/16).
1. få dyr
- Kommersielt få kvinnelige marsvin veiing 500-600 g.
- Huset seg under vanlige forhold i dyr burene. Mate standard rotte chow og autoklaveres vann ad libidum.
2. transthoracic Echocardiography
- Plasser marsvin i en induksjon kammer og bedøve dyret med isoflurane (2-3%). Sjekk dybden på anestesi av mangel på respons på tå-klemme.
- Plass bedøvet marsvin på en oppvarming plattform (40-42 ° C) i supine posisjon. Fortsette anestesi via en nesen membran (isoflurane 1.5-2%)
- Barbere og epilere meg guinea pig´s thorax bruker en elektrisk dyrehår barbermaskin.
- Bruke prewarmed (~ 25 ° C) ultralyd svinger gel. Bruk et echocardiography system som er utstyrt med en transducer frekvens høyere enn 15 MHz.
- Erverve todimensjonal parasternal lange aksen visninger ved å plassere svingeren på guinea´s gris thorax overfor fra halsen og høyre mot venstre ben og registrere lange aksen B-bilder på flyet aortic ventilen med en samtidige visualisering av LV apex. Undersøke pre-operative venstre ventrikkel funksjonen.
- Slå svingeren 90° grader å få utsikt kort aksen B-modus på midt-papillary nivå.
Merk: Dyret er da umiddelbart overført til tabellen OR. Dyret er kontinuerlig anesthetized med 3% isoflurane. 0,05 mg/kg atropin (IM) injiseres for å unngå økte bronkial sekret under mekanisk ventilasjon.
3. kirurgi
-
Induksjon av hjerteinfarkt
- Injisere 4 – 5 mg/kg carprofen og 0,05 mg/kg buprenorfin for analgesi subcutaneously med en 21 G nål og 10 mL sprøyte. 0,5 mg/kg atropin injiseres subcutaneously med en 21 G nål og 10 mL sprøyte.
- Plasser marsvin på ryggen og holde anestesi med en ansiktsmaske dekker munn og nese. Sjekk dybden på anestesi ved pinching bakben feet (mangel på pedal refleks).
- Spre marsvin ben og fastsette posisjonen med tape.
- Barbere brystet og tracheal regionen bedøvet dyret med en elektrisk barbermaskin. Desinfiser området mye med jod-baserte scrub, etterfulgt av 80% etanol. Gjenta denne desinfeksjon to ganger.
- Utfør en 1,5 cm loddrett snitt i tracheal området og rett ut dissekere musklene dekker luftrøret til luftrøret. Punktering luftrøret med 18 G IV kanyle og sett den fleksible delen av kanyle som en tracheal rør.
- Koble tracheal røret til en dyr respirator for å ventilere kontinuerlig marsvin under prosedyren.
Merk: Nå av bedøvelsen opprettholdes med isoflurane 3% via tracheal røret (inspirasjon assistert ventilasjon med maksimal inspirasjon press, pustefrekvens: 100-120/min, topp inspirasjon trykket: 18-22 cm Hg med PEEP-ventilasjon mens brystet er åpen ). - Identifisere den 5th interkostalrom plassen ved å telle ribben områdene begynner på den første interkostalrom plassen. Utføre en 2 cm vannrett snitt på 5 interkostalrom plass til venstre i marsvin saks og en tweezer. Sette inn en liten dyr festepunkt. Dissekere muskler med en electrocautery til interkostalrom musklene er nådd, som kan sees etter fjerning av subkutant vev, er nådd.
- Forsiktig dissekere interkostalrom muskler med pinsett til pleural plass er nådd, og man kan se venstre lunge foran. Sett inn festepunkt mellom ribbeina og åpne den nøye til en god utsikt over hjertet er oppnådd.
- Åpne pericardium ca 1 cm i regionen i den fremre venstre ventrikkel veggen med saks. Plass en komprimere på venstre lungene for å beskytte den mot skade når indusere cryoinjury av venstre ventrikkel.
- Plass tuppen av et svekket metall stempel (aluminium) med en cross-sectional diameter på 0,5 cm i flytende nitrogen i 3 minutter.
- Trykk nitrogen avkjølt sonde på venstre fremre veggen av hjertet for 30 s. Så Skill den fra hjertet med en elektrisk loddebolt (250 ° C) som er plassert inne stempel å varme den opp. Gjenta denne fremgangsmåten 3 ganger for å skaffe en transmuralt hjerteinfarkt skade. Observere blanchering i myokard.
- Blåse lungene ved maksimalt trykk (ved clamping utløp tube ventilen for 2 s), for å unngå atelectasis av lunge. Fjerne festepunkt fra interkostalrom plass.
- Lukk ribbeina med to 3-0 suturer. Lukk musklene over ribbeina med en 4-0 kjøre Sutur. Bruke 5-0 Sutur enkelt masker nedleggelsen av huden.
- Redusere isoflurane 1%. Når Dyret er åndedrag spontant, fjerne tracheal røret og fortsette anestesi med en ansiktsmaske (isoflurane 2-3%).
- Sikre fravær av reflekser ved pinching hind lem å overvåke tilstrekkelig dybde av anestesi. Deretter Bruk en enkelt 8-0 Sutur lukke punktering stedet luftrøret. Lukke såret med tre enkelt stich 4-0 suturer.
- Bruk buprenorfin (0,05 mg/kg per 12t) og carprofen (5 mg/kg 24 timer) for smerte medisiner for følgende 5 dager.
-
Implantering av EHT (7 dager etter cryoinjury)
- Plasser marsvin i en induksjon kammer og bedøve dyret med isoflurane sjekk dybden av anestesi for svar på tå-klemme.
- Injisere 4 – 5 mg/kg carprofen og 0,05 mg/kg buprenorfin subcutaneously med en 21 G nål og 10 mL sprøyte etter innledningen av anestesi. Plasser marsvin på ryggen og holde anestesi med en ansiktsmaske dekker munn og nese.
Merk: Tilstrekkelighet av anestesi bør kontrolleres ved pinching bakben feet. - Spre marsvin ben og fastsette posisjonen med tape.
- Utfør pre kirurgisk forberedelsene som beskrevet i trinn 3.1.4–3.1.6. Utføre en 2 cm vannrett huden snitt innen arr venstre lateral side ved hjelp av saks og pinsett.
- Forsiktig dissekere extrapleural adhesjon ved hjelp av en electrocautery. Nøye åpne pleural plass med saks. Sett inn en vrbord sprederen å avsløre hjertet.
- Visuelt Identifiser regionen infarkt ved bleke fargen i forhold til sunn omkringliggende myokard. Plass utviklet hjertet vev oppdateringen over regionen hjerteinfarkt.
- Fest den med to 8-0 suturer på begge sider. Pass på å sikre oppdateringen i ikke-infarcted-området i hjertet (figur 1). Blåse opp lungene med trykk for å unngå atelectasis av lunge. Fjerne festepunkt fra interkostalrom plass.
- Lukk ribbeina med to 3-0 suturer. Lukk musklene over ribbeina med en 4-0 kjøre Sutur. Bruke 5-0 Sutur enkelt masker nedleggelsen av huden.
- Redusere isoflurane 1%. Når Dyret er åndedrag spontant, fjerne tracheal røret og fortsette anestesi med en ansiktsmaske (isoflurane 2-3%).
- Sikre fravær av reflekser ved pinching hind lem å overvåke tilstrekkelig dybde av anestesi. Deretter Bruk en enkelt 8-0 Sutur lukke punktering stedet luftrøret. Lukke såret med tre enkle sy 4-0 suturer.
- Bruk buprenorfin (0,05 mg/kg per 12t) og carprofen (5 mg/kg 24 timer) for smerte medisiner for følgende 5 dager.
- Fire uker etter EHT implantasjon utføre en transthoracic echocardiography (som beskrevet i trinn 2) for å overvåke LV funksjonen over tid.
Merk: Funksjonen LV overvåkes før EHT implantasjon og 4 uker etter implantasjon overvåke for forbedring av hjertefunksjon av EHT implantasjon - Euthanize dyret hvilken protokoll du IACUC godkjent og kirurgisk explant hjertet for videre analyse.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Denne marsvin modellen er en passende modell å undersøke cardiac regenerering etter implantasjon av hiPSC avledet EHT-patcher. Reproduserbar fører til store transmuralt hjerteinfarkt skader. Arr størrelse vurderes ved histology fire uker etter cryoinjury. Mason trichrome flekker avslører stor transmuralt arr (figur 2). Arr størrelse var likt over et stort antall skadde dyr reflekterer en høy grad av reproduserbarhet8. Gjennomsnittlig ble 25% av venstre ventrikkel myokard erstattet av arrvev. Dystrophin flekker vist store hjerteinfarkt grafts som delvis remuscularized arret (figur 3a). Flekker for menneskelig Ku80 viste menneskelige opprinnelsen til denne nyopprettede myokard (figur 3b). Høyere forstørrelse avslørte at disse grafts besto av tett pakket myocytter. Venstre ventrikkel funksjonen var overvåket med transthoracic echocardiography. En vellykket EHT implantasjon er preget av en forbedring i LVEF, Fractional området forkorte og en nedgang i venstre ventrikkel ende-diastolisk diameter (Figur 4).
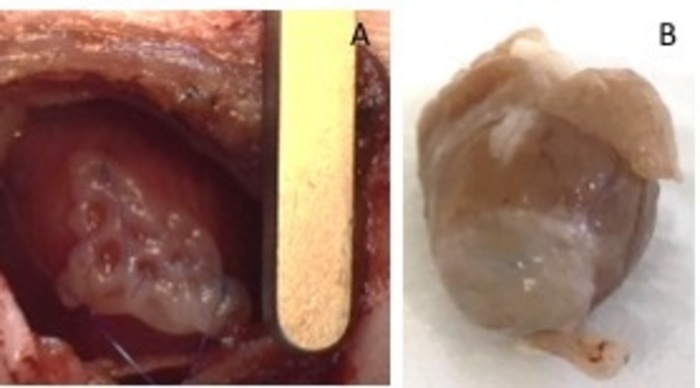
Figur 1: hEHT-patcher etter implantasjon. (A) oppdateringen umiddelbart etter implantasjon. (B) Patch fire uker etter implantasjon. Klikk her for å se en større versjon av dette tallet.
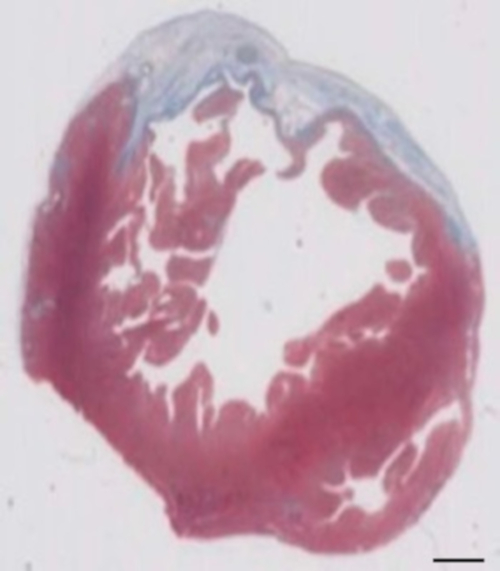
Figur 2: bestemmelse av hjerteinfarkt på Masson er trichrome farget parafin delen 28 dager etter cryoinjury. Infarkt bestemmes av den blå fargen i Masson's trichrome flekker, som representerer fibrotiske vev. Skala bar = 2 mm. Klikk her for å se en større versjon av dette tallet.
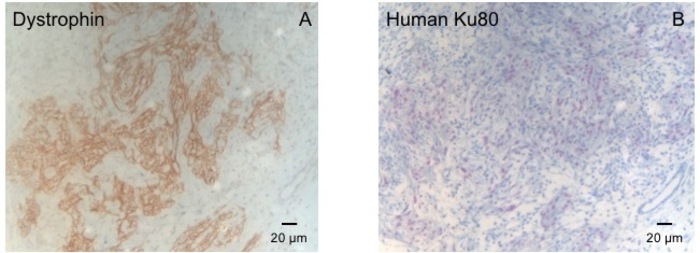
Figur 3: flekker med Dystrophin og menneskelig Ku80. (A) Dystrophin farging viser store muskel øyene (brun) i området arr (B) Ku flekker av parafin delt hjerte. Ku-80 er et menneske-spesifikke antistoff. Derfor er positivt farget cellene (brun farge) fra menneskelige opprinnelse. Klikk her for å se en større versjon av dette tallet.
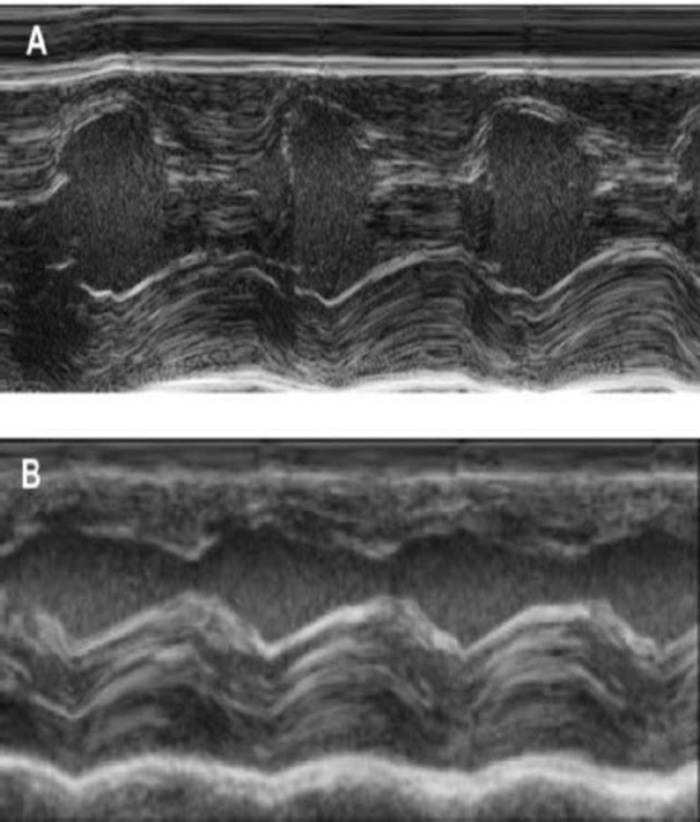
Figur 4: M-modus måling av venstre ventrikkel bruker transthoracic echocardiography. (A) ved baseline og (B) en uke etter cryoinjury. (IVS: Intraventricular septum, LV: venstre ventrikkel, PW: bakre vegg). Mål utføres 3 ganger. Ved baseline, 1 uke etter cryoinfarction og 4 uker etter EHT implantasjon Klikk her for å se en større versjon av dette tallet.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
En rekke små dyr modeller er tilgjengelig å studere effekten som cellen transplantasjon utøver på skadde hjerter9,10,11. Vi valgte et marsvin modell på grunn av alle små dyr modeller sin (elektro) fysiologi ligner mest for mennesker. Fordelene av små dyr modeller er enkle boliger, håndterbare kostnader og få arbeidsstokken. Med mus og rotter er guinea pigs´ hjerte (elektro) fysiologi mer lik mennesker. Spesielt hjerte frekvens er lavere (~250/min), ventrikkel handling potensielle viser en platå fase og kalium gjeldende jegkr er viktig for repolarisasjon7. Videre, den større størrelsen på dyrene forenkler operasjoner, som er spesielt viktig som en re-thoracotomy er nødvendig en uke etter induksjon av skade. Marsvin er imidlertid følsomme for anestesi krever litt erfaring.
Shiba et al., beskrevet bruk av 50 mg/kg ketamin og 2 mg/kg xylazine (IP) til å bedøve marsvin for hjerte cryoinjury4. Vi har også vurdert denne anestesi regiment. En av ulempene er at det er umulig å stoppe den narkotisk effekten av xylazine og ketamin på grunn av manglende potente motgift. Tatt i betraktning at marsvin er høy risiko for hypoglykemi under kirurgiske prosedyrer, besluttet vi å bruke en narkotisk gass effekten er lett å kontrollere og derfor føre til en svært kort bedøvende restitusjonsfasen. En trakeotomi brukes til å sikre en trygg ventilasjon i hele denne prosedyren. En oro-tracheal intubasjon er teknisk svært krevende i marsvin, som visualisering av åpningen av luftrøret er vanskelig og en trygg intubasjon kan ikke garanteres.
Selv om cryo-skade induserer en alvorlig hjerteinfarkt skade det ikke nøyaktig gjenspeile en koronarsykdom / hjerteinfarkt hos mennesker. I denne forbindelse viser ligation av GUTTEN eller selv ischemia-reperfusion skade modellen mer nært den menneskelige patofysiologien. Imidlertid er koronar anatomien i marsvin preget av en omfattende collateralization. Derfor resultere en ligation av venstre fremre synkende koronar ikke reproduserbar i store hjerteinfarkt skader i marsvin12,13. GUTTEN-ligatur i mus og rotter fører til en omfattende ombygging og til slutt fortynning av fremre veggen, en egenskap som ikke er sett i mennesker i denne grad. Marsvin cryo-skade modellen induserer remodeling prosesser og tynning ventrikkel veggen, men grad, som mer ligner et hjerteinfarkt skade sett hos mennesker. Derfor ble en cryoinjury modell som resulterer i en mer pålitelig hjerteinfarkt skade valgt13. Periprocedural dødelighet er et stort problem med denne modellen. I utgangspunktet ca 30% av dyrene døde under den første operasjonen eller innen 7 dager etter hjertestans skade. En annen 30% døde under EHT implantasjon regnskap for en Total dødelighet på 60%. Flere endringer føre til en betydelig nedgang i dødelighet. Isoflurane induserer tunge spyttsekresjon og bronkial sekret. Atropin reduserer bronkial sekret og var en viktig faktor å redusere dødelighet. Den andre faktoren som sterkt redusert dødelighet er bruken av en loddebolt å løslate kaldt metall stempel fra hjertet. Varmt vann ble opprinnelig brukt koble stempel fra myokard. Men var det vanskelig å fjerne vannet fra bryst hulrom. Gjenværende vann negativt påvirket åndedrett og føre til utvikling av vedheft som forverret animal´s prognosen. En annen endring som positivt påvirket prosedyren var beskyttelse av venstre lunge fra kaldt metall stempel med en komprimere. Etter at disse endringene ble implementert dødeligheten falt til ~ 20% for hjertestans skade operasjonen (inkludert den første postoperative uken) og en annen 25% for EHT transplantasjon. Induksjon av cryo skade representerer den teknisk enklere driften og konsistente resultater kan oppnås etter 5-10 dyrene ha blitt operert under tilsyn. EHT-transplantasjon er mer krevende og 20 operasjoner under tilsyn anbefales til reproduserbar resultater kan oppnås.
I begynnelsen brukte vi varmt saltvann å rense hjertet, og derfor ta frosne sonden fra venstre ventrikkel veggen. Denne prosedyren er lettere å håndtere, men noen ml saltoppløsning forblir i thorax øker risikoen for respirasjonssvikt.
Avslutningsvis avbildet marsvin modellen er reproduserbare, billig og fører til konsistente resultater. Transthoracic echocardiography tilbyr et mulig og ikke-invasiv verktøy for å evaluere tilstedeværelsen av hjertestans skade før nytt og pode-implantasjon utføres.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Ingen av forfatterne har konkurrerende økonomiske interesser eller andre interessekonflikter å erklære.
Acknowledgments
Finansiering ble mottatt for denne studien
Materials
| Name | Company | Catalog Number | Comments |
| Ventilator (VetFlo Dual Mode) | Kent Scientific | ||
| Forene | abbvie | 1000009819 | |
| Carprofen | Zoetis | 256692 | |
| Atropin | Braun | PZN 00648037 | |
| Buprenorphin | Sigma | ||
| Metal stamp | |||
| Electric soldering iron | Claytools | ||
| 3-0 prolene suture | Ethicon | ||
| 4-0 prolene suture | Ethicon | 662SLH | |
| 5-0 prolene suture | Ethicon | 8710H | |
| 8-0 prolene suture | Ethicon | 8841H | |
| Tungsten Carbide Scissor | FST | No. 14568-12 | |
| Stainless sterilization Container | FST | No. 20890-51 | |
| Graefe Forceps | FST | No.11652-10 | |
| Extra fine Graefe Forceps | FST | No.11150-10 | |
| Forceps | FST | No. 11022-15 | |
| Halsted- Mosquito | FST | No. 13009-12 | |
| Forceps | FST | No.13003-10 | |
| Baby Mixter | FST | No. 13013-14 | |
| Needle holder (Castroviejo with Tungsten Casbide Jaws) | FST | No. 12565-14 | |
| Needle Holder (Halsey) | FST | No. 12501-13 | |
| Alm Retractor with Blumt Teeth | FST | No. 17008-07 | |
| Spring Scissor | FST | No. 15000-00 | |
| Compress 5x5 | Fink + Walter | PZN 08821417 | |
| Venflon Pro Safety | Becton Dickinson | PZN11123964 | |
| Cautery High Temp 2" | Bovie Medical Corporation | 0100607151011055 |
References
- Kirklin, J. K., et al. Seventh INTERMACS annual report: 15,000 patients and counting. The Journal of heart and lung transplantation: the official publication of the International Society for Heart Transplantation. 34, 1495-1504 (2015).
- Soonpaa, M. H., Field, L. J. Survey of studies examining mammalian cardiomyocyte DNA synthesis. Circulation research. 83, 15-26 (1998).
- Shiba, Y., Hauch, K. D., Laflamme, M. A. Cardiac applications for human pluripotent stem cells. Current pharmaceutical design. 15, 2791-2806 (2009).
- Shiba, Y., et al. Human ES-cell-derived cardiomyocytes electrically couple and suppress arrhythmias in injured hearts. Nature. 489, 322-325 (2012).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510, 273-277 (2014).
- Kattman, S. J., et al. Stage-specific optimization of activin/nodal and BMP signaling promotes cardiac differentiation of mouse and human pluripotent stem cell lines. Cell stem cell. 8, 228-240 (2011).
- Watanabe, T., Rautaharju, P. M., McDonald, T. F. Ventricular action potentials, ventricular extracellular potentials, and the ECG of guinea pig. Circulation research. 57, 362-373 (1985).
- Weinberger, F., et al. Cardiac repair in guinea pigs with human engineered heart tissue from induced pluripotent stem cells. Science translational medicine. 8, 363ra148 (2016).
- Shiba, Y., et al. Electrical Integration of Human Embryonic Stem Cell-Derived Cardiomyocytes in a Guinea Pig Chronic Infarct Model. Journal of Cardiovascular Pharmacology and Therapy. 19, 368-381 (2014).
- van Laake, L. W., et al. Human embryonic stem cell-derived cardiomyocytes survive and mature in the mouse heart and transiently improve function after myocardial infarction. Stem cell research. 1, 9-24 (2007).
- Zimmermann, W. H., et al. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature medicine. 12, 452-458 (2006).
- Johns, T. N., Olson, B. J. Experimental myocardial infarction. I. A method of coronary occlusion in small animals. Annals of surgery. 140, 675-682 (1954).
- van den Bos, E. J., Mees, B. M., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. Heart and circulatory physiology. , H1291-H1300 (2005).



