Summary
Qui presentiamo un protocollo per l'induzione di cryoinjury ventricolare sinistra seguita dall'impianto di una patch di muscolo cardiaco, derivata da cardiomiociti iPS-cellula umana in un modello della cavia.
Abstract
A causa della capacità limitata rigenerazione del cuore nei mammiferi adulti, infarto del miocardio provoca una perdita irreversibile dei cardiomiociti. Questa perdita di rilevanti quantità di muscolo cardiaco massa può condurre a guasto di cuore. Oltre a trapianto del cuore, non esiste alcuna opzione di trattamento curativo per l'infarto di stadio finale. In tempi di carenza di donatori di organi, le modalità di trattamento indipendente di organo sono necessari. Dispositivi di assistenza ventricolare sinistra sono un'opzione di terapia promettente, tuttavia, soprattutto come terapia di destinazione, limitata dai suoi effetti collaterali come colpo, infezioni ed emorragie. Negli ultimi anni, sono state studiate diverse strategie di riparazione cardiaca tra cui iniezione di cellule staminali, progenitori cardiaci o ingegneria del tessuto del miocardio. Recenti miglioramenti nella biologia cellulare consentono la differenziazione di grandi quantità di cardiomiociti derivati da cellule staminali umane pluripotenti indotte (iPSC). Una delle strategie di riparazione cardiaca attualmente in corso di valutazione è quello del trapianto di tessuto cardiaco artificiale. Tessuto cardiaco ingegnerizzato (EHT) è una rete tridimensionale del cardiomyocyte creato in vitro, con proprietà funzionali del tessuto cardiaco nativo. Abbiamo creato EHT-patches da cardiomiociti hiPSC derivato. Qui presentiamo un protocollo per l'induzione di cryoinjury del miocardio ventricolare sinistro in una cavia, seguita da impianto di hiPSC derivati EHT sulla parete ventricolare sinistra.
Introduction
Il numero di pazienti con insufficienza cardiaca è in aumento nella nostra popolazione di invecchiamento. Per l'infarto di stadio finale, trapianto orthotopic del cuore è l'opzione di solo trattamento curativo. Tuttavia, specialmente nei paesi europei, c'è una crescente carenza di donatori di organi. Di conseguenza, le opzioni alternative di trattamento sono necessari. Recenti risultati in supporto circolatorio meccanico sono promettenti, ma soprattutto a lungo termine eseguire, limitato dai suoi effetti collaterali come emorragie, trombosi pompa e le complicazioni contagiose1.
La capacità di rigenerazione endogena del cuore umano adulto è estremamente limitata. Di conseguenza, terapie di rigenerazione cardiaca potrebbero diventare un'opzione terapeutica alternativa per stadio finale insufficienza cardiaca i pazienti2,3. Diverse tecniche tra cui iniezione basata su cellule staminali delle cellule o tessuti ingegneria approcci sono stati descritti3,4,5.
Cellule staminali umane pluripotenti indotte (hiPSC), come pure le cellule staminali embrionali umane (hESC) possono essere differenziati in modo efficace a spontaneamente battendo cardiomyocytes umano6, che è stato un risultato importante nel campo di cardiaco rigenerativa terapie.
Per sostituire il miocardio dopo un infarto miocardico e migliorare la funzione di un cuore di venire a mancare, la sopravvivenza di un numero adeguato di cardiomiociti e loro accoppiamento meccanico ed elettrico con cuore Natale è essenziale. Per studiare il potenziale delle terapie rigenerative cardiache con cardiomiociti su cellule umane iPS, è necessario un modello di ricerca adatto. Il modello ideale dovrebbe essere conveniente e hanno una fisiologia umana-come ed elettrofisiologia. Grandi modelli animali come maiali sarebbe l'ideale da questo punto di vista, tuttavia, tali esperimenti sono molto costosi e grandi quantità di cardiomiociti sarebbe necessario sostituire un numero rilevante di cardiomiociti per vedere gli effetti sulla sinistra ventricolare funzione in un modello di infarto di maiale.
Per rispondere a domande elementari biologiche verso rigenerazione cardiaca basati su cellule umane, ad esempio, la sopravvivenza delle cellule, vascolarizzazione e accoppiamento elettrico, modelli animali piccoli sono più adatti. Da disponibili modelli animali piccoli, la cavia è la specie più utile, rispetto ai ratti e topi, come loro elettrofisiologia assomiglia più da vicino la situazione in esseri umani7. In questo modello di cavia, abbiamo indotto un cryoinjury transmurale del ventricolo sinistro. Una settimana dopo l'induzione dell'infarto miocardico l'impianto di un tridimensionale, spontaneamente battendo fianchi-cellule derivate del cardiomyocyte zona è stata effettuata. Sopravvivenza delle cellule del cardiomyocyte è stata valutata 28 giorni dopo l'impianto da esame istologico.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Animali ha ricevuto un'assistenza umana in conformità con la guida per i principi di animali da laboratorio, preparato da Istituto di laboratorio animale risorse e pubblicato da National Institutes of Health. Tutti i protocolli di animali sono stati approvati dall'autorità locale responsabile (' Amt für Gesundheit und Verbraucherschutz, Hansestadt Hamburg ' / animali protocollo n. 109/16).
1. ottenere animali
- Commercialmente ottenere cavie femmina pesa 500 – 600 g.
- Casa loro condizioni convenzionali in gabbie per animali. Alimentazione cibo standard del ratto e sterilizzato nell'autoclave acqua ad libidum.
2. ecocardiogramma transtoracico
- Posizionare la cavia in un aula di induzione e anestetizzare l'animale con isoflurano (2 – 3%). Controllare la profondità dell'anestesia da mancanza di risposta per il punta-pizzico.
- Posizionare la cavia anestetizzati su una piattaforma di riscaldamento (40 – 42 ° C) in posizione supina. Continuare l'anestesia tramite un cono di naso (isoflurane 1.5-2%)
- Depilare il torace pig´s guinea utilizzando un rasoio elettrico animale capelli e la barba.
- Applicare gel di trasduttore di ultrasuoni preriscaldata (~ 25 ° C). Utilizzare un sistema di ecocardiografia che è attrezzato con una frequenza di trasduttore superiore a 15 MHz.
- Acquisire viste di bidimensionale parasternale asse lungo posizionando il trasduttore sul torace di maiale guinea´s fronte dal collo destro verso la gamba sinistra e record lungo asse B-mode immagini sul piano della valvola aortica con una visualizzazione simultanea dell'apex LV. Studiare la funzione ventricolare sinistra pre-operative.
- Girare il trasduttore di 90° gradi per ottenere una breve asse B-modalità a livello di metà-papillare.
Nota: L'animale viene poi immediatamente trasferito alla tabella OR. L'animale è continuamente anestetizzato con 3% isoflurane. L'atropina 0,05 mg/kg (i.m.) viene iniettato per evitare l'aumento della secrezione bronchiale durante la ventilazione meccanica.
3. chirurgia
-
Induzione dell'infarto miocardico
- Iniettare per via sottocutanea carprofen 4 – 5 mg/kg e buprenorfina 0,05 mg/kg per analgesia con un ago 21 G e una siringa da 10 mL. 0,5 mg/kg dell'atropina è iniettato per via sottocutanea con un ago 21 G e una siringa da 10 mL.
- Posizionare la cavia sul dorso e mantenere l'anestesia con una facciale che ricopre il naso e bocca. Controllare la profondità dell'anestesia pizzicando le zampe posteriori (mancanza di riflesso pedale).
- Diffondere le gambe dei porcellini d'India e fissare la posizione con del nastro.
- Radere il torace e la regione trachea dell'animale anestetizzato con un rasoio elettrico. Disinfettare la zona ampiamente utilizzando scrub iodato, seguita da 80% di etanolo. Ripetere due volte questa procedura di disinfezione.
- Eseguire un'incisione verticale di 1,5 cm in zona trachea e senza mezzi termini sezionare i muscoli che coprono la trachea fino a quando vedrete la trachea. Puntura della trachea con cannula di 18 G i.v. e inserire la parte flessibile della cannula come un tubo tracheale.
- Collegare il tubo trachea per un animale respiratore per ventilare continuamente la cavia durante la procedura.
Nota: Ora l'anestesia è mantenuta con isoflurano 3% attraverso il tubo trachea (ventilazione con pressione massima di ispirazione, tasso di respirazione assistita ispirazione: 100 – 120/min, pressione di picco di ispirazione: 18-22 cm Hg utilizzando PEEP-ventilazione, mentre il petto è aperto ). - Identificare lo spazio intercostale dith 5 contando gli spazi di costola inizio al primo spazio intercostale. Eseguire un'incisione orizzontale di 2 cm sul 5 ° spazio intercostale sul lato sinistro della cavia con delle forbici, una pinzetta. Inserire un retrattore piccolo animale. Sezionare i muscoli con un elettrocauterio fino a raggiungono i muscoli intercostali, che può essere visto dopo aver rimosso il tessuto sottocutaneo, sono raggiunti.
- Sezionare delicatamente i muscoli intercostali con pinzette finché non viene raggiunto lo spazio pleurico e si può vedere il polmone di sinistra nella parte anteriore. Inserire il divaricatore tra le costole e aprirlo con cura fino ad ottenuta una buona vista del cuore.
- Le forbici per aprire il pericardio circa 1 cm nella regione della parete ventricolare sinistra anteriore. Posizionare un impacco sul polmone di sinistra per proteggerlo da eventuali danni quando inducendo la cryoinjury del ventricolo sinistro.
- Posizionare la punta del timbro eroso di metallo (alluminio) con 0,5 cm di diametro a sezione trasversale nell'azoto liquido per 3 min.
- Premere l'azoto raffreddato sonda sulla parete anteriore di sinistra del cuore per 30 s. Quindi di separarla dal cuore utilizzando un saldatore elettrico (250 ° C) che viene inserito all'interno il timbro per riscaldarlo. Ripetere questa procedura 3 volte per ottenere una lesione del miocardio transmurale. Osservare l'imbiancamento del miocardio.
- Gonfiare i polmoni con pressione massima (fissando il tubo di efflusso del ventilatore per 2 s), per evitare di atelectasia del polmone. Rimuovere il retrattore dallo spazio intercostale.
- Chiudere le costole con due punti di sutura 3-0. Nelle vicinanze i muscoli sopra le costole con un 4-0 in esecuzione suturare. Per la chiusura della pelle utilizzare punti singoli di sutura 5-0.
- Ridurre l'isoflurano all'1%. Quando l'animale respira spontaneamente, rimuovere il tubo trachea e continuare l'anestesia con una maschera facciale (isoflurano 2 – 3%).
- Assicurano l'assenza di riflessi pizzicando dell'arto per monitorare sufficiente profondità dell'anestesia. Quindi utilizzare un unico 8-0 sutura per chiudere il sito di puntura alla trachea. Chiudere la ferita con tre punti di sutura singola stich 4-0.
- Utilizzare buprenorfina (0,05 mg/kg / 12 h) e il carprofen (5 mg/kg / 24 h) per il farmaco di dolore per i 5 giorni seguenti.
-
Impianto di EHT (7 giorni dopo cryoinjury)
- Posizionare la cavia in un aula di induzione e anestetizzare l'animale con isoflurano Check la profondità dell'anestesia dalla mancanza di risposta a punta-pizzico.
- Iniettare il carprofen 4 – 5 mg/kg e buprenorfina 0,05 mg/kg per via sottocutanea con un ago 21 G e una siringa da 10 mL dopo induzione dell'anestesia. Posizionare la cavia sul dorso e mantenere l'anestesia con una facciale che ricopre il naso e bocca.
Nota: Sufficienza dell'anestesia dovrebbe essere controllato da pizzicare le zampe posteriori. - Diffondere gambe della cavia e fissare la posizione con del nastro.
- Eseguire la preparazione pre-operatoria come descritto nel passo 3.1.4–3.1.6. Eseguire un'incisione orizzontale della pelle di 2 cm nella zona della cicatrice del fianco laterale sinistro con delle forbici, pinzette.
- Delicatamente e sezionare le aderenze extrapleural utilizzando un elettrocauterio. Aprire con cautela lo spazio pleurico con le forbici. Inserire un divaricatore per esporre il cuore.
- Identificare visivamente la regione dell'infarto per il suo colore pallido in confronto il miocardio sano circostante. Collocare il cerotto di tessuto cardiaco ingegnerizzato sopra la regione di infarto.
- Fissarlo con due 8-0 suture su entrambi i lati. Assicurarsi di proteggere la patch nell'area infartuata-non del cuore (Figura 1). Gonfiare i polmoni con pressione, per evitare di atelectasia del polmone. Rimuovere il retrattore dallo spazio intercostale.
- Chiudere le costole con due punti di sutura 3-0. Nelle vicinanze i muscoli sopra le costole con un 4-0 in esecuzione suturare. Per la chiusura della pelle utilizzare punti singoli di sutura 5-0.
- Ridurre l'isoflurano all'1%. Quando l'animale respira spontaneamente, rimuovere il tubo trachea e continuare l'anestesia con una maschera facciale (isoflurano 2 – 3%).
- Assicurano l'assenza di riflessi pizzicando dell'arto per monitorare sufficiente profondità dell'anestesia. Quindi utilizzare un unico 8-0 sutura per chiudere il sito di puntura alla trachea. Nelle vicinanze la ferita con solo tre punti 4-0 suturare.
- Utilizzare buprenorfina (0,05 mg/kg / 12 h) e il carprofen (5 mg/kg / 24 h) per il farmaco di dolore per i 5 giorni seguenti.
- Quattro settimane dopo l'impianto EHT eseguire un ecocardiogramma transtoracico (come descritto nel passaggio 2) per monitorare la funzione di LV nel tempo.
Nota: La funzione di LV è monitorata prima l'impianto EHT e 4 settimane dopo l'impianto da monitorare per il miglioramento della funzione cardiaca tramite impianto di EHT - Eutanasia animale quale protocollo IACUC approvato e chirurgicamente explant cuore per ulteriori analisi.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Questo modello della cavia è un modello adatto per indagare la rigenerazione cardiaca dopo impianto di hiPSC derivato EHT-patches. Riproducibile conduce alle lesioni del miocardio transmurale grande. Dimensione della cicatrice viene valutata dall'istologia a quattro settimane dopo cryoinjury. Colorazione tricromica Mason rivela grande transmurale cicatrici (Figura 2). Dimensione della cicatrice era simile nel corso di un gran numero di animali feriti, che riflettono un alto grado di riproducibilità8. In media il 25% del miocardio ventricolare di sinistra è stato sostituito da tessuto cicatriziale. Macchiatura di distrofina ha dimostrato grandi innesti del miocardio che remuscularized parzialmente la cicatrice (Figura 3a). Macchiando per Ku80 umano ha dimostrato l'origine umana di questa neonata miocardio (Figura 3b). Maggiore ingrandimento ha rivelato che questi innesti hanno consistito dei miociti densamente imballato. Funzione ventricolare sinistra è stata monitorata mediante ecocardiografia transtoracica. Un riuscito impianto di EHT è caratterizzato da un miglioramento della LVEF, frazionaria area riduzione e una diminuzione nel diametro fine-diastolica ventricolare sinistra (Figura 4).
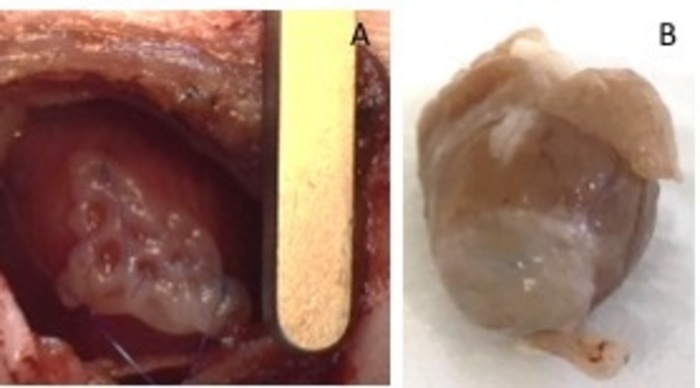
Figura 1: hEHT-patch dopo impianto. (A) Patch subito dopo l'impianto. (B) Patch quattro settimane dopo l'impianto. Clicca qui per visualizzare una versione più grande di questa figura.
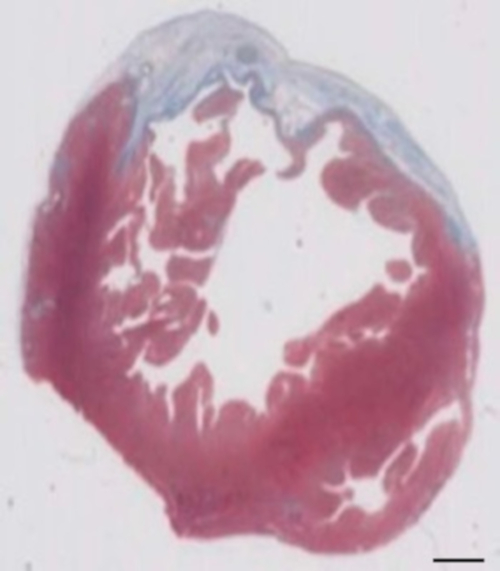
Figura 2: determinazione di infarto il Masson s trichrome macchiato paraffina sezione 28 giorni dopo cryoinjury. L'infarto è determinato dal colore blu in colorazione tricromica di Masson, che rappresentano il tessuto fibrotico. Barra della scala = 2 mm. per favore clicca qui per visualizzare una versione più grande di questa figura.
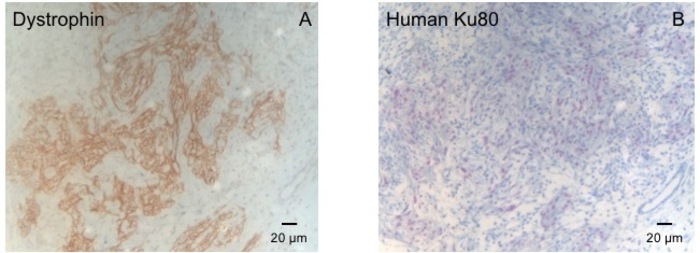
Figura 3: colorazione con distrofina e umano Ku80. (A) distrofina spettacoli grande muscolo isole di colorazione (marrone) nella zona della cicatrice (B) Ku-macchiatura di paraffina sezionato il cuore. Ku-80 è un anticorpo umano specifico. Di conseguenza, le cellule positivamente macchiate (colore marrone) sono di origine umana. Clicca qui per visualizzare una versione più grande di questa figura.
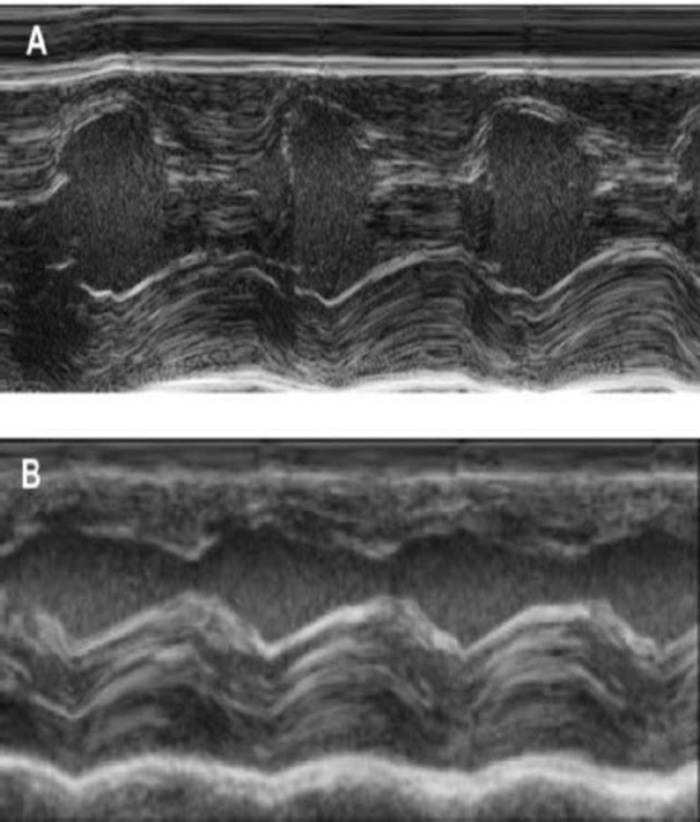
Figura 4: misura di M-Mode del ventricolo sinistro mediante ecocardiografia transtoracica. (A) al basale e (B) una settimana dopo cryoinjury. (IVS: setto intraventricolare, LV: ventricolo sinistro, PW: parete posteriore). Misurazioni eseguite 3 volte. Al basale, 1 settimana dopo cryoinfarction e 4 settimane dopo l'impianto EHT Clicca qui per visualizzare una versione più grande di questa figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Una varietà di modelli animali di piccole dimensioni sono disponibili per studiare l'effetto che esercita il trapianto di cellule cuori feriti9,10,11. Abbiamo scelto un modello della cavia a causa di tutti gli animali piccoli modelli sua (electro) fisiologia assomiglia più molto attentamente a quello degli esseri umani. I vantaggi di piccoli modelli animali sono semplice alloggio, costi gestibili e pochi dipendenti. Confronto con topi e ratti, guinea pigs´ cardiaco (electro) fisiologia è più simile agli esseri umani. In particolare la frequenza cardiaca è inferiore (~250/min), spettacoli di potenziale d'azione ventricolare una fase di plateau e il potassio corrente hokr è importante per ripolarizzazione7. Inoltre, la dimensione più grande degli animali facilita gli ambulatori, che è particolarmente importante in quanto una re-toracotomia è necessaria una settimana dopo l'induzione della lesione. Tuttavia, le cavie sono sensibili all'anestesia che richiedono qualche esperienza.
Shiba et al., ha descritto l'uso di 50 mg/kg ketamina e 2 mg/kg xylazina (i.p.) per anestetizzare cavie per cryoinjury cardiaco4. Abbiamo anche valutato questo reggimento di anestesia. Uno degli svantaggi è il fatto che è Impossibile sospendere l'effetto narcotico di xilazina e ketamina dovuta alla mancanza di potenti antidoti. Considerando che le cavie sono ad alto rischio di ipoglicemia durante le procedure chirurgiche, abbiamo deciso di utilizzare un gas narcotico di cui l'effetto è facile da controllare e quindi che conduce ad una fase di recupero anestetico molto brevi. Una tracheotomia è utilizzata per garantire una ventilazione sicura durante tutta la procedura. Un'intubazione oro-tracheale è tecnicamente molto esigente in cavie, come la visualizzazione dell'apertura della trachea è spesso difficile e non può essere garantita un'intubazione sicuro.
Anche se cryo-lesione induce una grave lesione del miocardio non rispecchia proprio una malattia coronarica / infarto miocardico in esseri umani. A questo proposito, la legatura del ragazzo o anche un modello di lesione di ischemia-riperfusione più strettamente ricapitola la fisiopatologia umana. Tuttavia, l'anatomia dell'arteria coronaria in cavie è caratterizzata da un vasto collateralization. Di conseguenza, una legatura dell'arteria coronaria discendente anteriore di sinistra non riproducibile provocato grandi lesioni del miocardio in cavie12,13. LAD-legatura in topi e ratti conduce ad un ampio rimodellamento e alla fine assottigliamento della parete anteriore, una caratteristica che non si vede negli esseri umani in questa misura. Il modello di cryo-infortunio-cavia induce processi di rimodellamento e assottigliamento della parete ventricolare, ma in una misura, che più assomiglia a miocardio lesione veduta in esseri umani. Di conseguenza, un modello di cryoinjury conseguente a una lesione del miocardio più affidabile è stato scelto13. Periprocedural mortalità è un grosso problema con questo modello. Inizialmente, circa il 30% degli animali morirono durante la prima operazione o entro 7 giorni dopo la lesione cardiaca. Un altro 30% è morto durante EHT impianto contabilità per una mortalità complessiva del 60%. Parecchie modifiche portano ad una diminuzione significativa nella mortalità. Isoflurano induce pesanti salivazione e secrezione bronchiale. L'atropina riduce la secrezione bronchiale ed era un fattore importante per fare diminuire la mortalità. Il secondo fattore che fortemente diminuito la mortalità è l'uso di un saldatore per rilasciare il timbro di metallo freddo dal cuore. Acqua calda è stato inizialmente utilizzato per scollegare il timbro dal miocardio. Tuttavia, era difficile da rimuovere l'acqua dalla cavità toracica. Restanti respirazione acqua influenzato negativamente e portare allo sviluppo di adesione che ha peggiorato la prognosi di umano. Un'altra modifica che influenzato positivamente la procedura era la protezione del polmone di sinistra dal timbro di metallo freddo con un impacco. Dopo queste modifiche sono state implementate mortalità è sceso a ~ 20% per l'operazione di lesione cardiaca (tra cui la prima settimana postoperatoria) e un altro 25% per il trapianto di EHT. Induzione della lesione cryo rappresenta l'operazione tecnicamente più facile e coerente risultati possono essere raggiunti dopo 5-10 animali sono stati operati sotto supervisione. EHT-trapianto è più esigente e circa 20 interventi chirurgici sotto supervisione sono raccomandati fino a quando non si possono ottenere risultati riproducibili.
All'inizio, abbiamo usato la soluzione salina calda per sciacquare il cuore e, quindi, staccare la sonda congelata da parete ventricolare di sinistra. Questa procedura è più facile da gestire, ma pochi millilitri di soluzione fisiologica rimangono all'interno del torace, aumentando il rischio di insufficienza respiratoria.
In conclusione, il modello raffigurato cavia è riproducibile, poco costoso e conduce a risultati coerenti. L'ecocardiografia transthoracic offre uno strumento fattibile e non invasivo per valutare la presenza di lesione cardiaca prima di rifunzionamento e impianto dell'innesto viene eseguita.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Nessuno degli autori ha concorrenti interessi finanziari o altri conflitti di interesse di dichiarare.
Acknowledgments
Nessun finanziamento è stato ricevuto per questo studio
Materials
| Name | Company | Catalog Number | Comments |
| Ventilator (VetFlo Dual Mode) | Kent Scientific | ||
| Forene | abbvie | 1000009819 | |
| Carprofen | Zoetis | 256692 | |
| Atropin | Braun | PZN 00648037 | |
| Buprenorphin | Sigma | ||
| Metal stamp | |||
| Electric soldering iron | Claytools | ||
| 3-0 prolene suture | Ethicon | ||
| 4-0 prolene suture | Ethicon | 662SLH | |
| 5-0 prolene suture | Ethicon | 8710H | |
| 8-0 prolene suture | Ethicon | 8841H | |
| Tungsten Carbide Scissor | FST | No. 14568-12 | |
| Stainless sterilization Container | FST | No. 20890-51 | |
| Graefe Forceps | FST | No.11652-10 | |
| Extra fine Graefe Forceps | FST | No.11150-10 | |
| Forceps | FST | No. 11022-15 | |
| Halsted- Mosquito | FST | No. 13009-12 | |
| Forceps | FST | No.13003-10 | |
| Baby Mixter | FST | No. 13013-14 | |
| Needle holder (Castroviejo with Tungsten Casbide Jaws) | FST | No. 12565-14 | |
| Needle Holder (Halsey) | FST | No. 12501-13 | |
| Alm Retractor with Blumt Teeth | FST | No. 17008-07 | |
| Spring Scissor | FST | No. 15000-00 | |
| Compress 5x5 | Fink + Walter | PZN 08821417 | |
| Venflon Pro Safety | Becton Dickinson | PZN11123964 | |
| Cautery High Temp 2" | Bovie Medical Corporation | 0100607151011055 |
References
- Kirklin, J. K., et al. Seventh INTERMACS annual report: 15,000 patients and counting. The Journal of heart and lung transplantation: the official publication of the International Society for Heart Transplantation. 34, 1495-1504 (2015).
- Soonpaa, M. H., Field, L. J. Survey of studies examining mammalian cardiomyocyte DNA synthesis. Circulation research. 83, 15-26 (1998).
- Shiba, Y., Hauch, K. D., Laflamme, M. A. Cardiac applications for human pluripotent stem cells. Current pharmaceutical design. 15, 2791-2806 (2009).
- Shiba, Y., et al. Human ES-cell-derived cardiomyocytes electrically couple and suppress arrhythmias in injured hearts. Nature. 489, 322-325 (2012).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510, 273-277 (2014).
- Kattman, S. J., et al. Stage-specific optimization of activin/nodal and BMP signaling promotes cardiac differentiation of mouse and human pluripotent stem cell lines. Cell stem cell. 8, 228-240 (2011).
- Watanabe, T., Rautaharju, P. M., McDonald, T. F. Ventricular action potentials, ventricular extracellular potentials, and the ECG of guinea pig. Circulation research. 57, 362-373 (1985).
- Weinberger, F., et al. Cardiac repair in guinea pigs with human engineered heart tissue from induced pluripotent stem cells. Science translational medicine. 8, 363ra148 (2016).
- Shiba, Y., et al. Electrical Integration of Human Embryonic Stem Cell-Derived Cardiomyocytes in a Guinea Pig Chronic Infarct Model. Journal of Cardiovascular Pharmacology and Therapy. 19, 368-381 (2014).
- van Laake, L. W., et al. Human embryonic stem cell-derived cardiomyocytes survive and mature in the mouse heart and transiently improve function after myocardial infarction. Stem cell research. 1, 9-24 (2007).
- Zimmermann, W. H., et al. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature medicine. 12, 452-458 (2006).
- Johns, T. N., Olson, B. J. Experimental myocardial infarction. I. A method of coronary occlusion in small animals. Annals of surgery. 140, 675-682 (1954).
- van den Bos, E. J., Mees, B. M., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. Heart and circulatory physiology. , H1291-H1300 (2005).



