Summary
在这里, 我们提出了一个方案, 诱导左心室内皮损伤, 然后植入心肌贴片, 从人类 ips 细胞心肌细胞在豚鼠模型中获得。
Abstract
由于成人哺乳动物心脏再生能力有限, 心肌梗死导致心肌细胞不可逆转的丢失。这种心脏肌肉质量的损失会导致心力衰竭。除了心脏移植, 没有治疗终末期心力衰竭的治疗方案。在器官捐献者短缺的情况下, 需要器官独立的治疗方式。左心室辅助设备是一个很有前途的治疗选择, 然而, 特别是作为目的地治疗, 其副作用, 如中风, 感染和出血的限制。近年来, 研究了几种心脏修复策略, 包括干细胞注射、心脏祖细胞或心肌组织工程。最近在细胞生物学方面的改进使来自人类诱导的多能干细胞 (iPSC) 的大量心肌细胞分化。目前正在评估的心脏修复策略之一是移植人工心脏组织。工程心脏组织 (EHT) 是一个三维体外生成的心肌细胞网络, 具有本地心脏组织的功能特性。我们已经创造了由 hiPSC 衍生的心肌细胞的 eht 斑块。本文提出了一种诱导豚鼠左心室心肌损伤的方案, 然后在左心室壁植入 hiPSC 衍生 EHT。
Introduction
在我们老龄化的人口中, 心力衰竭患者的数量正在增加。对于终末期心力衰竭, 原位心脏移植是唯一的治疗选择。然而, 特别是在欧洲国家, 器官捐献者日益短缺。因此, 替代治疗方案是必要的。最近在机械循环支持方面取得的成就很有希望, 但特别是在长期运行中, 受到出血、泵血栓形成和感染并发症等副作用的限制1。
成人心脏的内源性再生能力极其有限。因此, 心脏再生疗法可能成为终末期心力衰竭患者2,3 的替代治疗方案。不同的技术, 包括干细胞注射或组织工程的方法已经描述了 3,4,5。
人类诱导的多能干细胞 (hiPSC) 以及人类胚胎干细胞 (hESC) 可以有效地分化为自发跳动的人心肌细胞 6,这是心脏再生领域的一项重大成就。疗法。
为了在心肌梗死后更换心肌和改善心脏衰竭的功能, 存活适量的心肌细胞及其与原生心脏的机械和电耦合是必不可少的。为了研究人 iPS 细胞源性心肌细胞心脏再生疗法的潜力, 需要一个合适的研究模型。理想的模型应该具有成本效益, 并具有类似人类的生理和电生理。从这个角度来看, 像猪这样的大型动物模型是理想的, 然而, 这些实验非常昂贵, 为了看到对左心室的影响, 需要大量的心肌细胞来取代相关数量的心肌细胞在猪梗塞模型中的功能。
为了回答人类细胞心脏再生的基本生物学问题, 例如细胞存活、血管化和电耦合, 小动物模型更为合适。从现有的小动物模型来看, 与老鼠和老鼠相比, 豚鼠是最有用的物种, 因为它们的电生理更类似于人类的情况.在这个豚鼠模型中, 我们诱发了左心室的经膜冷冻损伤。诱导心肌梗死一周后进行三维、自发跳动的 hips 细胞源性心肌细胞贴片。通过组织学检查, 对植入术后28天的心肌细胞存活率进行评估。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
动物得到了符合实验动物资源研究所编写并由国立卫生研究院出版的《实验动物原理指南》的人道护理。所有动物议定书都得到了负责的地方当局的批准 (' Amt für Gesundheit und Verbraucherschutz, Hansestadt hamburg ' ' '/动物议定书 # 109/16)。
1. 获取动物
- 商业获得的豚鼠体重500–600克。
- 将它们放在常规条件下的动物笼子里。饲料标准大鼠和蒸压水的。
2. 经胸超声心动图
- 将豚鼠放入诱导室, 用异氟醚麻醉动物 (2-3%)。检查麻醉的深度, 缺乏对脚趾夹紧的反应。
- 将麻醉后的豚鼠放置在温暖的平台 (40–42°c) 上的仰视位置。通过鼻锥继续麻醉 (异氟醚 1.5-2%)
- 用电动动物剃须刀对豚鼠进行剃须和脱毛。
- 应用预热 (~ 25°c) 超声换能器凝胶。使用配备高于 15 MHz 的传感器频率的超声心动图系统。
- 通过将换能器放置在几内亚的情况下, 获得二维的准轴长轴视图, 从右颈朝左腿的猪胸, 并记录长轴 b 模式图像在主动脉瓣的平面与 LV 先端的并发可视化。探讨术前左心室功能。
- 将传感器旋转90°度 , 以获得在状中的短轴 b 模式视图。
请注意:然后立即将动物转移到 OR 表中。该动物被连续麻醉与3% 异氟烷。注射 0.05 mg/kg 阿托品 (i.m.), 以避免机械通气时支气管分泌物增加。
3. 手术
-
心肌梗死的诱导
- 用 21 G 针和10毫升注射器注射 4-5 mg/kg carpropen 和 0.05 mg/kg 丁丙诺非术, 用于皮下镇痛。0.5 mg/kg 阿托品在皮下注射 21 G 针和10毫升注射器。
- 将豚鼠放在背上, 用面罩覆盖口腔和鼻子进行麻醉。通过捏后脚 (缺乏踏板反射) 检查麻醉的深度。
- 把豚鼠的腿摊开, 用胶带固定位置。
- 用电动剃须刀刮掉麻醉动物的胸部和气管区域。广泛使用碘基擦洗对该地区进行消毒, 然后是80% 的乙醇。重复此消毒步骤两次。
- 在气管区域进行1.5 厘米的垂直切口, 并平直地解剖覆盖气管的肌肉, 直到你看到气管。用 18 G i. v. 插管刺穿气管, 并将插管的柔性部分作为气管管插入。
- 将气管管连接到动物呼吸器, 以便在手术过程中不断给豚鼠通气。
请注意:现在, 通过气管管使用异氟醚3% 保持麻醉 (灵感辅助通气, 最大吸气压力, 呼吸速率: 100–120/min, 峰值灵感压力: 18-22 厘米的汞使用 peec 通风, 而胸部是开放的). - 通过计算从第一个肋间空间开始的肋骨空间来确定第5个肋间空间。用剪刀和推子在豚鼠左侧的第5个肋间空间上进行2厘米的水平切口。插入小型动物牵引器。用电烧来解剖肌肉, 直到达到肋间肌肉, 切除皮下组织后可以看到。
- 用推子轻轻解剖肋间肌肉, 直到达到胸膜空间, 可以看到前面的左肺。将牵引器插入肋骨之间, 并小心地打开, 直到获得心脏的良好视图。
- 用剪刀打开左前心室壁区域约1厘米的心包。在诱导左心室滑块损伤时, 将压缩放在左肺上, 以保护其免受损伤。
- 将横截面直径为0.5 厘米的腐蚀金属邮票 (铝) 的尖端放入液氮中3分钟。
- 将氮气冷却探头按在心脏左前壁上30秒。然后使用电焊铁 (250°c) 将其与心脏分离, 该电焊铁被放置在邮票内, 以使其升温。重复此过程 3次, 以获得经膜外心肌损伤。观察心肌的漂白。
- 用最大压力充气肺部 (通过夹紧呼吸机的流出管 2次), 以避免肺肺肺肺肺不张。从肋间空间取下牵引器。
- 用两个3-0 的缝合线缝合肋骨。用4-0 的跑步缝合线缝合肋骨上的肌肉。对于关闭皮肤使用5-0 缝合单针。
- 将异氟醚降低到1%。当动物自发呼吸时, 取出气管管, 并继续使用面罩 (异氟醚 2%-3%) 进行麻醉。
- 通过捏后肢以监测足够深度的麻醉来确保没有反射。然后使用单个8-0缝合关闭气管的穿刺部位。用三个单粘4-0 缝合伤口。
- 在接下来的5天内, 使用丁丙诺非 (每 12小时 0.05 mg/kg) 和 carprofen (每 24小时 5 mg/kg) 进行止痛药。
-
EHT 植入术 (冷冻损伤后 7天)
- 将豚鼠放入诱导室, 用异氟烷麻醉动物, 检查麻醉深度, 以缺乏对脚趾夹紧的反应。
- 在麻醉诱导后, 用 21 g 针和10毫升注射器, 在皮下注射 4-5 mg/kg carpropen 和 0.05 Mg/kg 丁丙诺非。将豚鼠放在背上, 用面罩覆盖口腔和鼻子进行麻醉。
请注意:麻醉的充分性应通过捏后脚来检查。 - 铺开豚鼠的腿, 用胶带固定位置。
- 按照步骤3.1.4 中的描述-3.1.6 进行手术前的准备。使用剪刀和推子在左侧侧的疤痕区域进行2厘米的水平皮肤切口。
- 用电烧轻轻解剖胸膜外粘连。用剪刀小心地打开胸膜空间。插入肋骨摊铺机以露出心脏。
- 与周围健康的心肌相比, 用苍白的颜色直观地识别梗死的区域。将工程心脏组织贴膜置于梗死区。
- 用两个8-0 保护它缝合在两侧。确保在心脏的非梗塞区域固定补丁 (图 1)。用压力充气肺部, 以避免肺肺不张。从肋间空间取下牵引器。
- 用两个3-0 的缝合线缝合肋骨。用4-0 的跑步缝合线缝合肋骨上的肌肉。对于关闭皮肤使用5-0 缝合单针。
- 将异氟醚降低到1%。当动物自发呼吸时, 取出气管管, 并继续使用面罩 (异氟醚 2%-3%) 进行麻醉。
- 通过捏后肢以监测足够深度的麻醉来确保没有反射。然后使用单个8-0缝合关闭气管的穿刺部位。用三针4-0 缝合伤口。
- 在接下来的5天内, 使用丁丙诺非 (每 12小时 0.05 mg/kg) 和 carprofen (每 24小时 5 mg/kg) 进行止痛药。
- EHT 植入术四周后进行经胸超声心动图 (如步骤2所述), 以监测 LV 功能随着时间的推移。
请注意:在 EHT 植入术前和植入术后4周内监测 LV 功能, 以改善 EHT 植入术改善心功能 - 对 IACUC 批准的动物进行安乐死, 并手术外植心脏进行进一步分析。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
该豚鼠模型是研究 Hepsc 衍生的 eht 斑块植入后心脏再生的合适模型。它可重复地导致大的经膜外心肌损伤。疤痕大小在冷冻损伤后四周由组织学评估。梅森三色染色显示大的横突疤痕 (图 2)。疤痕大小在大量受伤的动物身上是相似的, 反映了高度的重现性8。平均25% 的左心室心肌被瘢痕组织所取代。肌营养不良染色显示大的心肌移植部分重新移植疤痕 (图 3a)。为人类的粘液染色证明了这种新形成的心肌的人类起源 (图 3b)。较高的放大倍率显示, 这些移植物由密集的肌细胞组成。采用经胸超声心动图监测左心室功能。成功的 EHT 植入术的特点是 LVEF 的改善, 分数面积缩短, 左心室舒张终末期直径的减少 (图 4)。
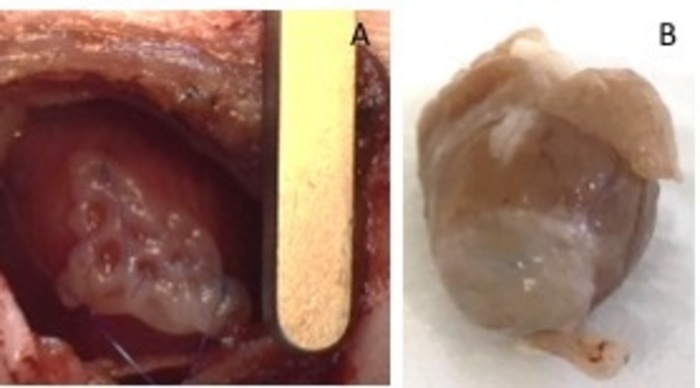
图 1: 植入后的 heht 补丁.(a) 植入后立即贴上补丁。(b) 植入四周后补丁。请点击这里查看此图的较大版本.
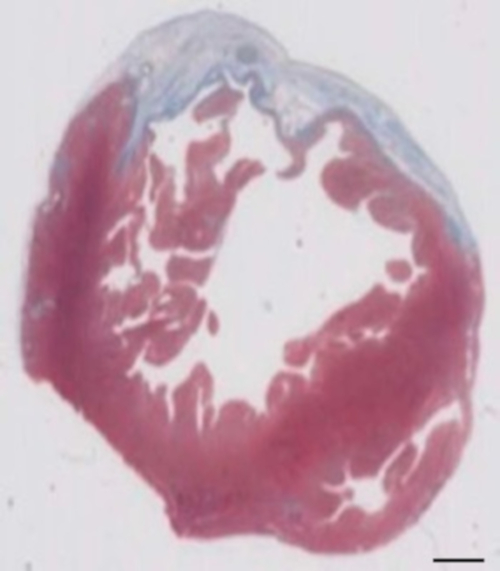
图 2: 在冷冻损伤28天后, 马松三色三色石蜡切片的梗塞的测定.在马松的三色染色中, 梗死是由蓝色决定的, 代表纤维化组织。刻度栏 = 2 毫米. 请点击这里查看此图的较大版本.
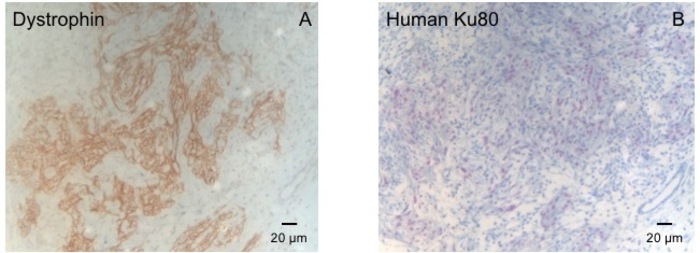
图 3: 用肌营养蛋白和人 Ku80 染色.(a) 肌营养不良染色显示在石蜡切片心脏的瘢痕区 (b) Ku-Staining 染色处有很大的肌肉岛屿 (棕色)。Ku-80 是一种人类特有的抗体。因此, 正面染色的细胞 (棕色) 来自人类。请点击这里查看此图的较大版本.
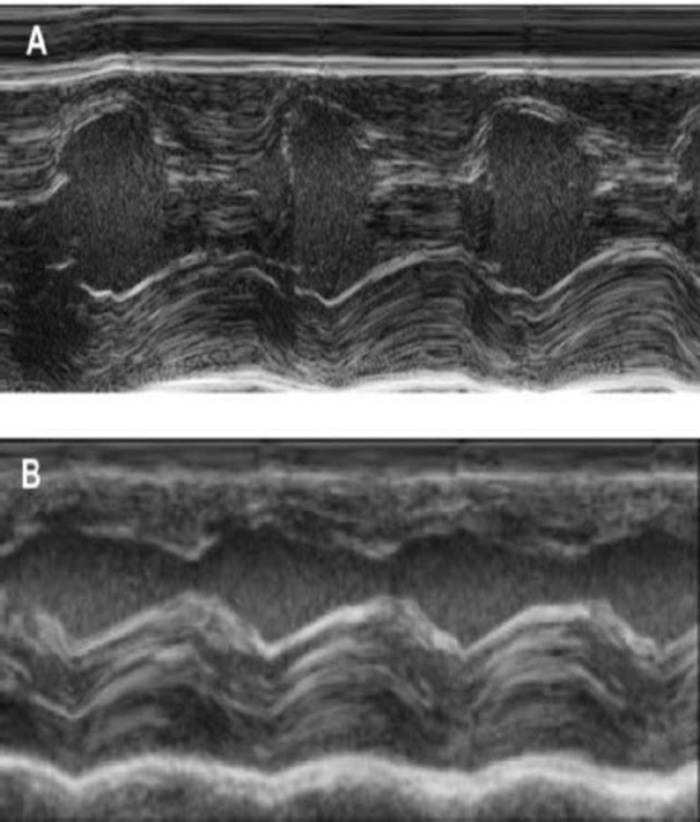
图 4:2-经胸超声心动图测量左心室 m 型.(a) 在基线处, (b) 在冷冻损伤后一周。(IVS: 室内间隔, LV: 左心室, PW: 后壁)。测量执行3次。在基线, 1 周后的冷冻梗塞和4周后, EHT 植入请点击这里查看这个数字的更大版本.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
有多种小动物模型可用于研究细胞移植对受伤心脏的影响 9,10, 11.我们选择了豚鼠模型, 因为所有小动物模型, 它的 (电子) 生理最接近于人类。小动物模型的优点是住房简单、成本可控、劳动力少。与小鼠和大鼠相比, 豚鼠心脏 (电) 生理更类似于人类。特别是心脏频率较低 (~ 250/min), 心室动作电位呈高原期, 钾电流 ikr对复极化有重要意义。此外, 较大的动物大小有利于手术, 这一点特别重要, 因为在诱发伤害后一周需要重新开胸手术。然而, 豚鼠对麻醉很敏感, 需要一些经验。
Shiba等人介绍了使用 50 mg kg 氯胺酮和 2 mg kg xylazine (即) 麻醉豚鼠治疗心肌细胞伤4。我们还评估了这个麻醉团。其中一个缺点是, 它是不可能暂停 xylazine 和氯胺酮的麻醉作用, 由于缺少强大的解毒剂。考虑到豚鼠在外科手术中处于低血糖的高风险, 我们决定使用一种麻醉气, 其效果易于控制, 因此导致麻醉恢复阶段非常短。气管切开术用于确保整个过程中的安全通风。气管插管在技术上对豚鼠的要求很高, 因为气管开口的可视化往往很困难, 而且不能保证安全插管。
虽然冷冻损伤会导致严重的心肌损伤, 但它并不能准确反映人类的冠状动脉疾病/心肌梗死。在这方面, LAD 甚至缺血再灌注损伤模型的结扎更紧密地概括了人类的病理生理学。然而, 豚鼠冠状动脉解剖的特点是广泛的抵押。因此, 左前降冠状动脉结扎不能重复导致豚鼠大心肌损伤 12,13.小鼠和大鼠的 lad 结扎导致广泛的重塑, 并最终变薄的前壁, 这是在人类没有看到到这一程度的特点。豚鼠低温损伤模型可导致心室壁的重塑过程和变薄, 但在一定程度上更类似于在人类身上看到的心肌损伤。因此, 选择了一个冷冻损伤模型, 导致更可靠的心肌损伤13。程序性死亡率是这一模式的一个主要问题。最初, 约有 3 0% 的动物在第一次手术中死亡, 或在心脏受伤后7天内死亡。另有30% 的人在超高温植入术中死亡, 总死亡率为60%。一些修改导致死亡率显著下降。异氟醚诱导大量的唾液和支气管分泌物。阿托品减少支气管分泌, 是降低死亡率的主要因素。死亡率大幅下降的第二个因素是使用焊铁从心脏释放冷金属邮票。温水最初是用来从心肌上分离邮票的。然而, 从胸腔中取出水却很困难。剩余的水对呼吸有负面影响, 导致粘连的发展, 使动物的预后恶化。另一个积极影响手术的修改是用压缩保护左肺免受冷金属邮票的影响。实施这些修饰后, 心脏损伤手术 (包括术后第一周) 的死亡率下降到 ~ 20%, EHT 移植的死亡率下降到25% 左右。裂解损伤的诱导代表了技术上更容易操作, 在5-10 种动物的监督下手术后可以取得一致的结果。在获得可重现的结果之前, 推荐大约20次在监督下的手术。
一开始, 我们用温热的盐水冲洗心脏, 因此, 将冷冻探针从左心室壁中分离出来。这个程序更容易处理, 但几毫升的盐水仍然在胸腔增加呼吸衰竭的风险。
总之, 所描述的豚鼠模型是可重现的, 价格低廉, 并导致一致的结果。经胸超声心动图提供了一个可行的和非侵入性的工具, 以评估是否存在心脏损伤之前, 再手术和移植植入术。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
提交人都没有相互竞争的经济利益或其他利益冲突需要申报。
Acknowledgments
没有收到这项研究的资金
Materials
| Name | Company | Catalog Number | Comments |
| Ventilator (VetFlo Dual Mode) | Kent Scientific | ||
| Forene | abbvie | 1000009819 | |
| Carprofen | Zoetis | 256692 | |
| Atropin | Braun | PZN 00648037 | |
| Buprenorphin | Sigma | ||
| Metal stamp | |||
| Electric soldering iron | Claytools | ||
| 3-0 prolene suture | Ethicon | ||
| 4-0 prolene suture | Ethicon | 662SLH | |
| 5-0 prolene suture | Ethicon | 8710H | |
| 8-0 prolene suture | Ethicon | 8841H | |
| Tungsten Carbide Scissor | FST | No. 14568-12 | |
| Stainless sterilization Container | FST | No. 20890-51 | |
| Graefe Forceps | FST | No.11652-10 | |
| Extra fine Graefe Forceps | FST | No.11150-10 | |
| Forceps | FST | No. 11022-15 | |
| Halsted- Mosquito | FST | No. 13009-12 | |
| Forceps | FST | No.13003-10 | |
| Baby Mixter | FST | No. 13013-14 | |
| Needle holder (Castroviejo with Tungsten Casbide Jaws) | FST | No. 12565-14 | |
| Needle Holder (Halsey) | FST | No. 12501-13 | |
| Alm Retractor with Blumt Teeth | FST | No. 17008-07 | |
| Spring Scissor | FST | No. 15000-00 | |
| Compress 5x5 | Fink + Walter | PZN 08821417 | |
| Venflon Pro Safety | Becton Dickinson | PZN11123964 | |
| Cautery High Temp 2" | Bovie Medical Corporation | 0100607151011055 |
References
- Kirklin, J. K., et al. Seventh INTERMACS annual report: 15,000 patients and counting. The Journal of heart and lung transplantation: the official publication of the International Society for Heart Transplantation. 34, 1495-1504 (2015).
- Soonpaa, M. H., Field, L. J. Survey of studies examining mammalian cardiomyocyte DNA synthesis. Circulation research. 83, 15-26 (1998).
- Shiba, Y., Hauch, K. D., Laflamme, M. A. Cardiac applications for human pluripotent stem cells. Current pharmaceutical design. 15, 2791-2806 (2009).
- Shiba, Y., et al. Human ES-cell-derived cardiomyocytes electrically couple and suppress arrhythmias in injured hearts. Nature. 489, 322-325 (2012).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510, 273-277 (2014).
- Kattman, S. J., et al. Stage-specific optimization of activin/nodal and BMP signaling promotes cardiac differentiation of mouse and human pluripotent stem cell lines. Cell stem cell. 8, 228-240 (2011).
- Watanabe, T., Rautaharju, P. M., McDonald, T. F. Ventricular action potentials, ventricular extracellular potentials, and the ECG of guinea pig. Circulation research. 57, 362-373 (1985).
- Weinberger, F., et al. Cardiac repair in guinea pigs with human engineered heart tissue from induced pluripotent stem cells. Science translational medicine. 8, 363ra148 (2016).
- Shiba, Y., et al. Electrical Integration of Human Embryonic Stem Cell-Derived Cardiomyocytes in a Guinea Pig Chronic Infarct Model. Journal of Cardiovascular Pharmacology and Therapy. 19, 368-381 (2014).
- van Laake, L. W., et al. Human embryonic stem cell-derived cardiomyocytes survive and mature in the mouse heart and transiently improve function after myocardial infarction. Stem cell research. 1, 9-24 (2007).
- Zimmermann, W. H., et al. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature medicine. 12, 452-458 (2006).
- Johns, T. N., Olson, B. J. Experimental myocardial infarction. I. A method of coronary occlusion in small animals. Annals of surgery. 140, 675-682 (1954).
- van den Bos, E. J., Mees, B. M., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. Heart and circulatory physiology. , H1291-H1300 (2005).



