Summary
Nous présentons ici un protocole pour l’induction de cryoinjury ventriculaire gauche, suivie de l’implantation d’un patch du muscle cardiaque, dérivée de cellules iPS humaines cardiomyocytes dans un modèle de cobaye.
Abstract
En raison de la capacité de régénération limitée du cœur chez les mammifères adultes, infarctus du myocarde se traduit par une perte irréversible des cardiomyocytes. Cette perte de montants correspondants du muscle cardiaque masse peut conduire à l’insuffisance cardiaque. En plus de la transplantation cardiaque, il n’y a aucune option de traitement curatif pour l’insuffisance cardiaque terminale. En période de pénurie de donneurs d’organes, les modalités de traitement indépendant d’orgue sont nécessaires. Dispositifs d’assistance ventriculaire gauche sont une option thérapeutique prometteuse, mais surtout comme thérapie de destination, limitée par ses effets secondaires comme les accidents vasculaires cérébraux, les infections et les hémorragies. Ces dernières années, plusieurs stratégies de réparation cardiaque, y compris l’injection de cellules souches, cellules souches cardiaques ou ingénierie tissulaire myocardique ont été étudiées. Les améliorations récentes en biologie cellulaire permettent la différenciation de grandes quantités de cardiomyocytes provenant des cellules souches humaines pluripotentes induites (iPSC). Une des stratégies de réparation cardiaque actuellement en cours d’évaluation est de transplanter des tissus cardiaques artificielles. Coeur ingénierie tissulaire (ISE) est un réseau tridimensionnel cardiomyocyte créé in vitro, ayant des propriétés fonctionnelles du tissu cardiaque native. Nous avons créé ISE-patches de cardiomyocytes dérivé de hiPSC. Nous présentons ici un protocole pour l’induction de la cryoinjury de myocardique ventriculaire gauche chez un cobaye, suivi par l’implantation de hiPSC dérivés ise sur la paroi ventriculaire gauche.
Introduction
Le nombre de patients atteints d’insuffisance cardiaque augmente dans notre population vieillissante. Pour l’insuffisance cardiaque terminale, orthotopic transplantation de coeur est l’option de traitement uniquement curatif. Cependant, en particulier dans les pays européens, il y a une pénurie de donneur d’organes croissante. Par conséquent, les autres traitements possibles sont nécessaires. Réalisations récentes en assistance circulatoire mécanique sont prometteurs, mais surtout à long terme exécutent, limitée par ses effets secondaires tels que saignements, thrombose de la pompe et des complications infectieuses1.
La capacité de régénération endogène du cœur humain adulte est extrêmement limitée. Par conséquent, des thérapies de régénération cardiaque pourraient devenir une option thérapeutique alternative pour terminale insuffisance cardiaque patients2,3. Différentes techniques y compris l’injection de cellules à base de cellules souches ou d’un tissu approches techniques ont été décrites3,4,5.
Les cellules souches humaines pluripotentes induites (hiPSC), ainsi que les cellules souches embryonnaires humaines (CSEh) peuvent être efficacement différenciés à battant spontanément des cardiomyocytes humaine6, qui a été un succès majeur dans le domaine de la régénération cardiaque thérapies.
Pour remplacer le myocarde après un infarctus du myocarde et d’améliorer le fonctionnement d’un cœur défaillant, la survie d’un nombre adéquat de cardiomyocytes et leurs mécaniques et électriques de couplage avec le cœur natif est essentielle. Afin d’étudier le potentiel des thérapies régénératives cardiaques avec cardiomyocytes dérivés de cellules iPS humaines, un modèle de recherche approprié est nécessaire. Le modèle idéal devrait être rentable et avoir un humain-comme la physiologie et l’électrophysiologie. Grands modèles animaux comme des cochons serait idéales de ce point de vue, toutefois, ces expériences sont très coûteux et grandes quantités de cardiomyocytes serait nécessaires pour remplacer un nombre pertinent de cardiomyocytes afin de pouvoir constater les effets sur la ventricule gauche fonction dans un modèle d’infarctus du myocarde de porc.
Pour répondre à des questions biologiques élémentaires vers la régénération cardiaque humaine axée sur la cellule, par exemple, la survie des cellules, vascularisation et couplage électrique, petits modèles animaux sont plus adaptées. De petits modèles animaux disponibles, le cobaye est l’espèce plus utiles, comparativement à des rats et des souris, car leur électrophysiologie ressemble plus étroitement à la situation dans les humains7. Dans ce modèle de cochon d’Inde, nous avons induit une cryoinjury transmurale du ventricule gauche. Une semaine après l’induction de l’implantation de l’infarctus du myocarde d’un three-dimensional, battant spontanément des hanches-cellulaire cardiomyocyte patch a été réalisée. La survie des cellules cardiomyocytes a été évaluée à 28 jours après l’implantation par l’examen histologique.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Animaux a reçu tous les soins en conformité avec le Guide pour les principes des animaux de laboratoire, préparé par l’Institut des ressources animales de laboratoire et publié par le National Institutes of Health. Tous les protocoles d’animaux ont été approuvés par l’autorité locale responsable ('' Amt für Gesundheit und Verbraucherschutz, Hansestadt Hamburg'' / Animal protocole # 109/16).
1. obtenir des animaux
- Commercialement, obtenir des cochons d’Inde femelles pesant 500 à 600 g.
- Les loger dans des conditions classiques dans les cages d’animaux. Flux des chow rat standard et autoclavé eau ad libitum.
2. transthoracique échocardiographie
- Placer le cobaye dans une chambre à induction et anesthésier l’animal à l’isoflurane (2 – 3 %). Vérifier la profondeur de l’anesthésie par l’absence de réponse au pied-presseur.
- Placez le cobaye anesthésié sur une plate-forme de réchauffement de la planète (40 à 42 ° C) en position couchée. Continuer l’anesthésie par un cône de nez (isoflurane 1,5-2 %)
- Raser et épiler le thorax de pig´s de Guinée à l’aide d’un rasoir électrique de poils.
- Appliquer le gel de transducteur ultrasonique préchauffée (~ 25 ° C). Utiliser un système d’échocardiographie qui est équipé avec une fréquence de transducteur supérieure à 15 MHz.
- Acquérir des vues long axe parasternale bidimensionnelle en plaçant la sonde sur le thorax de cochon guinea´s face à partir du cou droit vers la jambe gauche et l’axe le plus long enregistrement images mode B sur le plan de la valve aortique avec une visualisation simultanée de l’apex LV. Enquêter sur la fonction ventriculaire gauche préopératoire.
- Tourner le transducteur de 90° degrés pour obtenir une vue d’axe court mode B au niveau du milieu de l’année-papillaire.
Remarque : L’animal est alors immédiatement transféré à la table d’OR. L’animal est continuellement anesthésié à l’isoflurane 3 %. 0,05 mg/kg l’atropine (i.m.) est injecté pour éviter l’augmentation de la sécrétion bronchique au cours de la ventilation mécanique.
3. chirurgie
-
Induction de l’infarctus du myocarde
- Injecter par voie sous-cutanée carprofène 4 à 5 mg/kg et la buprénorphine de 0,05 mg/kg pour l’analgésie avec une aiguille de 21 G et une seringue de 10 mL. 0,5 mg/kg l’Atropine est injecté par voie sous-cutanée avec une aiguille de 21 G et une seringue de 10 mL.
- Placez le cochon d’Inde sur le dos et garder l’anesthésie avec un masque couvrant le nez et la bouche. Vérifier la profondeur de l’anesthésie en pinçant les pattes (absence de réflexe de pédale).
- Jambes des cobayes écartées et fixer la position à l’aide de ruban adhésif.
- Raser la poitrine et dans la région de trachée de l’animal anesthésié avec un rasoir électrique. Désinfecter la zone largement à l’aide de gommage à base d’iode, suivie de l’éthanol à 80 %. Répétez ces étapes de désinfection deux fois.
- Effectuer une incision verticale de 1,5 cm dans la zone trachéale et carrément disséquer les muscles couvrant la trachée jusqu'à ce que vous voyiez la trachée. Ponction de la trachée avec canule de 18 G i.v. et insérer la partie souple de la canule comme un tube trachéal.
- Raccordez le tube trachéal à un respirateur animal de ventiler en permanence le cochon d’Inde au cours de la procédure.
Remarque : Maintenant, l’anesthésie est maintenu avec l’isoflurane 3 % via le tube trachéal (inspiration assistée par ventilation avec une pression maximale d’inspiration, fréquence respiratoire : 100 – 120/min, pression de crête inspiration : 18-22 cm de Hg à l’aide de PEEP-ventilation, tandis que le coffre est ouvert ). - Identifier l’espace intercostalth 5 en comptant les espaces côtes dès le premier espace intercostal. Effectuer une incision horizontale de 2 cm sur le 5ème espace intercostal du côté gauche du cobaye à l’aide de ciseaux et une pince. Insérer un petit enrouleur animal. Disséquer les muscles avec un bistouri électrique jusqu'à ce que les muscles intercostaux sont atteints, qui peut être vu après avoir enlevé le tissu sous-cutané, sont atteints.
- Doucement de disséquer les muscles intercostaux avec des pincettes jusqu'à ce que la cavité pleurale est atteinte et on peut voir le poumon gauche à l’avant. Insérer le rétracteur entre les nervures et ouvrez-le avec précaution jusqu'à l’obtention d’une bonne vue du cœur.
- Ouvrez le péricarde environ 1 cm de la paroi ventriculaire gauche antérieure dans la région avec des ciseaux. Placez une compresse sur le poumon gauche pour le protéger contre les dommages causés lors de l’induction de la cryoinjury du ventricule gauche.
- Placez la pointe d’un cachet érodé en métal (aluminium) avec un diamètre transversal de 0,5 cm dans l’azote liquide pendant 3 min.
- Presse l’azote refroidi par la sonde sur la paroi antérieure gauche du cœur pendant 30 s. Puis il se séparent du fond du cœur à l’aide d’un fer à souder électrique (250 ° C) qui est placé à l’intérieur du timbre à réchauffer. Répétez l’opération 3 fois afin d’obtenir une lésion myocardique transmural. Observer la blancheur du myocarde.
- Gonfler les poumons avec une pression maximale (en pinçant le tube de sortie du ventilateur pendant 2 s), afin d’éviter une atélectasie du poumon. Retirez le rétracteur de l’espace intercostal.
- Fermer les côtes avec deux sutures 3-0. Près de suture des muscles au niveau des côtes avec un 4-0 en cours d’exécution. Fermeture de la peau utiliser unique points de suture 5-0.
- Réduire l’isoflurane à 1 %. L’animal respire spontanément, retirez le tube trachéal et continuer d’anesthésie avec un masque facial (isoflurane 2 – 3 %).
- S’assurer de l’absence de réflexes en pinçant le membre postérieur pour surveiller une profondeur suffisante de l’anesthésie. Puis utilisez un seul 8-0 suture de fermer le site de ponction à la trachée. Refermer la plaie avec trois sutures simples stich 4-0.
- Utilisez buprénorphine (0,05 mg/kg / 12 h) et le carprofène (5 mg/kg / 24h) pour les médicaments contre la douleur pour les 5 jours suivants.
-
Implantation de l’ISE (7 jours après cryoinjury)
- Placer le cobaye dans une chambre à induction et anesthésier l’animal à l’isoflurane vérifier la profondeur de l’anesthésie par l’absence de réponse pour le pied-presseur.
- Injecter le carprofène 4 à 5 mg/kg et la buprénorphine de 0,05 mg/kg par voie sous-cutanée avec une aiguille de 21 G et une seringue de 10 mL après l’induction de l’anesthésie. Placez le cochon d’Inde sur le dos et garder l’anesthésie avec un masque couvrant le nez et la bouche.
Remarque : Suffisance de l’anesthésie doit être vérifiée en pinçant les pattes postérieures. - Jambes du cochon d’Inde écartées et fixer la position à l’aide de ruban adhésif.
- Effectuer la préparation pré-opératoire comme décrit à l’étape 3.1.4–3.1.6. Effectuer une incision horizontale de la peau de 2 cm dans la zone de la cicatrice du côté latéral gauche à l’aide de ciseaux et pince à épiler.
- Doucement, disséquer les adhérences extrapleural à l’aide d’un bistouri électrique. Ouvrir soigneusement la cavité pleurale avec des ciseaux. Insérer un épandeur de côtes pour exposer le cœur.
- Visuellement identifier la zone de l’infarctus du myocarde par sa couleur pâle en comparaison avec le myocarde sain environnant. Placez le patch de tissu machiné coeur au-dessus de la région de l’infarctus du myocarde.
- Fixer avec deux 8-0 sutures sur les deux côtés. Veillez à sécuriser le patch dans la zone non-infarcie du cœur (Figure 1). Gonfler les poumons avec la pression, afin d’éviter une atélectasie du poumon. Retirez le rétracteur de l’espace intercostal.
- Fermer les côtes avec deux sutures 3-0. Près de suture des muscles au niveau des côtes avec un 4-0 en cours d’exécution. Fermeture de la peau utiliser unique points de suture 5-0.
- Réduire l’isoflurane à 1 %. L’animal respire spontanément, retirez le tube trachéal et continuer d’anesthésie avec un masque facial (isoflurane 2 – 3 %).
- S’assurer de l’absence de réflexes en pinçant le membre postérieur pour surveiller une profondeur suffisante de l’anesthésie. Puis utilisez un seul 8-0 suture de fermer le site de ponction à la trachée. Fermer la plaie avec trois single piquer les sutures de 4-0.
- Utilisez buprénorphine (0,05 mg/kg / 12 h) et le carprofène (5 mg/kg / 24h) pour les médicaments contre la douleur pour les 5 jours suivants.
- Quatre semaines après l’implantation de l’ISE effectuer une échocardiographie transthoracique (tel que décrit à l’étape 2) pour évaluer la fonction Ventriculaire dans le temps.
Remarque : La fonction Ventriculaire est contrôlée avant l’implantation de l’ISE et 4 semaines après l’implantation à surveiller pour l’amélioration de la fonction cardiaque par implantation d’ISE - Euthanasier l’animal quel protocole IACUC approuvé et explantation chirurgicalement le cœur pour une analyse ultérieure.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Ce modèle de cochon d’Inde est un modèle approprié pour étudier la régénération cardiaque après que implantation de hiPSC dérivé d’ISE-patches. Elle conduit façon reproductible à transmurale grandes lésions myocardiques. Taille de la cicatrice est évaluée par histologie quatre semaines après le cryoinjury. Coloration trichrome de Mason révèle transmurale grandes cicatrices (Figure 2). Taille de la cicatrice était similaire entre un grand nombre d’animaux blessés, ce qui reflète un haut degré de reproductibilité8. En moyenne, 25 % du myocarde ventriculaire gauche a été remplacé par du tissu cicatriciel. Coloration de la dystrophine démontré grands greffes myocardiques que partiellement remuscularized la cicatrice (Figure 3 a). Coloration pour Ku80 humaine prouvé l’origine humaine de ce myocarde nouvellement formé (Figure 3 b). Un grossissement supérieur a révélé que ces greffes se composait des myocytes des. La fonction ventriculaire gauche a été suivie à l’aide d’échocardiographie transthoracique. Une implantation réussie d’ISE se caractérise par une amélioration de la FEVG fractionnelle raccourcissement et une diminution de diamètre télédiastolique ventriculaire gauche (Figure 4).
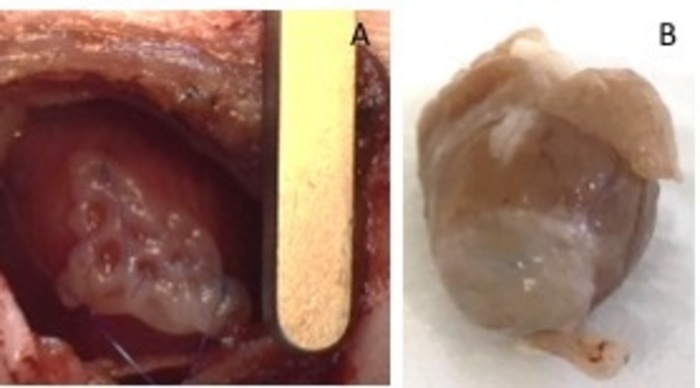
Figure 1 : hEHT-patches post-implantation. (A) Patch immédiatement après l’implantation. (B) Patch quatre semaines après l’implantation. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
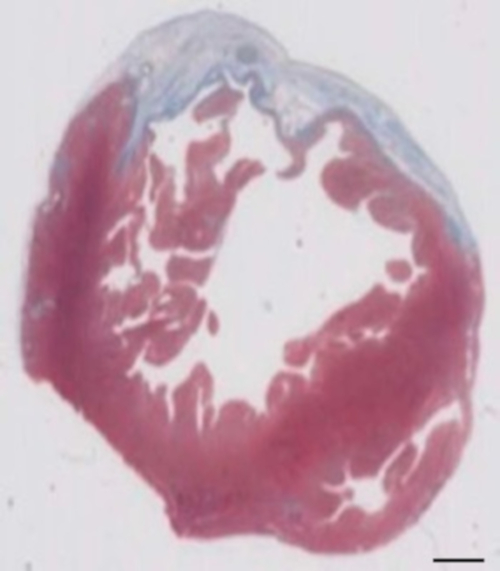
Figure 2 : détermination de l’infarctus du myocarde sur Masson de trichrome teinté paraffine section 28 jours après cryoinjury. L’infarctus du myocarde est déterminé par la couleur bleue dans la coloration trichrome de Masson, représentant le tissu fibreux. Echelle = 2 mm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
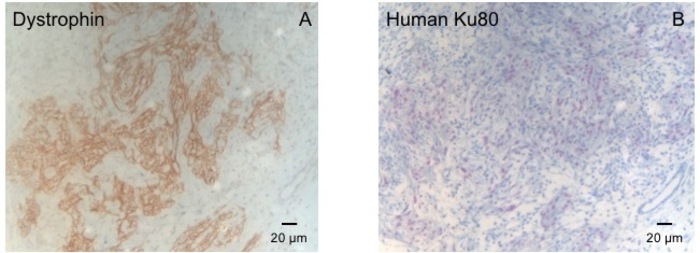
Figure 3 : la coloration à la dystrophine et humaine Ku80. (A) dystrophine coloration montre gros muscles îles (brun) dans la zone de la cicatrice (B) Ku-coloration de paraffine sectionné le cœur. Ku-80 est un anticorps spécifiques à l’homme. Par conséquent, les cellules colorées positivement (couleur marron) sont d’origine humaine. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
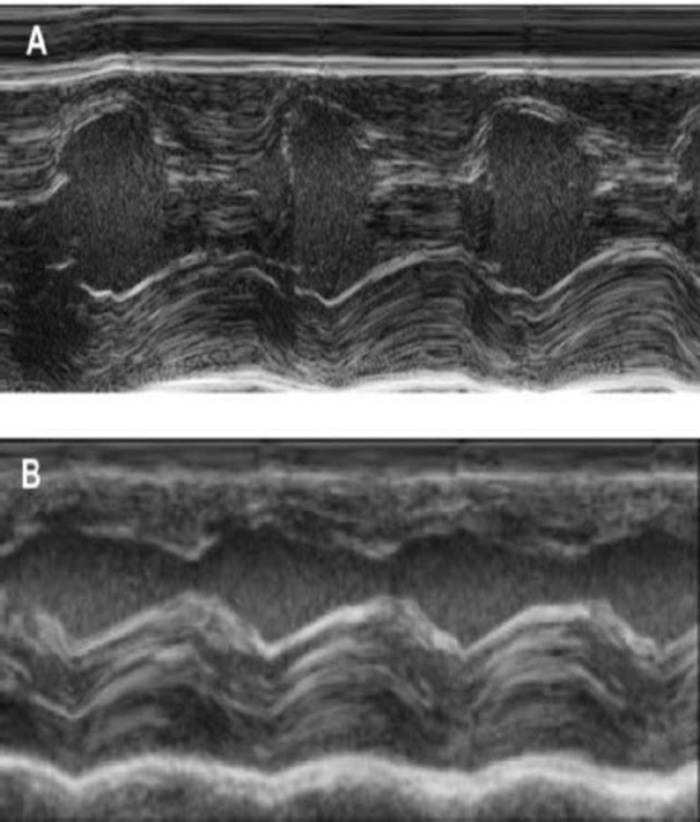
Figure 4 : mesure de M-Mode du ventricule gauche à l’aide d’échocardiographie transthoracique. (A) au départ et (B), une semaine après la cryoinjury. (IVS : septum intraventriculaire, LV : ventricule gauche, PW : mur postérieur). Mesures sont effectuées 3 fois. Au départ, 1 semaine après cryoinfarction et 4 semaines après l’implantation de l’ISE s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Il existe une variété de petits modèles animaux étudier l’effet que la transplantation de cellules exerce le cœur blessé9,10,11. Nous avons choisi un modèle de cobaye à cause de tous les petits animaux modèles sa (électro) physiologie ressemble plus étroitement à celui de l’homme. Les avantages des petits modèles animaux sont logement simple, coûts contrôlables et quelques groupes de travailleurs. En comparaison avec des souris et des rats, physiologie de la Guinée pigs´ cardiaque (électro) est plus semblable à l’homme. En particulier la fréquence cardiaque est inférieure (~250/min), montre potentiel action ventriculaire une phase de plateau et le courant potassique jekr est important pour la repolarisation7. En outre, la taille des animaux facilite chirurgies, qui est particulièrement important qu’une re-thoracotomie est nécessaire une semaine après l’induction de la blessure. Toutefois, cochons d’Inde sont sensibles à l’anesthésie nécessitant une certaine expérience.
Shiba et al., décrit l’utilisation de 50 mg/kg de xylazine kétamine et 2 mg/kg (i.p.) pour anesthésier les cobayes pour cardiaque cryoinjury4. Nous avons également évalué ce régiment de l’anesthésie. Un des inconvénients est le fait qu’il est impossible de suspendre l’effet narcotique de xylazine et de kétamine par manque de puissants antidotes. Considérant que les cochons d’Inde sont à haut risque d’hypoglycémie lors d’interventions chirurgicales, nous avons décidé d’utiliser un gaz narcotique dont l’effet est facile à contrôler et donc conduit à une phase de récupération anesthésie très court. Une trachéotomie est utilisée pour assurer une ventilation sécuritaire tout au long de la procédure. Une intubation oro-trachéale est techniquement très exigeante chez les cobayes, comme la visualisation de l’ouverture de la trachée est souvent difficile et une intubation sécuritaire ne peut être garantie.
Bien que la cryo-blessure provoque une lésion myocardique grave il miroir pas précisément une maladie coronarienne / infarctus du myocarde chez les humains. À cet égard, la ligature de la LAD ou même un modèle de lésion d’ischémie-reperfusion plusieurs récapitule étroitement la physiopathologie humaine. Toutefois, l’anatomie de l’artère coronaire chez les cobayes se caractérise par une garantie étendue. Par conséquent, une ligature de l’artère coronaire descendante antérieure gauche n’entraîne pas reproductible en grandes blessures myocardiques en cobayes12,13. LAD-ligature chez les souris et les rats mène à un vaste remodelage et finit par l’amincissement de la paroi antérieure, une caractéristique qui n’est pas vu chez l’être humain dans cette mesure. Le modèle de cryo-blessure de cobaye induit des processus de remodelage et amincissement de la paroi ventriculaire, mais dans une certaine mesure, qui ressemble plus à un myocardique des blessures chez les humains. Par conséquent, un modèle de cryoinjury, ce qui entraîne une lésion myocardique plus fiable a été choisi13. Periprocedural mortalité constitue un problème majeur avec ce modèle. Au départ, environ 30 % des animaux sont morts au cours de la première opération ou dans les 7 jours après la lésion cardiaque. Un autre 30 % sont morts pendant la comptabilité implantation ISE pour une mortalité globale de 60 %. Plusieurs modifications conduisent à une diminution significative de la mortalité. Isoflurane induit la salivation lourde et la sécrétion bronchique. L’atropine réduit la sécrétion bronchique et a été un facteur majeur pour réduire la mortalité. Le deuxième facteur qui a fortement diminué la mortalité est l’utilisation d’un fer à souder pour libérer le cachet en métal froid du cœur. L’eau chaude a été initialement utilisé pour détacher le timbre par le myocarde. Cependant, il était difficile d’enlever l’eau de la cavité thoracique. La respiration influence négative sur l’eau et conduit à l’élaboration de l’adhérence qui s’est aggravée le pronostic animal´s restants. Une autre modification qui a une influence positive sur la procédure était la protection du poumon gauche depuis le cachet en métal froid avec une compresse. Après ces modifications ont été mises en œuvre mortalité a chuté à environ 20 % pour le fonctionnement de la lésion cardiaque (y compris la première semaine post-opératoire) et un autre 25 % destinés à la transplantation de l’ISE. Induction de cryo blessure représente l’opération techniquement plus facile et des résultats constants peuvent être réalisés après que 5-10 animaux ont été opérés sous surveillance. ISE-transplantation est plus exigeante et environ 20 interventions chirurgicales sous surveillance sont recommandées jusqu'à ce qu’on trouvera des résultats reproductibles.
Au début, nous avons utilisé une solution saline tiède pour rincer le cœur et, par conséquent, détacher la sonde congelée de la paroi ventriculaire gauche. Cette procédure est plus facile à manipuler, mais quelques millilitres de solution saline restent dans le thorax augmente le risque d’insuffisance respiratoire.
En conclusion, le modèle cobaye dépeinte est reproductible, peu coûteux et conduit à des résultats cohérents. Échocardiographie transthoracique offre un outil réalisable et non invasif pour évaluer la présence d’une lésion cardiaque avant réopération et greffe-implantation est effectuée.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Aucun des auteurs a des intérêts financiers divergents ou autres conflits d’intérêts à déclarer.
Acknowledgments
Aucun financement n’a été reçu pour cette étude
Materials
| Name | Company | Catalog Number | Comments |
| Ventilator (VetFlo Dual Mode) | Kent Scientific | ||
| Forene | abbvie | 1000009819 | |
| Carprofen | Zoetis | 256692 | |
| Atropin | Braun | PZN 00648037 | |
| Buprenorphin | Sigma | ||
| Metal stamp | |||
| Electric soldering iron | Claytools | ||
| 3-0 prolene suture | Ethicon | ||
| 4-0 prolene suture | Ethicon | 662SLH | |
| 5-0 prolene suture | Ethicon | 8710H | |
| 8-0 prolene suture | Ethicon | 8841H | |
| Tungsten Carbide Scissor | FST | No. 14568-12 | |
| Stainless sterilization Container | FST | No. 20890-51 | |
| Graefe Forceps | FST | No.11652-10 | |
| Extra fine Graefe Forceps | FST | No.11150-10 | |
| Forceps | FST | No. 11022-15 | |
| Halsted- Mosquito | FST | No. 13009-12 | |
| Forceps | FST | No.13003-10 | |
| Baby Mixter | FST | No. 13013-14 | |
| Needle holder (Castroviejo with Tungsten Casbide Jaws) | FST | No. 12565-14 | |
| Needle Holder (Halsey) | FST | No. 12501-13 | |
| Alm Retractor with Blumt Teeth | FST | No. 17008-07 | |
| Spring Scissor | FST | No. 15000-00 | |
| Compress 5x5 | Fink + Walter | PZN 08821417 | |
| Venflon Pro Safety | Becton Dickinson | PZN11123964 | |
| Cautery High Temp 2" | Bovie Medical Corporation | 0100607151011055 |
References
- Kirklin, J. K., et al. Seventh INTERMACS annual report: 15,000 patients and counting. The Journal of heart and lung transplantation: the official publication of the International Society for Heart Transplantation. 34, 1495-1504 (2015).
- Soonpaa, M. H., Field, L. J. Survey of studies examining mammalian cardiomyocyte DNA synthesis. Circulation research. 83, 15-26 (1998).
- Shiba, Y., Hauch, K. D., Laflamme, M. A. Cardiac applications for human pluripotent stem cells. Current pharmaceutical design. 15, 2791-2806 (2009).
- Shiba, Y., et al. Human ES-cell-derived cardiomyocytes electrically couple and suppress arrhythmias in injured hearts. Nature. 489, 322-325 (2012).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510, 273-277 (2014).
- Kattman, S. J., et al. Stage-specific optimization of activin/nodal and BMP signaling promotes cardiac differentiation of mouse and human pluripotent stem cell lines. Cell stem cell. 8, 228-240 (2011).
- Watanabe, T., Rautaharju, P. M., McDonald, T. F. Ventricular action potentials, ventricular extracellular potentials, and the ECG of guinea pig. Circulation research. 57, 362-373 (1985).
- Weinberger, F., et al. Cardiac repair in guinea pigs with human engineered heart tissue from induced pluripotent stem cells. Science translational medicine. 8, 363ra148 (2016).
- Shiba, Y., et al. Electrical Integration of Human Embryonic Stem Cell-Derived Cardiomyocytes in a Guinea Pig Chronic Infarct Model. Journal of Cardiovascular Pharmacology and Therapy. 19, 368-381 (2014).
- van Laake, L. W., et al. Human embryonic stem cell-derived cardiomyocytes survive and mature in the mouse heart and transiently improve function after myocardial infarction. Stem cell research. 1, 9-24 (2007).
- Zimmermann, W. H., et al. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature medicine. 12, 452-458 (2006).
- Johns, T. N., Olson, B. J. Experimental myocardial infarction. I. A method of coronary occlusion in small animals. Annals of surgery. 140, 675-682 (1954).
- van den Bos, E. J., Mees, B. M., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. Heart and circulatory physiology. , H1291-H1300 (2005).



