Summary
هنا نقدم طريقة للتحقق من صحة ذيل حقن الوريد في الفئران باستخدام الأسفار القريبة من الأشعة تحت الحمراء بيانات التصوير من الأصباغ تدمج العوامل أو المجسات البيولوجية. الذيل يتم تصويرها قبل وبعد الحقن، إشارة الفلورسنت هو كمياً، وهو إجراء تقييم لنوعية الحقن.
Abstract
الحقن في الوريد (رابعا) إدارة وكلاء الوريد ذيل الفئران يمكن أن تكون صعبة وغير متناسقة. الأمثل حقن الوريد الذيل جزء رئيسي من العديد من الإجراءات التجريبية حيث يلزم الكواشف استحداث مباشرة إلى مجرى الدم. عن غير قصد، يمكن أن يكون الحقن تحت الجلد، ربما تغير نتائج علمية. استخدام مجس بيولوجية على أساس نانومولسيون مع صبغ (نيرف) فلورية مدمجة القريبة من الأشعة تحت حمراء، وهذا الأسلوب يوفر القدرة على التصوير ذيل نجاح حقن الوريد المجراة في. باستخدام تصوير نيرف، يتم أخذ صور قبل وبعد حقن عامل. حقن الرابع مقبولة ثم نوعيا أو كمياً يتحدد استناداً إلى كثافة إشارة نيرف في موقع الحقن.
Introduction
مسار إدارة وكلاء في الحيوانات الصغيرة بمثابة نقطة حرجة من العديد من التجارب. وهو يحدد أين الوكيل لتسليمها، وبعد ذلك ما الذي سيحدث بعد ذلك إلى العامل. على الرغم من أن يمكن استخدام طرق أخرى لوكيل الإدارة1، التوجيه عن طريق الحقن الوريدي للتسليم طريق مفضل لبعض العوامل. رابعا الحقن يسمح الوكلاء بالحقن مباشرة في مجرى الدم، تجاوز آثار الأول-تمرير الأنسجة والحاجة إلى absorption1 ذائبة دخيلة. وهذا يسمح أيضا لاستهداف الخلايا في مجرى الدم2،3 والتسليم المباشر لجميع الأنسجة داخل نظام الدورة الدموية. في القوارض، يمكن اعتبار الأوردة عدة، بما في ذلك حبل وفي الصافن، وعلى المنوال الذيل.
في هذا الأسلوب، وصبغ نيرف يتضمن تحقيق البيولوجي — في هذه الحالة، نانومولسيون (الشكل 1A)3،4،،من56-يتم حقن الوريد الذيل الأفقي للفئران. وقد استخدمت هذه نانومولسيون التي تحتوي على نيرف خاص سابقا الصورة، وتعقب neuroinflammation في الحية والسابقين فيفو7، 8 في نموذج الفئران9 من الأم الأعصاب2،،من34، 5،،من1011. يجري تصوير قبل وبعد الحقن مع تصوير fluorescence نير السريري (انظر الجدول للمواد). وهذا بمثابة أداة للتحقق من جودة الإدارة عامل. التصوير قبل يخدم حقن الوريد الذيل كأساس للحصول على صورة خط أساس.
متزايدة في الدراسات الحيوانية، تستخدم نانومولسيونس التي تدار عن طريق الوريد كالمجسات البيولوجية و استهداف وكلاء12،،13،،من1415. تحد ثبت لإدارة وكيلاً عن طريق ال16،المنطلق ذيل17– سواء كان دواء أو ناقل فيروسي أو مسبار آخر – وضمان أن محتويات بالكامل من الحقن دخلت بنجاح في مجرى الدم ولا الأنسجة المحيطة بها17. ولذلك، أسلوب تصور وتقييم نوعية حقنه الناجحة مفيدة.
نموذجياً، يتم استخدام على مصباح الحرارة أو المياه الحارة الحارة الذيل، الذي يسبب تمدد الوريد، سمحت التصور قبل الحقن. في حين أن هذا يضمن دخول أسهل في هذا السياق، لا توجد طريقة كمية لنتبين ما إذا كان المجمع قد دخلت مجرى الدم في مجموعها18،19،،من2021. وهذا يصبح أكثر صعوبة لا تزال في سلالات الحيوانات حيث الوريد يتناقض ضعيف مع الجلد، كما هو الحال في الفئران السوداء. عادة، يمكن قياس المحقق حقن فاشلة التي تعاني من المقاومة خلال الحقن، وفي بعض الحالات، تصور انتفاخ في الذيل، مما يشير إلى تسرب تحت الجلد لل22،عامل23.
في هذه الدراسة، يتم إجراء تصوير نيرف من نانومولسيون حقن الوريد الذيل الأفقي من الفئران حية على نيرف الحيوانات الصغيرة نظام التصوير (انظر الجدول للمواد). يتم تغذية الفئران خاص تنقية النظام الغذائي (انظر الجدول للمواد) للحد من الأسفار القناة الهضمية غير محدد. اكتساب صورة متزامنة من الضوء الأبيض و 800 نانومتر الأسفار يتم التقاطها باستخدام جهاز تصوير نيرف والبرامج المرتبطة بها. كثافة نسبية الأسفار يقاس في ذيل الدول الحقن ما قبل وما بعد الحقن. سجلت كثافة الأسفار عن المنطقة للفائدة (ROI) في موقع الحقن ومقسوما على المنطقة من العائد على الاستثمار. ويمكن إجراء تقييمات نوعية الحقن التي مقبولة. اختيارياً، يمكن إجراء التحليل الكمي كذلك بتحديد عتبات لحقن مقبولة وتعيين قياسات دوروا في مجموعات، وعند هذه النقطة يمكن حسابها بدلالة إحصائية.
باستخدام هذه الاستراتيجية التحقق من الصحة بعد حقن الوريد الذيل، يحسن مستوى دراسة بحثية بسبب زيادة اتساق إدارة وكيل. يمكن تخصيص هذا الأسلوب لتقييم نوعية حقن الوريد ذيل بسهولة للعوامل المختلفة القابلة للحقن تشمل الأشعة تحت الحمراء الفلورسنت المسابير تجارياً التي تقدمها عدة شركات.
Protocol
وأجريت جميع البروتوكولات وفقا للمبادئ التوجيهية الواردة في الدليل لرعاية واستخدام الحيوانات المختبرية للمعاهد الوطنية للصحة ورعاية الحيوان المؤسسية واستخدام اللجنة (إياكوك) في جامعة دوكين.
1-إعداد والتخدير
ملاحظة: وتستخدم تقنيات العقيم للإجراء بأكملها. فقط مواد معقمة جديدة ويعقم الصكوك العقيمة التي ستستخدم. معدات الوقاية الشخصية (قفازات معقمة، بونيه الشعر، قناع الجراحية، ويدعك) يحتاج إلى أن ترتديه لتجنب التلوث.
- واستخدمت الفئران سبراغ داولي الذكور البالغين وزنها 250-300 جم في هذا البروتوكول. تأقلم على الفئران لظروف المعيشة والاحتفاظ بها على ضوء/12 ح 12 دورة الظلام ح وتوفير الغذاء والمياه ad متواصلة. بيت الحيوان اجتماعيا، والاحتفاظ بها على ورقة الأسرة وتقديم خاص حمية (انظر الجدول للمواد) لتجنب أوتوفلوريسسينسي أثناء التصوير.
- مع استخدام وسادة تدفئة وضعها بشكل صحيح، تخدير الحيوان تحت isoflurane 5% أولية في الأوكسجين 20%، يليه مستوى صيانة لا تقل عن 1.5% إيسوفلوراني ولا تزيد عن 3%، ما لم يكن الحيوان يستيقظ أو يحتفظ بالشعور.
- تأكيد التخدير المناسب عن طريق عدم الاستجابة ذيل يقرصه. رصد تدفق الدم، وكذلك عن طريق العلامات الحيوية طوال فترة الإجراءات.
2-قبل حقن الصورة أكويسيتيون
- صورة الحيوان في تصوير fluorescence نير الإكلينيكية طريق وضع الحيوان جانبياً لفضح موقع الحقن في الذيل الأفقي إنشاء خط أساس للأسفار في الذيل (الشكل 1ج، هاء). أداء الحصول على صور متزامنة كلا الضوء الأبيض (عرض الجسم) وبالقرب من القنوات الأشعة تحت الحمراء باستخدام تصوير نيرف والبرامج المرتبطة بها، مع جداول البحث المرتبطة (طرفية).
- بعد التصوير، نقل الحيوان إلى طاولة العمليات الجراحية، ووضعه تحت التخدير لحقن الوريد الذيل.
ملاحظة: مواصلة رصد العلامات الحيوية للحيوان وإعادة فحص أنيسثيتيزيشن السليم عن طريق رشة الذيل.
3-الذيل حقن الوريد مع عامل المحتوية على نيرف
-
مع الحيوان في موقف المعرضة، توجيه الذيل مع الجانب الظهرية مواجها لأعلى. تمدد المفرج الذيل في المياه الدافئة للحد أدنى من 1 دقيقة المشرق الذيل الوريد حتى يتم تشغيل الجانب الأفقي (اليمنى أو اليسرى) 30° (اتجاه عقارب الساعة أو عكس اتجاه عقارب الساعة) لفضح على المنوال ذيل الأيمن أو الأيسر (الشكل 1ب).
- حالما يقع الوريد ذيل أفقي (الذي يظهر بلون داكن عند تمدد)، تطهير ذيل كامل مع منصات الكحول، وتكرار 2 x.
- جرعة مناسبة استناداً إلى تصميم الدراسة، يبدأ الحقن في المنطقة البعيدة coccygeal فقرات الذيل ويتحرك الدانية أكثر إذا فشل موضع الإبرة المناسبة.
- إدراج إبرة معقمة ز 25 – 27، مجسم مشطوف الحواف، الوريد الذيل الأفقي، مع ذيل بزاوية 180 درجة، إدراج الإبرة موازية لرفع الذيل. مراقبة الدم الارتجاع في حافة الإبرة للتأكد من الموضع الصحيح. إذا كان لا يوجد الارتجاع الظاهر، تتحرك ببطء نصيحة إبرة (دون إزالته من الذيل) للبحث عن الإدراج الوريد. إذا وضعت تحت الجلد، سوف يحدث الارتجاع الدم لا.
- إدراج المحاقن مع المواد القابلة للحقن في حافة الإبرة. عندما يتم تحقيق الموضع الصحيح، سوف لا تتحمل السوائل القابلة للحقن المقاومة عند الحقن. سوف تقدم الحقن بيسر وسهولة. بمجرد حقن، إزالة الإبر والمحاقن وتطبيق الضغط مع شاش معقم لمدة 1 دقيقة على الأقل لضمان تخثر الدم والاحتفال البقعة للحقن بقلم على الذيل، ضمان كان مرئياً على صورة الضوء الأبيض.
ملاحظة: لا ورم دموي أو الآفة ستكون مرئية في موقع الحقن. - إذا تحرك طرف الإبرة أثناء الإدراج المحاقن، إزالة الإبرة وإعادة محاولة الإجراء إدخال إبرة الدانية أكثر في هذا السياق الذيل عن. عدم إعادة استخدام نفس الإبرة إذا هو حاول نقطة عودة مختلفة.
ملاحظة: وبدلاً من ذلك، يمكن إجراء الحقن مع قسطرة الرابع مع مؤشر تدفق دم (انظر الجدول للمواد). وهذا قد يعود بالنفع لتأكيد البصرية للقسطرة أثناء فينيبونكتوري. أدخل القسطرة، مجسم مشطوف الحواف الجانبية، في الزاوية المذكورة سابقا. مراقبة سرعة الارتجاع في طول مؤشر تدفق الدم التأكد من الموضع الصحيح. يمكن استخدام الضغط الخلفي طفيفة لسحب الدم في المحاقن لتأكيد التنسيب السليم في السفينة قبل الحقن. مرة أخرى، سوف يشعر أي مقاومة.
4-الحصول على الصور بعد الحقن
- إجراء تقييم الجودة بعد حقن الوريد الذيل في جهاز تصوير fluorescence نير الإكلينيكية في نفس اتجاه الصورة قبل حقن خط الأساس. ضمان لا يزال بشكل صحيح يتم تخديره الحيوان – وسيكون ذلك خلال مدة تصوير – قبل وضعه في التصوير.
ملاحظة: ينبغي أن تستخدم نظام تصوير الذي يحتوي على اتصالات تخدير هوسينجويث درج وقناع للحيوان إذا كانت متوفرة. - توجيه الحيوان على جانبه الوحشي لفضح الحقن (كما تم وضع علامة) على الذيل الأفقي. تحقق لمعرفة ما إذا كانت هذه إشارة نيرف فقط في موقع الحقن. وهذا يدل حقن الوريد ذيل ناجحة (الشكل 1د).
ملاحظة: إذا هو الإشارة المنتشرة في جميع أنحاء كامل الذيل، فإنه يعتبر أن يكون تحت الجلد، ومن ثم غير الناجحة (الشكل 1و). ويبين الشكل 2 أمثلة إضافية للحقن الفاشلة.
5-صورة القياس الكمي
ملاحظة: يمكن إجراء تقدير حجم الصورة مع برامج التصوير التي ترافق تصوير الجرد، إذا كانت تتوفر هذه الوظيفة. بدلاً من ذلك، قد تكون برامج تحليل الصور المتاحة تجارياً أخرى تستخدم24.
- في الصورة بعد الحقن، ورسم منطقة لاهتمام حول المنطقة الأسفار في موقع الحقن2،6.
- قياس المنطقة وكثافة نسبية الأسفار وسجل كمنطقة/كثافة. مقارنة الصور قبل الحقن بعد الحقن والأساس أما نوعيا أو قوانتيتيفيلي باستخدام التحليل الإحصائي المناسب (اعتماداً على مجموعات الدراسة والشروط).
ملاحظة: يمكن أن يقرر الباحث العتبات التي تميز الصالح من حقن سيئة أو تعيين نسبة مئوية للجودة للحقن.
Representative Results
الفئران تم حقن الوريد الذيل الأفقي مع نانومولسيون التي تحتوي على نيرف، وأخذت الصور قبل وبعد حقن مع تصوير الحيوانات الصغيرة (جدول المواد) كما هو موضح في البروتوكول. الصور الحقن بعد تقييم لنوعية الحقن نوعيا ووضعها في 'حقن جيدة' (n = 7) و 'حقن سيئة' (n = 4) مجموعات. أجرى تقييم النوعية عن طريق مراقبة كثافة الأسفار بعد حقن المنطقة. في حقن أمثل، إشارة نيرف تنحصر في موقع الحقن. لا توجد إشارة سيتضح إذا الحقن ناجحاً لأن الوكيل قد شردوا تماما إلى مجرى الدم. حقنه سيئة النوعية عرض إشارة نيرف أن ينتشر على طول الذيل.
وجرى تحليل الصور مع برنامج تصوير نيرف المصاحبة لها. واستمدت مناطق المصالح في موقع الصور قبل الحقن (الشكل 1ج، هاء)، وحول المنطقة من الأسفار في الصور بعد الحقن (الشكل 1د، و). صور مرئية طوال طول الذيل فيها الأسفار يعتبر غير مقبول وإزالته من التحليل (الشكل 2). وسجلت قياسات لكثافة المنطقة والأسفار. حسبت قيم كثافة المنطقة/الأسفار والمرسومة (الشكل 1ز). فرق كبير (مزاوج تي-اختبار) الأسفار لوحظ كثافة بين الصور قبل وبعد الحقن في المجموعة 'حقن سيئة' (الشكل 1ز) (p = 0.0024).
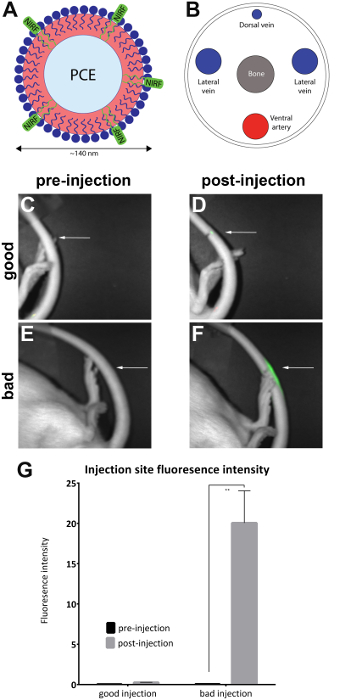
الشكل 1 : نيرف على أساس نانومولسيون وصور من المنطلق الذيل. (A) A المستندة إلى نانومولسيون مسبار البيولوجية التي تحتوي على صبغ نيرف كان حقن الوريد الذيل (ب) الجانبية وتصويرها في تصوير نيرف. (ج ود) قبل بوستينجيكتيون الصور ومن حقنه جيدة. (E و F) قبل بوستينجيكشن الصور ومن حقنه سيئة. تشير الأسهم البيضاء إلى نقطة الحقن. فمن الممكن لتقييم نجاح حقنه جيدة مقارنة بحقنه سيئة بتقييم مدى إشارة نيرف في موقع الحقن نوعيا. عرض الأسفار طوال طول الذيل الحقن غير مقبول وتم إزالته من التحليل (الشكل 2). (ز) يمكن أيضا تحليل الصور للكشف عن مقياس كمي لشدة الأسفار، مع عتبات لنوعية الحقن المعينة من قبل المحقق. تعبر مجالات الخطأ في الرسم البياني sem. لمجموعة 'حقن جيدة'، n = 7. لمجموعة 'حقن سيئة'، n = 4. هناك فرق إحصائية في كثافة fluorescence في المجموعة 'حقن سيئة' عند مقارنة الصور السابقة وبوستينجيكتيون (مزاوج تي-اختبار؛ p = 0.0024). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 2 : أمثلة لحقن سيئة- (أ) إشارة الفلورسنت ينظر في جزء من الذيل. (ب) إشارة الفلورسنت شهدت على مدى كامل طول الذيل. (ج) إشارة الفلورسنت فرقت اعتماداً كبيرا في مجال والذيلية لجسم الحيوان وذيل كامل. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Discussion
مختبرات أبحاث تكبد تكاليف كبيرة نتيجة المتعلقة وكلاء الاختبار. حقن الوريد الذيل تقنية صعبة للصفحة الرئيسية لبلوغ معدل النجاح المستمر، مع الأكثر خبرة من أخصائيي التكنولوجيا غالباً ما تحمل الأخطاء المتعلقة. لا يوجد أي طريقة يمكن الاعتماد عليها لتأكيد حقنه ناجحة. هذا البروتوكول يوفر حلاً لهذه المشكلة بإعطاء الباحثين أسلوب النوعي والكمي للتحقق من نجاح حقن الوريد موريني الذيل. هنا، يشتمل المسمى نيرف نانومولسيون7،،من825 وكيلاً للاختيار (في هذه حالة، المخدرات)، ويتم تصويرها في موقع الحقن في تصوير الحيوانات صغيرة نيرف. وهناك أيضا خيار لوضع عامل غير المستندة إلى نانومولسيون وتستخدم نفس المبدأ نيرف التصوير من خلال دمج الأصباغ الأشعة تحت الحمراء متوفرة تجارياً. بالإضافة إلى ذلك، وكلاء التصوير جاهزة للاستخدام مع مجموعة متنوعة من التطبيقات، مثل الورم التصوير، والايض التصوير، خلية الاتجار بالأشخاص، والمبرمج أيضا متوفرة تجارياً. حقن تتم أما باستخدام إبرة معقمة، أو بدلاً من ذلك، قسطرة الرابع؛ وهذا يتوقف على تفضيل الباحث. وباﻹضافة إلى ذلك، ذيل الآلي الوريد الحقن26 قد استخدمت للمساعدة في هذه العملية، ومتوافقة مع هذه المنهجية. ومع ذلك، هذه التكنولوجيا لم تصبح بعد المتاحة تجارياً.
وهناك خطوات هامة في أسلوب الحقن بالوريد الذيل التي تضمن نسبة أعلى من الإدارة عامل الصحيح. أولاً، يجب تنظيف الذيل مع الإيثانول لإزالة أي أوساخ أو الحطام، يسمح للباحثين رؤية أفضل وعلى المنوال. معلقاً على المنوال بغمر الذيل في المياه الدافئة أيضا خطوة هامة جداً في الأسلوب، كما أنه يتيح مساحة أكبر للحقن. عن طريق الحقن في نقطة القاصي أكثر في هذا السياق ذيل يسمح لبعض الأخطاء، بمحاولات متعددة مطلوبة. ينبغي محاولة حقن في موقف أكثر الدانية في الذيل كما السياق ذيل زيادات في حجم كما اقترب من الجانب والذيلية لجسم الحيوان. وبالإضافة إلى ذلك، يمكن استخدامها في السياق ذيل كونترالاتيرال إذا فشل وضع إبرة في أكثر من ثلاثة إلى خمسة مواقع في هذا السياق الذيل عن.
وجود إدارة ناجحة لعميل اختبار النتائج في قليل من أي إشارة نيرف نقطة الحقن. إذا كان هو رأي أي مقاومة أثناء إدارة الحقن وهناك القليل للا صف في الذيل، ثم الحقن يمكن تسجيل ناجحة. إذا كان هو شعر المقاومة خلال الحقن وهناك إشارة درب نيرف على بعض طول الذيل، ثم الحقن يتم تسجيلها كغير ناجحة، ومن المرجح جزئيا تحت الجلد. يتم أخذ صور الأسفار ما قبل وما بعد الحقن، وهو تقييم نوعية الحقن بمراقبة النوعية أو تحليل كمي إشارة fluorescence في موقع الحقن. البرامج المصاحبة لتصوير fluorescence الجرد غالباً ما قادرة على القيام بهذا التحليل.
الأسلوب يمكن تكييفها بطرق عدة. وينطبق ذيل حقن الوريد في الفئران والجرذان. معظم الحيوانات الصغيرة نير fluorescence التصوير ستكون قادرة على استيعاب مورين القوارض. مستويات تخدير يلزم تعديله تبعاً لوزن الحيوان، وفقا لبروتوكول إياكوك في مختبر أبحاث. وهو آخر احتمال تعديل إعداد التحقيق غير المستندة إلى نانومولسيون أما بتضمين عامل صيغت للباحث صبغة الأشعة تحت حمراء أو بواسطة شراء عامل تصوير جاهزة للاستخدام، ومصممة خصيصا لتطبيق معين بيولوجية.
إذا فأر كبير نسبيا، فإنه كثيرا ما يكون من الصعب على وضعه في تصوير الحيوانات الصغيرة. وبالتالي يوصي بأن يتم أخذ صورة اختبار مع الحيوان في الدرج قبل الحقن، ومجال رؤية تأكدت فيها مرئياً الذيل. فمن المفيد للشريط الذيل للساحب للتصوير، التأكد من أنها لا تتحرك أثناء التصوير.
الطرق البديلة التي تسعى إلى تقييم نوعية السياق ذيل الحقن في الحيوانات الصغيرة محدودة للاستفادة من تصنيف الكواشف التي لا تتداخل مع إجراءات تجريبية المتزامنة وتتطلب القتل الرحيم للحيوانات بوستينجيكتيون 12،13. بعض الكواشف قد تؤثر على نتائج الدراسة والتقييم العلاجية للحيوانات، حيث يوصي بالرعاية في التصميم التجريبي.
هذا الأسلوب في المستقبل، يمكن صقل مع التقدم في تكنولوجيا التصوير الحيوانات الصغيرة، فضلا عن التحسينات في تحقيقات الفلورسنت الأشعة تحت الحمراء. يمكن استخدام المجسات البيولوجية مع صبغة الأشعة تحت حمراء مدمجة، مصممة لمجموعة متنوعة من التطبيقات المختلفة، في مرحلة تصميم دراسة الإدارة عامل للتحقق من جودة حقنه، كما هو مبين في هذا الأسلوب2،3 ،27،،من2829،30،،من3132.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgments
J.A.P. و J.M.J. معا تصميم نهج تجريبي لتقييم نانومولسيونس في نموذج الفئران "انقباض الإصابة المزمنة" للآثار في الأم الأعصاب. J.M.J. تصور وتصميم نهج تسليم المخدرات تستهدف بلعم عموما مع نانومولسيونس، وتكوين نانومولسيون، وعمليات التصنيع. إنتاج J.M.J. نانومولسيون، التي لفقتها كذلك بتوجيه J.M.J. تم تقييم استقرار نانومولسيون بالرعاية J.M.J. ول، والحيوان ل. س، والجراحة، والسلوك، حقن الوريد الذيل، وتصوير نيرف أجريت باﻻشتراك ماجستير و A.M.S. بتوجيه J.A.P. كتب المخطوطة والتي أعدها م. س.، وكتب على البروتوكول بواسطة A.M.S.
وأجرى نير التصوير الضوئي على "نظام التصوير الحيوانات الصغيرة" في جامعة دوكين (بدعم من منحة بذور مبادرة الهندسية بيتسبرغ الأنسجة). وتسلم J.M.J. الدعم من وزارة الدفاع جائزة رقم FA8650-17-2-6836 والنداء جائزة رقم 1R21DA039621-01، نيبيب جائزة رقم R21EB023104-02 و "جائزة أفمسا" رقم FA8650-17-2-6836. J.A.P. و J.M.J الاعتراف بدعم من "منحة بذور مبادرة الهندسية بيتسبرغ الأنسجة". كما تسلم J.A.P. جائزة المرض اللعين هونكيلي وصموئيل ومؤسسة الشتاء أيما والصندوق الثاني تشارلز هنري ليتش وجائزة تعزيز رابطة البحوث العالمية. J.A.P. و J.M.J. الاعتراف بدعم من عميد الافتتاحية "جامعة دوكين التخصصات اتحادات منحة بحثية"، الذي يدعم "اتحاد البحوث الألم المزمن".
Materials
| Name | Company | Catalog Number | Comments |
| 100% Oxygen air tank | AirGas Heathcare | n/a | For ventilation of animal. |
| 70% Ethanol | Multiple sources | n/a | |
| Alcohol Pads | Henry Schein | 112-6131 | |
| Artificial Tears | Henry Schein | 100-2634 | This protects the rats eyes while it is anesthetized. |
| Beaker | Multiple sources | n/a | This holds warm water to dilate the tail veins. |
| Distilled water | Multiple sources | n/a | |
| Exhaust Fans | Hazard Technologies | n/a | For ventilation of lab, if it is not built in. |
| Face Mask | Multiple sources | n/a | |
| Gas Chamber with tubing and face mask | Multiple sources | n/a | |
| Gauze Pads | Henry Schein | 100-2634 | |
| Hair Bonnet | Multiple sources | n/a | |
| Heating Lamp | Multiple sources | n/a | |
| Heating Pad | Multiple sources | n/a | |
| Isoflurane | Southmedic Inc. | ND66794-013-25 | |
| Padded Bench Cloth | Box Board Products Inc. | 026755100I | |
| Pearl Small Animal Imager | Li-COR Biosciences | ||
| Pearl Trilogy Small Animal Imaging System | LI-COR Biosciences | n/a | Quote available via manufacturers web site. Other manufacturers such as Perkin Elmer (VisEn Medical FMT) offer preclinical NIR fluoresence imagers. |
| Scrubs, lab coat, shoe covers | Multiple sources | n/a | |
| Sharps container | Multiple sources | n/a | |
| special diet | Research Diets, Inc, New Brunswick, NJ | ||
| Sprague-Dawley rats | Hilltop Animals, Springdale, PA | ||
| Sterile injection cap | Multiple sources | n/a | |
| Sterile needle, 27 G | Multiple sources | n/a | |
| SURFLO IV Catheter, 24 G, yellow | TERUMO | SR+OX2419C1 | This is an alternative to using a sterile needle. It provides additional indication of correct venous insertion. |
| Surgical gloves | Multiple sources | n/a | |
| Surgical Tape | Multiple sources | n/a |
References
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: routes of administration and factors to consider. Journal of the American Association for Laboratory Animal Science: JAALAS. 50 (5), 600-613 (2011).
- Janjic, J. M., et al. Low-dose NSAIDs reduce pain via macrophage targeted nanoemulsion delivery to neuroinflammation of the sciatic nerve in rat. Journal of Neuroimmunology. 318, 72-79 (2018).
- Patel, S. K., Beaino, W., Anderson, C. J., Janjic, J. M. Theranostic nanoemulsions for macrophage COX-2 inhibition in a murine inflammation model. Clinical Immunology. 160 (1), 59-70 (2015).
- Patel, S. K., Janjic, J. M. Macrophage targeted theranostics as personalized nanomedicine strategies for inflammatory diseases. Theranostics. 5 (2), 150-172 (2015).
- Patel, S. K., Zhang, Y., Pollock, J. A., Janjic, J. M. Cyclooxgenase-2 inhibiting perfluoropoly (ethylene glycol) ether theranostic nanoemulsions-in vitro study. PLOS ONE. 8 (2), 55802 (2013).
- Liu, L., Bagia, C., Janjic, J. M. The First Scale-Up Production of Theranostic Nanoemulsions. BioResearch Open Access. 4 (1), 218-228 (2015).
- Patel, S. K., Patrick, M. J., Pollock, J. A., Janjic, J. M. Two-color fluorescent (near-infrared and visible) triphasic perfluorocarbon nanoemuslions. Journal of Biomedical Optics. 18 (10), 101312 (2013).
- O'Hanlon, C. E., Amede, K. G., O'Hare, M. R., Janjic, J. M. NIR-labeled perfluoropolyether nanoemulsions for drug delivery and imaging. Journal of Fluorine Chemistry. 137, 27-33 (2012).
- Bennett, G. J., Xie, Y. K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain. , (1988).
- Vasudeva, K., et al. In vivo and systems biology studies implicate IL-18 as a central mediator in chronic pain. Journal of Neuroimmunology. 283, 43-49 (2015).
- Vasudeva, K., et al. Imaging neuroinflammation in vivo in a neuropathic pain rat model with near-infrared fluorescence and (1)(9)F magnetic resonance. PLOS ONE. 9 (2), 90589 (2014).
- Cheng, Y., Liu, M., Hu, H., Liu, D., Zhou, S. Development, Optimization, and Characterization of PEGylated Nanoemulsion of Prostaglandin E1 for Long Circulation. AAPS PharmSciTech. 17 (2), 409-417 (2016).
- Fofaria, N. M., Qhattal, H. S., Liu, X., Srivastava, S. K. Nanoemulsion formulations for anti-cancer agent piplartine--Characterization, toxicological, pharmacokinetics and efficacy studies. International Journal of Pharmaceutics. 498 (1-2), 12-22 (2016).
- Ganta, S., et al. EGFR Targeted Theranostic Nanoemulsion for Image-Guided Ovarian Cancer Therapy. Pharmaceutical Research. 32 (8), 2753-2763 (2015).
- Shah, L., Kulkarni, P., Ferris, C., Amiji, M. M. Analgesic efficacy and safety of DALDA peptide analog delivery to the brain using oil-in-water nanoemulsion formulation. Pharmaceutical Research. 31 (10), 2724-2734 (2014).
- Maruyama, H., et al. High-level expression of naked DNA delivered to rat liver via tail vein injection. Journal of Gene Medicine. , (2002).
- Hibbitt, O. C., et al. Delivery and long-term expression of a 135 kb LDLR genomic DNA locus in vivo by hydrodynamic tail vein injection. Journal of Gene Medicine. , (2007).
- Sebestyén, M. G., et al. Mechanism of plasmid delivery by hydrodynamic tail vein injection. I. Hepatocyte uptake of various molecules. Journal of Gene Medicine. , (2006).
- Budker, V. G., et al. Mechanism of plasmid delivery by hydrodynamic tain vein injection. II. Morphological studies. Journal of Gene Medicine. , (2006).
- Lecocq, M., et al. Uptake by mouse liver and intracellular fate of plasmid DNA after a rapid tail vein injection of a small or a large volume. Journal of Gene Medicine. , (2003).
- Park, S., Park, H. -M., Sun, S. -H. Single-dose Intravenous Injection Toxicity of Water-soluble Danggui Pharmacopuncture (WDP) in Sprague-Dawley Rats. Journal of Pharmacopuncture. 21 (2), 104-111 (2018).
- Zhang, X., et al. Activatable fluorescence detection of epidermal growth factor receptor positive mediastinal lymph nodes in murine lung cancer model. PLOS ONE. 13 (6), 0198224 (2018).
- Liu, G., et al. Tracking of transplanted human umbilical cord-derived mesenchymal stem cells labeled with fluorescent probe in a mouse model of acute lung injury. International Journal of Molecular Medicine. 41 (5), 2527-2534 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Janjic, J. M., Srinivas, M., Kadayakkara, D. K., Ahrens, E. T. Self-delivering nanoemulsions for dual fluorine-19 MRI and fluorescence detection. Journal of the American Chemical Society. 130 (9), 2832-2841 (2008).
- Chang, Y. -C., et al. An Automated Mouse Tail Vascular Access System by Vision and Pressure Feedback. IEEE/ASME Transactions on Mechatronics. 20 (4), 1616-1623 (2015).
- Chen, Q., et al. Theranostic imaging of liver cancer using targeted optical/MRI dual-modal probes. Oncotarget. 8 (20), 32741-32751 (2017).
- Tansi, F. L., et al. Activatable bispecific liposomes bearing fibroblast activation protein directed single chain fragment/Trastuzumab deliver encapsulated cargo into the nuclei of tumor cells and the tumor microenvironment simultaneously. Acta Biomaterialia. 54, 281-293 (2017).
- Li, S., Johnson, J., Peck, A., Xie, Q. Near infrared fluorescent imaging of brain tumor with IR780 dye incorporated phospholipid nanoparticles. Journal of Translational Medicine. , (2017).
- Gao, M., Yu, F., Lv, C., Choo, J., Chen, L. Fluorescent chemical probes for accurate tumor diagnosis and targeting therapy. Chemical Society Reviews. , (2017).
- Wang, R., Han, X., You, J., Yu, F., Chen, L. Ratiometric Near-Infrared Fluorescent Probe for Synergistic Detection of Monoamine Oxidase B and Its Contribution to Oxidative Stress in Cell and Mice Aging Models. Analytical Chemistry. 90 (6), 4054-4061 (2018).
- Han, X., Song, X., Yu, F., Chen, L. A Ratiometric Near-Infrared Fluorescent Probe for Quantification and Evaluation of Selenocysteine-Protective Effects in Acute Inflammation. Advanced Functional Materials. 27 (28), 1700769 (2017).



