Summary
Qui presentiamo un metodo per convalidare le iniezioni della vena della coda in ratti utilizzando vicino infrarosso fluorescenza dati di imaging da coloranti incorporati in agenti o sonde biologiche. La coda è ripreso prima e dopo l'iniezione, il segnale fluorescente è quantificato, e viene fatta una valutazione della qualità di iniezione.
Abstract
Somministrazione endovenosa (IV) di agenti nella vena della coda dei ratti può essere difficile e incoerente. Ottimizzazione delle iniezioni della vena della coda è una parte fondamentale di molte procedure sperimentali dove i reagenti devono essere introdotti direttamente nel flusso sanguigno. Involontariamente, l'iniezione può essere sottocutaneo, possibilmente alterando i risultati scientifici. Utilizzando una sonda biologica basati su Nanoemulsione con un colorante fluorescente incorporato (NIRF) all'infrarosso, questo metodo offre la capacità di imaging un'iniezione della vena della coda successo in vivo. Con l'uso di un imager NIRF, le immagini sono prese prima e dopo l'iniezione dell'agente. Un'iniezione IV accettabile è quindi qualitativamente o quantitativamente determinata basato sull'intensità del segnale NIRF al sito di iniezione.
Introduction
La via di somministrazione di agenti in piccoli animali serve come un punto critico di molti esperimenti. Determina dove l'agente sta per essere consegnato e, successivamente, cosa succederà all'agente da allora in poi. Anche se altre vie possono essere utilizzati per agente amministrazione1, via endovenosa di consegna è un itinerario preferito per alcuni agenti. IV iniezione permette agli agenti di essere iniettato direttamente nel flusso sanguigno, bypassando effetti di primo passaggio del tessuto e la necessità di absorption1 soluto estranei. Ciò consente anche di targeting cellule nella circolazione sanguigna2,3 e consegna diretta a tutti i tessuti all'interno del sistema circolatorio. Nei roditori, parecchie vene possono essere considerate, tra cui la giugulare, la safena e vena caudale.
In questo metodo, un NIRF tingere contenente una sonda biologica — in questo caso, una Nanoemulsione (Figura 1A)3,4,5,6— viene iniettato nella vena caudale laterale dei ratti. Questo particolare Nanoemulsione contenenti NIRF è stato utilizzato in precedenza per immagine e tenere traccia di neuroinflammation in vivo ed ex vivo7,8 in un modello di ratto9 di dolore neuropatico2,3,4, 5,10,11. La formazione immagine è condotta prima e dopo l'iniezione con un imager di fluorescenza NIR preclinico (Vedi Tabella materiali). Questo serve come uno strumento per convalidare la qualità dell'amministrazione agente. Di imaging prima la coda vena iniezione serve come base per l'ottenimento di un'immagine di base.
Sempre più negli studi sugli animali, somministrato per via endovenosa nanoemulsioni sono utilizzati come sonde biologiche e targeting agenti12,13,14,15. È una sfida provata per amministrare un agente tramite la coda vena16,17— sia esso un farmaco, un vettore virale o un'altra sonda — e per garantire che l'intero contenuto dell'iniezione con successo hanno entrato nella circolazione sanguigna e non il tessuti circostanti17. Pertanto, un metodo di visualizzazione e la valutazione della qualità di un'iniezione di successo è benefico.
In genere, una lampada di calore o di acqua calda viene utilizzato per riscaldare la coda, che provoca la dilatazione della vena, permettendo la visualizzazione prima dell'iniezione. Mentre in questo modo facilita l'ingresso nella vena, non esiste un modo quantitativo di discernere se il composto ha entrato nella circolazione sanguigna nella sua interezza18,19,20,21. Questo diventa più difficile ancora in ceppi di animali dove la vena è contrasta debolmente con la pelle, come ad esempio nei topi di neri. In genere, lo sperimentatore può misurare un'iniezione fallito rivivendo la resistenza durante l'iniezione e, in alcuni casi, visualizzando un rigonfiamento sulla coda, che indica una perdita sottocutanea dell'agente22,23.
In questo studio, la formazione immagine NIRF di Nanoemulsione iniettato nella vena caudale laterale di ratti dal vivo è effettuata su un piccoli animali NIRF sistema di imaging (Vedi Tabella materiali). I ratti sono alimentati uno speciale purificato dieta (Vedi Tabella materiali) per ridurre la fluorescenza del budello non specifici. Acquisizione immagine simultanea di luce bianca e 800 nm fluorescenza viene catturato utilizzando il NIRF imager e software associati. L'intensità di fluorescenza relativa è misurata sulla coda presso gli stati pre-iniezione e post-iniezione. L'intensità di fluorescenza per la regione di interesse (ROI) al sito di iniezione è registrata e diviso per l'area del ROI. Valutazioni qualitative possono essere fatta su cui iniezioni sono accettabili. Facoltativamente, ulteriori analisi quantitativa può essere eseguita impostando soglie per iniezioni accettabile e assegnandolo misurazioni di ROI in gruppi, al punto che può essere calcolata la significatività statistica.
Utilizzando questa strategia di convalida dopo le iniezioni di vena di coda, lo standard di uno studio di ricerca migliora a causa di una maggiore coerenza dell'amministrazione agente. Questo metodo di valutazione della qualità dell'iniezione della vena della coda può essere facilmente personalizzato per diversi agenti iniettabili per includere infra-rosso fluorescente sonde fornite commercialmente da diverse società.
Protocol
Tutti i protocolli sono stati eseguiti in conformità con le linee guida nella Guida per la cura e l'uso di animali da laboratorio del National Institutes of Health e istituzionali Animal Care e uso Committee (IACUC) presso la Duquesne University.
1. preparazione e anestesia
Nota: Adottare tecniche asettiche sono utilizzati per la totalità della procedura. Solo nuovi materiali sterili e strumentario sterile sterilizzato nell'autoclave devono essere utilizzati. Dispositivi di protezione individuale (guanti sterili, cofano capelli, mascherina chirurgica, scrubs) devono essere indossato per evitare contaminazioni.
- In questo protocollo sono stati utilizzati ratti Sprague-Dawley maschi adulti pesano 250 – 300 g. Acclimatare i ratti a condizioni di vita standard, tenerli in un ciclo di 12 h luce/12 h scuro e fornire cibo e acqua ad libitum. Casa l'animale socialmente, tenerli su lettiera in carta e fornire una speciale dieta (Vedi Tabella materiali) per evitare di autofluorescenza durante la formazione immagine.
- Con l'uso di un dissipatore di calore posizionato correttamente, anestetizzare l'animale sotto un iniziale isoflurano 5% a 20% ossigeno, seguita da un livello di manutenzione non inferiore a 1,5% isoflurane e non più del 3%, a meno che l'animale si sveglia o conserva sensazione.
- Confermare la corretta anestesia tramite una mancanza di risposta alla coda pizzichi. Monitorare il flusso di sangue anche tramite segni vitali durante tutta la procedura.
2. pre-iniezione Image Aquisition
- Immagine dell'animale in un imager di fluorescenza NIR preclinico posizionando l'animale lateralmente per esporre il sito di iniezione sulla coda laterale per stabilire una base di fluorescenza nella coda (Figura 1C, E). Eseguire un'acquisizione immagine simultanea di entrambi una luce bianca (vista del corpo), nei pressi di canali a raggi infrarossi utilizzando il NIRF imager e software associato, con tabelle di ricerca collegate (LUT).
- Seguendo la formazione immagine, spostare l'animale nuovamente la tabella chirurgica e posizionarlo sotto anestesia per l'iniezione della vena della coda.
Nota: Continuare a monitorare i segni vitali dell'animale e ricontrollare amputate corretto tramite pizzico di coda.
3. coda vena iniezione con NIRF-contenente agente
-
Con l'animale in posizione prona, orientano la coda con il dorso rivolto verso l'alto. Dilatare il vasculature coda in acqua tiepida per un minimo di 1 minuto Orient la coda della vena così parte laterale (destro o sinistro) è girato 30° (in senso orario o antiorario) per esporre la vena caudale destro o sinistro (Figura 1B).
- Una volta individuata una vena caudale laterale (che appare di colore scuro su dilatazione), disinfettare l'intera coda con tamponi imbevuti di alcool, ripetere 2 volte.
- Ad un dosaggio appropriato basato su disegno dello studio, è necessario iniziare iniezioni nella regione distale coccygeal vertebre della coda e lo spostamento più prossimale in caso di posizionamento corretto dell'ago.
- Inserire un ago sterile da 25 – 27 G, smussatura, nella vena della coda laterale, con la coda con un angolo di 180°, inserire l'ago parallelo alla coda sollevata. Osservare il flashback di sangue nell'orlo dell'ago per assicurare il corretto posizionamento. Se nessun flashback è apparente, muovere lentamente la punta dell'ago (senza rimuoverlo dalla coda) per trovare l'inserzione nella vena. Se inserito per via sottocutanea, si verificherà nessun flashback di sangue.
- Inserire la siringa con i materiali iniettabili nel bordo dell'ago. Quando è raggiunto il corretto posizionamento, il liquido iniettabile non incorrerà in resistenza all'iniezione. L'iniezione avanzerà facilmente e senza problemi. Una volta iniettato, rimuovere l'ago e la siringa, esercitare una pressione con una garza sterile per almeno 1 min assicurare la coagulazione e segnare il punto di iniezione con una penna sulla coda, assicurando che è visibile nell'immagine di luce bianca.
Nota: Nessun ematoma o lesione sarà visibile presso il sito di iniezione. - Se la punta dell'ago si muove durante l'inserimento di siringa, rimuovere l'ago e riprovare la procedura di entrata dell'ago più prossimale sulla vena caudale ipsilateral. Non riutilizzare l'ago stesso se un punto di rientro diverso è provato.
Nota: In alternativa, l'iniezione può essere eseguita con un catetere IV con un indicatore di flusso sanguigno (Vedi Tabella materiali). Questo ha il vantaggio di conferma visiva del catetere durante il prelievo venoso. Inserire il catetere, smusso laterale, l'angolo descritto in precedenza. Osservare il rapido flashback in tutta la lunghezza dell'indicatore del flusso di sangue per garantire il corretto posizionamento. Leggera pressione posteriore può essere utilizzato per tirare il sangue nella siringa per confermare il corretto posizionamento nel vaso prima dell'iniezione. Ancora una volta, non si faranno sentire alcuna resistenza.
4. dopo l'iniezione Image Acquisition
- Effettuare la valutazione di qualità dopo l'iniezione della vena della coda in un imager di fluorescenza NIR preclinico nello stesso orientamento come l'immagine di pre-iniezione della linea di base. Garantire che l'animale è ancora adeguatamente anestetizzato — e sarà così per tutta la durata dell'imaging — prima inserendolo nel riproduttore d'immagini.
Nota: Un sistema di imaging contenente una connessioni di anestesia carenature cassetto e una maschera per l'animale dovrebbe essere usato se disponibile. - Orientare l'animale sul suo lato laterale per esporre il sito di iniezione (come indicato) sulla coda laterale. Verificare se è presente un segnale NIRF solo al sito di iniezione. Questo indica un'iniezione di vena di successo coda (Figura 1D).
Nota: Se il segnale è dispersa in tutta l'intera coda, è considerato essere sottocutaneo e, da qui infruttuoso (Figura 1,F). La figura 2 Mostra ulteriori esempi di iniezioni non riuscite.
5. immagine quantificazione
Nota: Quantificazione di immagine possa essere eseguite con il software di imaging che accompagna il dispositivo di imaging NIR, se questa funzione è disponibile. In alternativa, altri software di analisi di immagine disponibili in commercio può essere utilizzati24.
- Nell'immagine dopo l'iniezione, è possibile disegnare una regione di interesse intorno all'area della fluorescenza presso il sito di iniezione2,6.
- Misurare l'area e l'intensità di fluorescenza relativa e record come zona/intensità. Confrontare le immagini di pre-iniezione post-iniezione e basale sia qualitativamente o quantità utilizzando opportune analisi statistica (dipendente da condizioni e gruppi di studio).
Nota: Il ricercatore può decidere sulle soglie che discriminano bene da iniezioni di cattive o assegnare una percentuale di qualità per l'iniezione.
Representative Results
Ratti sono stati iniettati con nanoemulsione contenenti NIRF nella vena caudale laterale e immagini pre- e post-iniezione sono state scattate con il dispositivo di imaging di piccoli animali (Tabella materiali) come descritto nel protocollo. Post-iniezione immagini qualitativamente sono valutati per la qualità di iniezione e inseriti in 'buona iniezione' (n = 7) e 'cattivo iniezione' (n = 4) gruppi. Valutazione qualitativa è stata effettuata osservando l'intensità di fluorescenza di area di post-iniezione. In un'iniezione ottima, il segnale NIRF è limitato al sito di iniezione. Nessun segnale si vedrà se l'iniezione è riuscita perché l'agente è stato completamente spostato nel flusso sanguigno. Un'iniezione di cattiva qualità Visualizza un segnale NIRF che è sparsa lungo la lunghezza della coda.
Immagini sono stati analizzati con il software NIRF imager. Regioni di interesse sono stati disegnati nel sito di immagini pre-iniezione (Figura 1C, E) e intorno alla zona di fluorescenza in immagini post-iniezione (Figura 1D, F). Immagini dove fluorescenza era visibile per tutta la lunghezza della coda sono state ritenute inaccettabili e rimossa dall'analisi (Figura 2). Misure dell'intensità di fluorescenza e di zona sono state registrate. I valori per l'intensità di zona/fluorescenza sono stati calcolati e tracciati (Figura 1G). Una differenza significativa (spaiati t-test) in fluorescenza intensità tra le immagini pre- e post-iniezione è stata osservata nel gruppo 'iniezione male' (Figura 1G) (p = 0,0024).
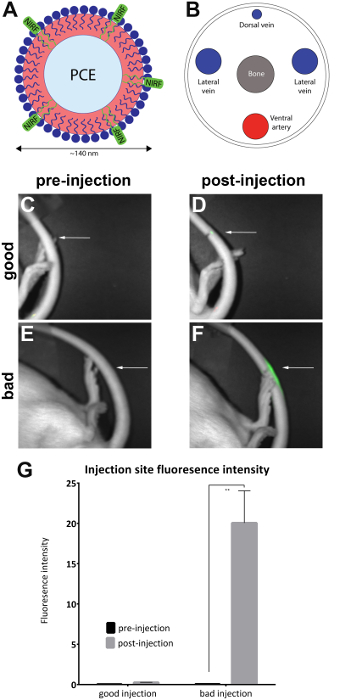
Figura 1 : NIRF base Nanoemulsione e immagini di vena caudale. (A) A basati su Nanoemulsione biologico sonda contenente NIRF colorante è stato iniettato nella vena caudale (B), il laterale e fotografata in un imager NIRF. Immagini pre- e postinjection (C e D) di una bella iniezione. Immagini pre- e postinjection (E e F) di un'iniezione di male. Frecce bianche indicano il punto di iniezione. È possibile valutare qualitativamente il successo di una bella iniezione rispetto ad un'iniezione di male di valutare l'entità del segnale NIRF al sito di iniezione. Iniezioni di inaccettabile visualizzare fluorescenza per tutta la lunghezza della coda e sono stati rimossi dall'analisi (Figura 2). (G) le immagini possono anche essere analizzate per rivelare una misura quantitativa dell'intensità di fluorescenza, con soglie per qualità di iniezione assegnate dallo sperimentatore. Le barre di errore sul grafico riflettono SEM. Per il gruppo di 'buona iniezione', n = 7. Per il gruppo di 'male iniezione', n = 4. C'è una differenza statistica in intensità di fluorescenza nel gruppo 'male iniezione' quando si confrontano le immagini pre- e postinjection (spaiati t-test; p = 0,0024). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2 : Esempi di cattive iniezioni. (A) segnale fluorescente visto in parte della coda. (B) segnale fluorescente visto su tutta la lunghezza della coda. (C) segnale fluorescente dispersi pesantemente nella zona caudale del corpo dell'animale e coda intera. Clicca qui per visualizzare una versione più grande di questa figura.
Discussion
Laboratori di ricerca sostengono costi significativi a causa del malgoverno di agenti di test. Iniezioni di vena della coda sono una tecnica difficile da padroneggiare per raggiungere il tasso di successo costante, con il più esperto dei tecnologi spesso incorrere in errori di malgoverno. Non esiste alcun modo affidabile per confermare un'iniezione di successo. Questo protocollo offre una soluzione a questo problema dando ai ricercatori un metodo qualitativo e quantitativo per convalidare il successo di un'iniezione della vena della coda murino. Qui, un NIRF-etichettati Nanoemulsione7,8,25 incorpora l'agente di scelta (in questo caso, un farmaco) ed è ripreso nel sito di iniezione in un imager di piccoli animali NIRF. C'è anche la possibilità di sviluppare un agente non basati su Nanoemulsione e utilizzare lo stesso principio dell'imaging NIRF incorporando commercialmente disponibili infra-rosso coloranti. Inoltre, ready-to-use agenti imaging con una varietà di applicazioni, ad esempio tumore imaging, metabolica di imaging, cella traffico e apoptosi sono anche disponibili in commercio. L'iniezione viene eseguita utilizzando un ago sterile o, in alternativa, un catetere IV; Questo dipende dalla preferenza del ricercatore. Inoltre, coda automatizzato vena iniettori26 sono stati usati per aiutare in questo processo e sono compatibili con questa metodologia. Tuttavia, questa tecnologia non è ancora diventata commercialmente disponibile.
Ci sono passi importanti nel metodo di iniezione della vena della coda che assicurano un più alto tasso di amministrazione agente corretto. In primo luogo, la coda deve essere pulita con etanolo per rimuovere qualsiasi sporco o detriti, consentendo ai ricercatori di visualizzare meglio la vena. Dilatare la vena immergendo la coda in acqua calda è anche un passo molto importante nel metodo, poiché consente una maggiore superficie per l'iniezione. L'iniezione in un punto più distale della vena della coda permette per qualche errore, nel caso in cui i tentativi multipli sono necessari. Iniezione deve essere eseguita in una posizione più prossimale nella coda la vena caudale aumenta di dimensioni, come la funzione caudale del corpo dell'animale è avvicinato. Inoltre, la vena caudale controlaterale può essere utilizzata in caso di posizionamento dell'ago in più di tre a cinque siti su vena caudale ipsilateral.
Una corretta amministrazione di un agente di test risultati in poco o nessun segnale NIRF nel punto di iniezione. Se nessuna resistenza è ritenuta durante la somministrazione dell'iniezione e c'è poco da alcuna fluorescenza alla coda, l'iniezione può essere registrata come successo. Se si avverte resistenza durante l'iniezione e c'è un sentiero di NIRF segnale lungo alcuni lunghezza della coda, poi l'iniezione viene registrata come esito negativo ed è probabile che in parte sottocutaneo. Immagini di fluorescenza sono prese pre- e post-iniezione, e la qualità dell'iniezione è valutata osservando qualitativamente o quantitativamente analizzando il segnale di fluorescenza nel sito di iniezione. Il software che accompagna il dispositivo di imaging di fluorescenza NIR è spesso in grado di eseguire questa analisi.
Il metodo può essere adattato in diversi modi. È applicabile alla coda della vena di iniezione in entrambi i topi e ratti. La maggior parte delle stampanti di fluorescenza NIR piccoli animali sarà in grado di ospitare roditori murini. Livelli di anestesia necessario essere regolato a seconda del peso dell'animale, conformemente al protocollo IACUC di laboratorio di ricerca. Un'altra modifica possibile è la preparazione di una sonda non basati su Nanoemulsione incorporando un colorante a infrarossi in agente formulato del ricercatore o con l'acquisto di un agente di imaging di ready-to-use, su misura per una specifica applicazione biologica.
Se un ratto è relativamente grande, può spesso essere difficile posizionarlo nel dispositivo di imaging di piccoli animali. È pertanto consigliabile che un'immagine di prova è preso con l'animale nel cassetto prima di iniettare, e un campo di vista accertato dove la coda è visibile. È utile su nastro la coda al cassetto del dispositivo di imaging, per assicurarsi che non si muove durante la formazione immagine.
Metodi alternativi che cercano di valutare la qualità della vena caudale iniezioni nei piccoli animali sono limitate all'utilizzo di reagenti che non interferire con le procedure sperimentali simultanee e richiedono l'eutanasia del di postinjection di animali di etichettatura 12,13. Alcuni reagenti possono impatto risultati di uno studio e l'assessment terapeutico degli animali coinvolti, quindi la cura nel disegno sperimentale è suggerita.
Questo metodo può, in futuro, essere raffinato con gli avanzamenti nella tecnologia di imaging di piccoli animali, come pure miglioramenti in sonde fluorescenti a infrarossi. Sonde biologiche con un colorante a infrarossi incorporato, progettato per una varietà di diverse applicazioni, possono essere utilizzati nella fase di amministrazione agente di un disegno di studio per convalidare la qualità di un'iniezione, come indicato in questo metodo2,3 ,27,28,29,30,31,32.
Disclosures
Gli autori non hanno nulla a rivelare.
Acknowledgments
J.A.P e G.M.G. progettato insieme l'approccio sperimentale per la valutazione nanoemulsioni nel modello del ratto di lesione da costrizione cronica per gli effetti sul dolore neuropatico. G.M.G. ideato e progettato l'approccio di consegna della droga nel complesso del macrofago-mirati con nanoemulsioni, Nanoemulsione composizione e processi per la fabbricazione. G.M.G. prodotto Nanoemulsione, che fu ulteriormente fabbricata da L.L. sotto la Guida di G.M.G. La stabilità della Nanoemulsione è stata valutata dalla cura G.M.G., L.L. e S.P. animale, comportamento, chirurgia, iniezioni della vena della coda, e la formazione immagine NIRF sono state effettuate congiuntamente da M.S. e A.M.S. sotto la Guida di J.A.P Il manoscritto è stato scritto e preparato da M.S., e il protocollo è stato scritto da A.M.S.
Imaging ottico NIR è stata eseguita il piccolo sistema di Imaging animale presso la Duquesne University (supportato da Grant seme di Pittsburgh Tissue Engineering iniziativa). G.M.G. riconosce sostegno dal numero di premio DOD FA8650-17-2-6836, NIDA premio numero 1R21DA039621-01, NIBIB premio numero R21EB023104-02 e AFMSA premio numero FA8650-17-2-6836. J.A.P e J.M.J riconoscere sostegno da Grant seme di Pittsburgh Tissue Engineering iniziativa. J.A.P riconosce anche il premio di malattia temuta Hunkele, Samuel ed Emma inverni Foundation, il fondo Charles Henry Leach II e il premio di valorizzazione ricerca universale del Commonwealth. J.A.P e G.M.G. riconoscere sostegno da parte del prevosto di Duquesne University inaugurale interdisciplinare ricerca consorzi Grant, che supporta il Consorzio di ricerca di dolore cronico.
Materials
| Name | Company | Catalog Number | Comments |
| 100% Oxygen air tank | AirGas Heathcare | n/a | For ventilation of animal. |
| 70% Ethanol | Multiple sources | n/a | |
| Alcohol Pads | Henry Schein | 112-6131 | |
| Artificial Tears | Henry Schein | 100-2634 | This protects the rats eyes while it is anesthetized. |
| Beaker | Multiple sources | n/a | This holds warm water to dilate the tail veins. |
| Distilled water | Multiple sources | n/a | |
| Exhaust Fans | Hazard Technologies | n/a | For ventilation of lab, if it is not built in. |
| Face Mask | Multiple sources | n/a | |
| Gas Chamber with tubing and face mask | Multiple sources | n/a | |
| Gauze Pads | Henry Schein | 100-2634 | |
| Hair Bonnet | Multiple sources | n/a | |
| Heating Lamp | Multiple sources | n/a | |
| Heating Pad | Multiple sources | n/a | |
| Isoflurane | Southmedic Inc. | ND66794-013-25 | |
| Padded Bench Cloth | Box Board Products Inc. | 026755100I | |
| Pearl Small Animal Imager | Li-COR Biosciences | ||
| Pearl Trilogy Small Animal Imaging System | LI-COR Biosciences | n/a | Quote available via manufacturers web site. Other manufacturers such as Perkin Elmer (VisEn Medical FMT) offer preclinical NIR fluoresence imagers. |
| Scrubs, lab coat, shoe covers | Multiple sources | n/a | |
| Sharps container | Multiple sources | n/a | |
| special diet | Research Diets, Inc, New Brunswick, NJ | ||
| Sprague-Dawley rats | Hilltop Animals, Springdale, PA | ||
| Sterile injection cap | Multiple sources | n/a | |
| Sterile needle, 27 G | Multiple sources | n/a | |
| SURFLO IV Catheter, 24 G, yellow | TERUMO | SR+OX2419C1 | This is an alternative to using a sterile needle. It provides additional indication of correct venous insertion. |
| Surgical gloves | Multiple sources | n/a | |
| Surgical Tape | Multiple sources | n/a |
References
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: routes of administration and factors to consider. Journal of the American Association for Laboratory Animal Science: JAALAS. 50 (5), 600-613 (2011).
- Janjic, J. M., et al. Low-dose NSAIDs reduce pain via macrophage targeted nanoemulsion delivery to neuroinflammation of the sciatic nerve in rat. Journal of Neuroimmunology. 318, 72-79 (2018).
- Patel, S. K., Beaino, W., Anderson, C. J., Janjic, J. M. Theranostic nanoemulsions for macrophage COX-2 inhibition in a murine inflammation model. Clinical Immunology. 160 (1), 59-70 (2015).
- Patel, S. K., Janjic, J. M. Macrophage targeted theranostics as personalized nanomedicine strategies for inflammatory diseases. Theranostics. 5 (2), 150-172 (2015).
- Patel, S. K., Zhang, Y., Pollock, J. A., Janjic, J. M. Cyclooxgenase-2 inhibiting perfluoropoly (ethylene glycol) ether theranostic nanoemulsions-in vitro study. PLOS ONE. 8 (2), 55802 (2013).
- Liu, L., Bagia, C., Janjic, J. M. The First Scale-Up Production of Theranostic Nanoemulsions. BioResearch Open Access. 4 (1), 218-228 (2015).
- Patel, S. K., Patrick, M. J., Pollock, J. A., Janjic, J. M. Two-color fluorescent (near-infrared and visible) triphasic perfluorocarbon nanoemuslions. Journal of Biomedical Optics. 18 (10), 101312 (2013).
- O'Hanlon, C. E., Amede, K. G., O'Hare, M. R., Janjic, J. M. NIR-labeled perfluoropolyether nanoemulsions for drug delivery and imaging. Journal of Fluorine Chemistry. 137, 27-33 (2012).
- Bennett, G. J., Xie, Y. K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain. , (1988).
- Vasudeva, K., et al. In vivo and systems biology studies implicate IL-18 as a central mediator in chronic pain. Journal of Neuroimmunology. 283, 43-49 (2015).
- Vasudeva, K., et al. Imaging neuroinflammation in vivo in a neuropathic pain rat model with near-infrared fluorescence and (1)(9)F magnetic resonance. PLOS ONE. 9 (2), 90589 (2014).
- Cheng, Y., Liu, M., Hu, H., Liu, D., Zhou, S. Development, Optimization, and Characterization of PEGylated Nanoemulsion of Prostaglandin E1 for Long Circulation. AAPS PharmSciTech. 17 (2), 409-417 (2016).
- Fofaria, N. M., Qhattal, H. S., Liu, X., Srivastava, S. K. Nanoemulsion formulations for anti-cancer agent piplartine--Characterization, toxicological, pharmacokinetics and efficacy studies. International Journal of Pharmaceutics. 498 (1-2), 12-22 (2016).
- Ganta, S., et al. EGFR Targeted Theranostic Nanoemulsion for Image-Guided Ovarian Cancer Therapy. Pharmaceutical Research. 32 (8), 2753-2763 (2015).
- Shah, L., Kulkarni, P., Ferris, C., Amiji, M. M. Analgesic efficacy and safety of DALDA peptide analog delivery to the brain using oil-in-water nanoemulsion formulation. Pharmaceutical Research. 31 (10), 2724-2734 (2014).
- Maruyama, H., et al. High-level expression of naked DNA delivered to rat liver via tail vein injection. Journal of Gene Medicine. , (2002).
- Hibbitt, O. C., et al. Delivery and long-term expression of a 135 kb LDLR genomic DNA locus in vivo by hydrodynamic tail vein injection. Journal of Gene Medicine. , (2007).
- Sebestyén, M. G., et al. Mechanism of plasmid delivery by hydrodynamic tail vein injection. I. Hepatocyte uptake of various molecules. Journal of Gene Medicine. , (2006).
- Budker, V. G., et al. Mechanism of plasmid delivery by hydrodynamic tain vein injection. II. Morphological studies. Journal of Gene Medicine. , (2006).
- Lecocq, M., et al. Uptake by mouse liver and intracellular fate of plasmid DNA after a rapid tail vein injection of a small or a large volume. Journal of Gene Medicine. , (2003).
- Park, S., Park, H. -M., Sun, S. -H. Single-dose Intravenous Injection Toxicity of Water-soluble Danggui Pharmacopuncture (WDP) in Sprague-Dawley Rats. Journal of Pharmacopuncture. 21 (2), 104-111 (2018).
- Zhang, X., et al. Activatable fluorescence detection of epidermal growth factor receptor positive mediastinal lymph nodes in murine lung cancer model. PLOS ONE. 13 (6), 0198224 (2018).
- Liu, G., et al. Tracking of transplanted human umbilical cord-derived mesenchymal stem cells labeled with fluorescent probe in a mouse model of acute lung injury. International Journal of Molecular Medicine. 41 (5), 2527-2534 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Janjic, J. M., Srinivas, M., Kadayakkara, D. K., Ahrens, E. T. Self-delivering nanoemulsions for dual fluorine-19 MRI and fluorescence detection. Journal of the American Chemical Society. 130 (9), 2832-2841 (2008).
- Chang, Y. -C., et al. An Automated Mouse Tail Vascular Access System by Vision and Pressure Feedback. IEEE/ASME Transactions on Mechatronics. 20 (4), 1616-1623 (2015).
- Chen, Q., et al. Theranostic imaging of liver cancer using targeted optical/MRI dual-modal probes. Oncotarget. 8 (20), 32741-32751 (2017).
- Tansi, F. L., et al. Activatable bispecific liposomes bearing fibroblast activation protein directed single chain fragment/Trastuzumab deliver encapsulated cargo into the nuclei of tumor cells and the tumor microenvironment simultaneously. Acta Biomaterialia. 54, 281-293 (2017).
- Li, S., Johnson, J., Peck, A., Xie, Q. Near infrared fluorescent imaging of brain tumor with IR780 dye incorporated phospholipid nanoparticles. Journal of Translational Medicine. , (2017).
- Gao, M., Yu, F., Lv, C., Choo, J., Chen, L. Fluorescent chemical probes for accurate tumor diagnosis and targeting therapy. Chemical Society Reviews. , (2017).
- Wang, R., Han, X., You, J., Yu, F., Chen, L. Ratiometric Near-Infrared Fluorescent Probe for Synergistic Detection of Monoamine Oxidase B and Its Contribution to Oxidative Stress in Cell and Mice Aging Models. Analytical Chemistry. 90 (6), 4054-4061 (2018).
- Han, X., Song, X., Yu, F., Chen, L. A Ratiometric Near-Infrared Fluorescent Probe for Quantification and Evaluation of Selenocysteine-Protective Effects in Acute Inflammation. Advanced Functional Materials. 27 (28), 1700769 (2017).



