Summary
Здесь мы представляем метод для проверки инъекции Вену хвост у крыс, используя ближней ИК-области спектра флуоресценции визуализации данных из красителей включены агенты или биологических пробах. Хвост образы до и после инъекции, количественно флуоресцентного сигнала, и проведена оценка качества инъекции.
Abstract
Внутривенном (IV) агентов в Вену хвост крысы может быть трудным и непоследовательными. Оптимизация инъекции Вену хвост является ключевой частью многих экспериментальных процедур, где реагенты должны вводиться непосредственно в кровоток. Невольно инъекции может быть подкожной, возможно, изменяя научных результатов. Используя nanoemulsion на основе биологических зонд с встроенный инфракрасный Люминесцентную краску (NIRF), этот метод предоставляет возможность обработки изображений в естественных условиях инъекции успешным хвост-Вену. С использованием NIRF тепловизор изображения взяты до и после инъекции агента. Инъекция IV приемлемым затем качественно или количественно определяется на основе интенсивности сигнала NIRF в месте инъекции.
Introduction
Маршрут администрации агентов в мелких животных служит критической точкой многих экспериментов. Он определяет, где агент должен быть доставлен и, впоследствии, что произойдет после этого агенту. Хотя другие маршруты могут использоваться для агента администрирования1, внутривенного маршрут доставки является предпочтительным маршрутом для некоторых агентов. IV инъекции позволяет агентам вводиться непосредственно в кровоток, минуя эффекты первого прохода ткани и потребность посторонние вещества absorption1. Это также позволяет для ориентации клетки в кровь2,3 и прямые поставки во все ткани внутри кровеносной системы. Грызунов можно считать несколько вен, включая яремной, подкожной и хвост Вены.
В этом методе, NIRF краски, содержащие биологические зонд — в данном случае,5,3,4,nanoemulsion (рис. 1A)6— вводят в Вену боковой хвост крысы. Это особое NIRF-содержащих nanoemulsion ранее использовались изображения и отслеживать neuroinflammation in vivo и ex vivo7,8 в модель крыса9 невропатической боли2,3,4, 5,10,11. Визуализация проводится до и после инъекции с доклиническими тепловизор флуоресценции NIR (см. Таблицу материалы). Это служит инструментом для проверки качества агента администрирования. Визуализации до хвост вен инъекций служит основой для получения базового образа.
Все чаще в исследованиях на животных, внутривенно управляемых nanoemulsions используются как биологических пробах и нацеливания агентов12,13,14,15. Это доказано вызов для администрирования агента через хвост вен16,17— будь то наркотики, вирусный вектор или другой зонд — и обеспечить что все содержимое инъекций успешно вступила в кровь и не окружающих тканей17. Таким образом метод визуализации и оценки качества успешного внедрения выгодно.
Как правило тепла лампы или теплой водой используется тепло хвост, который вызывает расширение вен, позволяя ее визуализации до инъекции. Хотя это обеспечивает облегчает ввод в Вену, существует не количественный способ различать вошел ли соединение кровоток в его объеме18,19,,2021. Это становится еще труднее штаммов животных, где Вены контрастирует слегка с кожей, такие как черный мышей. Как правило следователь может измерить неудачных инъекций, испытывают сопротивление во время инъекции и, в некоторых случаях, Визуализация выпуклость на хвост, указывающее подкожной утечки агента22,23.
В этом исследовании, NIRF томография nanoemulsion вводят в Вену боковой хвост живой крысы осуществляется на небольших животных NIRF изображений системы (см. Таблицу материалы). Крыс кормили очищается специальной диете (см. Таблицу материалы) для уменьшения неспецифических кишки флуоресценции. Приобретение одновременное изображение белого света и 800 Нм флуоресценции фиксируются с помощью NIRF тепловизор и соответствующее программное обеспечение. Относительный флуоресценции интенсивность измеряется на хвосте на Предварительный впрыск и впрыск государств. Интенсивность флуоресценции для региона интерес (ROI) в месте инъекции записывается и разделенная на площадь ROI. Качественные оценки могут быть сделаны на которых инъекции являются приемлемыми. При необходимости дальнейшего количественного анализа может осуществляться настройка порогов для приемлемой инъекции и назначение ROI измерения на группы, в какой момент может быть рассчитана статистической значимости.
Используя эту стратегию проверки после инъекции Вену хвост, стандарт исследование улучшает за повышение согласованности агента администрирования. Этот метод оценки качества инъекции Вену хвост можно легко настроить для различных инъекционные агентов включить инфра красных флуоресцентных зондов коммерчески представленная несколькими компаниями.
Protocol
Все протоколы были исполнены в соответствии с руководящими принципами в руководстве для ухода и использования лабораторных животных из Национального института здравоохранения и институциональный уход животных и использование Комитет (IACUC) в Университете Duquesne.
1. Подготовка и анестезии
Примечание: Асептический методы используются для всей процедуры. Только новых стерильных материалов и автоклавного стерильные инструменты должны использоваться. Средства индивидуальной защиты (стерильные перчатки, волосы капота, хирургические маски, скрабы) необходимо носить, чтобы избежать загрязнения.
- Взрослых самцов крыс Sprague-Dawley, весом 250 – 300 g использовались в настоящем Протоколе. Акклиматизироваться крыс для стандартных условий, держать их на свет/12 12 h h темные цикла и снабжению продовольствием и водой ad libitum. Дом животное социально, держать их на бумаге постельных принадлежностей и предоставить специальной диете (см. Таблицу материалы), чтобы избежать аутофлюоресценция во время визуализации.
- С использованием надлежащим образом размещены грелку анестезировать животное под первоначальный 5% изофлюрановая в 20% кислорода, а затем уровень обслуживания не менее 1,5% изофлюрановая и не более 3%, если животное просыпается или сохраняет чувство.
- Подтверждение правильного анестезии через отсутствие реакции на хвост щепотки. Контролировать поток крови а также через признаки жизни на протяжении всей процедуры.
2. Предварительный впрыск изображения приобретение
- Изображение животного в доклинических тепловизор флуоресценции NIR, поместив животное боково подвергать укола на боковых хвост, чтобы создать базовый план флуоресценции в хвост (рис. 1C, E). Выполняйте одновременное изображение приобретение как белый свет (вид тела) и вблизи инфракрасные каналы, с помощью NIRF тепловизор и соответствующее программное обеспечение, с таблицами подстановок связанных (LUT).
- Следующие изображения, переместить животное обратно на операционный стол и поместите его под анестезией для инъекции Вену хвост.
Примечание: Продолжить мониторинг жизнедеятельности животного и перепроверять надлежащего анестезии через хвост пинча.
3. хвост инъекции Вену с NIRF-содержащих агента
-
С животным в лежачем положении Ориентируйте хвост с спинной стороне, обращенной. Разбавить сосудистую хвост в теплой воде в течение не менее 1 мин Ориент хвост вен так боковой (правый или левый) включено 30° (по часовой стрелке или против часовой стрелки) подвергать вправо или влево хвост вен (рис. 1Б).
- После того как боковые хвост Вену был расположен (которая появляется темный после дилатация), дезинфицировать весь хвост с алкоголем колодки, повторяя 2 x.
- В соответствующей дозировке, основанный на дизайн исследования Начните инъекций в регионе дистальной копчикового позвонка хвост и перемещение более проксимальном неудачном надлежащего иглы.
- Вставка 25 – 27 G стерильные иглы, наклонной вверх, в Вену боковой хвост, хвост на угол 180°, вставляя иглу параллельно поднял хвост. Соблюдайте воспоминаниях крови в оправе иглы для обеспечения правильного размещения. Если не кадр является очевидной, медленно перемещайте кончик иглы (без его удаления из хвоста) чтобы найти вену вставки. Если поместить подкожно, произойдет не крови воспоминаниях.
- Вставьте шприц с инъекционными материалами в оправе иглы. Когда будет достигнуто надлежащее размещение, инъекционные жидкость не повлечет сопротивление после инъекции. Инъекции будет заранее плавно и легко. После того, как вводили, удалите иглу и шприц, применить давление с стерильной марлей для по крайней мере 1 мин для обеспечения свертывания и отметить место инъекции с ручкой на хвост, обеспечивая что она видна на белый свет изображение.
Примечание: Нет гематомы или поражения будут видны в месте инъекции. - Если кончик иглы движется во время вставки шприц, удалите иглу и повторите процедуру ввода иглы более проксимальном на ипсилатеральной хвост вен. Не используйте повторно той же иглой точки различных спускаемого при попытке.
Примечание: Кроме того, инъекции могут быть выполнены с IV катетер с индикатором кровотока (см. Таблицу материалы). Это имеет преимущество визуального подтверждения при венепункции катетера. Вставьте катетер, наклона стороны вверх, на угол, в описанный ранее. Наблюдать за оперативное воспоминаниях в всей длине индикатор крови потока для обеспечения правильного размещения. Незначительные Противодавление может использоваться для тянуть крови в шприц для подтверждения правильного размещения на судне перед инъекцией. Опять же будет ощущаться никакого сопротивления.
4. впрыск изображения приобретение
- Выполните оценку качества после инъекции Вену хвост в доклинических тепловизор флуоресценции НИР в ту же ориентацию как Предварительный впрыск базового образа. Обеспечить животное еще правильно наркоз — и так будет на время изображений — до размещения в томографа.
Примечание: Тепловизионная система, содержащая соединения анестезии корпус с ящиком и маску для животных следует использовать при наличии. - Ориент животное на его боковой стороне подвергать место инъекции (как указано) на боковое хвост. Проверьте, чтобы увидеть, если NIRF сигнал присутствует только в месте инъекции. Это указывает на Успешный хвост инъекции Вену (рис. 1D).
Примечание: Если сигнал рассредоточивались весь хвост, она считается подкожной и, следовательно неудачной (рис. 1F). Рисунок 2 показывает дополнительные примеры неудачных инъекций.
5. изображения количественная оценка
Примечание: Количественная оценка изображения могут быть выполнены с изображений программное обеспечение, которое сопровождает NIR томографа, если эта функция доступна. Кроме того программное обеспечение для анализа других коммерчески доступных изображений могут быть используется24.
- В изображении впрыск Нарисуйте региона интерес вокруг области флуоресцирования на сайт впрыска,2,,6.
- Измерение площади и относительной флуоресценции интенсивности и запись как район/интенсивности. Сравнить впрыск и исходных изображений предварительного впрыска либо качественно или quantitively с помощью соответствующего статистического анализа (зависит от исследовательских групп и условий).
Примечание: Исследователь может принять решение о пороговых значений, которые хорошо дискриминации от плохих инъекции или назначить инъекции процент качества.
Representative Results
Крысы были вводят с NIRF-содержащих nanoemulsion в Вену боковой хвост, и предварительная и впрыск изображения были взяты с малого животное томографа (Таблица материалов), как описано в протоколе. Впрыск изображений качественно оценку качества инъекций и помещен в «хорошая инъекция» (n = 7) и «плохие» (n = 4) групп. Качественная оценка была проведена путем наблюдения интенсивности флуоресценции впрыск области. В оптимальной инъекции NIRF сигнал сводится в месте инъекции. Сигнал не будет рассматриваться, если инъекции успешным, потому что агент были полностью перемещены в кровоток. Бад качество инъекции отображает сигнал NIRF который рассеивается по длине хвоста.
Изображения были проанализированы с сопровождающим программным обеспечением тепловизор NIRF. Регионы интереса были нарисованы на сайте изображений предварительного впрыска (рис. 1C, E) и вокруг области флуоресценции в впрыск изображения (рис. 1D, F). Изображения, где было видно по всей длине хвост флуоресценции были неприемлемым и удаляется из анализа (рис. 2). Измерения интенсивности флуоресценции и области были записаны. Значения для области/флюоресценцию интенсивности были рассчитаны и диаграмме (рис. 1G). Значительная разница (непарные t-тест) в флуоресцировании интенсивности между предварительная и впрыск изображений было отмечено в группе «плохой инъекции» (рис. 1G) (p = 0,0024).
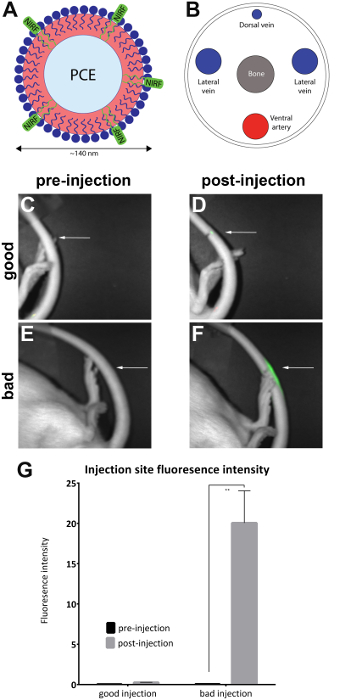
Рисунок 1 : NIRF на основе nanoemulsion и изображения хвост вен. (A) A на основе nanoemulsion биологических зонд, содержащий краситель NIRF был вводят в Вену (B) боковые хвост и отражаться в NIRF тепловизор. (C и D) предварительно и постинъекционные изображения хорошо инъекции. (E и F) предварительно и постинъекционные изображения плохой инъекции. Белые стрелки указывают точки инъекции. Это позволяет качественно оценить успех хорошо по сравнению с плохой инъекций путем оценки степени NIRF сигнала на месте инъекции инъекции. Неприемлемые инъекции отображения флуоресценции по всей длине хвоста и были исключены из анализа (рис. 2). (G) изображения также могут быть проанализированы выявить количественные измерения интенсивности флуоресценции, с порогами для инъекций качества назначается следователь. Планки погрешностей на диаграмме отражает SEM. Для «хорошая инъекция» группа, n = 7. Для «плохой инъекции» группа, n = 4. Есть статистическая разница в интенсивности флуоресценции в группе «плохой инъекции» при сравнении предварительной и постинъекционные изображения (непарные t-теста; p = 0,0024). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2 : Примеры плохих инъекции. Флуоресцентный сигнала (A) видели в части хвоста. (B) флуоресцентного сигнала видели на полную длину хвоста. Флуоресцентного сигнала (C) сильно разошлись в весь хвост и хвостового области тела животного. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Discussion
Научно-исследовательские лаборатории несут значительные расходы в результате нарушения агентов тестирования. Хвост вен инъекции являются сложной технике освоить для достижения последовательного успеха, с наиболее опытных технологов, часто неся ошибки нарушения. Существует нет надежного способа подтверждения успешного инъекции. Этот протокол предлагает решение этой проблемы, давая исследователям качественный и количественный метод для проверки успеха инъекции Вену мышиных хвост. Здесь,8,7,nanoemulsion, NIRF, меченного25 включает агент по выбору (в данном случае, наркотиков) и образы на месте инъекции в тепловизор малых животных NIRF. Существует также возможность разработки на основе nanoemulsion агент и использовать тот же принцип NIRF изображений путем включения коммерчески доступных инфра красной краски. Кроме того готовые к использованию изображений агентов с большим количеством приложений, таких как опухоль изображений, метаболические изображений, мобильный людьми, и apoptosis также коммерчески доступны. Инъекция производится с помощью стерильной иглой или, альтернативно, катетер IV; Это зависит от предпочтений исследователя. Кроме того автоматизированных хвост вен инжекторы26 были использованы для оказания помощи в этом процессе и совместимы с этой методологии. Однако эта технология еще не стать коммерчески доступными.
Есть важные шаги в методе инъекции Вену хвост, которые обеспечивают более высокий показатель правильного агента администрирования. Во-первых хвост должны быть очищены с этанол, чтобы удалить грязь и мусор, что позволяет исследователям получить более наглядное представление связи. Расширяя Вены, погрузив хвост в теплой воде является также очень важным шагом в методе, поскольку она позволяет больше площадь поверхности для инъекций. Инъекций в более дистальной точке на хвост ключе позволяет для некоторых ошибок, в том случае, если множественные попытки необходимы. Инъекции, должно выполняться в более проксимальном позиции в хвост как хвост вен увеличивается в размерах, как подошел хвостовой аспект тела животного. Кроме того контралатеральной хвост вен может использоваться, если иглы не более трех-пяти узлов на ипсилатеральной хвост вен.
Успешного управления агента тестирования приводит к практически нет сигнала NIRF точке впрыска. Если сопротивления не ощущается во время администрации инъекции и мало что не флуоресцирования на хвост, затем инъекции могут быть записаны как успешный. Если почувствуете сопротивление во время инъекции и там тропа NIRF сигнал вдоль некоторых длина хвоста, то инъекций регистрируется как неудачной и вероятно частично подкожной. Флуоресценции изображения взяты предварительная и впрыск, а качество инъекции оценивается путем наблюдения за качественно или количественно анализируя сигнал флуоресценции в месте инъекции. Программное обеспечение, сопровождающих тепловизор флуоресценции NIR часто способен выполнять этот анализ.
Этот метод может быть адаптирована несколькими способами. Это применимо к хвост инъекции Вену мышей и крыс. Большинство малых животных NIR флуоресценции тепловизоры будет способный разместить мышиных грызунов. Уровень анестезии должны быть скорректированы в зависимости от веса животного, в соответствии с протоколом IACUC научно-исследовательской лаборатории. Еще одна возможная модификация является подготовка на основе nanoemulsion зонд либо путем включения инфракрасного красителя в исследователь сформулировал агента покупки готовых к использованию изображений агент, с учетом конкретных биологических приложений.
Если крыса является относительно большим, он часто может быть трудно расположить его в малых животное томографа. Таким образом, рекомендуется, что тестовый образ взят с животным в ящик перед инъекцией, и поле зрения установлено, где виден хвост. Это полезно для ленты, хвост, чтобы ящик томографа, чтобы убедиться, что он не двигаться во время визуализации.
Альтернативные методы, пытаясь оценить качество хвост вен, что инъекции в мелких животных ограничены для использования маркировки реагенты, которые не мешают параллельных экспериментальных процедур и требуют эвтаназии животных postinjection 12,13. Некоторые реагенты могут повлиять исходы исследования и терапевтических оценки животных участвующих, поэтому рекомендуется уход в экспериментальный дизайн.
Этот метод может в будущем, уточняться с достижениями в технологии визуализации малых животных, а также улучшения в инфракрасной флуоресцентных зондов. Биологические датчики с включены инфракрасный краситель, предназначенные для ряда различных приложений, может использоваться на этапе агента администрирования дизайна исследования для проверки качества инъекции, как описано в этом метод2,3 ,27,28,,2930,,3132.
Disclosures
Авторы не имеют ничего сообщать.
Acknowledgments
J.A.P. и J.M.J. совместно разработали экспериментальный подход для оценки Nanoemulsions в мышиной модели хронической травмы сужения для воздействия на нейропатической боли. J.M.J. задуман и разработан подход доставки наркотиков в целом Макрофаг целевой с nanoemulsions, nanoemulsion композиции и процессов для изготовления. J.M.J. производства nanoemulsion, который был далее сфабрикованы л.л. под руководством J.M.J. Стабильность nanoemulsion был оценен J.M.J., л.л. и с.п. животных уход, хирургии, поведение, инъекции Вену хвост, и NIRF томографии были проведены совместно м.с. и A.M.S. под руководством J.A.P. Манускрипт был написан и подготовленный м.с., и протокол был написан A.M.S.
В небольших изображений системы животных в Университете Duquesne (поддерживается грантом Питтсбург ткани инженерных инициативе семян) была выполнена НИР оптических изображений. J.M.J. выражает поддержку от DOD премии номер FA8650-17-2-6836, Нида премии номер 1R21DA039621-01, NIBIB премии номер R21EB023104-02 и награда AFMSA номер FA8650-17-2-6836. J.A.P. и J.M.J отметить поддержку от Грант Seed Питтсбург ткани инженерных инициативе. J.A.P. также признает Hunkele ужасной болезни премии, Самуэль и Эмма зимы фонда, Чарльз Генри Лич II фонд и Содружества универсальный исследований повышения премии. J.A.P. и J.M.J. отметить поддержку Благочинный первого Университета Duquesne междисциплинарных исследовательских консорциумов Грант, который поддерживает хронической боли исследовательский консорциум.
Materials
| Name | Company | Catalog Number | Comments |
| 100% Oxygen air tank | AirGas Heathcare | n/a | For ventilation of animal. |
| 70% Ethanol | Multiple sources | n/a | |
| Alcohol Pads | Henry Schein | 112-6131 | |
| Artificial Tears | Henry Schein | 100-2634 | This protects the rats eyes while it is anesthetized. |
| Beaker | Multiple sources | n/a | This holds warm water to dilate the tail veins. |
| Distilled water | Multiple sources | n/a | |
| Exhaust Fans | Hazard Technologies | n/a | For ventilation of lab, if it is not built in. |
| Face Mask | Multiple sources | n/a | |
| Gas Chamber with tubing and face mask | Multiple sources | n/a | |
| Gauze Pads | Henry Schein | 100-2634 | |
| Hair Bonnet | Multiple sources | n/a | |
| Heating Lamp | Multiple sources | n/a | |
| Heating Pad | Multiple sources | n/a | |
| Isoflurane | Southmedic Inc. | ND66794-013-25 | |
| Padded Bench Cloth | Box Board Products Inc. | 026755100I | |
| Pearl Small Animal Imager | Li-COR Biosciences | ||
| Pearl Trilogy Small Animal Imaging System | LI-COR Biosciences | n/a | Quote available via manufacturers web site. Other manufacturers such as Perkin Elmer (VisEn Medical FMT) offer preclinical NIR fluoresence imagers. |
| Scrubs, lab coat, shoe covers | Multiple sources | n/a | |
| Sharps container | Multiple sources | n/a | |
| special diet | Research Diets, Inc, New Brunswick, NJ | ||
| Sprague-Dawley rats | Hilltop Animals, Springdale, PA | ||
| Sterile injection cap | Multiple sources | n/a | |
| Sterile needle, 27 G | Multiple sources | n/a | |
| SURFLO IV Catheter, 24 G, yellow | TERUMO | SR+OX2419C1 | This is an alternative to using a sterile needle. It provides additional indication of correct venous insertion. |
| Surgical gloves | Multiple sources | n/a | |
| Surgical Tape | Multiple sources | n/a |
References
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: routes of administration and factors to consider. Journal of the American Association for Laboratory Animal Science: JAALAS. 50 (5), 600-613 (2011).
- Janjic, J. M., et al. Low-dose NSAIDs reduce pain via macrophage targeted nanoemulsion delivery to neuroinflammation of the sciatic nerve in rat. Journal of Neuroimmunology. 318, 72-79 (2018).
- Patel, S. K., Beaino, W., Anderson, C. J., Janjic, J. M. Theranostic nanoemulsions for macrophage COX-2 inhibition in a murine inflammation model. Clinical Immunology. 160 (1), 59-70 (2015).
- Patel, S. K., Janjic, J. M. Macrophage targeted theranostics as personalized nanomedicine strategies for inflammatory diseases. Theranostics. 5 (2), 150-172 (2015).
- Patel, S. K., Zhang, Y., Pollock, J. A., Janjic, J. M. Cyclooxgenase-2 inhibiting perfluoropoly (ethylene glycol) ether theranostic nanoemulsions-in vitro study. PLOS ONE. 8 (2), 55802 (2013).
- Liu, L., Bagia, C., Janjic, J. M. The First Scale-Up Production of Theranostic Nanoemulsions. BioResearch Open Access. 4 (1), 218-228 (2015).
- Patel, S. K., Patrick, M. J., Pollock, J. A., Janjic, J. M. Two-color fluorescent (near-infrared and visible) triphasic perfluorocarbon nanoemuslions. Journal of Biomedical Optics. 18 (10), 101312 (2013).
- O'Hanlon, C. E., Amede, K. G., O'Hare, M. R., Janjic, J. M. NIR-labeled perfluoropolyether nanoemulsions for drug delivery and imaging. Journal of Fluorine Chemistry. 137, 27-33 (2012).
- Bennett, G. J., Xie, Y. K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain. , (1988).
- Vasudeva, K., et al. In vivo and systems biology studies implicate IL-18 as a central mediator in chronic pain. Journal of Neuroimmunology. 283, 43-49 (2015).
- Vasudeva, K., et al. Imaging neuroinflammation in vivo in a neuropathic pain rat model with near-infrared fluorescence and (1)(9)F magnetic resonance. PLOS ONE. 9 (2), 90589 (2014).
- Cheng, Y., Liu, M., Hu, H., Liu, D., Zhou, S. Development, Optimization, and Characterization of PEGylated Nanoemulsion of Prostaglandin E1 for Long Circulation. AAPS PharmSciTech. 17 (2), 409-417 (2016).
- Fofaria, N. M., Qhattal, H. S., Liu, X., Srivastava, S. K. Nanoemulsion formulations for anti-cancer agent piplartine--Characterization, toxicological, pharmacokinetics and efficacy studies. International Journal of Pharmaceutics. 498 (1-2), 12-22 (2016).
- Ganta, S., et al. EGFR Targeted Theranostic Nanoemulsion for Image-Guided Ovarian Cancer Therapy. Pharmaceutical Research. 32 (8), 2753-2763 (2015).
- Shah, L., Kulkarni, P., Ferris, C., Amiji, M. M. Analgesic efficacy and safety of DALDA peptide analog delivery to the brain using oil-in-water nanoemulsion formulation. Pharmaceutical Research. 31 (10), 2724-2734 (2014).
- Maruyama, H., et al. High-level expression of naked DNA delivered to rat liver via tail vein injection. Journal of Gene Medicine. , (2002).
- Hibbitt, O. C., et al. Delivery and long-term expression of a 135 kb LDLR genomic DNA locus in vivo by hydrodynamic tail vein injection. Journal of Gene Medicine. , (2007).
- Sebestyén, M. G., et al. Mechanism of plasmid delivery by hydrodynamic tail vein injection. I. Hepatocyte uptake of various molecules. Journal of Gene Medicine. , (2006).
- Budker, V. G., et al. Mechanism of plasmid delivery by hydrodynamic tain vein injection. II. Morphological studies. Journal of Gene Medicine. , (2006).
- Lecocq, M., et al. Uptake by mouse liver and intracellular fate of plasmid DNA after a rapid tail vein injection of a small or a large volume. Journal of Gene Medicine. , (2003).
- Park, S., Park, H. -M., Sun, S. -H. Single-dose Intravenous Injection Toxicity of Water-soluble Danggui Pharmacopuncture (WDP) in Sprague-Dawley Rats. Journal of Pharmacopuncture. 21 (2), 104-111 (2018).
- Zhang, X., et al. Activatable fluorescence detection of epidermal growth factor receptor positive mediastinal lymph nodes in murine lung cancer model. PLOS ONE. 13 (6), 0198224 (2018).
- Liu, G., et al. Tracking of transplanted human umbilical cord-derived mesenchymal stem cells labeled with fluorescent probe in a mouse model of acute lung injury. International Journal of Molecular Medicine. 41 (5), 2527-2534 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Janjic, J. M., Srinivas, M., Kadayakkara, D. K., Ahrens, E. T. Self-delivering nanoemulsions for dual fluorine-19 MRI and fluorescence detection. Journal of the American Chemical Society. 130 (9), 2832-2841 (2008).
- Chang, Y. -C., et al. An Automated Mouse Tail Vascular Access System by Vision and Pressure Feedback. IEEE/ASME Transactions on Mechatronics. 20 (4), 1616-1623 (2015).
- Chen, Q., et al. Theranostic imaging of liver cancer using targeted optical/MRI dual-modal probes. Oncotarget. 8 (20), 32741-32751 (2017).
- Tansi, F. L., et al. Activatable bispecific liposomes bearing fibroblast activation protein directed single chain fragment/Trastuzumab deliver encapsulated cargo into the nuclei of tumor cells and the tumor microenvironment simultaneously. Acta Biomaterialia. 54, 281-293 (2017).
- Li, S., Johnson, J., Peck, A., Xie, Q. Near infrared fluorescent imaging of brain tumor with IR780 dye incorporated phospholipid nanoparticles. Journal of Translational Medicine. , (2017).
- Gao, M., Yu, F., Lv, C., Choo, J., Chen, L. Fluorescent chemical probes for accurate tumor diagnosis and targeting therapy. Chemical Society Reviews. , (2017).
- Wang, R., Han, X., You, J., Yu, F., Chen, L. Ratiometric Near-Infrared Fluorescent Probe for Synergistic Detection of Monoamine Oxidase B and Its Contribution to Oxidative Stress in Cell and Mice Aging Models. Analytical Chemistry. 90 (6), 4054-4061 (2018).
- Han, X., Song, X., Yu, F., Chen, L. A Ratiometric Near-Infrared Fluorescent Probe for Quantification and Evaluation of Selenocysteine-Protective Effects in Acute Inflammation. Advanced Functional Materials. 27 (28), 1700769 (2017).



