Summary
Этот протокол использует G6PI смешанные пептиды для построения ревматоидных моделей артрита, которые ближе к модели человеческого ревматоидного артрита в CD4и Т-клеток и цитокинов. Высокая чистота инвариантных естественных киллеров Т-клеток (главным образом iNKT2) со специфическими фенотипами и функциями были получены путем индукции in vivo и в пробирке для очищения для приемной иммунотерапии.
Abstract
Ревматоидный артрит (РА) является сложным хроническим воспалительным аутоиммунным заболеванием. Патогенез заболевания связан с инвариантными естественными клетками-убийцами Т (iNKT). Пациенты с активной РА представляют меньше iNKT клеток, дефектной функции клеток, и чрезмерная поляризация Th1. В этом исследовании, модель РА животных была создана с использованием смеси gpI325-339 и hGPI469-483 пептидов. Клетки iNKT были получены индукцией in vivo и очисткой in vitro, а затем настой в мышей РА для приемной иммунотерапии. Система обработки in vivo (IVIS) показала, что клетки iNKT в основном распределяются в селезенке и печени. На 12 день после клеточной терапии прогрессирование заболевания значительно замедлилось, клинические симптомы были смягчены, обилие клеток iNKT в тимусе увеличилось, доля iNKT1 в тимусе снизилась, а уровни ТНФ-З, IfN-Q и IL-6 в сыворотка уменьшилась. Приемная иммунотерапия клеток iNKT восстановила баланс иммунных клеток и исправила чрезмерное воспаление организма.
Introduction
Ревматоидный артрит (РА) является аутоиммунным заболеванием, характеризующимся хронической, прогрессирующей инвазивностью с частотой 0,5-1%1,2. Основной патогенез связан с аномальным распространением аутореактивныхCD4 иCD8 - Т-клеток, проявляющихся в увеличении доли CD4иIFN-Q иCD4- IL-17A- Т-клеток, а также уменьшенного числа CD4-ИЛ-4 и CD4 -CD25-FoxP3- Т-клеток. Поэтому секреция воспалительных цитокинов усиливается, а чрезмерная воспалительная реакция разрушает родной баланс и функцию толерантности иммунной системы организма. Кроме того, помощник Т-лимфоцитов (Т) 1 клетки, которые проникают в сустав, усугубляют воспалительные реакции и повреждения суставов. Таким образом, ингибирование чрезмерной воспалительной реакции и восстановление иммунной толерантности и иммунного баланса являются ключевыми для лечения РА3,4.
Ячейки iNKT имеют функции и характеристики НК-клеток и Т-клеток. Клетки iNKT питают различный, инвариантный Т-клеточный рецептор (TCR) - цепь с ограниченным репертуаром TCR и цепи5 и распознают гликолипидный антиген, представленный основным комплексом гистосовместимости (MHC) молекулы CD1d класса CD1d на поверхности антиген-представляя клеток. Mitsuo et al.6 обнаружили большое количество клеток iNKT и функциональные дефекты во многих аутоиммунных заболеваниях, включая РА. Aurore et al.7 продемонстрировали, что клетки iNKT оказывают положительное влияние на поддержание аутоиммунной толерантности и что при восстановлении количества и функции клеток iNKT болезнь облегчается. Кроме того, Miellot-Gafsou et al.8 обнаружили, что клетки iNKT не только анонсировали болезнь, но и увеличили прогрессирование заболевания. Эти противоречивые результаты свидетельствуют о том, что iNKT-клетки являются неоднородными Т-клетками, и функция различных подмножеств может быть обращена вспять. В клиническом исследовании РА частота клеток iNKT коррелирует со счетом активности заболевания9. Результаты также подтвердили, что частота iNKT была снижена у пациентов РА, количество CD4иIFN-я Т-клеток подмножества увеличились, и секреторные уровни воспалительных цитокинов IFN-я и TNF-я увеличилось10,11. Кроме того, Шариф и др.12 исследовали диабет типа 1 (T1D) и обнаружили, что селективный вливание клеток iNKT upregulated выражение воспалительного цитокина IL-4, поддерживаетиммунную толерантность, и предотвратить развитие диабета типа 1. Таким образом, приемная инфузия специфических клеток iNKT или целевая активация клеток iNKT повышает уровень клеток iNKT у пациентов РА, что может стать прорывом в лечении РА.
Клеточная иммунотерапия в настоящее время представляет большой интерес и широко используется в терапии рака. Тем не менее, iNKT клетки редки, неоднородные иммунорегуляторные клетки (только 0,3% от общего числа ПБМК)13, что ограничивает потенциальное клиническое применение. Эти клетки в основном делятся на три субпопуляции: 1) клетки iNKT1, которые имеют высокое выражение промиелоцитарного белка цинка-пальца (ПЛЗФ) и коэффициент акрипции Т-бокса (T-bet); 2) iNKT2 клетки с промежуточным выражением ПЛЗФ и связывающего белка GATA 3 (GATA3); 3) iNKT17 клетки с низкой экспрессией ПЛЗФ и ретиноидных связанных сирот ядерных рецепторов (ROR)-Зт, которые выделяют IFN-Я, IL-4, и IL-1714. Активированные клетки iNKT выделяют Th1, Th2 и Th17-подобные цитокины, которые определяют различные иммуномодулирующие эффекты клеток iNKT15. Иммуномодулирующие и иммунотерапевтические эффекты специфической активации различных субпопуляций клеток iNKT различны. Поэтому выбор специфических фенотипов клеток iNKT (главным образом iNKT2) с противовоспалительными функциями для регулирования иммунного ответа организма может исправить иммунный дисбаланс и иммунные расстройства в РА.
Создание идеальной модели животного имеет большое значение для лечения и изучения патогенеза РА. В настоящее время наиболее часто используемые и зрелые модели животных включают коллагена индуцированного артрита, адъювантного артрита, zymosan-индуцированного артрита, и полисахарид индуцированный артрит16-17. Тем не менее, нет модели, которая может полностью имитировать все особенности человека РА. Тип II коллагена индуцированного артрита (ЦРУ) является классической моделью артрита. ЦРУ индуцируется иммунизации мышей с типом II коллагена конкретных моноклональных антител, отражающих зависимость антител этой модели заболевания. Бенус и др. описал модель с системным иммунным ответом на глюкозу-6-фосфат изомеразу (G6PI), которая вызывает периферический симметричный полиартрит в восприимчивых штаммов мыши18,19. В этой модели развитие артрита зависит от Т-клеток, В-клеток и врожденного иммунитета18,19,20. Horikoshi21 обнаружил, что модели РА в результате иммунизации мышей DBA/1 с фрагментами полипептида G6PI больше похожи на человеческие РА с точки зрения CD4и Т-клеток и цитокинов (т.е. IL-6 и TNF-я), чем модели ЦРУ. Для усиления стимулирующего эффекта на сайте распознавания TCR смешанные полипептидные фрагменты G6PI (hGPI325-339 и hGPI469-483) были использованы для иммунизации мышей DBA/1 для построения модели мыши РА. Уровень успеха этого подхода может быть высоким, потому что hGPI325-339 и hGPI469-483 являются иммунодоминирующими для I-A q-ограниченных Т-клеток ответов. Таким образом, эта модель может имитировать чрезмерное распространение CD4и Т-клеток и дефектов клеток iNKT у пациентов РА22. Фундаментальные исследования иммунопатологии РА заложили основу для нашего дальнейшего углубленного исследования.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Все экспериментальные мыши (всего 150) были здоровыми мышами DBA/1, 6-8 недель (20,0 и 1,5 г), выращенных в специфической среде, свободной от патогенов (SPF). Существует нет специального лечения до моделирования. Эксперимент был разделен на здоровую контрольную группу (15 мышей), модельную контрольную группу (15 мышей) и группу клеточной терапии (55 мышей). Это исследование было одобрено Комитетом по защите животных и этике Университета Хэвэя.
1. Построение модели болезни
- Дублирование модели животных РА
- Взвесьте 1,75 мг обоих hG6PI 325-339 и hG6PI 469-483 фрагментов и растворите их в 5,25 мл 4 градуса Цельсия тройной дистиллированной воды.
- Растворите полный адъювант Фрейнда (CFA) в водяной бане 50 градусов по Цельсию, нарисуйте 5,25 мл в еще одну центрифугу мощностью 10 мл и охладите ее для использования.
- Поместите смесь раствора hG6PI и раствора CFA в искусственный эмульсионный блок с двумя стеклянными шприцев.
- Нажмите шприц с постоянной скоростью и частотой 10-20x на мин, чтобы полностью эмульгировать смешанный пептидный раствор и cfA раствор. Выполните операцию в ледяной ванне, и держать эмульсии капель в воде в течение 10 минут после завершения эмульгации без разгона.
- Введите 150 л эмульгированных hG6PIs в хвостовой корень мыши подкожно.
- Впрысните 200 мг токсина котуса в мышь интраперитонена на 0 ч и 48 ч после инъекции hG6PI.
- Экспериментальная проверка модели РА
- Измерьте толщину лапы мыши с помощью калипера Вернье (2 раз в день).
- Наблюдайте и отмечайте степень покраснения и отеки стопы. Используйте следующие критерии оценки: 1) носы с легким отеком; 2) дисс и подножка для ног с прозрачным красным отеком; 3) лодыжка с красным отеком.
- Эвтаназия мышей под глубокой анестезией путем интраперитонеальной инъекции 1% пентобарбитала натрия (50 мг/кг массы тела) через 14 дней после моделирования и удалить лапы для окрашивания HE.
- Определите уровни секреции сыворотки IL-2, IL-4, IL-6, IL-10, IL-17A, TNF-я и IFN-з с помощью коммерческого цитометрического массива бисера (CBA) в соответствии с протоколом производителя.
2. Получение iNKT клеток с приемной клеточной терапии
- Направленная индукция iNKT-клеток
- Вводят нормальных мышей интраперитонеально с помощью q-GalCer (0,1 мг/кг массы тела).
- Изоляция iNKT-клеток
- Через три дня после моделирования, вводят мышей интраперитоневом с 1% пентобарбитала натрия (50 мг/кг массы тела) для анестезии. Адекватно обезвлечимых мышей не показывают заднюю лапу вывода ответ на нос щепотку.
- Изолировать селезенку мыши DBA/1 после введения ее интраперитонеально с помощью q-GalCer. Подготовка одной подвески ячейки путем резки и шлифования селезенки в 200 сетки сито.
- Вымойте суспензию клетки с PBS, центрифуга на 200 х г в течение 5 мин, и отказаться от супернатанта. Повторите.
- Приостановите работу клеток с 1 мл цельной крови и раствором разбавления тканей. Добавьте 3 мл мышиной среды разделения лимфоцитов, а затем центрифугите клетки в течение 20 мин при температуре 300 х при комнатной температуре.
- Соберите слой молочно-белых лимфоцитов (т.е. второго слоя сверху), промойте его в 2 x с помощью PBS и посчитайте с помощью автоматизированного счетчика клеток.
- Магнитная активированная сортировка клеток (MACS)положительная стратегия отбора для очистки клеток iNKT
ПРИМЕЧАНИЕ: Для предварительной обработки тетрамеров CD1d, 1 мг/мл из к-Galcer был разбавлен до 200 мкг/мл с 0,5% Tween-20 и 0,9% NaCl, и 5 qL результирующего раствора был добавлен в 100 л раствора тетрамер CD1d. Смесь была инкубирована в течение 12 ч при комнатной температуре и помещена при 4 градусах Цельсия для использования. ТКР был разбавлен в 80раз деионизированной водой. Все остальные антитела были использованы в качестве акционерного раствора.- Отрептить 107 ячеек с 100 qL 4 C PBS, добавить 10 qL из q-GalCer-загруженных CD1d Tetramer-PE, и инкубировать их при 4 кС в течение 15 минут в темноте.
- Вымойте клетки 2x с PBS и повторно их в 80 Зл Л PBS.
- Добавьте 20 qL анти-PE-MicroBeads и инкубировать их при 4 градусах по Цельсию в течение 20 минут в темноте.
- Вымойте их 2x с PBS и resuspend клетки с 500 Зл Л PBS.
- Поместите сортировочную колонку в магнитное поле сортировки MACS и промыть 500 зл и сортировки PBS.
- Добавьте суспензию ячейки со ступени 2.3.4 к столбце сортировки, соберите проходной и прополните 3x буфером PBS.
- Удалите магнитное поле и соберите ячейки из сортировочных столбцов. В этот момент добавьте 1 мл буфера PBS в столбец сортировки и быстро надавите поршень при постоянном давлении, чтобы загнать маркированные ячейки в трубку для сбора и получить очищенные iNKT-клетки. Рассчитывайте с помощью автоматического счетчика ячейки.
- Идентификация фенотипа клеток iNKT
- Возьмите 1 х 106 ячеек из шагов 2.2.5 и 2.3.7, соответственно, и повторно их в 50 Л PBS.
- Инкубация антител: Не добавляйте антитела в отрицательную контрольную трубку, добавляйте 0,5 л из й-GalCer-PE-CD1d Tetramer или 10 л FITC-TCR в одной положительной контрольной трубке. Добавьте в образец трубки 0,5 л тетрамера и 10 зл FITC-TCR. Инкубировать их при 4 градусах по Цельсию в течение 30 минут в темноте.
- Вымойте клетки в PBS, а затем центрифуга на 200 х г в течение 5 мин.
- Откажитесь от супернатанта, добавьте 1 мл рабочего раствора Foxp3 Foxation/Permeabilization и инкубация клеток в течение 45 минут при 4 градусах Цельсия в темноте.
- Добавьте 1 мл 1x пермякового буферного рабочего раствора и центрифугите клетки при комнатной температуре 500 х г при комнатной температуре в течение 5 мин.
- Отбросьте супернатант. Добавьте 1 qL Alexa Fluor 647 мышь Anti-PL-F и 1 зл и 1 л PerCP-Cy 5.5 мышь анти-T-bet (или 1 Зл PerCP-Cy 5.5 мышь анти-ROR) в течение 30 минут при комнатной температуре в темноте.
- Добавьте к 2 мл рабочего решения Permeabilization Buffer для очистки.
- Откажитесь от супернатанта, отрепримите клетки в 500 Л PBS и измерьте цитометрией потока.
- Функциональная идентификация клеток iNKT
- Возьмите 3 х 106 iNKT-ялки со ступени 2.3.7 и повторно применяйте их в 12 колодцах с 1,5 мл неполной среды RPMI-1640 (т.е. без сыворотки).
- Добавьте форбол эстер (PMA, 50 нг/мл) и иономицин кальций (IO, 1 мкг/мл) и поместите в инкубатор CO2 на 24 ч.
- Соберите супернатант ячейки и обнаружите уровни секреции ИЛ-2, Ил-17А, ТНФ-З, Ил-6, Ил-4, ИФН-З и Ил-10 с помощью коммерческого асссеа ЦБА в соответствии с протоколом производителя.
- Экспериментальное исследование пути миграции клеток iNKT у мышей РА
- Растворите краситель DiR (2,5 мг/мл) в DMSO.
- Resuspend iNKT-клетки в 6 скважинных пластинах с неполной средой RPMI-1640. Плотность составляет 1 х 106 ячеек/мл.
- Добавить раствор DiR (5 мг/мл) и инкубировать в инкубатор CO2 в течение 25 минут.
- Вымойте с PBS и повторной приостановки клеток (3 х 106/300 Л) для получения DiR-маркированных iNKT ячеек (DiR-iNKT).
- Вводят 1% пентобарбитала натрия (50 мг/кг массы тела) интраперитонеально для обезболиливания мышей. Адекватно обезвлечимых мышей не показывают заднюю лапу вывода на нос ущипнуть. Нанесите ветеринарную мазь на глаза мыши, чтобы предотвратить сухость в то время как под наркозом для визуализации.
- Впрысните клетки DiR-iNKT 3 x 106 на мышь в хвостовую вену с моделью RA в течение 8 дней. Мониторинг iNKT клеток у мышей после инъекции в течение 0 мин, 10 мин, 30 мин, 60 мин, и день 0 (после 3 ч), 1, 3, 6, 12, 26, 34, 38, и 42 дней с помощью небольшого животного in vivo системы визуализации (IVIS). Используемая длина волн возбуждения составила 748 нм, длина волны эмиссии - 780 нм, а время экспозиции было автоматическим.
- Поместите каждую мышь в отдельную клетку после каждого наблюдения и поддерживать строгое recumbency. Наблюдайте до выздоровления после наркоза.
3. Оценка приемной иммунотерапии мышей РА с клетками iNKT
- iNKT клеточная приемная иммунотерапия для мышей РА
- Впрысните 3 x 106 ячеек iNKT на мышь через хвостовую вену. Случайно выберите 15 мышей, которые были смоделированы за 8 дней до этого, и получите iNKT-клетки без маркировки DiR с шага 2.3.7 настой хвостовой вена.
- Оцените эффективность приемной иммунотерапии для клеток iNKT.
- Измерьте толщину лапы мыши, количественно очеловечить голеностопный сустав и систематически оценка после вливания клеток iNKT, как описано в шагах 1.2.1-1.2.2.
- Наблюдайте за инфильтрацией воспалительных клеток и изменениями суставов суставов суставов мыши, как описано в шаге 1.2.3.
- Определите уровни секреции Ил-2, Ил-4, Ил-6, Ил-10, Ил-17А, ТНФ-З и ИФН-З, как описано в шаге 1.2.4.
- Определите частоту iNKT-клеток и подмножеств.
- Изолировать тимус мыши и подготовить одну ячейку подвески.
- Отделите лимфоциты с жидкостью разделения лимфоцитов.
- Определите частоту и частоту клеток iNKT, описанную в шаге 2.4.
- Статистический анализ
ПРИМЕЧАНИЕ: Все данные представлены в виде средних значений SD. Значения P qlt; 0,05 были сочтены статистически значимыми.- Используйте однофакторный анализ дисперсии (ANOVA). Если отклонение удовлетворено, используйте тест ЛСД для дальнейшего сравнения.
- Если дисперсия не однородна, используйте непараметрический тест. Используйте тест Kruskal-Wallis H для дальнейшего сравнения31.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Оценка индекса артрита и толщина лапы увеличились после моделирования. По сравнению с контрольной группой, на лицах группы моделей РА начал проявляться красный отек через 6 дней после моделирования, с постепенным обострением. В 14 дней, красный отек в голеностопном суставе достиг своего пика, а затем постепенное облегчение. Толщина лапы изменилась аналогичным образом (P lt; 0,05)(Рисунок 1).
Инфильтрация воспалительных клеток значительно возросла после моделирования. Патологические результаты показали, что степень инфильтрации воспалительных клеток в синовиальной ткани лодыжки мышей модели РА была разной на разных стадиях. Пик воспаления произошло на 14 день после моделирования(рисунок 2).
В сыворотке увеличились воспалительные цитокины и уменьшились противовоспалительные цитокины. В модели группы РА уровень провоспалительных цитокинов в сыворотке крови (ТНФ-З, ИФН-З и ИЛ-6) значительно увеличился(P qlt; 0.05), в то время как противовоспалительные цитокины (IL-4 и IL-10) значительно снизились(P qlt; 0.05)(рисунок 3).
Клетки iNKT, полученные индукцией in vivo и очисткой in vitro, в основном состояли из подмножества клеток iNKT2, которые выделяют противовоспалительные цитокины. Интраперитонеальная инъекция З-Галсера увеличила частоту клеток iNKT в организме, преимущественно подгруппы iNKT2. Частота клеток селезенки iNKT у обычных мышей DBA/1 составляла около 2% лимфоцитов (iNKT2 составлял около 5%, iNKT1 около 15%, iNKT17 около 10%). Через три дня после интраперитонеальной инъекции З-Галсера частота iNKT-клеток составляла около 6% лимфоцитов (iNKT2 составлял около 82%, iNKT1 около 1,5%, а iNKT17 около 0,5%). После очистки MACS чистота iNKT-клеток составила более 85%, из которых iNKT2 составлял около 92%, iNKT1 около 0,4%, а iNKT17 около 0,2%(рисунок 4).
Собранные клетки iNKT выделяют больше противовоспалительных цитокинов и меньше воспалительных цитокинов. Клетки iNKT были изолированы от селезенок нормальных мышей и интраперитоно вводили с помощью s-GalCer через 3 дня после изучения селезенки мыши (группа Я-Галсер) и уровней цитокина в супернатанте клеточной культуры. По сравнению с контрольной группой, воспалительные цитокины (IL-17A, TNF-я, IFN-я и IL-6) группы З-Галсер значительно снизились(P lt; 0.05), а уровень противовоспалительных цитокинов IL-4 значительно увеличился(P lt; 0.05). Не было существенной разницы в Ил-10(P йgt; 0.05). Соотношение МФН-З/ИЛ-4 значительно уменьшилось(ПЦТ; 0,05)(рисунок 5).
Отслеживание IVIS подтвердило, что клетки DiR-iNKT были adoptively влиты в мышей РА и сразу же появились в легких после инъекции. Флуоресценция была обнаружена в печени на 10 мин и в селезенке на 60 мин(рисунок 6AI, 6AII, 6AIII). В изолированных органах не было флуоресценции в тимусе и паховых лимфатических узлах в пределах 1 ч. Флуоресценция была обнаружена в легких на 0 мин, интенсивность флуоресценции была наибольшей на 10 мин, а затем постепенно ослабевает. Была слабая флуоресценция в печени на 0 мин, а затем она постепенно увеличивалась. Флуоресценция в селезенке была обнаружена на 30 мин, а затем постепенно увеличивается(рисунок 6AIV, 6C).
После вливания клеток DiR-iNKT в мышей РА, флуоресценция была сосредоточена в основном в печени и селезенке(Рисунок 6BI, 6BII, 6BIII), но не было флуоресценции в тимус и паховые лимфатические узлы. Селезенка и печень имели самую высокую интенсивность флуоресценции на 1 день после клеточного вливания, но постепенно ослаблялись. На 34-й день поверхностная флуоресценция исчезла. На 42-й день исчезла флуоресценция изолированных органов. Средняя интенсивность флуоресценции сигнала печени после клеточного инфузии была выше, чем у селезенки(рисунок 6BIV, 6D).
Приемная вливание клеток iNKT в мышей РА может облегчить прогрессирование заболевания и улучшить клинические симптомы. Клетки iNKT улучшили клинические симптомы мышей РА после адативного инфузии. По сравнению с необработанной модельной группой РА, отек голеностопного сустава был освобожден в группе клеточного лечения, и оценки значительно снизились со дня 10 до дня 20 послеинъекции. В тот же период в группе клеточного лечения, воспалительное проникновение клеток в синовиальной ткани было уменьшено по сравнению с модельной группой РА (Рисунок 2).
Показатели успешности клеток thymus iNKT значительно возросли(P qlt; 0.05). По сравнению со здоровой контрольной группой, в модельной группе РА показатели клеток iNKT в тимусе снизились на стадии прогресса (день 11), пика (день 14) и восстановления (день 20) этапов. На пике воспаления, эти значения были минимальными и восстановился в фазе ремиссии. Группа клеточной терапии показала значительно увеличенные тарифы клеток iNKT на пике (день 14) и спасение (день 20) этапы по сравнению с группой модели RA (P qlt; 0.05) (Рисунок 7).
После вливания клеток iNKT, показатель успеха iNKT1 и iNKT17 в тимусе снизился, а iNKT2 увеличился. По сравнению с контрольной группой, в модельной группе РА в день 11 iNKT1 и iNKT17 в тимуса значительно увеличилось(P lt; 0.05), а iNKT2 значительно снизился(P qlt; 0.05). На 14-й день iNKT1 и iNKT2 в тимусе значительно увеличились(Пзл; 0,05) и iNKT17 значительно снизились(P'lt; 0.05). На 20-й день, iNKT1 в тимусе значительно увеличилось (P lt; 0.05), iNKT2 существенно не изменилась(P 0.05), и iNKT17 значительно снизился(P lt; 0.05). Соотношение iNKT1/iNKT2 значительно увеличилось во всех трех этапах(P qlt; 0.05).
По сравнению с модельной группой РА, на 11-й день в группах клеточной терапии, iNKT1 и iNKT17 были значительно ниже(P qlt; 0.05) и iNKT2 значительно увеличились(P qlt; 0.05). На 14-й день, в группе iNKT1 и iNKT17 значительно снизились(P qlt; 0.05), и iNKT2 существенно не изменился(P sgt; 0.05); в группе клеточной терапии iNKT1 и iNKT17 значительно снизились(P qlt; 0.05) и iNKT2 значительно увеличилось(P qlt; 0.05). На 20-й день, в группе q-GalCer, iNKT1 значительно снизился(P lt; 0.05), iNKT2 существенно не изменился(P sgt; 0.05), а iNKT17 значительно увеличился(P qlt; 0.05); в группе клеточной терапии iNKT1 и iNKT17 значительно снизились(P qlt; 0.05) и iNKT2 значительно увеличилось(P qlt; 0.05). Соотношение iNKT1/iNKT2 значительно снизилось на всех трех этапах(P qlt; 0.05)(рисунок 7).
Уровни воспалительных цитокинов были увеличены в сыворотке крови и противовоспалительные цитокины были снижены после инфузии iNKT клеток. В модели группы РА уровни ТНФ-З, IFN-q и IL-6in сыворотки значительно увеличились(P qlt; 0.05), в то время как ИЛ-4 и ИЛ-10 показали заметное снижение количества(P qlt; 0.05) по сравнению с контрольной группой. В группе клеточной терапии iNKT уровни ТНФ-З, IfN-q и IL-6 в сыворотке значительно снизились на прогрессе и пиковых стадиях воспаления(P qlt; 0.05), в то время как IL-4 и IL-10 значительно увеличились(P qlt; 0.05) по сравнению с модельной группой РА(рисунок 3).
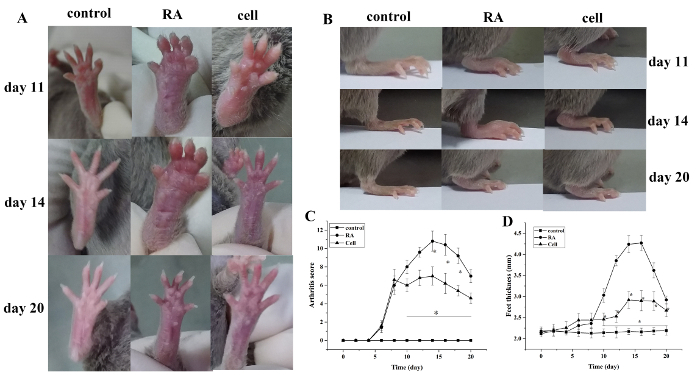
Рисунок 1: Совместный оценка отек и толщина лапизменения у мышей. (A) Отек голеностопного сустава у мышей. (B,D) Толщина лап в разных группах. (C) Клинические изменения оценки в разных группах. Оценка мышь артрита и толщина лапы были значительно сокращены в группе клеточной терапии в дни 10-20 (т.е., 2-12 дней после лечения) после моделирования. - Злт; 0,05 против управления,.л.; 0,05 против РА. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Гистопатологические изменения голеностопного сустава. Инфильтрация воспалительных клеток была значительно снижена в группе клеточной терапии и значительно увеличена в группе РА на 14-й день. Воспалительные клетки. (A) 100x (B) 400x. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: Уровни цитокинов сыворотки в каждой группе. (A) уровни цитокинов сыворотки у мышей на день 11 после моделирования (пг/мл). (B) уровни цитокинов сыворотки у мышей на день 14 после моделирования (пг/мл). Уровни ТНФ-З, ИФН-З и ИЛ-6 значительно снизились, а уровни ИЛ-4 и Ил-10 значительно возросли в группе клеточной терапии. PЗлт; 0,05 против управления. bП Злт; 0,05 против РА. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4: Скорость iNKT-ячеек и доля подмножества клеток iNKT. (A,B, C) Коэффициент iNKT2 у обычных мышей составляет 5%. (D,E,F) Ставка iNKT2 составляет около 82% после индукции in vivo. (G, H, Я) После очистки MACS уровень iNKT2 составляет более 92%. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 5: Уровни цитокинов в культуре супернатанта мыши селезенки полученных iNKT клеток. Уровень Ил-4 значительно повысился, а уровни Ил-17А, ТНФ-З, ИФН-З и Ил-6 значительно снизились. PЗлт; 0,05 против управления. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 6: Распределение и метаболизм клеток iNKT, прослеживаемых caliper IVIS lumina II. (A, B) Путь миграции iNKT-ячеек. (C) Изменение средней интенсивности сигнала флуоресценции в селезенке, печени и легких. (D) Изменение средней интенсивности сигнала флуоресценции в селезенке и печени. Флуоресценция была обнаружена в легких и печени на 0 мин, а затем постепенно увеличивается. Интенсивность флуоресценции была сильнейшей на 10 мин в легких, а затем уменьшилась. Флуоресценция селезенки была обнаружена на 30 мин, а затем постепенно увеличивалась. Флуоресценция всех органов исчезла на 42-й день. Средняя интенсивность флуоресценции сигнала печени выше, чем селезенка после клеточного инфузии (I: supine; II: боковая ложь; III: склонны; IV: изолированные ткани; a: контрольная группа; b: группа клеточного инфузии; 1, 2, 3, 4, 5 являются тимуса, селезенки, печени, паховых лимфатических узлов, легких). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 7: Скорость iNKT и его подмножества в тимусе мыши. (A) Показатели iNKT-клеток в 11, 14 и 20 дней после моделирования. (B) Соотношение iNKT1/iNKT2. (C,D,E) Скорость iNKT1, iNKT2 и iNKT17. В дни 11, 14 и 20 (дни 3, 6 и 12 после клеточной терапии) показатели iNKT-клеток значительно возросли, iNKT1 и iNKT17 тимуса значительно снизились в группе клеточной терапии, а iNKT2 был значительно увеличен. ПЗлт; 0,05 против управления. bП Злт; 0,05 против РА. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
iNKT-клетки представляют собой специальные Т-клетки, которые преодолевают врожденный и адаптивный иммунитет и в основном развиваются из CD4,CD8и тимоцитов. клетки iNKT обладают разнообразными иммунорегуляторными функциями и взаимодействуют с другими иммунными клетками путем прямого контакта и секреции различных цитокинов23,влияющих на дендритные клетки (ДК), макрофаги, нейтрофилы, В-клетки, Т-клетки, и ДИфференциации и развитии клеток НК24. К-ГалСер - это классический активатор для клеток iNKT, извлеченный из губок. Несколько исследований показывают, что частота клеток селезенки iNKT достигает пика после одного интраперитонеального инъекции в течение 3 дней25. Наши экспериментальные результаты продемонстрировали преобладание подмножества iNKT2 у мышей селезенки в течение 3 дней после интраперитонеальной инъекции К-Галсер, который в основном выделяет противовоспалительные цитокины IL-4 и IL-10. Мы также обнаружили, что обилие клеток iNKT2 уменьшилось, а количество клеток iNKT1 и iNKT17 увеличилось в мышах модели РА во время воспалительной фазы. Таким образом, мы выделили клетки iNKT селезенки мыши путем интраперитонеальной инъекции к-GalCer в течение 3 дней. Они были использованы для лечения МОДЕЛИ РА мышей. После индукции in vivo уровень подставки iNKT2 составил 82%. После очистки MACS, скорость iNKT2 превысила 92%.
Специфическая активация клеток iNKT используется в качестве нового биологического лечения РА. Horikoshi et al.21 продемонстрировали, что интрейдермальная инъекция к-ГалЦер ингибирует пептидный артрит GPI, значительно подавляя количество CD4и Т-клеток. Chiba et al.26 показали, что неоднократные инъекции синтетического селективного актививатора iNKT2 OCH ингибировали ЦРУ, в то время как З-Галсер показал небольшой ингибирующее действие. Мы вводили селезенки полученных iNKT в РА модели мышей, и результаты показали, что степень отеков суставов в группе клеточной терапии и количество воспалительных клеток, проникающих в суставы была снижена. Увеличился уровень противовоспалительных цитокинов сыворотки (например, ИЛ-4 и Ил-10), а также уменьшилась секреция провоспалительных цитокинов (например, ИФН-З и ТНФ-З). целенаправленная активация клеток iNKT смогла облегчить прогрессирование РА и ингибировать воспалительные реакции. Кроме того, мы обнаружили частоту iNKT в тимусе и обнаружили, что количество iNKT-клеток в группе моделей РА было значительно сокращено, а частота в тимусе увеличилась после вливания клеток iNKT. Из-за наличия системы барьера тимуса, мы не рассматривали приемно едкое повышение уровня iNKT в тимьяне, что было подтверждено в последующих экспериментах. Дальнейшее обнаружение субпопуляций клеток iNKT в тимусе показало, что, по сравнению со здоровой контрольной группой, количество клеток iNKT1 в модельной группе РА значительно увеличилось в течение трех стадий воспаления и максимально во время пика воспаления, в то время как доля подмноза iNKT2 начала увеличиваться на пике воспаления. Примечательно, что подмножество iNKT1 может быть вовлечено в раннее воспаление РА, а подмножество iNKT2 может играть важную роль в ингибировании воспаления. По сравнению с модельной группой РА, подмножество iNKT1 в группе клеточной терапии значительно уменьшилось во время воспалительной фазы, а подмножество iNKT2 значительно увеличилось на ранней и ремиссионной стадии воспаления. Эти результаты показали, что приемная инфузия специфических фенотипов и функциональных клеток iNKT значительно увеличила частоту iNKT-клеток в РА и изменила долю подмножеств iNKT.
Мы использовали IVIS для наблюдения за распределением клеток iNKT у мышей после адаптивного инфузии и обнаружили самую высокую интенсивность флуоресценции в легких через 10 мин после инфузии, которая постепенно исчезла. Печень показала слабую флуоресценцию, которая постепенно увеличивалась и постепенно уменьшалась через 2 дня. Флуоресценция была обнаружена в селезенке на 30 мин, которая постепенно увеличивалась и уменьшалась через 2 дня. Средняя интенсивность флуоресценции печени была сильнее, чем у селезенки. Однако в тимусе и ингинале лимфатических узлов не выявлено флуоресценции. Обнаружение флуоресценции в легких может быть связано с вливанием клеток iNKT в хвостовую вену. Эти клетки циркулируют в легкие с кровью. Флуоресцирует печень раньше, чем селезенка, и средняя интенсивность флуоресценции печени сильнее, чем у селезенки. Это преференциальное накопление клеток iNKT может быть связано с обильными кровеносными сосудами в печени, основной метаболический орган. Флуоресценция не была обнаружена в тимусе. Это может быть связано с гематологическим барьером, который может препятствовать проникновению клеток iNKT. Флуоресценция никогда не была обнаружена в ингинатических лимфатических узлах, возможно, потому, что меньше енкоров вошел в лимфатические узлы и не достигли минимального уровня обнаружения. Кроме того, можно предположить, что клетки iNKT, влитые в хвостовую вену, могут не попасть в лимфатические узлы. Таким образом, мы предполагаем, что развитие и дифференциация клеток iNKT в тимусе может регулироваться через цитокиновые пути после адаптивного вливания в мышей. Это необходимо прояснить дальше.
GPI присутствует в сыворотке крови и синовиальной жидкости большинства пациентов РА и является широко используемым тестом для клинической диагностики РА27. Bruns et al.28 использовали пептиды разной длины из последовательности GPI и иммунизировали мышей DBA/1 для выявления шести иммунодоминсивных эпитопов Т-клеток. Из них три были артритогенными. Пептиды с йgt;95% заболеваемости артритом являются hGPI 325-339 и hGPI469-483. Наши предыдущие исследования показали, что использование смеси двух пептидов для создания модели РА лучше, чем один пептид. В результате РА модели, носы и суставы мышей начали появляться красными на 6-й день и достиг пика воспаления на 14-й день. Инфильтрация воспалительных клеток сопровождалась гиперплазией тканей в синовиальной ткани суставов, а инфильтрация воспалительных клеток была наиболее тяжелой на 14-й день. Количество клеток iNKT значительно уменьшилось в тимусе на пике воспаления, что соответствовало тенденции iNKT-клеток у пациентов РА29. Дальнейшее обнаружение подмножества клеток iNKT показало, что частота iNKT1 и iNKT17 в тимусе увеличилась, а частота iNKT2 снизилась во время прогрессирования воспаления (день 11). Кроме того, уровни цитокинов сыворотки IFN-и IL-17A увеличились во время прогрессии (день 11) и пик воспаления (день 14), предполагая аналогичную поляризацию Th1 и Th17 подгрупп в модели МЫшей РА30. Таким образом, модель мыши РА, индуцированная hGPI325-339 и hGPI469-483 смешанных фрагментов полипептида, продемонстрировала характеристики гиперпролиферации клеток CD4и T, которая была похожа на дефекты клеток РА, и могла быть использована в качестве идеальной животной модели для исследования иммунитета клеток РА. Эти результаты были в согласии с результатами наших предыдущих исследований и продемонстрировали стабильность hGPIs-индуцированной модели РА31.
В целом, модель мыши РА, индуцированная смешанными пептидами G6PI, может имитировать изменения в КЛЕТКах CD4и Т, iNKT-клетках и связанных с ними цитокинах у пациентов РА. Это обеспечивает хорошую модель для углубленного исследования РА. Последовательно, iNKT (главным образом iNKT2) индуцированный интраперитонеальной инъекцией q-GalCer и очищенной in vitro был использован в обработке RA. Он может исправить иммунный дисбаланс, вызванный аномальным распространением Т подмножеств, облегчить прогрессирование РА, и в будущем может обеспечить новые методы для клинического лечения РА.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Авторы не заявляют об отсутствии финансирования или конфликтах интересов.
Acknowledgments
Наше исследование было поддержано Национальным фондом естественных наук Китая (NSFC) (81771755), колледжами и ключевым исследовательским проектом науки и техники университета провинции Хэбей (D2017009) и Центром медицинских экспериментов Animal Lab of Medical Experiment, Университетом Хэвэя. Мы благодарны за их поддержку.
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 647 Mouse Anti-PLZF | BD | 563490 | America |
| Anti-PE MicroBeads | Miltenyi | 130-048-801 | Germany |
| Columns | Miltenyi | MS | Germany |
| Cryogenic Centrifuge | Beckman | Allegra® X-15R | America |
| DiR | Thermo Fisher Scientific | D12731 | America |
| Embedding Center | Tianjin Aviation Electromechanical Co., Ltd. | BMJ-1 | China |
| FITC Hamster Anti-Mouse TCR β Chain | BD | 553170 | America |
| Flow cytometer | BD | Accuri C6 | America |
| Freund's complete adjuvant | Sigma | F5881 | America |
| hGPI325-339 (IWYINCFGCETHAML) | Karebay Biochem | 18062202 | China |
| hGPI469-483 (EGNRPTNSIVFTKLT) | Karebay Biochem | 18062203 | China |
| In Vivo Imaging System | PerkinElmer | caliper IVIS lumina II | America |
| Ionomycin Calcium | Cayman | 10004974 | America |
| KRN7000 | AdipoGen | AG-CN2-0013 | America |
| Mouse CD1d Tetramer-PE | MBL | TS-MCD-1 | Japan |
| Mouse percoll | Solarbio | P8620 | China |
| Optical Microscope | Olympus | Olympus-II | Japan |
| PerCP-CyTM5.5 Mouse anti-ROR-ϒt | BD | 562683 | America |
| PerCP-CyTM5.5 Mouse anti-T-bet | BD | 561316 | America |
| Pertussis toxin | Sigma | P7208 | America |
| phorbol esters | Cayman | 10008014 | America |
| Red Blood Cell Lysis Buffer | BD | 555899 | America |
| RPMI-1640 | Biological Industries | 01-100-1ACS | Israel |
| Th1/Th2/Th17 cytokines kit | BD | 560485 | America |
| Ultramicrotome | Leica | Leica EM UC6 | Germany |
References
- Tobón, G. J., Youinou, P., Saraux, A. The environment, geo-epidemiology, and autoimmune disease: Rheumatoid arthritis. Autoimmunity Reviews. 35 (1), 0-14 (2010).
- Cross, M., et al. The global burden of rheumatoid arthritis: estimates from the Global Burden of Disease 2010 study. Annals of the Rheumatic Diseases. 73 (7), 1316-1322 (2014).
- Kanashiro, A., Bassi, G. S., Queiróz Cunha, F. D., Ulloa, L. From neuroimunomodulation to bioelectronic treatment of rheumatoid arthritis. Bioelectronics in Medicine. 1 (2), 151-165 (2018).
- Brennan, P. J., Brigl, M., Brenner, M. B. Invariant natural killer T cells: an innate activation scheme linked to diverse effector functions. Nature Reviews Immunology. 13 (2), 101-117 (2013).
- Bianca, B. S. Unraveling Natural Killer T-Cells Development. Frontiers in Immunology. 8, 1950 (2018).
- Mitsuo, A., et al. Decreased CD161+CD8+ T cells in the peripheral blood of patients suffering from rheumatic diseases. Rheumatology. 45 (12), 1477-1484 (2006).
- Miellot, A., et al. Activation of invariant NK T cells protects against experimental rheumatoid arthritis by an IL-10-dependent pathway. European Journal of Immunology. 35 (12), 3704-3713 (2005).
- Miellot-Gafsou, A., et al. Early activation of invariant natural killer T cells in a rheumatoid arthritis model and application to disease treatment. Immunology. 130 (2), 296-306 (2010).
- Tudhope, S. J., Delwig, A. V., Falconer, J., Pratt, A., Ng, W. F. Profound invariant natural killer t-cell deficiency in inflammatory arthritis. Annals of the Rheumatic Diseases. 69 (10), 1873-1879 (2010).
- Ming, M., et al. Effects on immunoregulation of iNKT cells in RA by novel synthetic immunostimulator CH1b. Chinese Journal of Immunology. 32 (02), 218-222 (2016).
- Ming, M., et al. Study of the correlation between the percentage of iNKT cells and the ratio of IFN-γ/IL-4 in patients with rheumatoid arthritis. Chinese Journal of Microbiology Immunology. 35 (3), 213-218 (2015).
- Sharif, S., et al. Activation of natural killer T cells by α-galactosylceramide treatment prevents the onset and recurrence of autoimmune Type 1 diabetes. Nature Medicine. 7, 1057-1062 (2010).
- Gapin, L. Development of invariant natural killer T cells. Current Opinion in Immunology. 39, 68-74 (2016).
- Kwon, D. I., Lee, Y. J. Lineage Differentiation Program of Invariant Natural Killer T Cells. Immune Network. 17 (6), (2017).
- Thapa, P., et al. The differentiation of ROR-γt expressing iNKT17 cells is orchestrated by Runx1. Scientific Reports. 7 (1), 7018 (2017).
- Schurgers, E., Billiau, A., Matthys, P. Collagen-induced arthritis as an animal model for rheumatoid arthritis: focuson interferon-γ. Interferon Cytokine Research. 31 (12), 917-926 (2011).
- Van Haalen, H. G. M., Severens, J. L., Tran-Duy, A., Boonen, A. How cost-effectiveness A systematic review and stepwise approach for selecting a transferable health economic evaluation rheumatoid arthritis. Pharmacoeconomics. 32 (5), 429-442 (2014).
- Schubert, D., Maier, B., Morawietz, L., Krenn, V., Kamradt, T. Immunization with glucose-6-phosphate isomerase induces T cell-dependent peripheral polyarthritis in genetically unaltered mice. Journal of Immunology. 172, 4503-4509 (2004).
- Bockermann, R., Schubert, D., Kamradt, T., Holmdahl, R. Induction of a B-cell-dependent chronic arthritis with glucose-6-phosphate isomerase. Arthritis Research, Therapy. 7, 131613-131624 (2005).
- Kamradt, T., Schubert, D. The role and clinical implications of G6PI in experimental models of rheumatoid arthritis. Arthritis Research, Therapy. 7, 20-28 (2005).
- Horikoshi, M., et al. Activation of Invariant NKT Cells with Glycolipid Ligand α-Galactosylceramide Ameliorates Glucose-6-Phosphate Isomerase Peptide-Induced Arthritis. PlosOne. 7 (12), 51215 (2012).
- Zhang, X. J., et al. Immunization with mixed peptides derived from glucose-6-phosphate isomerase induces rheumatoid arthritis in DBA /1 mice. Chinese Journal of Pathophysiology. 32 (3), 569-576 (2016).
- Motohashi, S., Nakayama, T. Invariant natural killer T cell-based immunotherapy for cancer. Immunotherapy. 1 (1), 73 (2017).
- Jung, S., et al. The requirement of natural killer T-cells in tolerogenic APCs-mediated suppression of collagen-induced arthritis. Experimental and Molecular Medicine. 42 (8), 547-554 (2010).
- Luc, V. K., Lan, W. Therapeutic Potential of Invariant Natural Killer T Cells in Autoimmunity. Frontiers in Immunology. 9, 519-526 (2018).
- Chiba, A., et al. Suppression of collagen-induced arthritis by natural killer T cell activation with OCH, a sphingosine-truncated analog of α-galactosylceramide. Arthritis, Rheumatism. 50 (1), 305-313 (2004).
- Tudhope, S. J., Delwig, A. V., Falconer, J., Pratt, A., Ng, W. F. Profound invariant natural killer t-cell deficiency in inflammatory arthritis. Annals of the Rheumatic Diseases. 69 (10), 1873-1879 (2010).
- Bruns, L., et al. Immunization with an immunodominant self-peptide derived from glucose-6-phosphate isomerase induces arthritis in DBA/1 mice. Arthritis Research, Therapy. 11 (4), (2009).
- Parietti, V., et al. Rituximab treatment overcomes reduction of regulatory iNKT cells in patients with rheumatoid arthritis. Clinical Immunology. 134 (3), 331-339 (2010).
- Yoshida, Y., et al. Functional mechanism(s) of the inhibition of disease progression by combination treatment with fingolimod plus pathogenic antigen in a glucose-6-phosphate isomerase peptide-induced arthritis mouse model. Biological, Pharmaceutical Bulletin. 38 (8), 1120-1125 (2015).
- Chen, D., et al. Study of the adoptive immunotherapy on rheumatoid arthritis with Thymus-derived invariant natural killer T cells. International Immunopharmacology. 67, 427-440 (2019).



