Summary
פרוטוקול זה משתמש G6PI פפטידים מעורבים לבנות מודלים דלקת מפרקים שגרונית כי הם קרובים לזו של דלקת מפרקים שגרונית האדם ב CD4+ T תאים ציטוקינים. טוהר גבוהה קבוע הרוצח טבעי תאים T (בעיקר iNKT2) עם פנוטיפים ספציפיים פונקציות הושגו על-ידי בvivo אינדוקציה וטיהור מבחנה עבור חיסוני המאמצת.
Abstract
דלקת מפרקים שגרונית (RA) היא מחלה חיסונית כרונית מורכבת דלקתית. הפתוגנזה של המחלה קשורה הרוצח הטבעי קבוע T (iNKT) תאים. חולים עם RA פעיל מציגים פחות תאים iNKT, הפונקציה תא פגום, ו פולריזציה מוגזמת של Th1. במחקר זה, מודל בעל חיים RA הוקמה באמצעות תערובת של hGPI325-339 ו-hGPI469-483 פפטידים. התאים iNKT הושגו על ידי vivo אינדוקציה וטיהור מבחנה, ואחריו אינפוזיה לתוך עכברים RA לטיפול חיסוני המאמצת. במערכת הדמיה vivo (IVIS) מעקב חשף כי תאים iNKT הופצו בעיקר בטחול ובכבד. ביום 12 לאחר טיפול בתאים, התקדמות המחלה האט למטה באופן משמעותי, הסימפטומים הקליניים היו להקלה, שפע של תאים iNKT ב בלוטת התימוס גדל, הפרופורציה של iNKT1 ב בלוטת התימוס ירד, ואת רמות של TNF-α, IFN-γ, ו-IL-6 ב הנסיוב ירד. חיסוני המאמצת של תאים iNKT שוחזר את האיזון של תאים חיסוניים תוקן דלקת מוגזמת של הגוף.
Introduction
דלקת מפרקים שגרונית (RA) היא מחלה אוטואימונית מאופיין על ידי כרונית, החלטיות מתקדמת עם 0.5 – 1%השכיחות 1,2. הפתוגנזה הבסיסית מיוחסת התפשטות נורמלית של התאים האוטומטיים CD4+ ו CD8+ T, המתבטאת בגידול ביחס של CD4+IFN-γ+ ו CD4+il-17a+ T תאים, ואת מספר מופחת של CD4+il-4+ ו CD4+CD25 + FoxP3 + T תאים. לכן, הפרשת ציטוקינים דלקתיים מוגברת, ותגובה דלקתית מוגזמת הורסת את האיזון הטבעי ואת תפקוד הסובלנות של המערכת החיסונית של הגוף. יתר על כן, המסייע T לימפוציטים (Th) 1 תאים החודרים המפרק להחמיר את התגובה הדלקתית נזק משותף. לכן, עיכוב של תגובה דלקתית מוגזמת ושחזור של סובלנות החיסונית ואיזון החיסון הם המפתח לטיפול RA3,4.
התאים iNKT יש גם תא NK ו-T פונקציות תא ומאפיינים. התאים iNKT הנמל ברורים, קולטן תא T קבוע (TCR) α-שרשרת עם מוגבל TCR β-שרשרת repertoires5 ולהכיר את האנטיגן גליקולפיד הציג על ידי מורכבות מורכבת היסטולידית העיקריים (mhc) מולקולה cd1d ו על פני השטח של תאים אנטיגן הצגת. מיצ ואח '6 זיהה מספר גדול של תאים inkt ופגמים פונקציונליים במחלות אוטואימוניות רבות, כולל RA. Aurore ואח '7 הפגינו כי תאים inkt יש השפעה חיובית על שמירה על סובלנות אוטואימונית וכי כאשר מספר ותפקוד של תאים inkt משוחזרים, המחלה היא להקלה. בנוסף, Miellot-גסו ואח '8 נמצא כי תאים inkt לא רק abרוזין את המחלה אלא גם הגביר את ההתקדמות של המחלה. אלה התוצאות סותרות מראים כי תאים iNKT הם תאים T הטרוגנית, ואת הפונקציה של קבוצות מערכות שונות יכול להיות הפוך. במחקר קליני של RA, תדירות של תאים iNKT בקורלציה עם התוצאה של פעילות המחלה9. התוצאות אישרו גם כי התדירות של inkt הצטמצמה בחולים RA, מספר CD4+ifn-γ+ תא מערכות המשנה של התא גדל, ואת רמות הסוד של ציטוקינים דלקתיות ifn-γ ו-tnf-α גדל10,11. בנוסף, שריף ואח '12 חקר סוכרת סוג 1 (T1D) ומצא כי עירוי סלקטיבי של תאים inkt upregulated את הביטוי של cy, דלקתיות IL-4, מתוחזק סובלנות החיסונית, ומנעו את ההתפתחות של סוכרת מסוג 1. לכן, עירוי המאמצת של תאים מסוימים iNKT או הפעלה ממוקדת של תאים iNKT מגביר את רמת התאים iNKT בחולים RA, אשר יכול להיות פריצת דרך בטיפול RA.
חיסוני הסלולר הוא כעת עניין רב והיה בשימוש נרחב בטיפול בסרטן. עם זאת, תאים iNKT הם נדירים, הטרוגנית החיסונית תאים (רק 0.3% מהמספר הכולל של PBMCs)13, אשר מגביל יישומים קליניים פוטנציאליים. תאים אלה מחולקים בעיקר לשלוש אוכלוסיות משנה: 1) iNKT1 תאים, אשר יש ביטוי גבוה של פרוליקמיה לוקמיה אבץ אצבע (PLZF) ומקדם תמלול T-box (T-bet); 2) iNKT2 תאים עם ביטוי ביניים של חלבון מאגד PLZF ו-טה 3 (GATA3); 3) iNKT17 תאים בעלי ביטוי נמוך של הקולטן PLZF ו retinoid הקשורים ליתומים גרעיני (ROR)-γt להפריש IFN-γ, IL-4, ו-IL-1714. תאים iNKT הופעל להפריש Th1, Th2, ו Th17 כמו ציטוקינים, אשר קובעים את ההשפעות האימונומודולטוריים שונים של תאים iNKT15. האפקטים האימונומודולטוריים והאימונותרפיה של הפעלה ספציפית של אוכלוסיות משנה שונות של תאי iNKT שונים. לכן, הבחירה של פנוטיפים ספציפיים של תאים iNKT (בעיקר iNKT2) עם פונקציות אנטי דלקתיות כדי לווסת את התגובה החיסונית של הגוף יכול לתקן את חוסר האיזון החיסונית הפרעות החיסון RA.
הקמתה של המודל החי האידיאלי הוא משמעותי מאוד לטיפול ולחקר של הפתוגנזה RA. כיום, הדגמים הנפוצים ביותר בשימוש בעלי חיים בוגרים כוללים דלקת מפרקים הנגרמת קולגן, דלקת מפרקים, מפרקים zymosan המושרה, ודלקת מפרקים רב המושרה16–17. עם זאת, אין מודל שיכול לדמות לחלוטין את כל התכונות של RA האנושית. סוג II קולגן המושרה דלקת מפרקים (CIA) הוא מודל דלקת מפרקים קלאסית. ה-CIA נגרמת על ידי חיסון של עכברים עם סוג II הקולגן הספציפי נוגדנים חד שבטיים, המשקף את התלות הנוגדן של מודל זה מחלה. Benurs ואח ' תיאר מודל עם תגובה חיסונית מערכתית ל גלוקוז-6-פוספט איזומראז (G6PI), אשר משרה מערכת מפרקים סימטרית היקפית סימטרי בזנים של העכבר הרגיש18,19. במודל זה, התפתחות של דלקת מפרקים תלויה בתאי T, B תאים, וחסינות מולדת18,19,20. Horikoshi21 נמצא כי מודלים RA כתוצאה מחיסון של DBA/1 עכברים עם שברי G6PI פוליפטידים דומים יותר לאדם RA במונחים של CD4+ T תאים ציטוקינים (כלומר, IL-6 ו-tnf-α) מאשר דגמי ה-CIA. כדי להגביר את ההשפעה המעוררת על אתר הזיהוי של TCR, שברי הפוליפפטיד המעורבים של G6PI (hGPI325-339 ו-hGPI469-483) שימשו לחיסון של עכברים DBA/1 כדי לבנות את מודל העכבר RA. שיעור ההצלחה של גישה זו יכול להיות גבוה בגלל hGPI325-339 ו-hGPI469-483 הם אימונומישומיניטית עבור התגובות האלה של תא T-A-q-מוגבל. לכן, מודל זה יכול לדמות את התפשטות יתר של CD4+ T תאים ופגמים תא inkt בחולים RA22. המחקר הבסיסי של RA immunopathology הניח את הבסיס לחקירה העמוקה יותר שלנו.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
כל העכברים הניסיוניים (150 בסך הכל) היו גברים בריאים DBA/1 עכברים, 6 – 8 בן שבועות (20.0 ± 1.5 g), גדל בסביבה מסוימת ללא הפתוגן (SPF). אין טיפול מיוחד לפני דוגמנות. הניסוי התחלק לקבוצת שליטה בריאה (15 עכברים), קבוצת בקרת מודל (15 עכברים) וקבוצת טיפול בתאים (55 עכברים). מחקר זה אושר על ידי רווחה בעלי חיים והוועדה האתית של אוניברסיטת חביי.
1. בניית מודל המחלה
- שכפול מודל בעלי חיים RA
- שוקלים 1.75 מ"ג של שני hG6PI 325-339 ו hG6PI 469-483 שברים לפזר אותם 5.25 mL של 4 ° c משולשת מים מזוקקים.
- התמוססות להשלים את הפסיקה של פרוינד (פרנק) באמבט מים ב50 ° c, שלוף 5.25 mL לתוך שפופרת צנטריפוגה נוספת של 10 מ ל, וצנן אותו לשימוש.
- לשים את התערובת של פתרון hG6PI ואת הפתרון של המכשיר ביחידת אמולסיה מלאכותית עם שני מזרקים זכוכית מחוברים.
- לדחוף את המזרק במהירות קבועה ותדירות של 10-20x לדקה כדי לטפל לחלוטין בפתרון פפטיד מעורב ופתרון. בצע את הפעולה באמבט קרח, ושמור את טיפות האמולסיה במים למשך 10 דקות לאחר השלמת התחליב ללא פיזור.
- הכנס 150 μL של אמולסיה hG6PIs לתוך תת-עורי הזנב של העכבר.
- הכנס 200 מ"ג של הרעלן של פרטזיס לתוך העכבר intraperitoneally ב 0 h ו 48 h לאחר הזרקת hG6PI.
- אימות ניסיוני של מודל RA
- מדוד את עובי כף העכבר עם קליבר (2x ביום).
- להתבונן ולסמן את מידת האדמומיות והנפיחות של כף הרגל. השתמש בקריטריוני הניקוד הבאים: 1) בהונות עם נפיחות קלה; 2) משטח כף רגל עם נפיחות אדומה ברורה; 3) קרסול עם נפיחות אדומה.
- המתת חסד העכברים תחת הרדמה עמוקה על ידי הזרקה תוך הצפק של 1% נתרן פנטוברביטל (50 mg/ק"ג משקל הגוף) 14 ימים לאחר דוגמנות ולהסיר את כפות הרגליים עבור כתמים הוא.
- בדוק את רמות הפרשת הסרום IL-2, IL-4, IL-6, IL-10, IL-17A, TNF-α, ו-IFN-γ באמצעות מערך מסחרי של הסייטוטריק חרוז (CBA) בהתאם לפרוטוקול של היצרן.
2. קבלת תאים iNKT עם טיפול הסלולר המאמצת
- אינדוקציה כיוונית של תאי iNKT
- הכנס עכברים נורמליים intraperitoneally עם α-GalCer (0.1 מ"ג/ק"ג של משקל הגוף).
- בידוד של תאי iNKT
- שלושה ימים לאחר דוגמנות, להזריק עכברים intraperitoneally עם 1% נתרן פנטוברביטל (50 mg/ק"ג של משקל הגוף) עבור ההרדמה. עכברים מורדם כראוי לא מראים תגובה נסיגה האחוריות לצבוט בבוהן.
- לבודד את הטחול של עכבר DBA/1 לאחר הזרקת אותו intraperitoneally עם α-GalCer. הכן תא השעיה אחד על ידי גזירה ושיוף הטחול בתוך הנפה 200 שינוי.
- לשטוף את ההשעיה התא עם PBS, צנטריפוגה ב 200 x g עבור 5 דקות, ולמחוק את supernatant. חזור על.
- השהה מחדש את התאים באמצעות 1 מ ל של פתרון לדילול הדם והרקמה השלמה. הוסף 3 מ ל של הפרדה בינונית לימפוציטים של העכבר, ולאחר מכן צנטריפוגה את התאים עבור 20 דקות ב 300 x g בטמפרטורת החדר.
- לאסוף את השכבה של לימפוציטים לבנים חלבי (כלומר, השכבה השנייה מלמעלה), לשטוף את זה 2x עם PBS, ולספור עם מונה תאים אוטומטי.
- מיון תא מגנטי מופעל (מקינטוש) אסטרטגיה בחירה חיובית לטיהור של תאים iNKT
הערה: לטיפול מקדים של Cd1d ו ארבמרס, 1 מ"ג/mL של α-Galcer היה מדולל 200 μg/mL עם 0.5% של רצף-20 ו-0.9% של הנאל, ו 5 μL של הפתרון שהתקבל נוספה כדי 100 μL של הפתרון Cd1d ו ארבמאר. התערובת הייתה מודקרת ל -12 שעות בטמפרטורת החדר וממוקמת ב -4 ° c לשימוש. TCR β היה מדולל 80x עם מים מפוהים. כל הנוגדנים האחרים שימשו כפתרון מניות.- השהה מחדש 107 תאים עם 100 μl של 4 ° c PBS, להוסיף 10 μl של α-galcer טעון Cd1d ו הטטרמר-PE, ומארג אותם ב 4 ° c עבור 15 דקות בחושך.
- שטוף את התאים 2x עם PBS והשהה אותם מחדש ב-80 μL של PBS.
- הוסף 20 μL של anti-PE-מיקרוחרוזים ו מודב 4 ° c עבור 20 דקות בחושך.
- לשטוף אותם 2x עם PBS ולהשעות מחדש את התאים עם 500 μL של PBS.
- הצב את עמודת המיון בשדה המגנטי של סדרן מקינטוש ושטוף עם 500 μL של PBS.
- הוסף את ההשעיה התא משלב 2.3.4 לעמודת מיון, לאסוף את הפרח, ולשטוף 3x עם מאגר PBS.
- הסר את השדה המגנטי ואסוף את התאים מעמודת המיון. בשלב זה, להוסיף 1 mL של מאגר PBS לעמודת מיון, ובמהירות לדחוף את הבוכנה בלחץ קבוע כדי לכונן את התאים המסומנים לצינור האוסף ולקבל מטוהר תאים iNKT. . תספור עם מונה תאים אוטומטי
- זיהוי התא של iNKT
- קח 1 x 106 תאים משלבים 2.2.5 ו 2.3.7, בהתאמה, ו להשעות אותם מחדש ב-50 μl של PBS.
- הדגירה נוגדן: לא להוסיף את הנוגדן לצינור הבקרה שלילי, להוסיף 0.5 μL של α-GalCer-PE-Cd1d ו ארבמר או 10 μL של FITC-TCR β בצינור הבקרה החיובי היחיד. להוסיף 0.5 μL של α-GalCer-PE-Cd1d ו ארבמר ו 10 μL של FITC-TCR β במבחנה לדוגמה. מודקון אותם ב 4 ° c עבור 30 דקות בחושך.
- לשטוף את התאים PBS ולאחר מכן צנטריפוגה ב 200 x g עבור 5 דקות.
- להיפטר supernatant, להוסיף 1 מ ל של Foxp3 Foxation/החדירות הפתרון העבודה, ו מודלת את התאים עבור 45 דקות ב 4 ° c בחושך.
- הוסף 1 mL של מאגר חדירות 1x עבודה וצנטריפוגה את התאים בטמפרטורת החדר עבור 500 x g בטמפרטורת החדר עבור 5 דקות.
- . מחק את הסופרנטאנט הוסף 1 μL של אלקסה Fluor 647 העכבר Anti-PLZF ו 1 μL של PerCP-Cy 5.5 העכבר נגד-T-bet (או 1 μL של PerCP-Cy 5.5 העכבר anti-RORΥt) עבור 30 דקות בטמפרטורת החדר בחושך.
- הוסף ל 2 מ ל של מאגר החדירות פתרון עבודה לניקוי.
- להיפטר supernatant, להשעות מחדש את התאים ב-500 μL של PBS, ולמדוד על ידי זרימה cy, לנסות.
- זיהוי תפקודי של תאי iNKT
- לקחת 3 x 106 תאים inkt משלב 2.3.7 ולהשעות אותם בתוך 12 צלחות טוב עם 1.5 ML של RPMI-1640 בינוני שלם (כלומר, ללא סרום).
- הוסף את אסתר (PMA, 50 ng/mL) ואיקונמיצין סידן (IO, 1 μg/mL) ומקום בחממה2 עבור 24 שעות.
- לאסוף את הטלפון supernatant ולזהות את רמות הפרשת IL-2, IL-17A, TNF-α, IL-6, IL-4, IFN-γ, ו-IL-10 באמצעות שיטת CBA מסחרי על פי פרוטוקול היצרן.
- מחקר ניסיוני על מסלול הגירה של תאים iNKT בעכברים RA
- לפזר את צבע DiR (2.5 mg/mL) ב DMSO.
- השעיה מחדש של תאים iNKT ב 6 צלחות היטב עם RPMI-1640 בינוני לא שלם. הצפיפות היא 1 × 106 תאים/mL.
- הוסף את DiR (5 μg/mL) פתרון ו-מודטה באינקובטור CO2 עבור 25 דקות.
- לשטוף עם PBS ולהשעות מחדש את התאים (3 x 106/300 μl) כדי להשיג את התאים inkt שכותרתו DiR (Dir-inkt).
- הכנס 1% נתרן פנטוברביטל (50 מ"ג/ק"ג משקל הגוף) intraperitoneally כדי להרג את העכברים. עכברים מורדם כראוי לא מראים נסיגה האחוריות לצבוט הבוהן. החלת משחה וטרינרית על עיני העכבר כדי למנוע יובש תוך הרדמה להדמיה.
- הכנס את מספר התאים DiR-iNKT 3 x 106 לכל עכבר לתוך הווריד הזנב עם מודל RA במשך 8 ימים. ניטור תאים iNKT בתוך הזרקת עכברים עבור 0 דקות, 10 דקות, 30 דקות, 60 דקות, ויום 0 (אחרי 3 שעות), 1, 3, 6, 12, 26, 34, 38, ו 42 ימים באמצעות בעל חיים קטן במערכת הדמיה vivo (IVIS). אורך הגל המשמש היה 748 ננומטר, אורך הגל הפליטה היה 780 ננומטר, ואת זמן החשיפה היה אוטומטי.
- מניחים כל עכבר בכלוב נפרד לאחר כל התבוננות לשמור על שכיבה. להתבונן עד התאוששות מהרדמה.
3. הערכה של הטיפול חיסוני המאמצת של עכברים RA עם תאים iNKT
- תא iNKT-טיפול חיסוני המאמצת עבור עכברים RA
- הכנס 3 x 106 תאים inkt תאים לכל עכבר דרך הווריד הזנב. באופן אקראי לבחור 15 עכברים שהיו מעוצב 8 ימים לפני ולהשיג תאים iNKT ללא תיוג משלב 2.3.7 על ידי אינפוזיה וריד הזנב.
- הערכת את היעילות של טיפול חיסוני המאמצת עבור תאי iNKT.
- למדוד את העובי של כף העכבר, לכמת את הנפיחות של מפרק הקרסול, וציון בשיטתיות לאחר העירוי של תאים iNKT כפי שמתואר בשלבים 1.2.1 – 1.2.2.
- להתבונן הסתננות תא דלקתי שינויים משותפים של המפרקים העכבר כפי שמתואר בשלב 1.2.3.
- לקבוע את רמות הפרשת IL-2, IL-4, IL-6, IL-10, IL-17A, TNF-α, ו-IFN-γ כפי שמתואר בשלב 1.2.4.
- קבע את התדירות של תאים וערכות ממשנה של iNKT.
- לבודד את התימוס העכבר ולהכין השעיה תא אחד.
- הפרד את לימפוציטים עם נוזל הפרדה לימפוציט.
- קבע את תדירות התא של iNKT ואת תדירות קבוצות המשנה כפי שמתואר בשלב 2.4.
- אנליזה סטטיסטית
הערה: כל הנתונים מוצגים כממוצע ± SD. ערכים של P < 0.05 נחשבו משמעותיים סטטיסטית.- השתמש בניתוח של גורם אחד של סטיה (ANOVA). אם הסטיה מסופקת, השתמש בבדיקת LSD להשוואה נוספת.
- אם הסטיה אינה אחידה, השתמש בבדיקה שאינה פרמטרית. השתמש במבחן מקרוקאל-ווליס. להמשך השוואה31
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
מדד דלקת מפרקים ניקוד ועובי כפה עלה לאחר הדוגמנות. בהשוואה לקבוצת הביקורת, הבהונות של קבוצת מודל RA החלו להראות נפיחות אדומה ב 6 ימים לאחר הדוגמנות, עם החמרה הדרגתית. במהלך 14 ימים, הנפיחות האדומה במפרק הקרסול הגיעה לשיאה, ולאחריה הקלה הדרגתית. עובי כף היד השתנה באופן דומה (P < 0.05) (איור 1).
הסתננות התא דלקתית גדל באופן משמעותי לאחר הדוגמנות. התוצאות הפתולוגיים הראו כי מידת החדירה של תאים דלקתיים ברקמת הקרסול של העכברים מודל RA היה שונה בשלבים שונים. דלקת בשיא התרחשה ביום 14 פוסט מידול (איור 2).
ציטוקינים דלקתיות גדל ואנטי דלקתיות ציטוקינים ירד בסרום. בקבוצת המודל RA, רמות הסרום של ציטוקינים פרו-דלקתיות (TNF-α, IFN-γ, ו-IL-6) גדל באופן משמעותי (p < 0.05), בעוד ציטוקינים אנטי דלקתיות (il-4 ו-il-10) ירד באופן משמעותי (P ≪ 0.05) (איור 3).
התאים iNKT שהתקבלו על ידי vivo אינדוקציה וטיהור מבחנה בעיקר מורכב של קבוצות מערכות iNKT2 תאים, אשר להפריש ציטוקינים אנטי דלקתיים. הזרקה תוך הצפק של α-GalCer הגדילה את התדירות של תאים iNKT בגוף, בעיקר את קבוצת המשנה iNKT2. התדירות של הטחול תאים iNKT בעכברים רגיל DBA/1 היה כ 2% של לימפוציטים, (iNKT2 היה על 5%, iNKT1 על 15%, iNKT17 על 10%). שלושה ימים לאחר ההזרקה התוך הצפק של α-GalCer, התדירות של תאים iNKT היה כ 6% של לימפוציטים, (iNKT2 היה כ 82%, iNKT1 על 1.5%, ו iNKT17 על 0.5%). לאחר הטיהור על ידי מקינטוש, הטוהר של תאים iNKT היה מעל 85%, אשר iNKT2 היה כ 92%, iNKT1 על 0.4%, ו iNKT17 על 0.2% (איור 4).
התאים שנקטפו iNKT הפריש ציטוקינים אנטי דלקתיות יותר ציטוקינים דלקתיים פחות. התאים inkt מבודדים את טחולים של עכברים נורמליים intraperitoneally הוזרק עם α-galcer 3 ימים לאחר הטחול של העכבר (α-galcer הקבוצה) ואת רמות ציטוקינים בתרבות הסופרנטאנט התרבויות נבדקו. בהשוואה לקבוצת הביקורת, ציטוקינים דלקתיים (IL-17A, TNF-α, IFN-γ, ו-IL-6) של קבוצת α-GalCer באופן משמעותי ירד (p < 0.05), ואת האנטי דלקתיות CY, IL-4 רמת הגדילה באופן משמעותי (p < 0.05). לא היה הבדל משמעותי ב-IL-10 (P > 0.05). היחס IFN-γ/IL-4 הופחת באופן משמעותי (P < 0.05) (איור 5).
מעקב IVIS אישר כי התאים DiR-iNKT היו מאומצים לתוך עכברים RA ומיד הופיעו הזרקת הריאות. הקרינה הפלואורסצנטית זוהה בכבד 10 דקות בטחול ב 60 דקות (איור 6AI, 6AII, 6aiii). באיברים מבודדים, לא היה זריחה ב בלוטת התימוס ואת בלוטות הלימפה בתוך 1 h. הזריחה התגלתה בריאות ב 0 דקות, האינטנסיביות הפלואורסצנטית היה הגדול ביותר 10 דקות, ולאחר מכן נחלש בהדרגה. הכבד היה בתוך 0 דקות, והוא גדל בהדרגה. הזריחה בטחול זוהה 30 דקות ואז גדל בהדרגה (איור 6Aiv, 6c).
לאחר העירוי של תאים DiR-iNKT לתוך העכברים RA, הזריחה היה מרוכז בעיקר בכבד ובטחול (איור 6BI, 6bii, 6bii), אבל לא היה זריחה בבלוטות הלימפה התימוס. הטחול והכבד היתה עוצמת הקרינה הגבוהה ביותר ביום 1 לאחר עירוי התא, אך הוא נחלש בהדרגה. ביום 34, הזריחה. מפני השטח נעלמה ביום 42, הקרינה הפלואורסצנטית של האיברים המבודדים נעלמה. העוצמה הממוצעת של האות הזריחה של הכבד לאחר האינפוזיה התא היה גבוה יותר מזו של הטחול (איור 6בתים, 6d).
עירוי המאמצת של תאים iNKT לתוך עכברים RA יכול להקל על התקדמות המחלה ולשפר את הסימפטומים הקליניים. התאים iNKT שיפרו את הסימפטומים הקליניים של עכברים RA לאחר עירוי המאמצת. בהשוואה לקבוצה המודל RA מטופל, הנפיחות של מפרק הקרסול הוקל בקבוצת הטיפול בתאים, והציונים ירדו באופן משמעותי מהיום 10 עד יום 20 הזרקת. באותה תקופה בקבוצה הטיפול התא, הסתננות תאים דלקתיים ברקמת אמתחת הופחת בהשוואה לקבוצת מודל RA (איור 2).
שיעורי ההצלחה של תאים iNKT בתימוס גדל באופן משמעותי (P < 0.05). בהשוואה לקבוצת השליטה הבריאה, בקבוצת המודל של RA, התעריפים של תאי iNKT בבלוטת התימוס ירדו במהלך ההתקדמות (יום 11), שיא (יום 14) ושחזור (יום 20) שלבים. בשלב הדלקת השיא, ערכים אלה היו מינימליים והוא הוכן בתקופת ההפוגה. הקבוצה טיפול בתאים הראו משמעותית שיעורי הגדילה של תאים iNKT בשיא (יום 14) והתאוששות (יום 20) שלבים בהשוואה עם קבוצת מודל RA (P < 0.05) (איור 7).
לאחר אינפוזיה תא iNKT, שיעור ההצלחה של iNKT1 ו iNKT17 בתימוס ירד ו iNKT2 גדל. בהשוואה לקבוצת הביקורת, בקבוצת המודל RA ביום 11 iNKT1 ו iNKT17 בתימוס גדל באופן משמעותי (p < 0.05), ו iNKT2 ירדו באופן משמעותי (p < 0.05). ביום 14, iNKT1 ו iNKT2 בתימוס גדל באופן משמעותי (p < 0.05) ו iNKT17 ירדו באופן משמעותי (p < 0.05). ביום 20, iNKT1 בתימוס גדל באופן משמעותי (p < 0.05), iNKT2 לא השתנה באופן משמעותי (p > 0.05), ו iNKT17 ירדו באופן משמעותי (p < 0.05). INKT1/iNKT2 היחס גדל באופן משמעותי במהלך כל שלושת השלבים (P < 0.05).
בהשוואה לקבוצת המודל RA, ביום 11 ב α-GalCer ואת קבוצות הטיפול בתאים, iNKT1 ו iNKT17 היו נמוכים באופן משמעותי (p < 0.05) ו iNKT2 גדל באופן משמעותי (p < 0.05). ביום 14, בקבוצה α-GalCer iNKT1 ו iNKT17 ירד באופן משמעותי (p < 0.05), ו iNKT2 לא השתנה באופן משמעותי (p > 0.05); בקבוצת טיפול התא iNKT1 ו iNKT17 ירדו באופן משמעותי (p < 0.05) ו iNKT2 גדלו באופן משמעותי (p < 0.05). ביום 20, בקבוצה α-GalCer iNKT1 ירד באופן משמעותי (p < 0.05), iNKT2 לא השתנה באופן משמעותי (p > 0.05), ו iNKT17 גדל באופן משמעותי (p < 0.05); בקבוצת טיפול התא iNKT1 ו iNKT17 ירדו באופן משמעותי (p < 0.05) ו iNKT2 גדלו באופן משמעותי (p < 0.05). היחס של iNKT1/iNKT2 ירד באופן משמעותי במהלך כל שלושת השלבים (P < 0.05) (איור 7).
רמות של ציטוקינים דלקתיים גדלו בסרום, ציטוקינים אנטי דלקתיים ירדו לאחר עירוי תא iNKT. בקבוצת המודל RA, רמות של TNF-α, IFN-γ, ו IL-6in סרום גדל באופן משמעותי (p < 0.05), בעוד il-4 ו-il-10 הראו כמויות ירידה ניכרת (p < 0.05) בהשוואה לקבוצת הביקורת. בקבוצת הטיפול של תא iNKT, רמות של TNF-α, IFN-γ, ו-IL-6 בסרום ירד באופן משמעותי בהתקדמות ובשלבים שיא של דלקת (p < 0.05), בעוד il-4 ו-il-10 גדל באופן משמעותי (p < 0.05) בהשוואה לקבוצת מודל RA (איור 3).
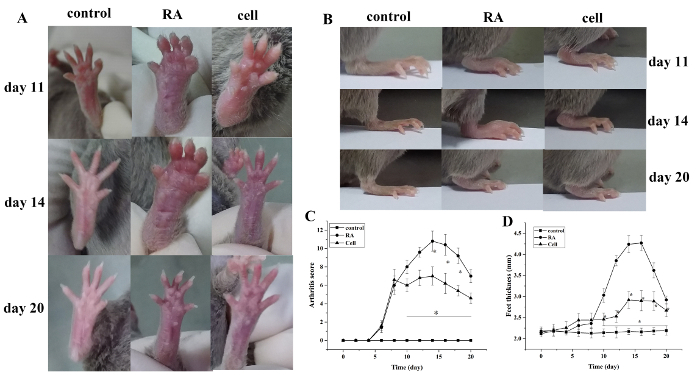
איור 1: הציון הנפיחות המשותפת ועובי שינוי בעכברים. (א) נפיחות של מפרק הקרסול בעכברים. (ב, ד) . כעובי כף בקבוצות שונות (ג) שינויים בניקוד הקליני בקבוצות שונות. הציון של דלקת מפרקים העכבר ואת עובי כף היד הופחת באופן משמעותי בקבוצת הטיפול בתאים בימים 10 – 20 (כלומר, 2 – 12 ימים לאחר הטיפול) לאחר הדוגמנות. *P < 0.05 לעומת שליטה, * *P < 0.05 לעומת RA. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: שינויי ההיסטואולוגיים של מפרק הקרסול. חדירת תאים דלקתיים הופחת באופן משמעותי בקבוצת הטיפול בתאים וגדל באופן משמעותי בקבוצת RA ביום 14. ◊ = תאים דלקתיים. (א) 100 x (ב) 400x. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: רמות ציטוקינים של סרום בכל קבוצה. (א) סרום ציטוקינים רמות בעכברים ביום 11 לאחר מידול (Pg/mL). (ב) סרום ציטוקינים רמות בעכברים ביום 14 לאחר דוגמנות (Pg/mL). הרמות של TNF-α, IFN-γ, ו-IL-6 ירד באופן משמעותי, ורמות IL-4 ו-IL-10 גדל באופן משמעותי בקבוצת הטיפול בתאים. P < 0.05 לעומתשליטה. bP < 0.05 לעומת רא. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4: שיעורי התאים של inkt וחלק מערכות המשנה של תא inkt. (א, ב, ג) הקצב של iNKT2 בעכברים נורמליים הוא ~ 5%. (D, E, F) שיעור iNKT2 הוא כ 82% לאחר vivo אינדוקציה. (G, H, I) שיעור iNKT2 הוא יותר מ 92% לאחר טיהור מקינטוש. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 5: רמות Cytokine בתרבות supernatant של הטחול העכבר-הנגזרים תאים iNKT. רמת IL-4 הוגדלה באופן משמעותי, ואת רמות IL-17A, TNF-α, IFN-γ, ו-IL-6 ירד באופן משמעותי. P < 0.05 לעומתשליטה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 6: הפצה ומטבוליזם של תאים inkt מעקב על ידי קליבר ivis לומינה II. (א, ב) נתיב העברה של תאי iNKT. (ג) השינוי בעוצמת האות הפלואורסצנטית הממוצעת בטחול, בכבד ובריאה. (ד) השינוי של עוצמת אות הזריחה הממוצעת בטחול ובכבד. הזריחה זוהתה בריאות ובכבד ב -0 דקות, ואז הוגדלה בהדרגה. עוצמת הקרינה היה החזק ביותר 10 דקות בריאות ולאחר מכן ירד. הקרינה הפלואורסצנטית של הטחול זוהה 30 דקות, ואז גדל בהדרגה. הקרינה הפלואורסצנטית של כל. האיברים נעלמה ביום 42 עוצמת האות הממוצעת בזריחה של הכבד גבוהה יותר מאשר הטחול אחרי התאים אינפוזיה (I: supine; II: שקרים צדדיים; III: נוטה; IV: רקמה מבודדת; a: קבוצת בקרה; b: קבוצת עירוי תאים; 1, 2, 3, 4, 5 הם בלוטת התימוס, הטחול, הכבד, בלוטות הלימפה אינרינאלה, הריאות). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 7: שיעורי iNKT וקבוצות המשנה שלה בתימוס העכבר. (א) שיעורי תאים inkt ב -11, 14, ו 20 ימים לאחר הדוגמנות. (ב) היחס של INKT1/iNKT2. (C, D, E) הקצב של iNKT1, iNKT2 ו-iNKT17. בימים 11, 14, ו 20 (ימים 3, 6, ו 12 לאחר טיפול בתאים), שיעורי התאים iNKT גדל באופן משמעותי, iNKT1 ו iNKT17 של התימוס ירד באופן משמעותי בקבוצה טיפול בתאים, ו iNKT2 הוגדלה באופן משמעותי. aP < 0.05 לעומת שליטה. bP < 0.05 vs RA. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
תאים iNKT הם תאי T מיוחדים המגשרים חסינות מולדת ואדפטיבית מפותחים בעיקר מ CD4+/cd8+ thymocytes. תאים iNKT יש פונקציות immunoregulatory מגוונת אינטראקציה עם תאים חיסוניים אחרים על ידי מגע ישיר הפרשת ציטוקינים שונים23, המשפיעים על תאים דנדריטים (DCs), מקרופאגים, נויטרופילים, B תאים, T תאים, ו בידול התא NK ופיתוח24. α-GalCer הוא activator הקלאסי תא דיו שחולצו מן ספוגים. מספר מחקרים מצביעים על כך הטחול תדר תא iNKT מגיע לפסגה לאחר הזרקה בודדת הצפק של α-GalCer עבור 3 ימים25. התוצאות הנסיוניות שלנו הפגינו את הדומיננטיות של iNKT2 המשנה בטחול עכברים עבור 3 ימים לאחר הזרקה התוך הצפק של α-GalCer, אשר בעיקר מפריש ציטוקינים אנטי דלקתיות IL-4 ו-IL-10. מצאנו גם כי שפע של תאים iNKT2 ירד וכי של iNKT1 ו iNKT17 תאים גדל בעכברים מודל RA בשלב דלקתי. לכן, בודדנו את תאי iNKT של הטחול של העכבר על ידי הזרקה תוך הצפק של α-GalCer עבור 3 ימים. אלה שימשו לטיפול עכברים מודל RA. קצב iNKT2 המשנה היה 82% לאחר vivo אינדוקציה. לאחר הטיהור על ידי מקינטוש, הקצב של iNKT2 חרג 92%.
ההפעלה הספציפית של תאים iNKT מועסק כטיפול ביולוגי רומן עבור RA. האוריקואשי ואח '21 הפגינו כי הזרקה הפנים של α-galcer עכבות gpi המושרה פפטיד-דלקת מפרקים על ידי עיכוב משמעותי את מספר CD4+ T תאים. צ'יבה ואח '26 הראה כי זריקות חוזרות של הiNKT2 הסינתטי סלקטיבי activator, בעוד α-galcer הראה אפקט מעכבות קל. מזריקים הטחול נגזר iNKT לתוך עכברים מודל RA, ואת התוצאות הראו כי מידת הנפיחות של המפרקים בקרסול בקבוצה טיפול בתאים ומספר תאים דלקתיים החדירה לתוך המפרקים הופחת. הרמה של הסרום ציטוקינים אנטי דלקתיים (למשל, IL-4 ו-IL-10) גדל, ואת הפרשה של ציטוקינים פרו דלקתיים (למשל, IFN-γ ו-TNF-α) ירד. הפעלה ממוקדת של תאים iNKT היה מסוגל להקל על ההתקדמות של RA ולעכב את התגובה הדלקתית. בנוסף, גילינו את התדירות של iNKT ב בלוטת התימוס ומצא כי מספר תאי iNKT בקבוצה מודל RA הופחת באופן משמעותי, בעוד התדר של התימוס גדל לאחר העירוי של תאים iNKT. בשל נוכחותם של מערכת המחסום בדם-בלוטת התימוס, לא היינו מחשיבים את העלייה המצמנת ברמה של iNKT ב בלוטת התימוס אשר אושרה בניסויים מאוחרים יותר. זיהוי נוסף של אוכלוסיות התת של תאים iNKT בתימוס חשף כי, בהשוואה לקבוצת השליטה בריאה, מספר התאים iNKT1 בקבוצה מודל RA גדל באופן משמעותי במהלך שלושת השלבים של דלקת מקסימאלית במהלך השיא של דלקת, בעוד שיעור של הקבוצה iNKT2 החלה להגדיל בשיא של דלקת. בעיקר, המשנה iNKT1 עשוי להיות מעורב בדלקת מוקדם של RA, ואת המשנה iNKT2 עשוי לשחק תפקיד חשוב בעיכוב דלקת. בהשוואה לקבוצת המודל RA, iNKT1 המשנה בקבוצת הטיפול בתאים ירד באופן משמעותי במהלך השלב הדלקתי, ומערכת המשנה iNKT2 גדלה באופן משמעותי בשלב המוקדם וההפוגה של דלקת. תוצאות אלה הראו כי העירוי המאמצת של פנוטיפים ספציפיים ותאי iNKT פונקציונליים הגדילו באופן משמעותי את התדירות של תאים iNKT ב RA ושינו את החלק של תת-ערכות של תא iNKT.
השתמשנו IVIS להתבונן התפלגות של תאים iNKT בעכברים לאחר העירוי המאמצת ומצא את עוצמת הקרינה הגבוהה ביותר בריאות 10 דקות לאחר העירוי, אשר נמוג בהדרגה. הכבד הראה זריחה חלשה, אשר הוגדלה בהדרגה וירד בהדרגה לאחר 2 ימים. הקרינה הפלואורסצנטית זוהה בטחול ב 30 דקות, אשר גדל בהדרגה וירד לאחר יומיים. עוצמת הקרינה הפלואורסצנטית הממוצעת. של הכבד הייתה חזקה יותר מזו של הטחול עם זאת, הקרינה הפלואורסצנטית לא זוהה בבלוטת התימוס ואת הלימפה. גילוי של קרינה פלואורסצנטית בריאות עשוי להיות מיוחס העירוי של תאים iNKT לתוך העורק הזנב. התאים האלה מופץ. לריאות עם הדם הכבד זוהר מוקדם יותר הטחול, ואת עוצמת הזריחה הממוצעת של הכבד הוא חזק יותר מזו של הטחול. זו הצטברות מועדף של תאים iNKT עשוי להיות בשל כלי הדם השופעים בכבד, איבר מטבולית הראשי. הקרינה הפלואורסצנטית לא זוהה ב בלוטת התימוס. זה יכול להיות בגלל המכשול המטולוגי, אשר יכול לעכב את הכניסה של תאים iNKT. הקרינה הפלואורסצנטית מעולם לא זוהה בבלוטות הלימפה, אולי משום שתאי iNKT פחות נכנסו לבלוטות הלימפה ולא להגיע לרמה המינימלית של זיהוי. כמו כן, זה יכול להיות העריך כי תאים iNKT הכניסו את הווריד הזנב עלול לא להיכנס לבלוטות הלימפה. לכן, אנחנו ההשערה כי הפיתוח והבידול של תאים iNKT בתימוס עשוי להיות מוסדר באמצעות מסלולים cy, לאחר אינפוזיה המאמצת לתוך העכברים. צריך להבהיר את זה יותר.
Gpi קיים סרום ונוזל אמתחת של רוב חולי RA והוא מבחן נפוץ לאבחון RA קליני27. ברונס ואח '28 פפטידים משומשים של אורכים שונים מן הרצף gpi והחיסון של העכברים DBA/1 כדי לזהות שישה אפיאומיניאנט תא T החיסונית. . שלושה מהם היו דלקת פרקים הפפטידים עם > 95% שכיחות של דלקת מפרקים הם ה325-339 ו hGPI469-483. המחקרים הקודמים שלנו הוכיחו כי השימוש בתערובת של שני הפפטידים כדי להקים מודל RA הוא טוב יותר מאשר פפטיד אחד. בדגמי ה-RA הנובעים מכך, הבהונות והמפרקים של העכברים החלו להופיע ביום השישי והגיעו לשיא דלקת ביום 14. הסתננות תא דלקתי היה מלווה היפרפלזיה רקמות ברקמת אמתחת של המפרקים, ואת הסתננות התא דלקתי היה חמור ביותר ביום 14. מספר תאים iNKT הופחת באופן משמעותי בבלוטת התימוס בשיא הדלקת, אשר היה עקבי עם המגמה של תאים iNKT בחולים RA29. זיהוי נוסף של ערכות משנה של תאים של iNKT חשף כי תדירות של iNKT1 ו iNKT17 בתימוס גדל ואת תדירות iNKT2 ירד במהלך ההתקדמות של דלקת (יום 11). בנוסף, רמות של סרום ציטוקינים IFN-γ ו-IL-17A גדל במהלך ההתקדמות (יום 11) ואת השיא של דלקת (יום 14), מציע פולריזציה דומה של Th1 ו Th17 קבוצות מודל RA עכברים30. לכן, מודל העכבר RA הנגרמת על ידי hGPI325-339 ו-hGPI469-483 שברי פוליפפטיד מעורבים הציגו את המאפיינים של CD4+ תא T היפרפצת ופגמים תא inkt, אשר היה דומה לזה של חולי ra, ויכול לשמש כמודל בעל חיים אידיאלי לחקירת החסינות של תאי ra. תוצאות אלה היו בהסכמה עם אלה מן המחקרים הקודמים שלנו והפגינו את היציבות של ה-RA מודל31.
באופן כללי, מודל העכבר RA הנגרמת על ידי פפטידים G6PI מעורב יכול לדמות את השינויים CD4+ T תאים, תאים inkt, ציטוקינים הקשורים בחולים RA. זה מספק מודל טוב לחקירה מעמיקה של RA. ברציפות, iNKT (בעיקר iNKT2) הנגרמת על ידי הזרקה התוך הצפק של α-GalCer ומטוהרים בתוך מבחנה שימש לטיפול RA. זה יכול לתקן את חוסר האיזון החיסוני שנגרם על ידי התפשטות חריגה של ערכות המשנה של Th, להקל על ההתקדמות של RA, ובעתיד יכול לספק שיטות הרומן של RA.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
המחברים לא מצהירים על שום מימון או קונפליקטים של עניין.
Acknowledgments
המחקר שלנו היה נתמך על ידי הקרן הלאומית למדעי הטבע של סין (NSFC) (81771755), מכללות והמדע של האוניברסיטה וטכנולוגיה מפתח מחקר הפרויקט של מחוז חביי (ZD2017009) ואת המעבדה לבעלי חיים של ניסוי רפואי מרכז, אוניברסיטת חביי. . אנו אסירי תודה על תמיכתם
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 647 Mouse Anti-PLZF | BD | 563490 | America |
| Anti-PE MicroBeads | Miltenyi | 130-048-801 | Germany |
| Columns | Miltenyi | MS | Germany |
| Cryogenic Centrifuge | Beckman | Allegra® X-15R | America |
| DiR | Thermo Fisher Scientific | D12731 | America |
| Embedding Center | Tianjin Aviation Electromechanical Co., Ltd. | BMJ-1 | China |
| FITC Hamster Anti-Mouse TCR β Chain | BD | 553170 | America |
| Flow cytometer | BD | Accuri C6 | America |
| Freund's complete adjuvant | Sigma | F5881 | America |
| hGPI325-339 (IWYINCFGCETHAML) | Karebay Biochem | 18062202 | China |
| hGPI469-483 (EGNRPTNSIVFTKLT) | Karebay Biochem | 18062203 | China |
| In Vivo Imaging System | PerkinElmer | caliper IVIS lumina II | America |
| Ionomycin Calcium | Cayman | 10004974 | America |
| KRN7000 | AdipoGen | AG-CN2-0013 | America |
| Mouse CD1d Tetramer-PE | MBL | TS-MCD-1 | Japan |
| Mouse percoll | Solarbio | P8620 | China |
| Optical Microscope | Olympus | Olympus-II | Japan |
| PerCP-CyTM5.5 Mouse anti-ROR-ϒt | BD | 562683 | America |
| PerCP-CyTM5.5 Mouse anti-T-bet | BD | 561316 | America |
| Pertussis toxin | Sigma | P7208 | America |
| phorbol esters | Cayman | 10008014 | America |
| Red Blood Cell Lysis Buffer | BD | 555899 | America |
| RPMI-1640 | Biological Industries | 01-100-1ACS | Israel |
| Th1/Th2/Th17 cytokines kit | BD | 560485 | America |
| Ultramicrotome | Leica | Leica EM UC6 | Germany |
References
- Tobón, G. J., Youinou, P., Saraux, A. The environment, geo-epidemiology, and autoimmune disease: Rheumatoid arthritis. Autoimmunity Reviews. 35 (1), 0-14 (2010).
- Cross, M., et al. The global burden of rheumatoid arthritis: estimates from the Global Burden of Disease 2010 study. Annals of the Rheumatic Diseases. 73 (7), 1316-1322 (2014).
- Kanashiro, A., Bassi, G. S., Queiróz Cunha, F. D., Ulloa, L. From neuroimunomodulation to bioelectronic treatment of rheumatoid arthritis. Bioelectronics in Medicine. 1 (2), 151-165 (2018).
- Brennan, P. J., Brigl, M., Brenner, M. B. Invariant natural killer T cells: an innate activation scheme linked to diverse effector functions. Nature Reviews Immunology. 13 (2), 101-117 (2013).
- Bianca, B. S. Unraveling Natural Killer T-Cells Development. Frontiers in Immunology. 8, 1950 (2018).
- Mitsuo, A., et al. Decreased CD161+CD8+ T cells in the peripheral blood of patients suffering from rheumatic diseases. Rheumatology. 45 (12), 1477-1484 (2006).
- Miellot, A., et al. Activation of invariant NK T cells protects against experimental rheumatoid arthritis by an IL-10-dependent pathway. European Journal of Immunology. 35 (12), 3704-3713 (2005).
- Miellot-Gafsou, A., et al. Early activation of invariant natural killer T cells in a rheumatoid arthritis model and application to disease treatment. Immunology. 130 (2), 296-306 (2010).
- Tudhope, S. J., Delwig, A. V., Falconer, J., Pratt, A., Ng, W. F. Profound invariant natural killer t-cell deficiency in inflammatory arthritis. Annals of the Rheumatic Diseases. 69 (10), 1873-1879 (2010).
- Ming, M., et al. Effects on immunoregulation of iNKT cells in RA by novel synthetic immunostimulator CH1b. Chinese Journal of Immunology. 32 (02), 218-222 (2016).
- Ming, M., et al. Study of the correlation between the percentage of iNKT cells and the ratio of IFN-γ/IL-4 in patients with rheumatoid arthritis. Chinese Journal of Microbiology Immunology. 35 (3), 213-218 (2015).
- Sharif, S., et al. Activation of natural killer T cells by α-galactosylceramide treatment prevents the onset and recurrence of autoimmune Type 1 diabetes. Nature Medicine. 7, 1057-1062 (2010).
- Gapin, L. Development of invariant natural killer T cells. Current Opinion in Immunology. 39, 68-74 (2016).
- Kwon, D. I., Lee, Y. J. Lineage Differentiation Program of Invariant Natural Killer T Cells. Immune Network. 17 (6), (2017).
- Thapa, P., et al. The differentiation of ROR-γt expressing iNKT17 cells is orchestrated by Runx1. Scientific Reports. 7 (1), 7018 (2017).
- Schurgers, E., Billiau, A., Matthys, P. Collagen-induced arthritis as an animal model for rheumatoid arthritis: focuson interferon-γ. Interferon Cytokine Research. 31 (12), 917-926 (2011).
- Van Haalen, H. G. M., Severens, J. L., Tran-Duy, A., Boonen, A. How cost-effectiveness A systematic review and stepwise approach for selecting a transferable health economic evaluation rheumatoid arthritis. Pharmacoeconomics. 32 (5), 429-442 (2014).
- Schubert, D., Maier, B., Morawietz, L., Krenn, V., Kamradt, T. Immunization with glucose-6-phosphate isomerase induces T cell-dependent peripheral polyarthritis in genetically unaltered mice. Journal of Immunology. 172, 4503-4509 (2004).
- Bockermann, R., Schubert, D., Kamradt, T., Holmdahl, R. Induction of a B-cell-dependent chronic arthritis with glucose-6-phosphate isomerase. Arthritis Research, Therapy. 7, 131613-131624 (2005).
- Kamradt, T., Schubert, D. The role and clinical implications of G6PI in experimental models of rheumatoid arthritis. Arthritis Research, Therapy. 7, 20-28 (2005).
- Horikoshi, M., et al. Activation of Invariant NKT Cells with Glycolipid Ligand α-Galactosylceramide Ameliorates Glucose-6-Phosphate Isomerase Peptide-Induced Arthritis. PlosOne. 7 (12), 51215 (2012).
- Zhang, X. J., et al. Immunization with mixed peptides derived from glucose-6-phosphate isomerase induces rheumatoid arthritis in DBA /1 mice. Chinese Journal of Pathophysiology. 32 (3), 569-576 (2016).
- Motohashi, S., Nakayama, T. Invariant natural killer T cell-based immunotherapy for cancer. Immunotherapy. 1 (1), 73 (2017).
- Jung, S., et al. The requirement of natural killer T-cells in tolerogenic APCs-mediated suppression of collagen-induced arthritis. Experimental and Molecular Medicine. 42 (8), 547-554 (2010).
- Luc, V. K., Lan, W. Therapeutic Potential of Invariant Natural Killer T Cells in Autoimmunity. Frontiers in Immunology. 9, 519-526 (2018).
- Chiba, A., et al. Suppression of collagen-induced arthritis by natural killer T cell activation with OCH, a sphingosine-truncated analog of α-galactosylceramide. Arthritis, Rheumatism. 50 (1), 305-313 (2004).
- Tudhope, S. J., Delwig, A. V., Falconer, J., Pratt, A., Ng, W. F. Profound invariant natural killer t-cell deficiency in inflammatory arthritis. Annals of the Rheumatic Diseases. 69 (10), 1873-1879 (2010).
- Bruns, L., et al. Immunization with an immunodominant self-peptide derived from glucose-6-phosphate isomerase induces arthritis in DBA/1 mice. Arthritis Research, Therapy. 11 (4), (2009).
- Parietti, V., et al. Rituximab treatment overcomes reduction of regulatory iNKT cells in patients with rheumatoid arthritis. Clinical Immunology. 134 (3), 331-339 (2010).
- Yoshida, Y., et al. Functional mechanism(s) of the inhibition of disease progression by combination treatment with fingolimod plus pathogenic antigen in a glucose-6-phosphate isomerase peptide-induced arthritis mouse model. Biological, Pharmaceutical Bulletin. 38 (8), 1120-1125 (2015).
- Chen, D., et al. Study of the adoptive immunotherapy on rheumatoid arthritis with Thymus-derived invariant natural killer T cells. International Immunopharmacology. 67, 427-440 (2019).



