Summary
يستخدم هذا البروتوكول الببتيدات المختلطة G6PI لبناء نماذج التهاب المفاصل الروماتويدي التي هي أقرب إلى أن من التهاب المفاصل الروماتويدي الإنسان في CD4+ الخلايا التائية وسيتوكينات. تم الحصول على الخلايا التائية القاتلة الطبيعية عالية النقاء (iNKT2 بشكل رئيسي) مع أنماط ظاهرية ووظائف محددة عن طريق الاستقراء في الجسم الحي والتنقية المختبرية للعلاج المناعي بالتبني.
Abstract
التهاب المفاصل الروماتويدي (RA) هو مرض المناعة الذاتية الالتهابي المزمن المعقد. يرتبط الإمراض للمرض بخلايا T (iNKT) القاتلة الطبيعية الثابتة. المرضى الذين يعانون من RA النشطة تقديم عدد أقل من الخلايا iNKT, وظيفة الخلية المعيبة, والاستقطاب المفرط من Th1. في هذه الدراسة، تم إنشاء نموذج الحيوانات RA باستخدام خليط من hGPI325-339 وhGPI469-483 الببتيدات. تم الحصول على خلايا iNKT عن طريق الاستقراء في الجسم الحي وتنقية المختبر، تليها ضخ في الفئران RA للعلاج المناعي بالتبني. كشف نظام التصوير في الجسم الحي (IVIS) تتبع أن خلايا iNKT كانت موزعة بشكل رئيسي في الطحال والكبد. في اليوم 12 بعد العلاج بالخلايا ، تباطأ تطور المرض بشكل كبير ، وتم تخفيف الأعراض السريرية ، وزيادة وفرة خلايا iNKT في الغدة الصعترية ، وانخفضت نسبة iNKT1 في الغدة الصعترية ، وانخفضت مستويات TNF-α ، IFN-α ، وIL-6 في انخفض المصل. العلاج المناعي بالتبني من خلايا iNKT استعادة توازن الخلايا المناعية وتصحيح الالتهاب المفرط في الجسم.
Introduction
التهاب المفاصل الروماتويدي (RA) هو مرض المناعة الذاتية التي تتميز المزمنة، الغازية التدريجيمع 0.5-1% الإصابة1،2. ويعزى الإمراض الكامنة إلى الانتشار غير الطبيعي للخلايا CD4+ و CD8+ T ، التي تتجلى في زيادة في نسبة CD4+IFN- ο + وCD4+IL - 17A+ الخلايا التائية ، وانخفاض عدد CD4+IL - 4+ وCD4+CD25+FoxP3+ الخلايا التائية. لذلك ، يتم زيادة إفراز السيتوكينات الالتهابية ، ويدمر التفاعل الالتهابي المفرط التوازن الأصلي ووظيفة التسامح في الجهاز المناعي في الجسم. وعلاوة على ذلك، فإن الخلايا اللمفاوية T المساعد (Th) 1 الخلايا التي تخترق المفصل تفاقم الاستجابة الالتهابية وتلف المفاصل. لذلك ، فإن تثبيط الاستجابة الالتهابية المفرطة واستعادة التسامح المناعي والتوازن المناعي هي المفتاح لعلاج RA3،4.
تحتوي خلايا iNKT على كل من وظائف وخصائص الخلية NK وT. خلايا iNKT تأوي مستقبلات خلايا T (TCR) مميزة وثابتة (TCR) α-chain مع TCR α-chain محدود 5وتتعرف على مستضد الجليكوبيد الذي تقدمه الفئة الرئيسية من المعقدة الهيستونتيفية (MHC) I جزيء CD1d على سطح الخلايا التي تقدم المستضد. اكتشف ميتسو وآخرون6 عددًا كبيرًا من خلايا iNKT وعيوبوظيفية في العديد من أمراض المناعة الذاتية، بما في ذلك RA. Aurore وآخرون7 أظهرت أن خلايا iNKT لها تأثير إيجابي على الحفاظ على التسامح المناعة الذاتية وأنه عندما يتم استعادة عدد ووظيفة الخلايا iNKT، يتم تخفيف المرض. وبالإضافة إلى ذلك، وجد ميللوت - غاسو وآخرون8 أن خلايا iNKT لم تقم بإلغاء المرض فحسب، بل زادت أيضا ً من تطور المرض. تشير هذه النتائج المتناقضة إلى أن خلايا iNKT هي خلايا T غير متجانسة ، ويمكن عكس وظيفة المجموعات الفرعية المختلفة. في دراسة سريرية لجمهورية راك، تواتر خلايا iNKT ترتبط مع درجة نشاط المرض9. وأكدت النتائج أيضا أن تواتر iNKT انخفض في مرضى RA، وعدد CD4+IFN-ο+ مجموعات الخلايا T زاد، ومستويات إفراز السيتوكينات الالتهابية IFN-α وTNF-α زيادة10،11. بالإضافة إلى ذلك ، حقق شريف وآخرون12 في مرض السكري من النوع 1 (T1D) ووجدوا أن التسريب الانتقائي لخلايا iNKT أدى إلى زيادة تنظيم التعبير عن السيتوكين الالتهابي IL-4 ، وحافظ على التسامح المناعي ، ومنع تطور مرض السكري من النوع 1. ولذلك، ضخ بالتبني من خلايا iNKT محددة أو التنشيط المستهدف للخلايا iNKT يزيد من مستوى خلايا iNKT في مرضى RA، والتي يمكن أن تكون اختراقا في العلاج RA.
العلاج المناعي الخلوي حاليا من اهتمام كبير، وقد استخدمت على نطاق واسع في علاج السرطان. ومع ذلك، فإن خلايا iNKT هي خلايا نادرة وغير متجانسة للمناعة (فقط 0.3٪ من العدد الإجمالي لمركبات ثنائي الفينيل متعدد البروم)13، مما يحد من التطبيقات السريرية المحتملة. وتنقسم هذه الخلايا أساسا إلى ثلاث مجموعات فرعية: 1) خلايا iNKT1، التي لديها تعبير عال من بروتين البلعوم الببروني بالإصبع الزنك (PLZF) وعامل النسخ T-box (T-bet)؛ 2) خلايا iNKT2 مع التعبير المتوسط من PLZF وجاتا البروتين ملزمة 3 (GATA3)؛ 3) iNKT17 الخلايا مع انخفاض التعبير عن PLZF والرتينويد ذات الصلة مستقبلات نووية يتيمة (ROR) - αt التي تفرز IFN-ο، IL-4، وIL-1714. خلايا iNKT المنشطة تفرز Th1 و Th2 و Th17 مثل السيتوكينات ، والتي تحدد الآثار المناعية المختلفة لخلايا iNKT15. تختلف الآثار المناعية والعلاجالمناعي للتنشيط المحدد لمختلف الفئات السكانية الفرعية لخلايا iNKT. لذلك ، فإن اختيار الأنماط الظاهرية المحددة لخلايا iNKT (بشكل رئيسي iNKT2) مع وظائف مضادة للالتهابات لتنظيم الاستجابة المناعية للجسم يمكن أن يصحح عدم التوازن المناعي والاضطرابات المناعية في RA.
إنشاء نموذج مثالي للحيوانات ذات أهمية كبيرة لعلاج ودراسة الإمراض RA. في الوقت الحاضر ، تشمل النماذج الحيوانية الأكثر استخدامًا ونضجًا التهاب المفاصل الناجم عن الكولاجين ، والتهاب المفاصل المعقّد ، والتهاب المفاصل الناجم عن الزيموسان ، والتهاب المفاصل الناجم عن البوليسكاريد16-17. ومع ذلك ، لا يوجد نموذج يمكن أن يحاكي بشكل كامل جميع ميزات RA الإنسان. النوع الثاني من التهاب المفاصل الناجم عن الكولاجين (CIA) هو نموذج التهاب المفاصل الكلاسيكي. وكالة المخابرات المركزية هو الناجم عن تحصين الفئران مع النوع الثاني الكولاجين محددة الأجسام المضادة أحادية النسيلة، مما يعكس الاعتماد على الأجسام المضادة لهذا النموذج المرض. وصف Benurs وآخرون نموذجًا مع استجابة مناعية جهازية لـ glucose-6-phosphate isomerase (G6PI) ، والذي يحفز التهاب المفاصل المتماثل المحيطي في سلالات الماوس الحساسة18،19. في هذا النموذج ، يعتمد تطور التهاب المفاصل على الخلايا التائية والخلايا B والمناعة الفطرية18و19و20. وجد Horikoshi21 أن نماذج RA الناتجة عن تحصين فئران DBA/1 بشظايا البولي ببتيد G6PI هي أكثر تشابهًا مع RA البشري من حيث خلايا CD4+ T والسيتوكينات (أي IL-6 و TNF-α) من نماذج وكالة الاستخبارات المركزية. من أجل زيادة التأثير المحفز على موقع التعرف على TCR ، تم استخدام شظايا البولي ببتيد المختلطة من G6PI (hGPI325-339 و hGPI469-483) لتحصين فئران DBA/1 لبناء نموذج الماوس RA. يمكن أن يكون معدل نجاح هذا النهج مرتفعًا لأن hGPI325-339 و hGPI469-483 هما مناعيان مهيمنان لاستجابات الخلايا التُوتية المقيدة I-A. لذلك ، يمكن لهذا النموذج محاكاة الانتشار المفرط لخلايا CD4+ T وعيوب خلايا iNKT في مرضى RA22. وضعت الأبحاث الأساسية لعلم الأمراض المناعية RA الأساس لمزيد من التحقيق المتعمق.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
كانت جميع الفئران التجريبية (150 في المجموع) من الذكور الأصحاء DBA/1 الفئران، 6-8 أسابيع من العمر (20.0 ± 1.5 غرام)، تربى في بيئة محددة خالية من مسببات الأمراض (SPF). لا توجد معاملة خاصة قبل النمذجة. تم تقسيم التجربة إلى مجموعة تحكم صحية (15 فأرًا) ومجموعة تحكم نموذجية (15 فأرًا) ومجموعة علاج بالخلايا (55 فأرًا). تمت الموافقة على هذه الدراسة من قبل لجنة رعاية الحيوان والأخلاق في جامعة خبى.
1- بناء نموذج المرض
- تكرار نموذج الحيوانات RA
- تزن 1.75 ملغ من كل من hG6PI 325-339 وhG6PI 469-483 شظايا وتذوب لهم في 5.25 مل من 4 درجة مئوية الماء المقطر الثلاثي.
- حل الكامل Fdjuvant Freund (CFA) في حمام مائي 50 درجة مئوية، ورسم 5.25 مل في آخر 10 مل أنبوب الطرد المركزي، وتبريده للاستخدام.
- وضع خليط من حل hG6PI وحل CFA في وحدة مستحلب اصطناعية مع اثنين من محاقن الزجاج متصلة.
- ادفع الحقنة بسرعة ووتيرة ثابتة من 10-20 x في دقيقة واحدة لاستحلاب محلول الببتيد المختلط وحل CFA تمامًا. قم بإجراء العملية في حمام جليدي ، والحفاظ على قطرات المستحلب في الماء لمدة 10 دقيقة بعد الانتهاء من الاستحلاب دون تشتيت.
- حقن 150 ميكرولتر من hG6PIs مستحلب في جذر ذيل الماوس تحت الجلد.
- حقن 200 ملغ من السم Pertussis في داخل بيت التسوى في 0 ساعة و 48 ساعة بعد حقن hG6PI.
- التحقق التجريبي من نموذج RA
- قياس سمك مخلب الماوس مع الفرجار فيرنييه (2x في اليوم).
- مراقبة وتمييز درجة احمرار وتورم القدم. استخدام معايير التهديف التالية: 1) أُبُل القدم ينتبّأ عليها تورم خفيف؛ 2) pedis دورسوم ووسادة القدم مع تورم أحمر واضح؛ 3) الكاحل مع تورم أحمر.
- القتل الرحيم الفئران تحت التخدير العميق عن طريق الحقن داخل البرابيتون من 1٪ بنتوباربيتال الصوديوم (50 ملغ / كغ وزن الجسم) 14 يوما بعد النمذجة وإزالة الكفوف لتلطيخ HE.
- تحديد مستويات إفراز المصل IL-2، IL-4، IL-6، IL-10، IL-17A، TNF-α، وIFN-α باستخدام مجموعة من الخلايا التجارية (CBA) تحليل وفقا لبروتوكول الشركة المصنعة.
2. الحصول على خلايا iNKT مع العلاج الخلوي بالتبني
- الحث الاتجاهي لخلايا iNKT
- حقن الفئران العادية داخل النُقَل مع α-GalCer (0.1 ملغم/كغ من وزن الجسم).
- عزل خلايا iNKT
- بعد ثلاثة أيام من النمذجة، حقن الفئران داخل بيت سليطانلي مع 1٪ بنتوباربيتال الصوديوم (50 ملغ /كجم من وزن الجسم) للحُسان. الفئران المنهوبة بشكل كاف لا تظهر استجابة انسحاب مخلب هند لقرصة إصبع القدم.
- عزل الطحال من الماوس DBA/1 بعد حقنه داخل الانضد مع α-GalCer. إعداد تعليق خلية واحدة عن طريق قطع وطحن الطحال في منخل شبكة 200.
- غسل تعليق الخلية مع برنامج تلفزيوني، والطرد المركزي في 200 × ز لمدة 5 دقيقة، وتجاهل supernatant. كرر.
- إعادة تعليق الخلايا مع 1 مل من محلول تخفيف الدم والأنسجة الكاملة. إضافة 3 مل من الماوس وسط فصل اللمفاوية، ومن ثم طرد مركزي الخلايا لمدة 20 دقيقة في 300 × ز في درجة حرارة الغرفة.
- جمع طبقة من الخلايا الليمفاوية البيضاء حليبي (أي، الطبقة الثانية من أعلى)، وغسلها 2x مع برنامج تلفزيوني، والعد مع عداد الخلية الآلي.
- المغناطيسي فرز الخلايا المنشط (MACS) استراتيجية اختيار إيجابية لتنقية خلايا iNKT
ملاحظة: بالنسبة للمعالجة المسبقة لرباعيات CD1d، تم تخفيف 1 ملغم/مل من α-Galcer إلى 200 ميكروغرام/مل مع 0.5٪ من Tween-20 و 0.9٪ من NaCl، وأضيف 5 μL من المحلول الناتج إلى 100 ميكرولتر من محلول رباعي الترايمر CD1d. تم احتضان الخليط لمدة 12 ساعة في درجة حرارة الغرفة ووضعها في 4 درجة مئوية للاستخدام. تم تخفيف TCR α 80x مع الماء المنزوع الأيونات. تم استخدام جميع الأجسام المضادة الأخرى كحل للمخزون.- إعادة تعليق 107 خلايا مع 100 ميكرولتر من 4 درجة مئوية PBS، إضافة 10 ميكرولتر من α-GalCer تحميل CD1d Tetramer-PE، واحتضانها في 4 درجة مئوية لمدة 15 دقيقة في الظلام.
- غسل الخلايا 2x مع برنامج تلفزيوني وإعادة تعليقها في 80 ميكرولتر من برنامج تلفزيوني.
- أضف 20 ميكرولتر من الميكروبات المضادة للPE واحتضانها عند 4 درجات مئوية لمدة 20 دقيقة في الظلام.
- غسلها 2x مع برنامج تلفزيوني وإعادة تعليق الخلايا مع 500 ميكرولتر من برنامج تلفزيوني.
- ضع عمود الفرز في المجال المغناطيسي لماكينة فرز MACS وشطفه بـ 500 ميكرولتر من برنامج تلفزيوني.
- إضافة تعليق الخلية من الخطوة 2.3.4 إلى عمود الفرز، وجمع flowthrough، وشطف 3x مع المخزن المؤقت PBS.
- قم بإزالة المجال المغناطيسي واجمع الخلايا من عمود الفرز. عند هذه النقطة، إضافة 1 مل من PBS المخزن المؤقت إلى عمود الفرز، ودفع بسرعة المكبس في ضغط مستمر لدفع الخلايا المسماة إلى أنبوب جمع والحصول على خلايا iNKT تنقية. العد مع عداد الخلية الآلي.
- تعريف النمط الظاهري لخلية iNKT
- اتخاذ 1 × 106 خلايا من الخطوات 2.2.5 و 2.3.7 ، على التوالي ، وإعادة تعليقها في 50 ميكرولتر من برنامج تلفزيوني.
- حضانة الأجسام المضادة: لا تضيف الجسم المضاد إلى أنبوب التحكم السلبي، أضف 0.5 ميكرولتر من α-GalCer-PE-CD1d Tetramer أو 10 ميكرولتر من FITC-TCR α في أنبوب التحكم الإيجابي الوحيد. أضف 0.5 ميكرولتر من رباعي ة α-GalCer-PE-CD1d و10 ميكرولتر من FITC-TCR α في أنبوب العينة. احتضان لهم في 4 درجة مئوية لمدة 30 دقيقة في الظلام.
- غسل الخلايا في برنامج تلفزيوني ومن ثم الطرد المركزي في 200 × ز لمدة 5 دقيقة.
- تجاهل supernatant، إضافة 1 مل من Foxp3 Foxp3 Foxp/Permeabilization حل العمل، واحتضان الخلايا لمدة 45 دقيقة في 4 درجة مئوية في الظلام.
- إضافة 1 مل من 1x Permeabilization حل العمل المخزن المؤقت والطرد المركزي الخلايا في درجة حرارة الغرفة لمدة 500 × ز في درجة حرارة الغرفة لمدة 5 دقيقة.
- تجاهل السوبرناستانت. أضف 1 ميكرولتر من أليكسا فلور 647 فأر مضاد لـ PLZF و 1 ميكرولتر من PerCP-Cy 5.5 الماوس المضاد ة T-bet (أو 1 ميكرولتر من PerCP-Cy 5.5 الماوس المضاد ة RORАt) لمدة 30 دقيقة في درجة حرارة الغرفة في الظلام.
- إضافة إلى 2 مل من Permeabilization حل العمل المخزن المؤقت للتنظيف.
- تجاهل supernatant، resuspend الخلايا في 500 ميكرولتر من PBS، وقياس عن طريق تدفق القياس الخلوي.
- التعرف الوظيفي لخلايا iNKT
- خذ 3 × 106 خلايا iNKT من الخطوة 2.3.7 وإعادة تعليقها في 12 لوحة بئر مع 1.5 مل من RPMI-1640 متوسطة غير مكتملة (أي بدون مصل).
- إضافة phorbol استر (PMA, 50 نانوغرام/مل) والكالسيوم الأيونومين (IO, 1 ميكروغرام/مل) ووضعها في حاضنة CO2 لمدة 24 ساعة.
- جمع supernatant الخلية والكشف عن مستويات إفراز IL-2، IL-17A، TNF-α، IL-6، IL-4، IFN-ο، وIL-10 باستخدام إجراء CBA التجارية وفقا لبروتوكول الشركة المصنعة.
- دراسة تجريبية حول مسار هجرة خلايا iNKT في فئران RA
- حل صبغة DiR (2.5 ملغم/مل) في DMSO.
- Resuspend خلايا iNKT في 6 لوحات جيدا مع RPMI-1640 متوسطة غير مكتملة. الكثافة هي 1 × 106 خلايا / مل.
- إضافة DiR (5 ميكروغرام / مل) الحل واحتضان في حاضنة CO2 لمدة 25 دقيقة.
- غسل مع PBS وإعادة تعليق الخلايا (3 × 106/ 300 μL) للحصول على DiR المسمى خلايا iNKT (DiR-iNKT).
- حقن 1٪ بنتوباربيتال الصوديوم (50 ملغ / كغ وزن الجسم) داخل البابينتين لحقن الفئران. الفئران المنهوبة بشكل كاف لا تظهر انسحاب مخلب هند لقرصة إصبع القدم. تطبيق مرهم البيطرية على عيون الماوس لمنع جفاف بينما تحت التخدير للتصوير.
- حقن خلايا DiR-iNKT 3 × 106 لكل فأرة في الوريد الذيل مع نموذج RA لمدة 8 أيام. مراقبة خلايا iNKT في الفئران بعد الحقن لمدة 0 دقيقة و 10 دقيقة و 30 دقيقة و 60 دقيقة ويوم 0 (بعد 3 ح) و 1 و 3 و 6 و 12 و 26 و 34 و 38 و 42 يومًا باستخدام الحيوان الصغير في نظام التصوير الحي (IVIS). وكان الطول الموجي للإثارة المستخدم748 نانومتر، وكان الطول الموجي للانبعاثات 780 نانومتر، وكان وقت التعرض تلقائيًا.
- وضع كل ماوس في قفص منفصل بعد كل ملاحظة والحفاظ على recumbency القص. لاحظ حتى الشفاء من التخدير.
3. تقييم العلاج المناعي بالتبني من الفئران RA مع خلايا iNKT
- iNKT خلية العلاج المناعي بالتبني للفئران RA
- حقن 3 × 10خلايا خلايا iNKT لكل فأرة من خلال الوريد الذيل. حدد عشوائيا 15 الفئران التي تم على غرار 8 أيام قبل والحصول على خلايا iNKT دون وضع العلامات DiR من الخطوة 2.3.7 عن طريق ضخ الوريد الذيل.
- تقييم فعالية العلاج المناعي بالتبني لخلايا iNKT.
- قياس سمك مخلب الماوس، وتحديد حجم تورم مفصل الكاحل، ويسجل بشكل منهجي بعد ضخ خلايا iNKT كما هو موضح في الخطوات 1.2.1-1.2.2.
- مراقبة تسلل الخلايا الالتهابية والتغيرات المشتركة للمفاصل الماوس كما هو موضح في الخطوة 1.2.3.
- تحديد مستويات إفراز IL-2، IL-4، IL-6، IL-10، IL-17A، TNF-α، وIFN-α كما هو موضح في الخطوة 1.2.4.
- تحديد تكرار الخلايا والمجموعات الفرعية iNKT.
- عزل الغدة الصعترية الماوس وإعداد تعليق خلية واحدة.
- فصل الخلايا اللمفاوية مع سائل فصل الخلايا الليمفاوية.
- تحديد تردد الخلية iNKT وتردد المجموعة الفرعية كما هو موضح في الخطوة 2.4.
- التحليل الإحصائي
ملاحظة: يتم تقديم جميع البيانات على أنها متوسط ± SD. تم اعتبار قيم P < 0.05 ذات دلالة إحصائية.- استخدم تحليل عامل واحد للتباين (ANOVA). إذا كان التباين مستوفياً، استخدم اختبار LSD لمزيد من المقارنة.
- إذا لم يكن التباين موحدًا، فاستخدم الاختبار غير البارامتري. استخدام اختبار Kruskal-Wallis H لمزيد من المقارنة31.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
درجة مؤشر التهاب المفاصل وسمك مخلب زاد بعد النمذجة. بالمقارنة مع مجموعة التحكم ، بدأت أقدام مجموعة نموذج RA تظهر تورمًا أحمر في 6 أيام بعد النمذجة ، مع تفاقم تدريجي. في 14 يوما، بلغ التورم الأحمر في مفصل الكاحل ذروته، يليه تخفيف تدريجي. سمك مخلب تغيرت بالمثل(P < 0.05)(الشكل 1).
زاد تسلل الخلايا الالتهابية بشكل كبير بعد النمذجة. أظهرت النتائج المرضية أن درجة تسلل الخلايا الالتهابية في الأنسجة الزليلية في الكاحل للفئران نموذج RA كانت مختلفة في مراحل مختلفة. ذروة التهاب حدث في اليوم 14 آخر النمذجة(الشكل 2).
زادت السيتوكينات الالتهابية وانخفضت السيتوكينات المضادة للالتهابات في المصل. في المجموعة النموذجية RA ، زادت مستويات المصل من السيتوكينات المؤيدة للالتهابات (TNF-α ، IFN-α ، و IL-6) بشكل كبير(P < 0.05) ، في حين انخفضت السيتوكينات المضادة للالتهابات (IL-4 و IL-10) بشكل ملحوظ(P < 0.05)(الشكل 3).
الخلايا iNKT التي تم الحصول عليها من قبل في تحريض الجسم الحي وتنقية المختبر تتكون أساسا من مجموعات فرعية خلية iNKT2، والتي تفرز السيتوكينات المضادة للالتهابات. حقن داخل الدم ية من α-GalCer زيادة وتيرة خلايا iNKT في الجسم, في الغالب المجموعة الفرعية iNKT2. وكان تواتر خلايا الطحال iNKT في الفئران DBA/1 العادية حوالي 2٪ من الخلايا الليمفاوية، (كان iNKT2 حوالي 5٪، iNKT1 حوالي 15٪، iNKT17 حوالي 10٪). بعد ثلاثة أيام من الحقن داخل السربين من α-GalCer، كان تواتر خلايا iNKT حوالي 6٪ من الخلايا الليمفاوية، (كان iNKT2 حوالي 82٪، iNKT1 حوالي 1.5٪، وiNKT17 حوالي 0.5٪). بعد تنقية من قبل MACS، وكان نقاء خلايا iNKT أكثر من 85٪، منها كان iNKT2 حوالي 92٪، iNKT1 حوالي 0.4٪، وiNKT17 حوالي 0.2٪(الشكل 4).
تفرز خلايا iNKT التي تم حصادها المزيد من السيتوكينات المضادة للالتهابات وسيتوكينات التهابية أقل. تم عزل خلايا iNKT من طحال الفئران العادية وتم حقنها داخل النخبة بـ α-GalCer بعد 3 أيام من فحص طحال الفأر (مجموعة α-GalCer) ومستويات السيتوكين في supernatant ثقافة الخلية. بالمقارنة مع مجموعة التحكم، انخفض السيتوكينات الالتهابية (IL-17A، TNF-α، IFN-α، وIL-6) من مجموعة α-GalCer بشكل ملحوظ(P < 0.05)، وارتفع مستوى السيتوكين IL-4 المضاد للالتهابات بشكل كبير(P < 0.05). لم يكن هناك فرق كبير في IL-10(P > 0.05). انخفضت نسبة IFN-ο/IL-4 بشكل ملحوظ(P < 0.05)(الشكل 5).
وأكد تتبع IVIS أن خلايا DiR-iNKT تم غرسها بالتبني في فئران RA وظهرت على الفور في الرئتين بعد الحقن. تم الكشف عن الفلورسينس في الكبد في 10 دقيقة وفي الطحال في 60 دقيقة(الشكل 6الذكاء الاصطناعي, 6AII, 6AIII). في الأعضاء المعزولة ، لم يكن هناك فلورة في الغدة الصعترية والغدد الليمفاوية الإنجية في غضون ساعة واحدة. كان هناك ضعف الفلورسينس في الكبد في 0 دقيقة ، ثم زاد تدريجيا. تم الكشف عن الفلورسينس في الطحال في 30 دقيقة ثم زادت تدريجيا(الشكل 6AIV، 6C).
بعد ضخ خلايا DiR-iNKT في فئران RA ، تركزت الفلورسينس بشكل رئيسي في الكبد والطحال(الشكل 6BI ، 6BII ، 6BIII)، ولكن لم يكن هناك فلورة في الغدد الليمفاوية الغدة الصعترية والبلع. وكان الطحال والكبد أعلى كثافة الفلورية في اليوم 1 بعد ضخ الخلايا، لكنه ضعف تدريجيا. في اليوم 34، اختفى الفلورسينس السطحي. في اليوم 42 ، اختفت مضانة الأعضاء المعزولة. متوسط شدة إشارة الفلورسينس للكبد بعد أن كان تسريب الخلايا أعلى من الطحال(الشكل 6BIV، 6D).
يمكن أن يؤدي التسريب بالتبني لخلايا iNKT إلى فئران RA إلى تخفيف تطور المرض وتحسين الأعراض السريرية. خلايا iNKT تحسين الأعراض السريرية للفئران RA بعد التسريب بالتبني. بالمقارنة مع مجموعة نموذج RA غير المعالجة ، تم تخفيف تورم مفصل الكاحل في مجموعة علاج الخلايا ، وانخفضت الدرجات بشكل كبير من اليوم 10 إلى اليوم 20 بعد الحقن. في نفس الفترة في مجموعة علاج الخلايا ، تم تقليل تسلل الخلايا الالتهابية في الأنسجة الزليلية بالمقارنة مع مجموعة نموذج RA(الشكل 2).
زادت معدلات نجاح خلايا الغدة الصعترية iNKT بشكل كبير(P < 0.05). بالمقارنة مع مجموعة التحكم الصحية ، في مجموعة نموذج RA انخفضت معدلات خلايا iNKT في الغدة الصعترية في مراحل التقدم (اليوم 11) ، والذروة (اليوم 14) ، والانتعاش (اليوم 20). في ذروة التهاب، وكانت هذه القيم الحد الأدنى وانتعشت في مرحلة مغفرة. أظهرت مجموعة العلاج بالخلايا زيادة كبيرة في معدلات خلايا iNKT في ذروة (اليوم 14) ومراحل التعافي (اليوم 20) بالمقارنة مع مجموعة نموذج RA(P < 0.05)(الشكل 7).
بعد ضخ الخلايا iNKT، انخفض معدل نجاح iNKT1 و iNKT17 في الغدة الصعترية وزيادة iNKT2. بالمقارنة مع مجموعة التحكم ، في مجموعة نموذج RA في اليوم 11 iNKT1 و iNKT17 في الغدة الصعترية زيادة كبيرة(P < 0.05) ، وانخفض iNKT2 بشكل ملحوظ(P < 0.05). في اليوم 14، iNKT1 و iNKT2 في الغدة الصعترية زيادة كبيرة(P < 0.05) وiNKT17 انخفض بشكل ملحوظ(P < 0.05). في اليوم 20 ، iNKT1 في الغدة الصعترية زيادة كبيرة(P < 0.05) ، iNKT2 لم يتغير بشكل كبير(P > 0.05) ، وiNKT17 انخفض بشكل ملحوظ(P < 0.05). زادت نسبة iNKT1/iNKT2 بشكل ملحوظ خلال المراحل الثلاث(P < 0.05).
بالمقارنة مع مجموعة نموذج RA، في اليوم 11 في α-GalCer ومجموعات العلاج بالخلايا، كانت iNKT1 و iNKT17 أقل بكثير(P < 0.05) وiNKT2 زيادة كبيرة(P < 0.05). في اليوم 14، في مجموعة α-GalCer iNKT1 و iNKT17 انخفضت بشكل ملحوظ(P < 0.05)، ولم يتغير iNKT2 بشكل كبير(P > 0.05)؛ في مجموعة العلاج بالخلايا iNKT1 و iNKT17 انخفض بشكل ملحوظ(P < 0.05) وiNKT2 زيادة كبيرة(P < 0.05). في اليوم 20، في مجموعة α-GalCer انخفض iNKT1 بشكل ملحوظ(P < 0.05)، لم يتغير iNKT2 بشكل كبير(P > 0.05)، وارتفع iNKT17 بشكل كبير(P < 0.05)؛ في مجموعة العلاج بالخلايا iNKT1 و iNKT17 انخفض بشكل ملحوظ(P < 0.05) وiNKT2 زيادة كبيرة(P < 0.05). انخفضت نسبة iNKT1/iNKT2 بشكل ملحوظ خلال المراحل الثلاث(P < 0.05)(الشكل 7).
تم زيادة مستويات السيتوكينات الالتهابية في المصل وانخفضت السيتوكينات المضادة للالتهابات بعد ضخ الخلايا iNKT. في المجموعة النموذجية RA، زادت مستويات مصل TNF-α و IFN-α وIL-6in بشكل كبير(P < 0.05)، في حين أظهرت IL-4 و IL-10 كميات منخفضة بشكل ملحوظ(P < 0.05) بالمقارنة مع مجموعة التحكم. في مجموعة العلاج بالخلايا iNKT ، انخفضت مستويات TNF-α و IFN-α و IL-6 في المصل بشكل ملحوظ عند مراحل التقدم والذروة من الالتهاب(P < 0.05) ، في حين زاد IL-4 و IL-10 بشكل كبير(P < 0.05) بالمقارنة مع مجموعة نموذج RA(الشكل 3).
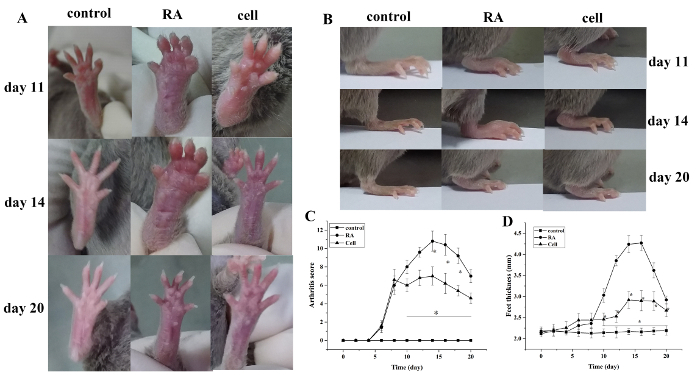
الشكل 1: درجة تورم المفصل وتغير سمك الكففي في الفئران. (أ)تورم مفصل الكاحل في الفئران. (B, D) سمك مخلب في مجموعات مختلفة. (ج)التغييرات السريرية في درجات مختلفة في مجموعات. تم تخفيض درجة التهاب المفاصل الماوس وسماكة مخلب بشكل ملحوظ في مجموعة العلاج بالخلايا في أيام 10-20 (أي 2-12 يوما بعد العلاج) بعد النمذجة. *P < 0.05 مقابل السيطرة، **P < 0.05 مقابل RA. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: التغيرات الباثوباثية في مفصل الكاحل. انخفض تسلل الخلايا الالتهابية بشكل كبير في مجموعة العلاج بالخلايا وازداد بشكل كبير في مجموعة RA في اليوم 14. ☆ = الخلايا الالتهابية. (A)100x(B)400x. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: مستويات السيتوكينات المصل في كل مجموعة. (A)مستويات السيتوكينات المصل في الفئران في اليوم 11 بعد النمذجة (pg/mL). (ب)مستويات السيتوكينات المصل في الفئران في اليوم 14 بعد النمذجة (pg/mL). انخفضت مستويات TNF-α و IFN-α و IL-6 بشكل ملحوظ ، وزادت مستويات IL-4 و IL-10 بشكل كبير في مجموعة العلاج بالخلايا. P < 0.05 مقابل التحكم. (ب)P < 0.05 مقابل RA. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: معدلات خلايا iNKT ونسبة المجموعات الفرعية للخلايا iNKT. (A, B, C) معدل iNKT2 في الفئران العادية هو ~ 5٪. (D، E، F) معدل iNKT2 حوالي 82٪ بعد في تحريض الجسم الحي. (G، H، I) معدل iNKT2 هو أكثر من 92٪ بعد تنقية MACS. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: مستويات السيتوكين في الثقافة supernatant من خلايا iNKT الطحال الماوس المستمدة. ارتفع مستوى IL-4 بشكل ملحوظ، وانخفضت مستويات IL-17A و TNF-α وIFN-α وIL-6 بشكل ملحوظ. P < 0.05 مقابل التحكم. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: توزيع واستقلاب خلايا iNKT التي تتبعها الفرجار IVIS lumina II. (A, B) مسار الترحيل لخلايا iNKT. (C)تغيير متوسط كثافة إشارة الفلورسينس في الطحال والكبد والرئة. (د)تغيير متوسط كثافة إشارة الفلورسينس في الطحال والكبد. تم الكشف عن الفلورسينس في الرئتين والكبد في 0 دقيقة، ثم زادت تدريجيا. كانت شدة الفلورية أقوى في 10 دقائق في الرئتين ثم انخفضت. تم الكشف عن مضان الطحال في 30 دقيقة ، ثم زادت تدريجيا. اختفت مضانة جميع الأعضاء في اليوم 42. متوسط شدة إشارة الفلورسينس في الكبد أعلى من الطحال بعد ضخ الخلايا (I: supine; ثانياً: الكذب الجانبي؛ ثالثا: عرضة؛ رابعا: الأنسجة المعزولة؛ أ: مجموعة المراقبة؛ ب: مجموعة ضخ الخلايا؛ 1، 2، 3، 4، 5 هي الغدة الصعترية والطحال والكبد والغدد الليمفاوية البُنوية والرئتين). يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 7: معدلات iNKT والمجموعات الفرعية في الغدة الصعترية الماوس. (أ)معدلات خلايا iNKT في 11 و 14 و 20 يوما بعد النمذجة. (ب)نسبة iNKT1/iNKT2. (C, D, E) معدل iNKT1، iNKT2، وiNKT17. في الأيام 11 و 14 و 20 (أيام 3 و 6 و 12 بعد العلاج بالخلايا) ، زادت معدلات خلايا iNKT بشكل كبير ، وانخفض iNKT1 و iNKT17 من الغدة الصعترية بشكل ملحوظ في مجموعة العلاج بالخلايا ، وتمت زيادة iNKT2 بشكل كبير. P < 0.05 مقابل التحكم. (ب)P < 0.05 مقابل RA. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
خلايا iNKT هي خلايا T خاصة تسد المناعة الفطرية والتكيفية ويتم تطويرها بشكل رئيسي من CD4++/ CD8+ thymocytes. خلايا iNKT لديها وظائف متنوعة المناعة التنظيمية وتتفاعل مع الخلايا المناعية الأخرى عن طريق الاتصال المباشر وإفراز السيتوكينات المختلفة23، مما يؤثر على الخلايا التشجرات (DCs) ، الضامة ، العدلات ، الخلايا B ، الخلايا التائية ، وتمايز الخلايا NK والتنمية24. α-GalCer هو المنشط الكلاسيكي الخاص بخلايا iNKT المستخرج من الإسفنج. تشير العديد من الدراسات إلى أن تردد خلية الطحال iNKT يصل إلى ذروته بعد حقنة واحدة داخل البلغية من α-GalCer لمدة 3 أيام25. أظهرت نتائجنا التجريبية غلبة المجموعة الفرعية iNKT2 في طحال الفئران لمدة 3 أيام بعد حقن داخل السربينة من α-GalCer ، والذي يفرز بشكل رئيسي السيتوكينات المضادة للالتهابات IL-4 و IL-10. وجدنا أيضا أن وفرة من الخلايا iNKT2 انخفضت وأن من خلايا iNKT1 و iNKT17 زادت في الفئران نموذج RA خلال المرحلة الالتهابية. لذلك ، قمنا بعزل خلايا iNKT لطحال الماوس عن طريق الحقن داخل السربينة لـ α-GalCer لمدة 3 أيام. وقد استخدمت هذه لعلاج الفئران نموذج RA. وكان معدل المجموعة الفرعية iNKT2 82٪ بعد في تحريض الجسم الحي. بعد تنقية من قبل لجنة الهدنة العسكرية، تجاوز معدل iNKT2 92٪.
يتم استخدام التنشيط المحدد لخلايا iNKT كعلاج بيولوجي جديد لـ RA. Horikoshi وآخرون21 أظهرت أن حقن intradermal من α-GalCer تثبيط التهاب المفاصل الناجم عن الببتيد GPI عن طريق تثبيط كبير لعدد من خلايا CD4+ T. وقد أظهر شيبا وآخرون26 أن الحقن المتكررة للمنشط الانتقائي iNKT2 الاصطناعي قد منعت وكالة المخابرات المركزية، في حين أظهرت α-GalCer تأثيرًا مثبطًا طفيفًا. حقننا iNKT المشتقة من الطحال في الفئران نموذج RA، وأظهرت النتائج أن درجة تورم مفاصل الكاحل في مجموعة العلاج بالخلايا وعدد الخلايا الالتهابية التي تتسلل إلى المفاصل قد انخفضت. ارتفع مستوى السيتوكينات المضادة للالتهابات في المصل (على سبيل المثال، IL-4 و IL-10)، وانخفض إفراز السيتوكينات المؤيدة للالتهابات (على سبيل المثال، IFN-α و TNF-α). وكان التنشيط المستهدف للخلايا iNKT قادرة على تخفيف تطور RA ومنع الاستجابة الالتهابية. بالإضافة إلى ذلك ، اكتشفنا تردد iNKT في الغدة الصعترية ووجدنا أن عدد خلايا iNKT في مجموعة نموذج RA انخفض بشكل كبير ، في حين زاد التردد في الغدة الصعترية بعد ضخ خلايا iNKT. بسبب وجود نظام حاجز الغدة الصعترية بالدم ، لم ننظر في الزيادة المطعّمة بالتبني في مستوى iNKT في الغدة الصعترية التي تم تأكيدها في التجارب اللاحقة. كشف المزيد من الفئات السكانية الفرعية من خلايا iNKT في الغدة الصعترية أن, بالمقارنة مع مجموعة التحكم السليم, عدد الخلايا iNKT1 في المجموعة نموذج RA زيادة كبيرة خلال المراحل الثلاث من الالتهاب وإلى أقصى حد خلال ذروة الالتهاب, في حين أن نسبة المجموعة الفرعية iNKT2 بدأت في الزيادة في ذروة الالتهاب. وتجدر الإشارة إلى أن المجموعة الفرعية iNKT1 قد تشارك في الالتهاب المبكر لجمهورية راكو، وقد تلعب المجموعة الفرعية iNKT2 دورًا مهمًا في تثبيط الالتهاب. بالمقارنة مع مجموعة نموذج RA ، انخفضت مجموعة iNKT1 الفرعية في مجموعة العلاج الخلوي بشكل ملحوظ خلال المرحلة الالتهابية ، وزادت المجموعة الفرعية iNKT2 بشكل كبير في مرحلة الالتهاب المبكر ة ومغفرة الالتهاب. وأشارت هذه النتائج إلى أن التسريب بالتبني للأنماط الظاهرية المحددة والخلايا الوظيفية iNKT زاد بشكل كبير من تواتر خلايا iNKT في RA وغير نسبة المجموعات الفرعية لخلايا iNKT.
استخدمنا IVIS لمراقبة توزيع خلايا iNKT في الفئران بعد التسريب بالتبني ووجدنا أعلى كثافة فلورية في الرئتين بعد 10 دقائق من التسريب ، والتي تلاشت تدريجيا. أظهر الكبد ضعف الفلورسينس ، الذي زاد تدريجيا وانخفض تدريجيا بعد يومين. تم الكشف عن الفلورسينس في الطحال في 30 دقيقة ، والتي زادت تدريجيا وانخفض بعد 2 أيام. كان متوسط كثافة الفلورسينس في الكبد أقوى من الطحال. ومع ذلك ، لم يتم اكتشاف الفلورسينس في الغدة الصعترية والغدد الليمفاوية الايجية. يمكن أن يعزى الكشف عن الفلورسينس في الرئتين إلى ضخ خلايا iNKT في الوريد الذيل. يتم تداول هذه الخلايا إلى الرئتين مع الدم. تفلور الكبد في وقت سابق من الطحال ، ومتوسط كثافة الفلورسة في الكبد أقوى من الطحال. قد يكون هذا التراكم التفضيلي لخلايا iNKT بسبب الأوعية الدموية الوفيرة في الكبد ، الجهاز الأيضي الرئيسي. لم يتم الكشف عن الفلورسينس في الغدة الصعترية. قد يكون هذا بسبب حاجز الدم، والتي يمكن أن تعوق دخول الخلايا iNKT. لم يتم الكشف عن الفلورفينفية في الغدد الليمفاوية الأربينية ، ربما لأن عدد ًا أقل من خلايا iNKT دخل الغدد الليمفاوية ولم يصل إلى الحد الأدنى من الكشف. أيضا، يمكن أن يكون تكهن أن الخلايا iNKT غرست في الوريد الذيل قد لا تدخل الغدد الليمفاوية. لذلك ، نفترض أن تطور وتمييز خلايا iNKT في الغدة الصعترية قد يتم تنظيمه من خلال مسارات السيتوكين بعد التسريب بالتبني في الفئران. وهذا يحتاج إلى مزيد من التوضيح.
GPI موجود في المصل والسوائل الزليلية لمعظم مرضى RA وهو اختبار شائع الاستخدام لتشخيص RAالسريرية 27. استخدم Bruns et al.28 الببتيدات ذات الأطوال المختلفة من تسلسل GPI وحصن الفئران DBA/1 لتحديد ستة مناعية الخلايا التُتية المُحَمَنة. ومن بين هذه المجالات، كان ثلاثة منها من المواد الهاوية. الببتيدات مع > 95% من حالات التهاب المفاصل هي hGPI 325-339 وhGPI469-483. أظهرت دراساتنا السابقة أن استخدام خليط من الببتيدات اثنين لإنشاء نموذج RA أفضل من الببتيد واحد. في نماذج RA الناتجة ، بدأت أجهزة قدم ومفاصل الفئران في الظهور باللون الأحمر في اليوم 6 ووصلت إلى ذروة الالتهاب في اليوم 14. ورافق تسلل الخلايا الالتهابية تضخم الأنسجة في الأنسجة الزليلية للمفاصل ، وكان تسلل الخلايا الالتهابية على أشده في اليوم 14. انخفض عدد خلايا iNKT بشكل ملحوظ في الغدة الصعترية في ذروة الالتهاب ، وهو ما كان متسقًا مع اتجاه خلايا iNKT في مرضى RA29. وكشف المزيد من الكشف عن مجموعات الخلايا iNKT أن تواتر iNKT1 و iNKT17 في الغدة الصعترية زادت وتواتر iNKT2 انخفض خلال تطور الالتهاب (اليوم 11). بالإضافة إلى ذلك ، زادت مستويات السيتوكينات المصلي IFN-ο و IL-17A خلال التقدم (اليوم 11) وذروة الالتهاب (اليوم 14) ، مما يشير إلى استقطاب مماثل للمجموعات الفرعية Th1 و Th17 في فئران نموذج RA30. ولذلك، فإن نموذج الماوس RA الناجم عن hGPI325-339 وhGPI469-483 شظايا بوليبتيد مختلطة أظهرت خصائص CD4+ T الخلايا فرط الانتشار وعيوب الخلايا iNKT، الذي كان مماثلا لتلك التي من المرضى RA، ويمكن استخدامها كنموذج الحيوان المثالي للتحقيق في مناعة خلايا RA. وكانت هذه النتائج متفقة مع تلك التي من دراساتنا السابقة وأظهرت استقرار نموذج RA31الناجم عن hGPIs.
بشكل عام، نموذج الماوس RA الناجمة عن الببتيدات G6PI المختلطة يمكن محاكاة التغييرات في خلايا CD4+ T، خلايا iNKT، والسيتوكينات ذات الصلة في مرضى RA. وهذا يوفر نموذجا جيدا للتحقيق المتعمق في جمهورية جمهورية الولايات المتحدة. على التوالي، تم استخدام iNKT (iNKT2 بشكل رئيسي) الناجم عن الحقن داخل السربينمنل من α-GalCer وتنقيتها في المختبر في علاج RA. فإنه يمكن تصحيح عدم التوازن المناعي الناجم عن انتشار غير طبيعي من المجموعات الفرعية Th, تخفيف تطور RA, وفي المستقبل قد توفر أساليب جديدة للعلاج السريري لجمهورية راكسة.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
ولا يعلن أصحاب البلاغ عن أي تمويل أو تضارب في المصالح.
Acknowledgments
تم دعم دراستنا من قبل المؤسسة الوطنية للعلوم الطبيعية في الصين (NSFC) (81771755) ، والكليات والجامعة العلمية والتكنولوجية مشروع البحوث الرئيسية في مقاطعة خبى (ZD2017009) ومختبر الحيوان من مركز التجارب الطبية ، جامعة خبى. ونحن ممتنون لدعمهم.
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 647 Mouse Anti-PLZF | BD | 563490 | America |
| Anti-PE MicroBeads | Miltenyi | 130-048-801 | Germany |
| Columns | Miltenyi | MS | Germany |
| Cryogenic Centrifuge | Beckman | Allegra® X-15R | America |
| DiR | Thermo Fisher Scientific | D12731 | America |
| Embedding Center | Tianjin Aviation Electromechanical Co., Ltd. | BMJ-1 | China |
| FITC Hamster Anti-Mouse TCR β Chain | BD | 553170 | America |
| Flow cytometer | BD | Accuri C6 | America |
| Freund's complete adjuvant | Sigma | F5881 | America |
| hGPI325-339 (IWYINCFGCETHAML) | Karebay Biochem | 18062202 | China |
| hGPI469-483 (EGNRPTNSIVFTKLT) | Karebay Biochem | 18062203 | China |
| In Vivo Imaging System | PerkinElmer | caliper IVIS lumina II | America |
| Ionomycin Calcium | Cayman | 10004974 | America |
| KRN7000 | AdipoGen | AG-CN2-0013 | America |
| Mouse CD1d Tetramer-PE | MBL | TS-MCD-1 | Japan |
| Mouse percoll | Solarbio | P8620 | China |
| Optical Microscope | Olympus | Olympus-II | Japan |
| PerCP-CyTM5.5 Mouse anti-ROR-ϒt | BD | 562683 | America |
| PerCP-CyTM5.5 Mouse anti-T-bet | BD | 561316 | America |
| Pertussis toxin | Sigma | P7208 | America |
| phorbol esters | Cayman | 10008014 | America |
| Red Blood Cell Lysis Buffer | BD | 555899 | America |
| RPMI-1640 | Biological Industries | 01-100-1ACS | Israel |
| Th1/Th2/Th17 cytokines kit | BD | 560485 | America |
| Ultramicrotome | Leica | Leica EM UC6 | Germany |
References
- Tobón, G. J., Youinou, P., Saraux, A. The environment, geo-epidemiology, and autoimmune disease: Rheumatoid arthritis. Autoimmunity Reviews. 35 (1), 0-14 (2010).
- Cross, M., et al. The global burden of rheumatoid arthritis: estimates from the Global Burden of Disease 2010 study. Annals of the Rheumatic Diseases. 73 (7), 1316-1322 (2014).
- Kanashiro, A., Bassi, G. S., Queiróz Cunha, F. D., Ulloa, L. From neuroimunomodulation to bioelectronic treatment of rheumatoid arthritis. Bioelectronics in Medicine. 1 (2), 151-165 (2018).
- Brennan, P. J., Brigl, M., Brenner, M. B. Invariant natural killer T cells: an innate activation scheme linked to diverse effector functions. Nature Reviews Immunology. 13 (2), 101-117 (2013).
- Bianca, B. S. Unraveling Natural Killer T-Cells Development. Frontiers in Immunology. 8, 1950 (2018).
- Mitsuo, A., et al. Decreased CD161+CD8+ T cells in the peripheral blood of patients suffering from rheumatic diseases. Rheumatology. 45 (12), 1477-1484 (2006).
- Miellot, A., et al. Activation of invariant NK T cells protects against experimental rheumatoid arthritis by an IL-10-dependent pathway. European Journal of Immunology. 35 (12), 3704-3713 (2005).
- Miellot-Gafsou, A., et al. Early activation of invariant natural killer T cells in a rheumatoid arthritis model and application to disease treatment. Immunology. 130 (2), 296-306 (2010).
- Tudhope, S. J., Delwig, A. V., Falconer, J., Pratt, A., Ng, W. F. Profound invariant natural killer t-cell deficiency in inflammatory arthritis. Annals of the Rheumatic Diseases. 69 (10), 1873-1879 (2010).
- Ming, M., et al. Effects on immunoregulation of iNKT cells in RA by novel synthetic immunostimulator CH1b. Chinese Journal of Immunology. 32 (02), 218-222 (2016).
- Ming, M., et al. Study of the correlation between the percentage of iNKT cells and the ratio of IFN-γ/IL-4 in patients with rheumatoid arthritis. Chinese Journal of Microbiology Immunology. 35 (3), 213-218 (2015).
- Sharif, S., et al. Activation of natural killer T cells by α-galactosylceramide treatment prevents the onset and recurrence of autoimmune Type 1 diabetes. Nature Medicine. 7, 1057-1062 (2010).
- Gapin, L. Development of invariant natural killer T cells. Current Opinion in Immunology. 39, 68-74 (2016).
- Kwon, D. I., Lee, Y. J. Lineage Differentiation Program of Invariant Natural Killer T Cells. Immune Network. 17 (6), (2017).
- Thapa, P., et al. The differentiation of ROR-γt expressing iNKT17 cells is orchestrated by Runx1. Scientific Reports. 7 (1), 7018 (2017).
- Schurgers, E., Billiau, A., Matthys, P. Collagen-induced arthritis as an animal model for rheumatoid arthritis: focuson interferon-γ. Interferon Cytokine Research. 31 (12), 917-926 (2011).
- Van Haalen, H. G. M., Severens, J. L., Tran-Duy, A., Boonen, A. How cost-effectiveness A systematic review and stepwise approach for selecting a transferable health economic evaluation rheumatoid arthritis. Pharmacoeconomics. 32 (5), 429-442 (2014).
- Schubert, D., Maier, B., Morawietz, L., Krenn, V., Kamradt, T. Immunization with glucose-6-phosphate isomerase induces T cell-dependent peripheral polyarthritis in genetically unaltered mice. Journal of Immunology. 172, 4503-4509 (2004).
- Bockermann, R., Schubert, D., Kamradt, T., Holmdahl, R. Induction of a B-cell-dependent chronic arthritis with glucose-6-phosphate isomerase. Arthritis Research, Therapy. 7, 131613-131624 (2005).
- Kamradt, T., Schubert, D. The role and clinical implications of G6PI in experimental models of rheumatoid arthritis. Arthritis Research, Therapy. 7, 20-28 (2005).
- Horikoshi, M., et al. Activation of Invariant NKT Cells with Glycolipid Ligand α-Galactosylceramide Ameliorates Glucose-6-Phosphate Isomerase Peptide-Induced Arthritis. PlosOne. 7 (12), 51215 (2012).
- Zhang, X. J., et al. Immunization with mixed peptides derived from glucose-6-phosphate isomerase induces rheumatoid arthritis in DBA /1 mice. Chinese Journal of Pathophysiology. 32 (3), 569-576 (2016).
- Motohashi, S., Nakayama, T. Invariant natural killer T cell-based immunotherapy for cancer. Immunotherapy. 1 (1), 73 (2017).
- Jung, S., et al. The requirement of natural killer T-cells in tolerogenic APCs-mediated suppression of collagen-induced arthritis. Experimental and Molecular Medicine. 42 (8), 547-554 (2010).
- Luc, V. K., Lan, W. Therapeutic Potential of Invariant Natural Killer T Cells in Autoimmunity. Frontiers in Immunology. 9, 519-526 (2018).
- Chiba, A., et al. Suppression of collagen-induced arthritis by natural killer T cell activation with OCH, a sphingosine-truncated analog of α-galactosylceramide. Arthritis, Rheumatism. 50 (1), 305-313 (2004).
- Tudhope, S. J., Delwig, A. V., Falconer, J., Pratt, A., Ng, W. F. Profound invariant natural killer t-cell deficiency in inflammatory arthritis. Annals of the Rheumatic Diseases. 69 (10), 1873-1879 (2010).
- Bruns, L., et al. Immunization with an immunodominant self-peptide derived from glucose-6-phosphate isomerase induces arthritis in DBA/1 mice. Arthritis Research, Therapy. 11 (4), (2009).
- Parietti, V., et al. Rituximab treatment overcomes reduction of regulatory iNKT cells in patients with rheumatoid arthritis. Clinical Immunology. 134 (3), 331-339 (2010).
- Yoshida, Y., et al. Functional mechanism(s) of the inhibition of disease progression by combination treatment with fingolimod plus pathogenic antigen in a glucose-6-phosphate isomerase peptide-induced arthritis mouse model. Biological, Pharmaceutical Bulletin. 38 (8), 1120-1125 (2015).
- Chen, D., et al. Study of the adoptive immunotherapy on rheumatoid arthritis with Thymus-derived invariant natural killer T cells. International Immunopharmacology. 67, 427-440 (2019).



