Summary
Dit protocol maakt gebruik van G6PI gemengde peptiden om reumatoïde artritis modellen die dichter bij die van de menselijke reumatoïde artritis in CD4+ T cellen en cytokines construeren. Hoge zuiverheid invariant natuurlijke killer T cellen (voornamelijk iNKT2) met specifieke fenotypes en functies werden verkregen door in vivo inductie en in vitro zuivering voor adoptieve immunotherapie.
Abstract
Reumatoïde artritis (RA) is een complexe chronische inflammatoire auto-immuunziekte. De pathogenese van de ziekte is gerelateerd aan invariant natuurlijke killer T (iNKT) cellen. Patiënten met actieve RA presenteren minder iNKT-cellen, een defecte celfunctie en overmatige polarisatie van Th1. In deze studie werd een RA-diermodel opgezet met behulp van een mengsel van hGPI325-339 en hGPI469-483 peptiden. De iNKT-cellen werden verkregen door in vivo inductie en in vitro zuivering, gevolgd door infusie in RA-muizen voor adoptieve immunotherapie. Uit het in vivo imaging systeem (IVIS) bleek dat iNKT-cellen voornamelijk in de milt en lever werden verdeeld. Op dag 12 na de celtherapie vertraagde de progressie van de ziekte aanzienlijk, werden de klinische symptomen verlicht, nam de overvloed aan iNKT-cellen in de thymus toe, nam het aandeel iNKT1 in de thymus af en daalde het niveau van TNF-α, IFN-γ en IL-6 in het serum afnam. Adoptieve immunotherapie van iNKT-cellen herstelde het evenwicht van immuuncellen en corrigeerde de overmatige ontsteking van het lichaam.
Introduction
Reumatoïde artritis (RA) is een auto-immuunziekte gekenmerkt door chronische, progressieve invasiefheid met 0,5-1% incidentie1,2. De onderliggende pathogenese wordt toegeschreven aan de abnormale proliferatie van autoreactieve CD4+ en CD8+ T cellen, gemanifesteerd door een toename van het aandeel cd4+IFN-γ+ en CD4+IL-17A+ T cellen, en het verminderde aantal CD4+IL-4+ en CD4+CD25+FoxP3+ T cellen. Daarom wordt de afscheiding van ontstekingscytokinen verhoogd en vernietigt een overmatige ontstekingsreactie de inheemse balans en tolerantiefunctie van het immuunsysteem van het lichaam. Bovendien verergeren de helper T-lymfocyten (Th) 1 cellen die het gewricht binnendringen de ontstekingsreactie en gewrichtsschade. Daarom zijn de remming van overmatige ontstekingsrespons en herstel van immuuntolerantie en immuunbalans de sleutel tot de behandeling van RA3,4.
De iNKT cellen hebben zowel NK cel als T cel functies en kenmerken. De iNKT-cellen herbergen een aparte, invariant T-celreceptor (TCR) α-keten met beperkte TCR β-keten repertoires5 en herkennen het glycolipid antigeen gepresenteerd door het grote histocompatibiliteitscomplex (MHC) klasse I molecuul CD1d op het oppervlak van de antigeen-presenterende cellen. Mitsuo et al.6 ontdekte een groot aantal iNKT-cellen en functionele defecten bij veel auto-immuunziekten, waaronder RA. Aurore et al.7 toonden aan dat iNKT-cellen een positief effect hebben op het handhaven van auto-immuuntolerantie en dat wanneer het aantal en de functie van iNKT-cellen worden hersteld, de ziekte wordt verlicht. Bovendien, Miellot-Gafsou et al.8 bleek dat iNKT cellen niet alleen de ziekte ingetrokken, maar ook verhoogde de progressie van de ziekte. Deze tegenstrijdige resultaten suggereren dat iNKT-cellen heterogene T-cellen zijn en dat de functie van verschillende subgroepen kan worden omgekeerd. In een klinische studie van RA correleerde de frequentie van iNKT-cellen met de score van de ziekteactiviteit9. De resultaten bevestigden ook dat de frequentie van iNKT werd verlaagd bij RA-patiënten, het aantal CD4+IFN-γ+ T celsubsets steeg en de secretoire niveaus van ontstekingscytokines IFN-γ en TNF-α stegenmet 10,11. Bovendien onderzochten Sharif et al.12 diabetes type 1 (T1D) en ontdekten dat selectieve infusie van iNKT-cellen de expressie van de inflammatoire cytokine IL-4 uprestelde, immuuntolerantie handhaafde en de ontwikkeling van diabetes type 1 verhinderde. Daarom verhoogt adoptieve infusie van specifieke iNKT-cellen of gerichte activering van iNKT-cellen het niveau van iNKT-cellen bij RA-patiënten, wat een doorbraak kan zijn in ra-behandeling.
Cellulaire immunotherapie is momenteel van groot belang en is op grote schaal gebruikt in kankertherapie. INKT-cellen zijn echter zeldzame, heterogene immunoregulerende cellen (slechts 0,3% van het totale aantal PBMC's)13, wat potentiële klinische toepassingen beperkt. Deze cellen zijn voornamelijk verdeeld in drie subpopulaties: 1) iNKT1 cellen, die een hoge expressie van promyelocytische leukemie zink-vinger eiwit (PLZF) en T-box transcriptie factor (T-bet); 2) iNKT2-cellen met tussenexpressie van PLZF en GATA bindend eiwit 3 (GATA3); 3) iNKT17 cellen met een lage expressie van PLZF en retinoïde-gerelateerde weesnucleaire receptor (ROR)-γt die IFN-γ, IL-4 en IL-1714afscheiden. Geactiveerde iNKT-cellen scheiden Th1, Th2 en Th17-achtige cytokinen af, die de verschillende immunomodulatorische effecten van iNKT-cellenbepalen 15. De immunomodulatorische en immunotherapeutische effecten van specifieke activering van verschillende subpopulaties van iNKT-cellen zijn verschillend. Daarom kan de selectie van specifieke fenotypes van iNKT-cellen (voornamelijk iNKT2) met ontstekingsremmende functies om de immuunrespons van het lichaam te reguleren, de immuunonbalans en immuunaandoeningen in RA corrigeren.
De oprichting van een ideaal diermodel is van groot belang voor de behandeling en studie van RA pathogenese. Momenteel, de meest gebruikte en volwassen dierlijke modellen omvatten collageen-geïnduceerde artritis, adjuvante artritis, zymosan-geïnduceerde artritis, en polysaccharide-geïnduceerde artritis16–17. Er is echter geen model dat alle kenmerken van de menselijke RA volledig kan simuleren. Type II collageen-geïnduceerde artritis (CIA) is een klassiek artritis model. De CIA wordt veroorzaakt door immunisatie van muizen met type II collageen-specifieke monoklonale antilichamen, als gevolg van de afhankelijkheid van het lichaam van dit ziektemodel. Benurs et al. beschreven een model met een systemische immuunrespons op glucose-6-fosfaat-isomerase (G6PI), dat perifere symmetrische polyartritis induceert bij vatbare muizenstammen18,19. In dit model is de ontwikkeling van artritis afhankelijk van T-cellen, B-cellen en aangeboren immuniteit18,19,20. Horikoshi21 vond dat RA-modellen als gevolg van immunisatie van DBA/1 muizen met G6PI polypeptide fragmenten zijn meer vergelijkbaar met de menselijke RA in termen van CD4+ T cellen en cytokinen (dat wil zeggen, IL-6 en TNF-α) dan de CIA-modellen. Om het stimulerende effect op de TCR-herkenningssite te vergroten, werden de gemengde polypeptidefragmenten van G6PI (hGPI325-339 en hGPI469-483) gebruikt om DBA/1 muizen te immuniseren om het RA-muismodel te construeren. Het slagingspercentage van deze aanpak kan hoog zijn omdat hGPI325-339 en hGPI469-483 immunodominant zijn voor I-A q-restricted T-celreacties. Daarom kan dit model de overproliferatie van CD4+ T-cellen en iNKT-celdefecten bij RA-patiëntensimuleren 22. Het basisonderzoek naar RA immunopathologie legde de basis voor ons verder diepgaand onderzoek.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Alle experimentele muizen (150 in totaal) waren gezonde mannelijke DBA/1 muizen, 6-8 weken oud (20,0 ± 1,5 g), gefokt in een specifieke pathogene vrije (SPF) omgeving. Er is geen speciale behandeling voor het modelleren. Het experiment werd verdeeld in een gezonde controlegroep (15 muizen), een modelcontrolegroep (15 muizen) en een celtherapiegroep (55 muizen). Deze studie werd goedgekeurd door de Animal Welfare and Ethical Committee van de Hebei University.
1. Bouw van het ziektemodel
- Dupliceren van het RA-diermodel
- Weeg 1,75 mg hG6PI 325-339 en hG6PI 469-483 fragmenten en los ze op in 5,25 mL van 4 °C drievoudig gedestilleerd water.
- Los de hulpvanaat (CFA) van Freund op in een waterbad van 50 °C, trek 5,25 mL in een andere centrifugebuis van 10 mL en koel deze af voor gebruik.
- Doe het mengsel van hG6PI-oplossing en CFA-oplossing in een kunstmatige emulsificatie-eenheid met twee glazen spuiten aangesloten.
- Duw de spuit met een constante snelheid en frequentie van 10-20x per min om de gemengde peptideoplossing en CFA-oplossing volledig te emulgeren. Voer de operatie uit in een ijsbad en houd de emulsiedruppels 10 min in het water na de voltooiing van de emulsificatie zonder te verspreiden.
- Injecteer 150 μL emulgeerde hG6P's in de staartwortel van de muis onderhuids.
- Injecteer 200 mg Pertussis toxine intraperitoneally in de muis bij 0 h en 48 uur na de hG6PI injectie.
- Experimentele verificatie van het RA-model
- Meet de dikte van de poot van de muis met een Vernier remklauw (2x per dag).
- Observeer en markeer de mate van roodheid en zwelling van de voet. Gebruik de volgende scorecriteria: 1) tenen met een lichte zwelling; 2) dorsum pedis en voetpad met duidelijke rode zwelling; 3) enkel met rode zwelling.
- Euthanaseer de muizen onder diepe anesthesie door intraperitoneale injectie van 1% natriumpentobarbital (50 mg/kg lichaamsgewicht) 14 dagen na het modelleren en verwijder de poten HE vlekken.
- Bepaal de secretieniveaus van serum IL-2, IL-4, IL-6, IL-10, IL-17A, TNF-α en IFN-γ met behulp van een commerciële cytometrische kraalarray (CBA) test volgens het protocol van de fabrikant.
2. Het verkrijgen van iNKT cellen met adoptieve cellulaire therapie
- Directionele inductie van iNKT-cellen
- Injecteer normale muizen intraperitoneally met α-GalCer (0,1 mg/kg lichaamsgewicht).
- Isolatie van iNKT-cellen
- Drie dagen na het modelleren, injecteren muizen intraperitoneally met 1% natrium pentobarbital (50 mg/kg lichaamsgewicht) voor verdoving. Voldoende verdoofde muizen tonen geen hind paw terugtrekking reactie op een teen knijpen.
- Isoleer de milt van een DBA/1 muis na intraperitoneally injecteren met α-GalCer. Bereid een enkele cel suspensie door het snijden en slijpen van de milt in een 200 mesh zeef.
- Was de celvering met PBS, centrifuge er bij 200 x g gedurende 5 min en gooi de supernatant weg. Herhaal.
- Resuspend de cellen met 1 mL van volbloed en weefsel verdunning oplossing. Voeg 3 mL muislymfocytenscheidingsmedium toe en centrifugeer de cellen vervolgens gedurende 20 min bij 300 x g bij kamertemperatuur.
- Verzamel de laag melkwitte lymfocyten (d.w.z. de tweede laag van de bovenkant), was het 2x met PBS en tel met een geautomatiseerde celteller.
- Magnetische geactiveerde celsortering (MACS)positieve selectiestrategie voor zuivering van iNKT-cellen
OPMERKING: Voor de voorbehandeling van CD1d tetramers werd 1 mg/mL α-Galcer verdund tot 200 μg/mL met 0,5% Tween-20 en 0,9% van NaCl, en 5 μL van de resulterende oplossing werd toegevoegd aan 100 μL van de CD1d tetrameroplossing. Het mengsel werd 12 uur bij kamertemperatuur uitgebroed en op 4 °C geplaatst voor gebruik. TCR β werd verdund 80x met gedeïoniseerd water. Alle andere antilichamen werden gebruikt als een voorraad oplossing.- Schors 107 cellen met 100 μL van 4 °C PBS, voeg 10 μL α-GalCer-geladen CD1d Tetramer-PE toe en broed ze uit bij 4 °C gedurende 15 min in het donker.
- Was de cellen 2x met PBS en breg ze opnieuw op in 80 μL PBS.
- Voeg 20 μL anti-PE-MicroBeads toe en uitbroed ze bij 4 °C gedurende 20 min in het donker.
- Was ze 2x met PBS en breg de cellen opnieuw op met 500 μL PBS.
- Plaats de sorteerkolom in het magnetisch veld van de MACS sorteerder en spoel met 500 μL PBS.
- Voeg de celvering van stap 2.3.4 toe aan de sorteerkolom, verzamel de doorstroom en spoel 3x af met PBS-buffer.
- Verwijder het magnetisch veld en verzamel de cellen uit de sorteerkolom. Voeg op dit punt 1 mL PBS-buffer toe aan de sorteerkolom en duw de zuiger snel tegen een constante druk om de gelabelde cellen naar de verzamelbuis te drijven en gezuiverde iNKT-cellen te verkrijgen. Tel met een geautomatiseerde celteller.
- Identificatie van het iNKT-celfenotype
- Neem respectievelijk 1 x 106 cellen uit de stappen 2.2.5 en 2.3.7 en brep ze opnieuw in 50 μL PBS.
- Antilichaam incubatie: Voeg het antilichaam niet toe aan de negatieve controlebuis, voeg 0,5 μL α-GalCer-PE-CD1d Tetramer of 10 μL FITC-TCR β toe aan de enkele positieve controlebuis. Voeg 0,5 μL α-GalCer-PE-CD1d tetramer en 10 μL FITC-TCR β toe aan de monsterbuis. Incubeer ze bij 4 °C gedurende 30 min in het donker.
- Was de cellen in PBS en centrifugeer vervolgens op 200 x g gedurende 5 min.
- Gooi de supernatant weg, voeg 1 mL Foxp3 Foxation/Permeabilization werkoplossing toe en incubeer de cellen gedurende 45 min bij 4 °C in het donker.
- Voeg 1 mL 1x Permeabilization Buffer werkoplossing toe en centrifugeer de cellen bij kamertemperatuur gedurende 500 x g bij kamertemperatuur gedurende 5 min.
- Gooi de supernatant weg. Voeg 1 μL Alexa Fluor 647 muis Anti-PLZF en 1 μL PerCP-Cy 5.5 muis anti-T-bet (of 1 μL PerCP-Cy 5.5 muis anti-RORΥt) toe voor 30 min bij kamertemperatuur in het donker.
- Voeg toe aan 2 mL permeabilization Buffer werkoplossing voor reiniging.
- Gooi de supernatant weg, bretel de cellen in 500 μL PBS en meet de stroomcytometrie.
- Functionele identificatie van iNKT-cellen
- Neem 3 x 106 iNKT-cellen uit stap 2.3.7 en bredig ze opnieuw op in 12 putplaten met 1,5 mL RPMI-1640 onvolledig medium (d.w.z. zonder serum).
- Voeg phorbolester (PMA, 50 ng/mL) en ionomycine calcium (IO, 1 μg/mL) toe en plaats 24 uur in een CO2-incubator.
- Verzamel de celsupernatant en detecteer de afscheidingsniveaus van IL-2, IL-17A, TNF-α, IL-6, IL-4, IFN-γ en IL-10 met behulp van een commerciële CBA-test volgens het protocol van de fabrikant.
- Experimenteel onderzoek naar het migratietraject van iNKT-cellen bij RA-muizen
- Los DiR kleurstof (2,5 mg/mL) op in DMSO.
- Resuspend iNKT cellen in 6 put platen met RPMI-1640 onvolledig medium. De dichtheid is 1 × 106 cellen/mL.
- Voeg DiR (5 μg/mL) oplossing toe en incubeer gedurende 25 min in een CO 2-incubator.
- Was met PBS en breg de cellen opnieuw op (3 x 106/300 μL) om iNKT-cellen met DiR-label (DiR-iNKT) te verkrijgen.
- Injecteer 1% natriumpentobarbital (50 mg/kg lichaamsgewicht) intraperitoneally om de muizen te verdoven. Voldoende verdoofde muizen tonen geen achterpoot terugtrekking te teen knijpen. Breng veterinaire zalf aan op de muisogen om droogte te voorkomen terwijl u onder narcose bent.
- Injecteer DiR-iNKT-cellen 3 x 106 per muis gedurende 8 dagen in de staartader met het RA-model. Controleer de iNKT-cellen in muizen postinjectie gedurende 0 min, 10 min, 30 min, 60 min en dag 0 (na 3 uur), 1, 3, 6, 12, 26, 34, 38 en 42 dagen met behulp van een klein dier in vivo imaging systeem (IVIS). De gebruikte excitatiegolflengte was 748 nm, de emissiegolflengte was 780 nm en de belichtingstijd was automatisch.
- Plaats elke muis in een aparte kooi na elke observatie en handhaven strengrecumbency. Observeer tot herstel van anesthesie.
3. Evaluatie van adoptieve immunotherapie van RA-muizen met iNKT-cellen
- iNKT celadoptieve immunotherapie voor RA-muizen
- Injecteer 3 x 106 cellen iNKT cellen per muis door de staartader. Selecteer willekeurig 15 muizen die 8 dagen eerder zijn gemodelleerd en verkrijg iNKT-cellen zonder Dat DiR labeling van stap 2.3.7 door de staartaderinfusie.
- Evalueer de werkzaamheid van adoptieve immunotherapie voor iNKT-cellen.
- Meet de dikte van de poot van de muis, kwantificeer de zwelling van het enkelgewricht en score systematisch na de infusie van iNKT-cellen zoals beschreven in de stappen 1.2.1–1.2.
- Let op de inflammatoire celinfiltratie en gewrichtsveranderingen van de muisgewrichten zoals beschreven in stap 1.2.3.
- Bepaal de afscheidingsniveaus van IL-2, IL-4, IL-6, IL-10, IL-17A, TNF-α en IFN-γ zoals beschreven in stap 1.2.4.
- Bepaal de frequentie van iNKT-cellen en -subsets.
- Isoleer de muisthymus en bereid een enkele cel suspensie voor.
- Scheid de lymfocyten met lymfocytenscheidingsvloeistof.
- Bepaal de iNKT-celfrequentie en subgroepfrequentie zoals beschreven in stap 2.4.
- Statistische analyse
OPMERKING: Alle gegevens worden gepresenteerd als gemiddelde ± SD. Waarden van P < 0,05 werden als statistisch significant beschouwd.- Gebruik eenfactoranalyse van variantie (ANOVA). Als de variantie is voldaan, gebruik dan de LSD-test voor verdere vergelijking.
- Als de variantie niet uniform is, gebruikt u de niet-parametrische test. Gebruik de Kruskal-Wallis H-test voor verdere vergelijking31.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
De artritis index score en poot dikte verhoogd na het modelleren. Vergeleken met de controlegroep, begonnen de tenen van de RA-modelgroep rode zwelling te vertonen op 6 dagen na het modelleren, met geleidelijke verergering. Na 14 dagen piekte de rode zwelling in het enkelgewricht, gevolgd door geleidelijke verlichting. De dikte van de poot veranderde eveneens (P < 0,05) (Figuur 1).
De inflammatoire celinfiltratie nam aanzienlijk toe na het modelleren. De pathologische resultaten toonden aan dat de infiltratiegraad van ontstekingscellen in het enkelsynoviale weefsel van de RA-modelmuizen in verschillende stadia anders was. Piekontsteking deed zich voor op dag 14 na het modelleren(figuur 2).
Ontstekingscytokinen verhoogden en ontstekingsremmende cytokinen daalden in het serum. In de RA-modelgroep namen het serumgehalte van ontstekingsremmende cytokinen (TNF-α, IFN-γ en IL-6) aanzienlijk toe (P < 0,05), terwijl ontstekingsremmende cytokinen (IL-4 en IL-10) aanzienlijk daalden (P < 0,05) (figuur 3).
De iNKT-cellen verkregen door in vivo inductie en in vitro zuivering bestonden voornamelijk uit iNKT2 celsubsets, die ontstekingsremmende cytokinen afscheiden. Intraperitoneale injectie van α-GalCer verhoogde de frequentie van iNKT-cellen in het lichaam, voornamelijk de iNKT2-subgroep. De frequentie van milt iNKT cellen bij normale DBA/1 muizen was ongeveer 2% van de lymfocyten, (iNKT2 was ongeveer 5%, iNKT1 ongeveer 15%, iNKT17 ongeveer 10%). Drie dagen na de intraperitoneale injectie van α-GalCer was de frequentie van iNKT-cellen ongeveer 6% van de lymfocyten (iNKT2 was ongeveer 82%, iNKT1 ongeveer 1,5% en iNKT17 ongeveer 0,5%). Na zuivering door MACS bedroeg de zuiverheid van iNKT-cellen meer dan 85%, waarvan de iNKT2 ongeveer 92%, iNKT1 ongeveer 0,4% en iNKT17 ongeveer 0,2% (figuur 4).
De geoogste iNKT-cellen onthielden meer ontstekingsremmende cytokinen en minder ontstekingscytokinen af. De iNKT cellen werden geïsoleerd van de milt van normale muizen en intraperitoneally geïnjecteerd met α-GalCer 3 dagen na de muis milt (α-GalCer groep) en de cytokine niveaus in de celcultuur supernatant werden onderzocht. Vergeleken met de controlegroep zijn de ontstekingscytokinen (IL-17A, TNF-α, IFN-γ en IL-6) van de α-GalCer-groep aanzienlijk afgenomen(P < 0,05) en het ontstekingsremmende cytokine IL-4-niveau aanzienlijk toegenomen (P < 0,05). Er was geen significant verschil in IL-10 (P > 0,05). De IFN-γ/IL-4 ratio daalde aanzienlijk (P < 0,05) (Figuur 5).
IVIS tracing bevestigde dat DiR-iNKT cellen werden adoptively toegediend in RA muizen en onmiddellijk verscheen in de longen postinjection. Fluorescentie werd ontdekt in de lever op 10 min en in de milt op 60 min (Figuur 6AI, 6AII, 6AIII). In de geïsoleerde organen was er geen fluorescentie in de thymus en inguinale lymfeklieren binnen 1 uur. Fluorescentie werd ontdekt in de longen op 0 min, de fluorescentieintensiteit was de grootste op 10 min, en vervolgens geleidelijk verzwakt. Er was zwakke fluorescentie in de lever op 0 min, en dan is het geleidelijk toegenomen. De fluorescentie in de milt werd ontdekt op 30 min en vervolgens geleidelijk toegenomen(figuur 6AIV, 6C).
Na de infusie van DiR-iNKT-cellen in RA-muizen was de fluorescentie voornamelijk geconcentreerd in de lever en milt(figuur 6BI, 6BII, 6BIII), maar er was geen fluorescentie in de thymus en inguinale lymfeklieren. De milt en lever hadden de hoogste fluorescentieintensiteit op dag 1 na celinfusie, maar het verzwakte geleidelijk. Op dag 34 verdween de oppervlaktefluorescentie. Op dag 42 verdween de fluorescentie van de geïsoleerde organen. De gemiddelde fluorescentiesignaalintensiteit van de lever na de celinfusie was hoger dan die van de milt (figuur 6BIV, 6D).
Adoptieve infusie van iNKT-cellen in RA-muizen kan de progressie van de ziekte verlichten en klinische symptomen verbeteren. De iNKT cellen verbeterden de klinische symptomen van RA-muizen na adoptieve infusie. Vergeleken met de onbehandelde RA-modelgroep werd de zwelling van het enkelgewricht verlicht in de celbehandelingsgroep en daalden de scores aanzienlijk van dag 10 tot dag 20 nainjectie. In dezelfde periode in de celbehandelingsgroep werd de inflammatoire celinfiltratie in het synoviale weefsel verminderd in vergelijking met de RA-modelgroep (figuur 2).
De slagingspercentages van thymus iNKT cellen stegen aanzienlijk (P < 0,05). Vergeleken met de gezonde controlegroep daalden in de RA-modelgroep de percentages iNKT-cellen in de thymus bij de voortgang (dag 11), piek (dag 14) en herstel (dag 20) fasen. Op piekontsteking waren deze waarden minimaal en herstelden ze in de remissiefase. De celtherapiegroep vertoonde aanzienlijk verhoogde tarieven van iNKT-cellen op het hoogtepunt (dag 14) en herstel (dag 20) in vergelijking met de RA-modelgroep (P < 0,05) (figuur 7).
Na iNKT celinfusie nam het slagingspercentage van iNKT1 en iNKT17 in de thymus af en nam iNKT2 toe. Vergeleken met de controlegroep zijn in de RA-modelgroep op dag 11 iNKT1 en iNKT17 in de thymus aanzienlijk toegenomen(P < 0,05) en iNKT2 aanzienlijk gedaald (P < 0,05). Op dag 14 stegen iNKT1 en iNKT2 in de thymus aanzienlijk (P< 0,05) en iNKT17 aanzienlijk (P< 0,05). Op dag 20, iNKT1 in de thymus aanzienlijk toegenomen (P < 0,05), iNKT2 niet significant veranderd (P > 0,05), en iNKT17 aanzienlijk gedaald (P < 0,05). De iNKT1/iNKT2 ratio steeg aanzienlijk in alle drie de fasen(P < 0,05).
Vergeleken met de RA-modelgroep waren iNKT1 en iNKT17 op dag 11 in de α-GalCer en de celtherapiegroepen aanzienlijk lager (P < 0,05) en iNKT2 aanzienlijk toegenomen (P < 0,05). Op dag 14 daalden in de α-GalCer groep iNKT1 en iNKT17 aanzienlijk (P < 0,05) en iNKT2 veranderde niet significant(P > 0,05); in de celtherapiegroep iNKT1 en iNKT17 aanzienlijk gedaald (P < 0,05) en iNKT2 aanzienlijk toegenomen (P < 0,05). Op dag 20, in de α-GalCer groep de iNKT1 aanzienlijk gedaald (P < 0,05), iNKT2 niet significant veranderd (P > 0,05), en iNKT17 aanzienlijk toegenomen (P < 0,05); in de celtherapiegroep iNKT1 en iNKT17 aanzienlijk gedaald (P < 0,05) en iNKT2 aanzienlijk toegenomen (P < 0,05). De verhouding van iNKT1/iNKT2 daalde aanzienlijk in alle drie de fasen (P < 0,05) (Figuur 7).
De niveaus van ontstekingscytokinen werden verhoogd in serum en de ontstekingsremmende cytokinen werden verminderd na iNKT-celinfusie. In de RA-modelgroep stegen de niveaus van TNF-α, IFN-γ en IL-6in serum aanzienlijk (P < 0,05), terwijl IL-4 en IL-10 aanzienlijk daalden (P < 0,05) in vergelijking met de controlegroep. In de iNKT-celtherapiegroep daalden de niveaus van TNF-α, IFN-γ en IL-6 in serum aanzienlijk tijdens de voortgang en piekfase van ontsteking(P < 0,05), terwijl IL-4 en IL-10 aanzienlijk stegen(P < 0,05) in vergelijking met de RA-modelgroep (figuur 3).
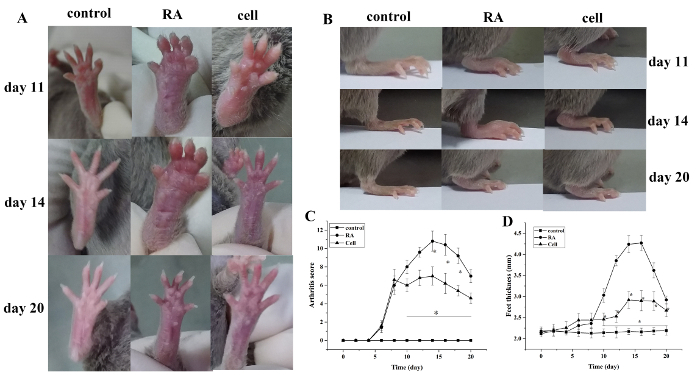
Figuur 1: De gewrichtszwellingsscore en pootdikte verandering bij muizen. (A) Zwelling van het enkelgewricht bij muizen. (B,D) Pootdikte in verschillende groepen. (C) Klinische score verandert in verschillende groepen. De muis artritis score en de dikte van de poot werden aanzienlijk verminderd in de celtherapie groep op dagen 10-20 (dat wil zeggen, 2-12 dagen na de behandeling) na het modelleren. *P < 0,05 vs. control, **P < 0,05 vs. RA. Klik hier om een grotere versie van dit cijfer te bekijken.

Figuur 2: Histopathologische veranderingen van het enkelgewricht. De infiltratie van ontstekingscellen werd aanzienlijk verminderd in de celtherapiegroep en werd aanzienlijk verhoogd in de RA-groep op dag 14. ∙ = ontstekingscellen. (A) 100x (B) 400x. Klik hier om een grotere versie van dit cijfer te bekijken.

Figuur 3: De niveaus van serumcytokines in elke groep. (A) Serum cytokines niveaus bij muizen op dag 11 na modellering (pg/mL). (B) Serum cytokines niveaus bij muizen op dag 14 na modellering (pg/mL). Het niveau van TNF-α, IFN-γ en IL-6 nam aanzienlijk af en het niveau van IL-4 en IL-10 nam aanzienlijk toe in de celtherapiegroep. eenP < 0,05 vs. control. bP < 0,05 vs. RA. Klik hier om een grotere versie van dit cijfer te bekijken.

Figuur 4: De percentages iNKT-cellen en het aandeel van iNKT-celsubsets. (A,B,C) Het tarief van iNKT2 bij normale muizen is ~5%. (D,E,F) Het tarief van iNKT2 is ongeveer 82% na in vivo inductie. (G, H, I) Het tarief van iNKT2 is meer dan 92% na MACS zuivering. Klik hier om een grotere versie van dit cijfer te bekijken.

Figuur 5: Cytokine niveaus in cultuur supernatant van muis milt-afgeleide iNKT cellen. Het niveau van IL-4 nam aanzienlijk toe en het niveau van IL-17A, TNF-α, IFN-γ en IL-6 nam aanzienlijk af. eenP < 0,05 vs. control. Klik hier om een grotere versie van dit cijfer te bekijken.

Figuur 6: Verdeling en metabolisme van iNKT-cellen getraceerd door remklauw IVIS lumina II. (A,B) Migratiepad van iNKT-cellen. (C) De verandering van de gemiddelde fluorescentiesignaalintensiteit in de milt, lever en long. (D) De verandering van de gemiddelde fluorescentiesignaalintensiteit in de milt en de lever. De fluorescentie werd ontdekt in de longen en lever op 0 min, en vervolgens geleidelijk toegenomen. De fluorescentieintensiteit was het sterkst op 10 min in de longen en nam toen af. De fluorescentie van de milt werd ontdekt op 30 min, dan geleidelijk toegenomen. De fluorescentie van alle organen verdween op dag 42. De gemiddelde fluorescentiesignaalintensiteit van de lever is hoger dan de milt na celinfusie (I: supine; II: zijdelingse liggend; III: gevoelig; IV: geïsoleerd weefsel; a: controlegroep; b: celinfuusgroep; 1, 2, 3, 4, 5 zijn thymus, milt, lever, inguinale lymfeklieren, longen). Klik hier om een grotere versie van dit cijfer te bekijken.

Figuur 7: De tarieven van iNKT en de subsets daarvan in de muisthymus. (A) De tarieven van iNKT cellen op 11, 14 en 20 dagen na het modelleren. (B) De verhouding van iNKT1/iNKT2. (C,D,E) Het tarief van iNKT1, iNKT2 en iNKT17. Op dag 11, 14 en 20 (dagen 3, 6 en 12 na celtherapie) namen de tarieven van iNKT-cellen aanzienlijk toe, de iNKT1 en iNKT17 van de thymus daalden aanzienlijk in de celtherapiegroep en iNKT2 werd aanzienlijk verhoogd. eenP < 0,05 vs Control. bP < 0,05 vs RA. Klik hier om een grotere versie van dit cijfer te bekijken.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
iNKT-cellen zijn speciale T-cellen die aangeboren en adaptieve immuniteit overbruggen en voornamelijk worden ontwikkeld uit CD4++/CD8+ thymocyten. iNKT-cellen hebben uiteenlopende immunoregulerende functies en werken samen met andere immuuncellen door direct contact en afscheiding van verschillende cytokines23, die dendritische cellen (DC's), macrofagen, neutrofielen, B-cellen, T-cellen en NK-celdifferentiatie en -ontwikkeling24beïnvloeden . α-GalCer is een klassieke iNKT celspecifieke activator uit sponzen. Verschillende studies geven aan dat milt iNKT celfrequentie een piek bereikt na een enkele intraperitoneale injectie van α-GalCer gedurende 3 dagen25. Onze experimentele resultaten toonden het overwicht aan van de iNKT2-subset in muizenmilt gedurende 3 dagen na een intraperitoneale injectie van α-GalCer, die voornamelijk ontstekingsremmende cytokines IL-4 en IL-10 afscheidt. We ontdekten ook dat de overvloed aan iNKT2-cellen afnam en dat van iNKT1- en iNKT17-cellen tijdens de ontstekingsfase in de RA-modelmuizen toenam. Daarom isoleerden we de iNKT-cellen van de muismilt door intraperitoneale injectie van α-GalCer gedurende 3 dagen. Deze werden gebruikt om de RA model muizen te behandelen. De snelheid van de iNKT2 subset was 82% na in vivo inductie. Na zuivering door MACS, de snelheid van iNKT2 overschreden 92%.
De specifieke activering van iNKT-cellen wordt gebruikt als een nieuwe biologische behandeling voor RA. Horikoshi et al.21 toonde aan dat intradermale injectie van α-GalCer gpi peptide-geïnduceerde artritis remde door het aantal CD4+ T-cellen aanzienlijk te remmen. Chiba et al.26 toonde aan dat herhaalde injecties van de synthetische iNKT2 selectieve activator OCH de CIA remden, terwijl α-GalCer een licht remmend effect vertoonde. We injecteerden milt-afgeleide iNKT in RA-modelmuizen, en de resultaten toonden aan dat de mate van zwelling van de enkelgewrichten in de celtherapiegroep en het aantal ontstekingscellen dat in de gewrichten infiltreert, werd verminderd. Het niveau van serum ontstekingsremmende cytokinen (bijvoorbeeld IL-4 en IL-10) nam toe en de afscheiding van ontstekingscytokinen (bijvoorbeeld IFN-γ en TNF-α) nam af. de gerichte activering van iNKT-cellen was in staat om de progressie van RA te verlichten en de ontstekingsreactie te remmen. Bovendien ontdekten we de frequentie van iNKT in de thymus en ontdekten dat het aantal iNKT-cellen in de RA-modelgroep aanzienlijk was verminderd, terwijl de frequentie in de thymus steeg na de infusie van de iNKT-cellen. Vanwege de aanwezigheid van het bloed-thymus barrièresysteem, hebben we niet rekening gehouden met de adoptiegraad van iNKT in de thymus die in latere experimenten werd bevestigd. Verdere detectie van de subpopulaties van iNKT-cellen in de thymus toonde aan dat, in vergelijking met de gezonde controlegroep, het aantal iNKT1-cellen in de RA-modelgroep aanzienlijk steeg tijdens de drie stadia van ontsteking en maximaal tijdens de piek van ontsteking, terwijl het aandeel van de iNKT2-subset begon te stijgen op het hoogtepunt van ontsteking. Met name de iNKT1-subset kan betrokken zijn bij de vroege ontsteking van RA, en de iNKT2-subset kan een belangrijke rol spelen bij het remmen van de ontsteking. Vergeleken met de RA-modelgroep nam de iNKT1-subset in de celtherapiegroep aanzienlijk af tijdens de ontstekingsfase en nam de iNKT2-subset aanzienlijk toe in de vroege en remissiefase van ontsteking. Deze resultaten gaven aan dat adoptieve infusie van specifieke fenotypen en functionele iNKT-cellen de frequentie van iNKT-cellen in RA aanzienlijk verhoogde en het aandeel iNKT-celsubsets veranderde.
We gebruikten IVIS om de verdeling van iNKT-cellen in muizen te observeren na adoptieve infusie en vonden de hoogste fluorescentieintensiteit in de longen 10 min na de infusie, die geleidelijk vervaagde. De lever vertoonde een zwakke fluorescentie, die geleidelijk toenam en na 2 dagen geleidelijk afnam. Fluorescentie werd ontdekt in de milt op 30 min, die geleidelijk toegenomen en daalde na 2 dagen. De gemiddelde fluorescentieintensiteit van de lever was sterker dan die van de milt. Er werd echter geen fluorescentie gedetecteerd in de thymus en inguinale lymfeklieren. De detectie van fluorescentie in de longen kan worden toegeschreven aan de infusie van iNKT-cellen in de staartader. Deze cellen worden doorgegeven aan de longen met het bloed. De lever fluoresces eerder dan de milt, en de gemiddelde fluorescentie intensiteit van de lever is sterker dan die van de milt. Deze preferentiële accumulatie van de iNKT cellen kan te wijten zijn aan de overvloedige bloedvaten in de lever, de belangrijkste metabole orgaan. Fluorescentie werd niet gedetecteerd in de thymus. Dit kan te wijten zijn aan de hematologische barrière, die de binnenkomst van iNKT-cellen zou kunnen belemmeren. Fluorescentie werd nooit gedetecteerd in de inguinale lymfeklieren, misschien omdat er minder iNKT-cellen in de lymfeklieren kwamen en het minimale detectieniveau niet haalden. Ook kan worden gespeculeerd dat de iNKT cellen toegediend in de staart ader misschien niet in de lymfeklieren. Daarom veronderstellen we dat de ontwikkeling en differentiatie van iNKT-cellen in de thymus kan worden gereguleerd door middel van cytokinetrajecten na adoptieve infusie in de muizen. Dit moet verder worden opgehelderd.
GPI is aanwezig in het serum en synoviale vloeistof van de meeste RA-patiënten en is een veelgebruikte test voor klinische RA-diagnose27. Bruns et al.28 gebruiktpeptiden van verschillende lengtes van de GPI-sequentie en geïmmuniseerd de DBA / 1 muizen om zes immunodominante T-cel epitopen te identificeren. Daarvan waren er drie arthritogeen. De peptiden met >95% incidentie van artritis zijn hGPI 325-339 en hGPI469-483. Onze eerdere studies toonden aan dat het gebruik van een mengsel van de twee peptiden om een RA-model vast te stellen beter is dan een enkel peptide. In de resulterende RA-modellen begonnen de tenen en gewrichten van de muizen rood te lijken op dag 6 en bereikten een piek van ontsteking op dag 14. De inflammatoire celinfiltratie ging gepaard met weefselhyperplasie in het synoviale weefsel van de gewrichten, en de inflammatoire celinfiltratie was het ernstigst op dag 14. Het aantal iNKT-cellen werd aanzienlijk verminderd in de thymus op het hoogtepunt van ontsteking, wat in overeenstemming was met de trend van iNKT-cellen bij RA-patiënten29. Verdere detectie van iNKT celsubsets toonde aan dat de frequentie van iNKT1 en iNKT17 in de thymus steeg en de frequentie van iNKT2 afnam tijdens de progressie van ontsteking (dag 11). Bovendien, de niveaus van serum cytokines IFN-γ en IL-17A steeg tijdens de progressie (dag 11) en de piek van ontsteking (dag 14), wat wijst op een soortgelijke polarisatie van de Th1 en Th17 subgroepen in RA model muizen30. Daarom vertoonde het RA-muismodel veroorzaakt door hGPI325-339 en hGPI469-483 gemengde polypeptidefragmenten de kenmerken van CD4+ T-celhyperproliferatie en iNKT-celdefecten, die vergelijkbaar waren met die van de RA-patiënten, en konden worden gebruikt als een ideaal diermodel voor het onderzoeken van de immuniteit van de RA-cellen. Deze resultaten waren in overeenstemming met die van onze vorige studies en toonden de stabiliteit aan van het door hGPIs geïnduceerde RA-model31.
In het algemeen kan het RA-muismodel dat wordt geïnduceerd door de gemengde G6PI-peptiden de veranderingen in CD4+ T-cellen, iNKT-cellen en gerelateerde cytokinen bij RA-patiënten simuleren. Dit biedt een goed model voor diepgaand onderzoek van RA. Achtereenvolgens werd iNKT (voornamelijk iNKT2) veroorzaakt door intraperitoneale injectie van α-GalCer en gezuiverd in vitro gebruikt bij de behandeling van RA. Het kan de immuunonbalans die wordt veroorzaakt door abnormale proliferatie van Th-subgroepen corrigeren, de progressie van RA verlichten en in de toekomst nieuwe methoden bieden voor de klinische behandeling van RA.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
De auteurs verklaren geen financiering of belangenconflicten.
Acknowledgments
Onze studie werd ondersteund door de National Natural Science Foundation of China (NSFC) (81771755), Hogescholen en wetenschap en technologie van de universiteit belangrijk onderzoeksproject van de provincie Hebei (ZD2017009) en het Animal Lab of Medical Experiment Center, Hebei University. We zijn dankbaar voor hun steun.
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 647 Mouse Anti-PLZF | BD | 563490 | America |
| Anti-PE MicroBeads | Miltenyi | 130-048-801 | Germany |
| Columns | Miltenyi | MS | Germany |
| Cryogenic Centrifuge | Beckman | Allegra® X-15R | America |
| DiR | Thermo Fisher Scientific | D12731 | America |
| Embedding Center | Tianjin Aviation Electromechanical Co., Ltd. | BMJ-1 | China |
| FITC Hamster Anti-Mouse TCR β Chain | BD | 553170 | America |
| Flow cytometer | BD | Accuri C6 | America |
| Freund's complete adjuvant | Sigma | F5881 | America |
| hGPI325-339 (IWYINCFGCETHAML) | Karebay Biochem | 18062202 | China |
| hGPI469-483 (EGNRPTNSIVFTKLT) | Karebay Biochem | 18062203 | China |
| In Vivo Imaging System | PerkinElmer | caliper IVIS lumina II | America |
| Ionomycin Calcium | Cayman | 10004974 | America |
| KRN7000 | AdipoGen | AG-CN2-0013 | America |
| Mouse CD1d Tetramer-PE | MBL | TS-MCD-1 | Japan |
| Mouse percoll | Solarbio | P8620 | China |
| Optical Microscope | Olympus | Olympus-II | Japan |
| PerCP-CyTM5.5 Mouse anti-ROR-ϒt | BD | 562683 | America |
| PerCP-CyTM5.5 Mouse anti-T-bet | BD | 561316 | America |
| Pertussis toxin | Sigma | P7208 | America |
| phorbol esters | Cayman | 10008014 | America |
| Red Blood Cell Lysis Buffer | BD | 555899 | America |
| RPMI-1640 | Biological Industries | 01-100-1ACS | Israel |
| Th1/Th2/Th17 cytokines kit | BD | 560485 | America |
| Ultramicrotome | Leica | Leica EM UC6 | Germany |
References
- Tobón, G. J., Youinou, P., Saraux, A. The environment, geo-epidemiology, and autoimmune disease: Rheumatoid arthritis. Autoimmunity Reviews. 35 (1), 0-14 (2010).
- Cross, M., et al. The global burden of rheumatoid arthritis: estimates from the Global Burden of Disease 2010 study. Annals of the Rheumatic Diseases. 73 (7), 1316-1322 (2014).
- Kanashiro, A., Bassi, G. S., Queiróz Cunha, F. D., Ulloa, L. From neuroimunomodulation to bioelectronic treatment of rheumatoid arthritis. Bioelectronics in Medicine. 1 (2), 151-165 (2018).
- Brennan, P. J., Brigl, M., Brenner, M. B. Invariant natural killer T cells: an innate activation scheme linked to diverse effector functions. Nature Reviews Immunology. 13 (2), 101-117 (2013).
- Bianca, B. S. Unraveling Natural Killer T-Cells Development. Frontiers in Immunology. 8, 1950 (2018).
- Mitsuo, A., et al. Decreased CD161+CD8+ T cells in the peripheral blood of patients suffering from rheumatic diseases. Rheumatology. 45 (12), 1477-1484 (2006).
- Miellot, A., et al. Activation of invariant NK T cells protects against experimental rheumatoid arthritis by an IL-10-dependent pathway. European Journal of Immunology. 35 (12), 3704-3713 (2005).
- Miellot-Gafsou, A., et al. Early activation of invariant natural killer T cells in a rheumatoid arthritis model and application to disease treatment. Immunology. 130 (2), 296-306 (2010).
- Tudhope, S. J., Delwig, A. V., Falconer, J., Pratt, A., Ng, W. F. Profound invariant natural killer t-cell deficiency in inflammatory arthritis. Annals of the Rheumatic Diseases. 69 (10), 1873-1879 (2010).
- Ming, M., et al. Effects on immunoregulation of iNKT cells in RA by novel synthetic immunostimulator CH1b. Chinese Journal of Immunology. 32 (02), 218-222 (2016).
- Ming, M., et al. Study of the correlation between the percentage of iNKT cells and the ratio of IFN-γ/IL-4 in patients with rheumatoid arthritis. Chinese Journal of Microbiology Immunology. 35 (3), 213-218 (2015).
- Sharif, S., et al. Activation of natural killer T cells by α-galactosylceramide treatment prevents the onset and recurrence of autoimmune Type 1 diabetes. Nature Medicine. 7, 1057-1062 (2010).
- Gapin, L. Development of invariant natural killer T cells. Current Opinion in Immunology. 39, 68-74 (2016).
- Kwon, D. I., Lee, Y. J. Lineage Differentiation Program of Invariant Natural Killer T Cells. Immune Network. 17 (6), (2017).
- Thapa, P., et al. The differentiation of ROR-γt expressing iNKT17 cells is orchestrated by Runx1. Scientific Reports. 7 (1), 7018 (2017).
- Schurgers, E., Billiau, A., Matthys, P. Collagen-induced arthritis as an animal model for rheumatoid arthritis: focuson interferon-γ. Interferon Cytokine Research. 31 (12), 917-926 (2011).
- Van Haalen, H. G. M., Severens, J. L., Tran-Duy, A., Boonen, A. How cost-effectiveness A systematic review and stepwise approach for selecting a transferable health economic evaluation rheumatoid arthritis. Pharmacoeconomics. 32 (5), 429-442 (2014).
- Schubert, D., Maier, B., Morawietz, L., Krenn, V., Kamradt, T. Immunization with glucose-6-phosphate isomerase induces T cell-dependent peripheral polyarthritis in genetically unaltered mice. Journal of Immunology. 172, 4503-4509 (2004).
- Bockermann, R., Schubert, D., Kamradt, T., Holmdahl, R. Induction of a B-cell-dependent chronic arthritis with glucose-6-phosphate isomerase. Arthritis Research, Therapy. 7, 131613-131624 (2005).
- Kamradt, T., Schubert, D. The role and clinical implications of G6PI in experimental models of rheumatoid arthritis. Arthritis Research, Therapy. 7, 20-28 (2005).
- Horikoshi, M., et al. Activation of Invariant NKT Cells with Glycolipid Ligand α-Galactosylceramide Ameliorates Glucose-6-Phosphate Isomerase Peptide-Induced Arthritis. PlosOne. 7 (12), 51215 (2012).
- Zhang, X. J., et al. Immunization with mixed peptides derived from glucose-6-phosphate isomerase induces rheumatoid arthritis in DBA /1 mice. Chinese Journal of Pathophysiology. 32 (3), 569-576 (2016).
- Motohashi, S., Nakayama, T. Invariant natural killer T cell-based immunotherapy for cancer. Immunotherapy. 1 (1), 73 (2017).
- Jung, S., et al. The requirement of natural killer T-cells in tolerogenic APCs-mediated suppression of collagen-induced arthritis. Experimental and Molecular Medicine. 42 (8), 547-554 (2010).
- Luc, V. K., Lan, W. Therapeutic Potential of Invariant Natural Killer T Cells in Autoimmunity. Frontiers in Immunology. 9, 519-526 (2018).
- Chiba, A., et al. Suppression of collagen-induced arthritis by natural killer T cell activation with OCH, a sphingosine-truncated analog of α-galactosylceramide. Arthritis, Rheumatism. 50 (1), 305-313 (2004).
- Tudhope, S. J., Delwig, A. V., Falconer, J., Pratt, A., Ng, W. F. Profound invariant natural killer t-cell deficiency in inflammatory arthritis. Annals of the Rheumatic Diseases. 69 (10), 1873-1879 (2010).
- Bruns, L., et al. Immunization with an immunodominant self-peptide derived from glucose-6-phosphate isomerase induces arthritis in DBA/1 mice. Arthritis Research, Therapy. 11 (4), (2009).
- Parietti, V., et al. Rituximab treatment overcomes reduction of regulatory iNKT cells in patients with rheumatoid arthritis. Clinical Immunology. 134 (3), 331-339 (2010).
- Yoshida, Y., et al. Functional mechanism(s) of the inhibition of disease progression by combination treatment with fingolimod plus pathogenic antigen in a glucose-6-phosphate isomerase peptide-induced arthritis mouse model. Biological, Pharmaceutical Bulletin. 38 (8), 1120-1125 (2015).
- Chen, D., et al. Study of the adoptive immunotherapy on rheumatoid arthritis with Thymus-derived invariant natural killer T cells. International Immunopharmacology. 67, 427-440 (2019).



