ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Neuron-glial-interaksjonene i nevrodegenerasjon er ikke godt forstått på grunn av utilstrekkelige verktøy og metoder. Her beskriver vi optimaliserte protokoller for å oppnå induserte nevroner, oligodendrocytter forløperceller og oligodendrocytter fra humane pluripotente stamceller og gir eksempler på verdiene av disse metodene for å forstå celletypespesifikke bidrag i Alzheimers sykdom.
Abstract
Ved Alzheimers sykdom (AD) og andre nevrodegenerative lidelser er oligodendroglial svikt et vanlig tidlig patologisk trekk, men hvordan det bidrar til sykdomsutvikling og progresjon, spesielt i hjernens grå substans, forblir stort sett ukjent. Dysfunksjonen av oligodendrocytter er preget av mangler i myelinisering og nedsatt selvfornyelse av oligodendrocytter forløperceller (OPC). Disse to feilene skyldes i det minste delvis forstyrrelsen av interaksjoner mellom nevron og oligodendrocytter langs oppbyggingen av patologi. OPC gir myeliniserende oligodendrocytter under CNS-utvikling. I den modne hjernebarken er OPCs de viktigste proliferative cellene (som består av ~ 5% av totale hjerneceller) og kontrollerer ny myelindannelse på en nevral aktivitetsavhengig måte. Slike neuron-til-oligodendrococyte-kommunikasjoner er betydelig understudert, spesielt i sammenheng med neurodegenerative tilstander som AD, på grunn av mangel på passende verktøy. I de senere år har vår gruppe og andre gjort betydelige fremskritt for å forbedre tilgjengelige protokoller for å generere funksjonelle nevroner og oligodendrocytter individuelt fra humane pluripotente stamceller. I dette manuskriptet beskriver vi våre optimaliserte prosedyrer, inkludert etablering av et samkultursystem for å modellere nevron-oligodendrocytterforbindelsene. Våre illustrerende resultater tyder på et uventet bidrag fra OPC / oligodendrocytter til hjerneamyloidose og synapseintegritet og fremhever nytten av denne metoden for AD-forskning. Denne reduksjonistiske tilnærmingen er et kraftig verktøy for å dissekere de spesifikke heterocellulære interaksjonene ut av den iboende kompleksiteten i hjernen. Protokollene vi beskriver her forventes å lette fremtidige studier på oligodendrogliale defekter i patogenesen av nevrodegenerasjon.
Introduction
Oligodendrocytter avstamningsceller - inkludert oligodendrocytter forløperceller (OPC), myeliniserende oligodendrocytter og overgangstyper i mellom - utgjør en stor gruppe humane hjerneceller1 som aktivt deltar i mange kritiske funksjoner for riktig drift og vedlikehold av sentralnervesystemet gjennom nevral utvikling og aldring 2,3,4 . Mens oligodendrocytter er kjent for å produsere myelin for å lette nevronaktivitetsoverføring og støtte aksonal helse i hvit substans, er OPCs rikelig (~ 5%) i grå substans hvor myelinisering er knapp og utfører aktivitetsavhengige signalfunksjoner for å styre læringsadferd og minnedannelse 5,6,7,8 . Hvordan oligodendrogliale celler fungerer og dysfunksjon i patogenesen av Alzheimers sykdom (AD) og andre aldersassosierte nevrodegenerative tilstander har blitt studert9. Utilstrekkeligheten til et passende modellsystem og mangler i generell kunnskap for å lede en eksperimentell vei fremover er de viktigste årsakene til dette gapet.
I lys av de siste gjennombruddene i å utlede menneskelige hjerneceller fra pluripotente stamceller, inkludert embryonale stamceller (ES) og induserte pluripotente stamceller (iPS), har slike cellulære modeller i forbindelse med moderne genredigeringsverktøy dukket opp som robuste verktøy for å håndtere den intrikate sammenhengen mellom cellulære interaksjoner i hjernen, og er i stand til å demonstrere menneskespesifikke sykdomsmanifestasjoner10, 11. Med tanke på at individuelle hjernecelletyper kan utvise forskjellige og til og med motstridende effekter i møte med de samme AD-fremmende forholdene12,13, tilbyr denne stamcellemetodikken unikt celletypespesifikk informasjon som tidligere har blitt savnet ved hjelp av etablerte in vivo- eller in vitro-modeller som bare gir samlede avlesninger fra samlinger av hjernecelletyper. I løpet av det siste tiåret har et stort antall pålitelige protokoller blitt utviklet for å generere humane nevroner fra transdifferensiering av ES / iPS-celler eller direkte konvertering fra andre terminalt differensierte celletyper (f.eks. fibroblaster) 14,15. Spesielt kan anvendelsen av viktige nevrogene transkripsjonsfaktorer (f.eks. Neurogenin 2, Ngn2)16 til humane pluripotente stamceller generere en homogen populasjon av godt karakteriserte nevroncelletyper for rene kulturer uten behov for kokulturering med gliaceller12,17,18. For induserte humane oligodendrocytter er det noen få publiserte protokoller som kan generere funksjonelle celler som ligner deres primære kolleger, med et bredt spekter av effektivitet og etterspørsel i tid og ressurser 19,20,21,22,23,24,25,26,27,28 . Til dags dato har ingen av disse protokollene blitt brukt til å undersøke hvordan oligodendrogliale celler reagerer på og påvirker AD-patogenesen.
Her beskriver vi våre forbedrede protokoller for enkle og blandede kulturer av humaninduserte nevroner (iNs) og OPC / oligodendrocytter (iOPCs / iOLs). iN-protokollen beskrevet her er basert på den mye brukte Ngn2-tilnærmingen16, og har den ekstra funksjonen å være gliafri. De resulterende iN-ene er homogene og ligner sterkt på de kortikale lag 2/3 eksitatoriske nevronene, med karakteristisk pyramidemorfologi, genuttrykksmønster og elektrofysiologiske trekk17,18 (figur 1). For å overvinne noen av de grunnleggende barrierene i rettet differensiering av pluripotente stamceller, har vi utviklet en enkel og effektiv metode for lavdose dimetylsulfoksid (DMSO) forbehandling29,30, og rapportert en forbedret tilbøyelighet til humane ES / iPS-celler til å transdifferensiere til iOPCs og iOLs31, basert på en bredt tilpasset protokoll av Douvaras og Fossati 32 . Vi har ytterligere forenklet protokollen og innlemmet en robust differensieringsfremmende forbindelse, clemastine 7,33,34, for å akselerere prosessen med oligodendroglial modning. Som et resultat (figur 2) kan iOPCs genereres på 2 uker (~ 95% positive for markøren O4) og iOLs om fire uker (uttrykker modne markører MBP og PLP1). Interessant nok fant vi at iOPCs alene utskiller en bemerkelsesverdig mengde amyloid-β (Aβ), i samsvar med de uavhengige transkriptomiske dataene som viser rikelig ekspresjon av amyloidforløperproteinet (APP) og behandlingsproteasen β-sekretase (BACE1) i oligodendrococyttlinjeceller35,36. Videre fremmer vårt iN-iOPC-kokultursystem ensheathing av aksoner ved MBP-positive iOL-prosesser og gir betydelig støtte til synapsedannelse (figur 3). Dermed har protokollene vi har beskrevet nedenfor tekniske og biologiske fordeler i forhold til tidligere katalogiserte neuron-oligodendroglia co-culturing metoder, og holder et løfte om bedre modellering av nevrodegenerasjonen i AD.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Human neuron induksjon fra humane pluripotente stamceller
- Lentivirus forberedelse (~ 5 dager, detaljert protokoll som beskrevet tidligere16)
- Plate ~ 1 million HEK293T-celler hver T75-kolbe, for å ha dem ~ 40% sammenflytende når de utfører transfeksjon. Transfekter dem med plasmider som uttrykker tetracyklininduserbart Ngn2 og puromycinresistent gen (PuroR; under samme TetO-promotorkontroll), rtTA og de tre hjelperplasmidene pRSV-REV, pMDLg / pRRE og VSV-G (12 μg lentiviralt vektor-DNA og 6 μg av hvert av hjelpeplasmid-DNA). Forbered minst tre kolber per lentiviruspreparat. Bruk PEI til transfeksjon etter produsentens instruksjon. Bytt media etter 16 timer og kast.
- Harvest utgitt virale partikler ved å samle kulturmedier hver dag og erstatte med friske medier i 3 dager. Pool de oppsamlede mediene som inneholder virale partikler for rensing. Filtrer viruset gjennom et 0,22 μm filter og sentrifuge ved 49 000 x g i 90 minutter. Resuspender pelleten i riktig volum PBS-glukose (~150 μL).
- Neuron induksjon (~ 5 dager)
MERK: Denne induksjonsprotokollen (figur 1A; flytskjema) er svært effektiv for både iPS- og ES-celler med validert pluripotens (som kan analyseres ved immunhistokjemifarging av godt karakteriserte pluripotensmarkører; Figur 1B).- Bruk kommersielt tilgjengelige H1 humane ES-celler ved passering av 52 (se materialtabell). Dyrk cellene på ekstracellulær matriksløsning belagt 6-brønnsplater (~ 0,5 mg matriksløsning per 6-brønnsplate; se Materialtabell) ved hjelp av ES-cellevedlikeholdsmedium (se Materialtabell) og inkuber platene ved 37 ° C med 5% CO2.
- På dag -2 løsner ES-celler (80% sammenløp) med 1 ml celleoppløsningsløsning (se materialtabell) og inkuberer ved romtemperatur i 10 minutter. Overfør cellene til et rør; vask brønnen med 2 ml media og kombiner i samme rør. Sentrifuge ved 300 x g i 5 minutter, resuspender pelleten i media og plate cellene på matriksbelagte 6-brønnsplater ved såtetthet på 1 x 105 celler per brønn.
- På dag -1, tilsett lentivirus som uttrykker Ngn2 pluss PuroR og rtTA sammen med polybren (8 μg / ml) til ES-cellene i ferskt ES-cellevedlikeholdsmedium (se materialtabell). Den nøyaktige mengden virus bør bestemmes av faktiske titere eller titrering. Vi tilsetter vanligvis 5 μL hvert virus per brønn i en 6-brønns plate.
- På dag 0, legg til Doxycycline (2 μg / ml, for å aktivere Ngn2 uttrykk) i DMEM-F12 medium med N2 supplement uten morfogener.
- På dag 1, tilsett puromycin i ferskt medium av DMEM-F12 pluss N2 og doksycyklin, til den endelige konsentrasjonen på 1 μg / ml medium. Velg de transduserte cellene i Puromycin i minst 24 timer. Høyere puromycinkonsentrasjon (opptil 5 μg/ml) og lengre seleksjonsperiode (opptil 48 timer) kan være nødvendig for å fjerne de undertransduserte cellene tilstrekkelig hvis virustiteren er lav.
- På dag 2, løsne differensierende nevroner med celleoppløsningsløsning (se Materialtabell), og re-plate dem på 24-brønnsplater (mellom 80.000-200.000 celler / brønn) belagt med matriseløsning (se Materialtabell), og vedlikehold dem i NBA / B27 medium uten doxycyklin. Såtettheten er kritisk.
- På dette stadiet kan frittliggende nevroner fryses i spesialisert kommersielt frysemedium (se Materialtabell) og lagres i flytende nitrogen i opptil 3 måneder. Rene nevroner kan belegges med tanke på den typiske ~ 15% -20% celledød etter tining, dyrket alene eller kokulturert med andre hjernecelletyper (se trinn 3.2.3. for samdyrking med OPCs).
- Kultur ren iNs på platene belagt med ekstracellulære matrisebaserte løsninger som instruert av produsenten (se Tabell over materialer). Den karakteristiske pyramidemorfologien skal være tydelig innen dag 4 (og dag 6; Figur 1C). Synapseformasjonen kan påvises så tidlig som dag 14 til 16 og er fremtredende ved dag 24 ved immunhistokjemisk farging med standard pre- og postsynaptiske markører. (Figur 1D; merket med den presynaptiske markøren Synapsin 1 og den dendrittiske markøren Map2).
2. Humant oligodendrococyttforløpercelle (OPCs) induksjon fra pluripotente stamceller og oligodendrocyttermodning
- Neural Progenitor Cell (NPC) generasjon: monolagsprotokoll (~ 7 dager). Se figur 2A for flytskjemaet.
- Kultur H1 humane ES-celler som beskrevet tidligere (se trinn 1.2.1.) og transdifferensierer dem til nevrale stamceller (NPC) ved en etablert tilnærming kalt dual SMADi, med små molekylhemmere for flere signalveier. Her bruker vi et allment akseptert kommersielt sett og følger monolagsprotokollen levert av produsenten (se Materialfortegnelse).
- På dag -1, plate 0,5-1 x 10 6 celler per brønn i en 6-brønns plate belagt av en vekstfaktor redusert matriksløsning (se Materialtabell; ~ 0,5 mg matriksløsning per 6-brønns plate) med ES-cellevedlikeholdsmedium (se Materialtabell). Denne vekstfaktorreduserte matriseløsningen brukes til å belegge alle platene som skal brukes i de følgende trinnene.
- På dag 0, behandle celler i 24 timer med ES-celle vedlikeholdsmedium (se Materialtabell) supplert med 2% DMSO.
- På dag 1–6 bytter du ut hele mediet med et varmt (37 °C) nevralt induksjonsmedium som inneholder SMAD-hemmerne fra det kommersielle settet (se materialfortegnelse). Hvis cellene deler seg og når sammenløp før dag 7, skal de gå over til såtettheten på 0,5–1 x 106, som beskrevet tidligere i trinn 2.1.2.
- På dag 7 passerer NPC-er ved hjelp av celleoppløsningsløsning (se materialtabell) og plate med en såtetthet på 1-2 x 105 celler / brønn av en 24-brønnsplate.
- Analyser differensieringseffektiviteten ved immunhistokjemisk (IHC) farging for fravær av pluripotensmarkør, OCT4 for eksempel, og tilstedeværelse av NPC-markører som PAX6, Nestin og Sox1.
- På dette stadiet kan frittliggende NPC-er fryses i det spesialiserte kommersielle NPC-frysemediet (se Materialtabell) og lagres i flytende nitrogen i opptil 3 måneder. Etter frysing og tining for en gangs skyld beholder NPC-er fortsatt multipotensen for å gi opphav til nevroner, astrocytter og OPC-er med pålitelige protokoller.
- Oligodendrocytt forløpercelle (OPC) generasjon (~ 7 dager). Se figur 2A for flytskjemaet.
- På dag 7, passasje NPC-er ved hjelp av celleoppløsningsløsning (se Materialtabell) og plate dem med en såtetthet på 1-2 x 105 celler per brønn i en 24-brønnsplate i varmt (37 ° C) nevralt induksjonsmedium pluss SMAD-hemmere fra det kommersielle settet (se Materialtabell).
- På dag 8, lag en løsning av 1% DMSO i OPC-differensieringsmediet og behandle de belagte NPC-ene i 24 timer. OPC-differensieringsmediet består av: DMEM/F12 medium, 1% N2 supplement, 1% B27 supplement, bFGF ved 20 ng/mL, SAG ved 1 μM, PDGF-AA ved 10 ng/ml (se materialtabell).
- På dag 9, erstatt media med ferskt OPC-differensieringsmedium uten DMSO. Fôr cellene annenhver dag frem til dag 15. Hvis cellene når sammenløp før dag 15, passerer dem til såtettheten på 1-2 x 105 celler per brønn som beskrevet i trinn 2.2.1.
- På dag 14, plate OPC i OPC differensieringsmedium med en tetthet på 1-2 x 105 celler / brønn i en 24-brønns plate.
- På dette stadiet (dag 15), test celler for tilstedeværelse av OPC-spesifikke markører ved IHC-farging eller qPCR (f.eks. O4, Olig1/2, CSPG4/Ng2, NKX2.2, PDGFRa; Figur 2B) og for fravær av NPC-markører (Pax6 eller Nestin; Figur 2D). Vi påviser typisk O4-immunreaktiviteten i mer enn 95 % av cellene ved dag 15. Av særlig relevans for Alzheimers sykdom er uttrykket av APP (amyloid forløperprotein), BACE1 (behandlingsprotease β-secreatase 1) og peptidamyloid-β (Aβ) rikelig i OPC (figur 2F).
- Oligodendrocytter (OL) modning (~7–20 dager)
- På dag 15, erstatt media med OL modningsmedium: Neurobasal-A medium, 2% B27 supplement, 1 μM cAMP, 200 ng / ml T3 triiodothyronin og Clemastine på 1 μM (se Tabell over materialer). Bytt medium annenhver dag eller hver dag, om nødvendig.
- Når celler når 90% sammenløp, splittes ved et 1: 3-forhold opptil 2 passasjer eller til celledelingen bremser betydelig. Hvis OPCs deler seg for fort og når sammenløp på mindre enn 3 dager, tilsett Ara-C (se materialtabell) i en konsentrasjon på 2-5 μM i 1-3 dager. Aktiv spredning indikerer redusert modningseffektivitet.
- Undersøk effektiviteten av oligodendroglial modning ved å vurdere uttrykket av OL-markører, for eksempel CLDN11, PLP1, MBP ved qPCR, IHC-farging eller immunoblotting. Den karakteristiske morfologien til svært komplekse strukturer (figur 2C) og uttrykket av OL-markører (figur 2E) bør lett oppdages innen dag 28.
3. Kodyrking av humaninduserte nevroner (iNs) og oligodendrocytter forløperceller (iOPCs)
- iOPC-plating (~ 3 dager)
- Plate iOPCs på dag 14 med en tetthet på 1 x 105 celler per brønn i en 24-brønns plate (som beskrevet ovenfor i trinn 2.2.4.) i OPC-differensieringsmedium (som beskrevet i trinn 2.2.2.).
- iN-iOPC samkultur satt opp
- På dag 15 løsner du de induserte humane nevronene på trinnet i dag 2 etter Puromycin-seleksjonen (som beskrevet i trinn 1.2.6.) med celleoppløsningsløsning (se Materialtabell).
- Legg nevroner på de dyrkede OPC-ene, plating ved såtettheten på 2 x 105 celler per brønn i 24-brønnsplaten med voksende OPCer (fra trinn 3.1.1). Bruk kokulturmediet som inneholder Neurobasal-A-medium, 2% B27-tilskudd og 100 ng / ml T3 triiodothyronin. Bytt medium neste dag og deretter annenhver dag etterpå. Hvis OPC sprer seg for fort og når sammenløp på mindre enn 3 dager, tilsett Ara-C i en konsentrasjon på 2-5 μM. Et representativt bilde av iNs og iOPCs dyrket i samkultur etter 7 dager nevroner er vist i figur 3A.
- Bruk frosne nevroner tilberedt som beskrevet ovenfor i trinn 1.2.7 for samdyrking med OPC. Plate fryse-og-tine nevroner med en høyere tetthet på 3 x 105 celler per brønn.
- Etter dag 14-16 i kokulturer kan synapseformasjonen i iNs observeres ved IHC-farging av pre- og postsynaptiske markører, og ved dag 21 bør den synaptiske puncta være rikelig (figur 3C) og nevronale aktiviteter kan registreres pålitelig.
- Fra og med dag 21 tester du celler for OL-spesifikke markører (for eksempel MBP og PLP1). Ved dag 28 observerer vi normalt fenomenet ensheathing av iN-aksoner ved iOL-prosesser, merket med IHC-farging for spesifikke markører (figur 3B; neurofilament NF for iN-aksoner og MBP for iOPC-prosesser).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Direkte generering av menneskeskapte nevroner fra humane pluripotente stamceller
Det er svært viktig at de begynnende humane pluripotente stamcellene utviser en høy grad av pluripotens for vellykket generering av iNs eller iOPCs / iOLs. Derfor bør celler farges for spesifikke markører, for eksempel Oct4 og SOX2, før du starter en av induksjonsprotokollene beskrevet i dette manuskriptet (figur 1A). Humane H1-celler ble brukt til å oppnå induserte eksitatoriske forhjerneneuroner etter den tidligere publiserte protokollen av Zhang et al. med noen modifikasjoner (figur 1C) 12,16,17,18. Her presenterer vi en protokoll der iNs på dag 2 re-belagt i ren kultur på matriseløsning (se Materialtabell), i fravær av noe materlag: glia eller fibroblaster. I tillegg til de tidligere publiserte protokollene observerer vi at frysing av iNs på dag 2 ikke påvirker cellens levedyktighet signifikant (~ 15% -20% celledød etter tining). Rene nevroner i kultur vil begynne å uttrykke synapsin1 på dag 14–16 (figur 1D). Etablering av en ren nevronkultur er svært viktig fordi visse faktorer, for eksempel den ledende AD-risikofaktoren ApoE, kan uttrykkes av celler i materlaget, og dette kan forvirre resultatene betydelig.
iOPC-generering og iOL-modning forbedres ved DMSO-behandling
Her presenterer vi en rask og effektiv protokoll som muliggjør generering av iOPC på 2 uker og modne iOL-er på 4–5 uker (figur 2A). Vi utnyttet metoden for forbigående DMSO-behandling vi tidligere utviklet for å øke differensieringseffektiviteten for ES- og iPS-celler 29,30,31. DMSO-behandling beriker antall celler i den tidlige G1-fasen for bedre signalintegrasjon, og favoriserer differensiering. Vi utførte den første behandlingen før vi induserte humane ES-celler til å generere NPC, og den andre behandlingen før vi differensierte NPCer i iOPCs. Vi kan oppdage spesifikke OPC-markører (Olig2, CSPG4, NKX2.2 og PDGFRA) så tidlig som 2 uker etter plating av ES H1-celler (figur 2B, E). IOPC-populasjonen på dette stadiet er ganske homogen, med >95% av cellene positive for O4-farging og et høyt nivå av immunreaktivitet for andre markører (figur 2B). Etter starten av OL-modning på dag 15, kan vi typisk oppdage spesifikke OL-markører (MBP, O1, CLDN11 og PLP1) som starter på dag 28 (figur 2C, E). Uttrykket av disse stadiumspesifikke markørene korrelerer med utviklingsforløpet til oligodendrogliale celler og antyder et akselerert tempo, med NPC-markørene som gradvis går ned, OPC-markører som topper seg rundt den andre uken, og OL-markører som øker innen den tredje uken (figur 2D, E) 37. Vær oppmerksom på at denne modningsprosessen diversifiserer cellepopulasjonene. Underpopulasjonene i kontinuum, som består av flere mellomstadier mellom OPC og modne myeliniserende oligodendrocytter, kan være til stede og utgjøre varierende prosentandel av totale celler, med mer modne celler som dominerer på et senere tidspunkt.
Til sammenligning kjøpte vi de svært refererte iOPC-ene, og modnet dem i iOL etter produsentprotokollen. Vi testet uttrykket av markørene nevnt ovenfor i både våre iOPC- og iOL-preparater, og i cellene vi kjøpte. Vi bestemte oss for at cellene som ble generert etter protokollen vår, hadde høyere uttrykk for alle genene som ble testet (figur 2E). Interessant, da vi testet de utskilte nivåene av to store isoformer av amyloid-β (Aβ40 og Aβ42) i iNs versus iOPCs, la vi merke til at iOPCs utskilte flere av begge fragmentene, men forholdet forble det samme (figur 2F).
Co-dyrking av iNs og iOPCs
Denne protokollen er optimalisert spesielt for samdyrking av iNs og iOPCs og tillater vår sanntidsovervåking av den intercellulære kommunikasjonen mellom disse to celletypene i løpet av nevral utvikling. Den ideelle pletteringstettheten for begge celletyper må avgjøres med en serie cellenummertitrering for å oppnå riktig differensiering (figur 3A). Etter 4 uker i kokulturer forventes iOPCene å være tilstrekkelig differensiert til OL-er som er positive for spesifikke markører som MBP og utvider prosesser til ensheath-aksoner (figur 3B). Kokultursystemet kan robust øke antall synapser, noe som indikerer at iOPCs gir en nevronstøtte gjennom fysiske kontakter eller frigjøring av trofiske faktorer (figur 3C). Vi kan opprettholde samkulturene i akseptabel helsetilstand i opptil 6 uker og observere at synapsetallet og andre nevronale attributter platåer rundt den femte uken. Det er verdt å merke seg at astrocytter og mikroglia ikke er til stede i våre preparater, og deres fravær kan dokumenteres ved å sjekke uttrykket av spesifikke markører (figur 3D). iOPCs uttrykker et stort antall godt karakteriserte gener som potensielt kan reagere på og formidle de aktivitetsavhengige signalene fra nærliggende nevroner, i en parakrin (f.eks. nevrotrofiner og metabolitter) og / eller en synaptisk måte (figur 3E og 3F).

Figur 1: Direkte generering av humaninduserte nevroner (iNs) fra hPSCs. (A) Flytskjema for iN-generasjon. (B) Representative lysfelt- og immunfluorescensbilder av startkulturen til humane pluripotente stamceller (H1) for å bekrefte pluripotensen. Oktober 4 er vist i rødt og Sox2 i grønt. (C) Representative lysfeltbilder av iNs på dag 4 og dag 6. (D) Den karakteristiske morfologien for dendritisk arborisering og synapse puncta i iNs dyrket i ren kultur i 24 dager og farget av immunfluorescensfarging for dendritisk markør Map2 og presynaptisk markør Synapsin 1 (Syn1). Klikk her for å se en større versjon av dette tallet.

Figur 2: iOPC-generering og iOL-modning. (A) Flytskjema for iOPC- og iOL-generering. (B) Representative lysfelt- og immunfluorescensbilder av iOPCs på dag 15. Olig2 (pan-oligodendroglia markør) er vist i grønt, O4 (OPC markør) i rødt, og DAPI i blått. Bildet viste at >95% av iOPCs er positive for O4 og 25% for Olig2. (C) Representative lysfelt- og immunfluorescensbilder av iOLs på dag 28. MBP vises i grønt, O1 i rødt og DAPI i blått. (D) Uttrykket av NPC-markøren PAX6 avtar dramatisk i iOPCs på dag 14 og senkes ytterligere til bakgrunnen i OLs på dag 28, noe som indikerer en robust NPC-transdifferensiering og et høyt nivå av homogenitet i iOPC-populasjonen. (E) Tidsforløpsuttrykksprofilen til vanlige OPC- og OL-markørgener i kulturer generert av den beskrevne protokollen, uten (-DMSO) eller med (+DMSO) trinnet for DMSO-inkubasjon (trinn 2.1.3 og 2.2.2), analysert på forskjellige tidspunkter. Til sammenligning ble kommersielle iOPC-er (se materialfortegnelse) modnet i henhold til produsentens instruksjoner, og både iOPCs (iOPC-Tempo) eller iOLs (iOL-Tempo) ble testet for de samme markørene. Som forventet ble MBP (en moden oligodendrococyttmarkør) ikke påvist (N.D.) i de tidlige stadiene av differensiering i alle iOPCene som ble testet. DMSO forbedret effektiviteten av OPC-differensiering og OL-modning betydelig. (F) Produksjon og sekresjon av Aβ40 og Aβ42 i rene iN- og iOPCs-kulturer, målt ved kommersielle ELISA-sett (se Materialtabell) på supernatant oppnådd fra rene iN- og iOPCs-kulturer både på dag 15 og normalisert ved celletall (begge ved tetthet på 200 000 celler per brønn i en 24-brønnplate). Klikk her for å se en større versjon av dette tallet.
Data i søylediagrammer plottes som gjennomsnitt ± SEM (n ≥ 3). Statistisk signifikans ble evaluert av Student t-test (*, p < 0,05; ***, p < 0,001); i (D), sammenlignet med NPC; i (E), sammenlignet med kontrollen iOPC-Tempo; i (F), sammenlignet med iN.

Figur 3: Samkultur av iNs og iOPCs. (A) Representativt lysfeltbilde av samkulturerte iNs og iOPCs på dag 7, som viser en riktig tetthet for videre modning. (B) Representativt immunfluorescensbilde av iNs og iOPCs samkulturert i 28 dager. Axonal markør neurofilament NF er vist i grønn og oligodendrococytisk markør MBP i rødt. Høyre, et segment av iN-akson som er kledd av iOL-prosess (MBP+). (C) Synapsedannelse analysert i 4 uker gamle samkulturer. Celler ble farget for Synapsin 1 (Syn1, grønn) og MAP2 (rød), og synaptisk puncta ble kvantifisert ved konfokal analyse av tetthet langs de dendrittiske segmentene som beskrevet17,18. (D) I våre samkulturer av iNs og iOPCs (7 dager med samdyrking) er uttrykket av astrocyttmarkører, ALDHL1 og GFAP, minimalt (øverst), og uttrykket av mikrogliamarkører, TMEM119, TREM2 og CD33, oppdages ikke (N.D.) av qPCR. Forurensningen fra disse to gliacelletypene er dermed utelukket. (E) Kokulturering av iOPC med iN fører til dannelsen av nevron-OPC-synapser. Den fluorescensmerkede postsynaptiske markøren PSD95-mCherry uttrykkes bare i OPC-er, og viser et diffust mønster i enkeltkulturer (venstre), men aggregerer for å danne puncta i kokulturer (høyre, indikert med piler; Tuj1, nevronmarkør). (F) Uttrykket av godt karakteriserte oligodendrogliale gener som kan fornemme og reagere på nevronale aktiviteter i de rene kulturene til iOPCs på dag 14. Klikk her for å se en større versjon av dette tallet.
Data i søylediagrammer plottes som gjennomsnitt ± SEM (n ≥ 3). Statistisk signifikans ble evaluert av Student t-test (**, p < 0,005; ***, p < 0,001); i (C), sammenlignet med ingen OPC-tilstand; i (D), sammenlignet med primære astrocytter i topppanelet.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
I tillegg til den fysiske og metabolske støtten for å stabilisere synapsestrukturene og for å lette den saltatoriske signalledningen ved myelinisering, kan oligodendrocytterlinjeceller forme nevronaktivitetsmønster via raske og dynamiske krysssamtaler med nevroner 5,6,7. Mens oligodendroglialresponsene i AD-patologi i utgangspunktet ble ansett som bare sekundære til betennelse og oksidativt stress, er det nå lovende bevis som tyder på at kompromittert myelinintegritet er en tidlig patogen hendelse før utseendet av Aβ-aggregering og tau-hyperfosforylering9. Videre er reparasjon av myelinisering gjennom selvfornyelse av OPC spesielt sårbar i AD38, en prosess som i stor grad avhenger av nevronaktiviteter. Å forstå mekanismen for å støtte sunn neuron-oligodendrocyttersignalering representerer dermed en utmerket mulighet for å identifisere nye terapeutiske mål.
Den enkle transkripsjonsfaktoren Ngn2-protokollen er en av de mest brukte teknikkene for generering av stamcelleavledede humane nevroner, og prosedyrene som er skissert her, er ytterligere forbedringer for å oppnå rene nevronkulturer. Vår iOPC/iOL-protokoll har en induksjonsperiode kortere enn de tidligere publiserte studiene (4 til 24 uker), med et robust utbytte og renhet som kan sammenlignes med andre vanlige protokoller19,20,22,23,24,25,26,27,28 . Vår protokoll introduserer trinnvis differensiering av ES-celler til NPC, OPC og til slutt oligodendrocytter ved karakteriserte mønstersignaler, og genererer funksjonelle celler som kan brukes til å studere reguleringen av myeliniseringshomeostase og reparasjon in vitro eller in vivo (f.eks. Ved innpodning i skjelvende musemodell) som beskrevet i forrige arbeid. Forbedringen i protokollen vår fremmes sterkt av DMSO-inkubasjonen, som aktiverer retinoblastomproteinet og forlenger G1-fasen av cellesyklusen for bedre å integrere stimuli av rettet differensiering, og forbedrer også terminal differensiering i funksjonelle derivater29,30. Endelig forkorter bruken av clemastine, en muskarin og antihistamin forbindelse identifisert gjennom legemiddelskjermer for remyeliniseringsterapi33, i tillegg oligodendrocyttermodningen, som observert i iPS-cellepreparat og levende dyr 7,28.
Begrensningene i teknikken ligger hovedsakelig i den iboende diskrepansen mellom de forenklede in vitro-innstillingene og in vivo-miljøene i hjernen; Denne uoverensstemmelsen fører til en rabatt i fullt utviklingspotensial på avanserte stadier for individuelle hjernecelletyper. For iNs var nyere studier i stand til å opprettholde kulturene i god synaptisk helse i betydelig lang tid, men avslørte fortsatt noen relative umodenhet manifestert som reduserte ryggradslignende strukturer og nedsatt spontan synaptisk overføring i "gamle" iN-kulturer (selv de 25 måneder gamle) 39. Mens iOPCs har blitt reproduserbart vist å myelinisere aksoner in vivo etter å ha blitt transplantert til transgene musehjerner, representerer in vitro myeliniseringsanalysene med elektronmikroskopisk evaluering fortsatt en teknisk utfordring med utilfredsstillende effektivitet for nesten alle publiserte protokoller19,28, inkludert denne. Derfor forventes ikke vårt neuron-OPC-kokultursystem å trofast etterligne hjernens aldringsprosess, så vel som det sene stadiet av AD-patologi. Snarere er det unikt klar til å disentangle de forseggjorte intercellulære interaksjonene mellom nevroner og OPCs eller tidlig stadium oligodendrocytter, som er uavhengige av myelinisering og likevel grunnleggende for riktig nevral utvikling og sykdomspatogenese.
Hver av de tre prosedyrene som er beskrevet her, har sine c-ritiske trinn i protokollen og kan kreve endringer og feilsøking. For iN-protokollen er det to kritiske trinn: puromycinvalg (trinn 1.2.5) og platingtetthet (trinn 1.2.6). Ufullstendig fjerning av undertransducert celle resulterer i forurensning av dårlig differensierte celler og kompromitterer nevronoverlevelse og funksjoner. Modifikasjonene for sterkere puromycinseleksjon med høyere konsentrasjon og lengre inkubasjon som beskrevet i trinn 1.2.5 må vurderes. Den passende pletteringstettheten bør bestemmes ved titrering for hver pluripotente cellelinje, da lav tetthet fører til kollaps av kulturene og høy tetthet oppmuntrer til celleaggregering og hindrer nevronvekst. For iOPC/iOL-protokollen er de to kritiske trinnene kontroll av celleproliferasjon i OPC-differensiering (trinn 2.2.3) og pletteringstetthet for OL-modning (trinn 2.2.4 og 2.3.2). Overveksten av differensierende NPC-er signaliserer en dårlig respons på OPC-differensieringsstimuli og må dempes av en passende dosering av Ara-C-behandling (innenfor det angitte området). Mens plating OPCs for modning, er et lavere område av celletetthet foretrukket her, da den sparsomme fordelingen kan lette induksjonen av en fysiologisk morfologi av komplekse strukturer (som vist i figur 2C). For iN-iOPC-kokultureringsprotokollen ønsker vi å rette oppmerksomheten mot det kritiske trinnet med plating med en passende tetthet for begge celletyper (trinn 3.1.1 og 3.2.2). Spesielt kan det hende at iNs ikke fester seg godt til overflaten mellom voksende OPC-er og har en tendens til å løsne først når kulturen når sammenløp. Det optimale forholdet må avgjøres ved å titrere celletallene.
Samlet sett er denne reduksjonistiske tilnærmingen som ligger i våre protokoller et kraftig verktøy for å dissekere de spesifikke heterocellulære interaksjonene fra den menneskelige hjernens iboende kompleksitet, og tjene til å avdekke oligodendroglial biologi i helse og i AD. Betydningen i forhold til eksisterende metoder er således etter vår mening nokså åpenbar. En ekstra nytte av metodene som er utviklet her for fremtidige applikasjoner, er cellebasert terapi for demyeliniserende tilstander, som poststrålebehandling40 og ryggmargsskade41,42. Videre kan den høye gjennomstrømningskapasiteten til dette stamcellebaserte systemet også brukes i større skala for å skjerme biblioteker av små molekyler for forbindelser som kan beskytte eller gjenopprette den fysiologiske statusen til nevroner, OPCer, oligodendrocytter og deres interaksjoner. Dermed tror vi at protokollene beskrevet her vil lette fremtidig arbeid med å utvikle bedre modelleringsverktøy og effektive behandlinger for AD og andre nevrodegenerative lidelser.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne har ingenting å avsløre.
Acknowledgments
Dette arbeidet ble støttet av tilskudd fra National Institutes of Health (R00 AG054616 til Y.A.H. og T32 GM136566 til K.C.), Stanford University School of Medicine og et Siebel Fellowship (tildelt SC). Y.A.H. er en GFL Translational Professor fra Center for Translational Neuroscience i Brown Institute for Translational Sciences.
Materials
| Name | Company | Catalog Number | Comments |
| Accutase | STEMCELL Technologies | 7920 | |
| B27 supplement | ThermoFisher | 17504044 | |
| bFGF | ThermoFisher | PHG 0266 | |
| cAMP | MilliporeSigma | A9501 | |
| Clemastine | MilliporeSigma | SML0445 | |
| DMEM/F12 medium | STEMCELL Technologies | 36254 | |
| DMSO | ThermoFisher | D12345 | |
| Doxycycline | MilliporeSigma | D3072 | |
| Fetal Bovine Serum | ScienCell | 10 | |
| H1 human ES cells | WiCell | WA01 | |
| Matrigel | Corning | 354234 | |
| mTeSR plus | STEMCELL Technologies | 5825 | |
| N2 supplement | ThermoFisher | 17502001 | |
| Neurobasal A medium | ThermoFisher | 10888-022 | |
| Non Essential Amino Acids | ThermoFisher | 11140-050 | |
| PDGF-AA | R&D Systems | 221-AA-010 | |
| PEI | VWR | 71002-812 | |
| pMDLg/pRRE | Addgene | 12251 | |
| Polybrene | MilliporeSigma | TR-1003-G | |
| pRSV-REV | Addgene | 12253 | |
| Puromycin | ThermoFisher | A1113803 | |
| ROCK Inhibitor Y-27632 | STEMCELL Technologies | 72302 | |
| SAG | Tocris | 4366 | |
| STEMdiff Neural Progenitor Freezing Media | STEMCELL Technologies | 5838 | |
| STEMdiff SMADi Neural Induction Kit | STEMCELL Technologies | 8581 | |
| T3 triiodothyronine | MilliporeSigma | T6397 | |
| Tempo-iOlogo: Human iPSC-derived OPCs | Tempo BioScience | SKU102 | |
| TetO-Ng2-Puro | Addgene | 52047 | |
| VSV-G | Addgene | 12259 |
References
- Pelvig, D. P., Pakkenberg, H., Stark, A. K., Pakkenberg, B. Neocortical glial cell numbers in human brains. Neurobiology of Aging. 29 (11), 1754-1762 (2008).
- Barres, B. A. The mystery and magic of glia: a perspective on their roles in health and disease. Neuron. 60 (3), 430-440 (2008).
- De Strooper, B., Karran, E. The cellular phase of Alzheimer's disease. Cell. 164 (4), 603-615 (2016).
- Monje, M. Myelin plasticity and nervous system function. Annual Review of Neuroscience. 41, 61-76 (2018).
- Hughes, E. G., Orthmann-Murphy, J. L., Langseth, A. J., Bergles, D. E. Myelin remodeling through experience-dependent oligodendrogenesis in the adult somatosensory cortex. Nature Neuroscience. 21 (5), 696-706 (2018).
- Gibson, E. M., et al. Neuronal activity promotes oligodendrogenesis and adaptive myelination in the mammalian brain. Science. 344 (6183), 1252304 (2014).
- Pan, S., Mayoral, S. R., Choi, H. S., Chan, J. R., Kheirbek, M. A. Preservation of a remote fear memory requires new myelin formation. Nature Neuroscience. 23 (4), 487-499 (2020).
- Thornton, M. A., Hughes, E. G. Neuron-oligodendroglia interactions: Activity-dependent regulation of cellular signaling. Neuroscience Letters. 727, 134916 (2020).
- Ettle, B., Schlachetzki, J. C. M., Winkler, J. Oligodendroglia and myelin in neurodegenerative diseases: more than just bystanders. Molecular Neurobiology. 53 (5), 3046-3062 (2016).
- Essayan-Perez, S., Zhou, B., Nabet, A. M., Wernig, M., Huang, Y. A. Modeling Alzheimer's disease with human iPS cells: advancements, lessons, and applications. Neurobiology of Disease. 130, 104503 (2019).
- Li, L., et al. GFAP mutations in astrocytes impair oligodendrocyte progenitor proliferation and myelination in an hiPSC model of Alexander disease. Cell Stem Cell. 23 (2), 239-251 (2018).
- Lin, Y. T., et al. APOE4 causes widespread molecular and cellular alterations associated with Alzheimer's disease phenotypes in human iPSC-derived brain cell types. Neuron. 98 (6), 1294 (2018).
- TCW, J., et al. Cholesterol and matrisome pathways dysregulated in human APOE ε4 glia. bioRxiv. , (2019).
- Ang, C. E., Wernig, M. Induced neuronal reprogramming. Journal of Comparitive Neurology. 522 (12), 2877-2886 (2014).
- Penney, J., Ralvenius, W. T., Tsai, L. H. Modeling Alzheimer's disease with iPSC-derived brain cells. Molecular Psychiatry. 25 (1), 148-167 (2020).
- Zhang, Y., et al. Rapid single-step induction of functional neurons from human pluripotent stem cells. Neuron. 78 (5), 785-798 (2013).
- Huang, Y. A., Zhou, B., Nabet, A. M., Wernig, M., Sudhof, T. C. Differential signaling mediated by ApoE2, ApoE3, and ApoE4 in human neurons parallels Alzheimer's Disease risk. Journal of Neuroscience. 39 (37), 7408-7427 (2019).
- Huang, Y. A., Zhou, B., Wernig, M., Sudhof, T. C. ApoE2, ApoE3, and ApoE4 Differentially Stimulate APP Transcription and Abeta Secretion. Cell. 168 (3), 427-441 (2017).
- Yang, N., et al. Generation of oligodendroglial cells by direct lineage conversion. Nature Biotechnology. 31 (5), 434-439 (2013).
- Douvaras, P., et al. Efficient generation of myelinating oligodendrocytes from primary progressive multiple sclerosis patients by induced pluripotent stem cells. Stem Cell Reports. 3 (2), 250-259 (2014).
- Lee, E. H., Park, C. H. Comparison of reprogramming methods for generation of induced-oligodendrocyte precursor cells. Biomolecules & Therapeutics (Seoul). 25 (4), 362-366 (2017).
- Ehrlich, M., et al. Rapid and efficient generation of oligodendrocytes from human induced pluripotent stem cells using transcription factors. Proceedings of the National Academy of Sciences of the United States of America. 114 (11), 2243-2252 (2017).
- Rodrigues, G. M. C., et al. Defined and scalable differentiation of human oligodendrocyte precursors from pluripotent stem cells in a 3D culture system. Stem Cell Reports. 8 (6), 1770-1783 (2017).
- Hu, B. Y., Du, Z. W., Li, X. J., Ayala, M., Zhang, S. C. Human oligodendrocytes from embryonic stem cells: conserved SHH signaling networks and divergent FGF effects. Development. 136 (9), 1443-1452 (2009).
- Izrael, M., et al. Human oligodendrocytes derived from embryonic stem cells: Effect of noggin on phenotypic differentiation in vitro and on myelination in vivo. Molecular and Cellular Neuroscience. 34 (3), 310-323 (2007).
- Yamashita, T., et al. Differentiation of oligodendrocyte progenitor cells from dissociated monolayer and feeder-free cultured pluripotent stem cells. PLoS One. 12 (2), 0171947 (2017).
- Wang, S., et al. Human iPSC-derived oligodendrocyte progenitor cells can myelinate and rescue a mouse model of congenital hypomyelination. Cell Stem Cell. 12 (2), 252-264 (2013).
- Chanoumidou, K., Mozafari, S., Baron-Van Evercooren, A., Kuhlmann, T. Stem cell derived oligodendrocytes to study myelin diseases. Glia. 68 (4), 705-720 (2020).
- Chetty, S., et al. A simple tool to improve pluripotent stem cell differentiation. Nature Methods. 10 (6), 553-556 (2013).
- Li, J., et al. A transient DMSO treatment increases the differentiation potential of human pluripotent stem cells through the Rb family. PLoS One. 13 (12), 0208110 (2018).
- Sambo, D., Li, J., Brickler, T., Chetty, S. Transient treatment of human pluripotent stem cells with DMSO to promote differentiation. Journal of Visualized Experiments: JoVE. (149), (2019).
- Douvaras, P., Fossati, V. Generation and isolation of oligodendrocyte progenitor cells from human pluripotent stem cells. Nature Protocols. 10 (8), 1143-1154 (2015).
- Mei, F., et al. Micropillar arrays as a high-throughput screening platform for therapeutics in multiple sclerosis. Nature Medicine. 20 (8), 954-960 (2014).
- Madhavan, M., et al. Induction of myelinating oligodendrocytes in human cortical spheroids. Nature Methods. 15 (9), 700-706 (2018).
- Zhang, Y., et al. Purification and characterization of progenitor and mature human astrocytes reveals transcriptional and functional differences with mouse. Neuron. 89 (1), 37-53 (2016).
- Grubman, A., et al. A single-cell atlas of entorhinal cortex from individuals with Alzheimer's disease reveals cell-type-specific gene expression regulation. Nature Neuroscience. 22 (12), 2087-2097 (2019).
- Goldman, S. A., Kuypers, N. J. How to make an oligodendrocyte. Development. 142 (23), 3983-3995 (2015).
- Behrendt, G., et al. Dynamic changes in myelin aberrations and oligodendrocyte generation in chronic amyloidosis in mice and men. Glia. 61 (2), 273-286 (2013).
- Patzke, C., et al. Neuromodulator signaling bidirectionally controls vesicle numbers in human synapses. Cell. 179 (2), 498-513 (2019).
- Piao, J., et al. Human embryonic stem cell-derived oligodendrocyte progenitors remyelinate the brain and rescue behavioral deficits following radiation. Cell Stem Cell. 16 (2), 198-210 (2015).
- Keirstead, H. S., et al. Human embryonic stem cell-derived oligodendrocyte progenitor cell transplants remyelinate and restore locomotion after spinal cord injury. Journal of Neuroscience. 25 (19), 4694-4705 (2005).
- Kim, D. S., et al. Rapid generation of OPC-like cells from human pluripotent stem cells for treating spinal cord injury. Experimental & Molecular Medicine. 49 (7), 361 (2017).
Tags
Nevrovitenskap utgave 165 induserte pluripotente stamceller iPS-celler humane embryonale stamceller ES-celler nevroner oligodendrocytter oligodendrocytter oligodendrocytter OPC Alzheimers sykdom amyloid-beta-peptider synapserErratum
Formal Correction: Erratum: Generation of Human Neurons and Oligodendrocytes from Pluripotent Stem Cells for Modeling Neuron-Oligodendrocyte Interactions
Posted by JoVE Editors on 12/29/2020.
Citeable Link.
An erratum was issued for: Generation of Human Neurons and Oligodendrocytes from Pluripotent Stem Cells for Modeling Neuron-Oligodendrocyte Interactions. The Representative Results section has been updated.
Figure 3 was updated from:
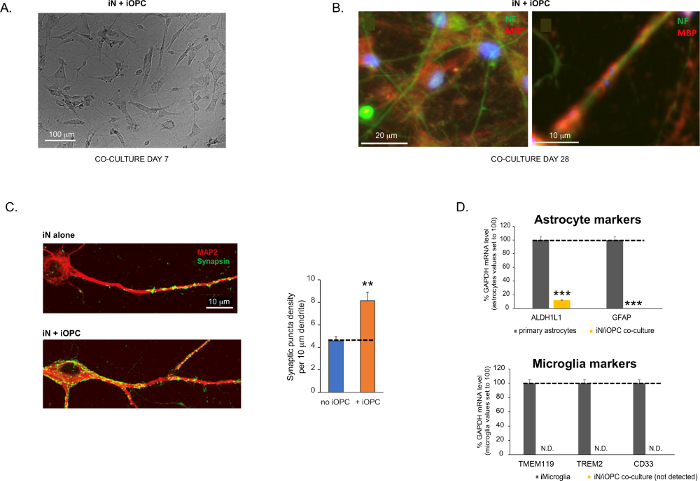
Figure 3: Co-culture of iNs and iOPCs. (A) Representative bright field image of co-cultured iNs and iOPCs at Day 7, showing a proper density for further maturation. (B) Representative immunofluorescence image of iNs and iOPCs co-cultured for 28 days. Axonal marker neurofilament NF is shown in green and oligodendrocytic marker MBP in red. Right, a segment of iN axon ensheathed by iOL process (MBP+). (C) Synapse formation assayed in 4-week-old co-cultures. Cells were stained for Synapsin 1 (Syn1, green) and MAP2 (red), and synaptic puncta were quantified by confocal analysis of density along the dendritic segments as described17,18. (D) In our co-cultures of iNs and iOPCs (7 days of co-culturing), the expression of astrocyte markers, ALDHL1 and GFAP, is minimal (top), and the expression of microglia markers, TMEM119, TREM2, and CD33, is not detected (N.D.) by qPCR. The contamination from these two glial cell types is thus excluded. Please click here to view a larger version of this figure.
to:
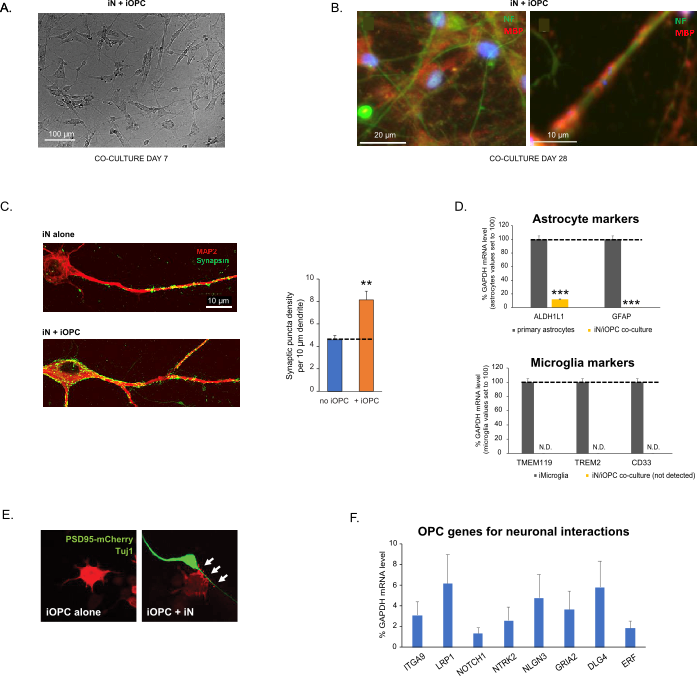
Figure 3: Co-culture of iNs and iOPCs. (A) Representative bright field image of co-cultured iNs and iOPCs at Day 7, showing a proper density for further maturation. (B) Representative immunofluorescence image of iNs and iOPCs co-cultured for 28 days. Axonal marker neurofilament NF is shown in green and oligodendrocytic marker MBP in red. Right, a segment of iN axon ensheathed by iOL process (MBP+). (C) Synapse formation assayed in 4-week-old co-cultures. Cells were stained for Synapsin 1 (Syn1, green) and MAP2 (red), and synaptic puncta were quantified by confocal analysis of density along the dendritic segments as described17,18. (D) In our co-cultures of iNs and iOPCs (7 days of co-culturing), the expression of astrocyte markers, ALDHL1 and GFAP, is minimal (top), and the expression of microglia markers, TMEM119, TREM2, and CD33, is not detected (N.D.) by qPCR. The contamination from these two glial cell types is thus excluded. (E) Coculturing iOPC with iN leads to the formation of neuron-OPC synapses. The fluorescence-tagged post-synaptic marker PSD95-mCherry is expressed only in OPCs, and display a diffuse pattern in single cultures (left) but aggregate to form puncta in cocultures (right, indicated by arrows; Tuj1, neuronal marker). (F) The expression of well-characterized oligodendroglial genes that can sense and respond to neuronal activities in the pure cultures of iOPCs at Day 14. Please click here to view a larger version of this figure.
The fourth paragraph was updated from:
Co-culturing of iNs and iOPCs
This protocol is optimized specifically for co-culturing iNs and iOPCs and allow our real-time monitoring of the inter-cellular communications between these two cell types along the course of neural development. The ideal plating densities for both cell types need to be decided with a series of cell number titration to achieve proper differentiation (Figure 3A). After 4 weeks in co-cultures, the iOPCs are expected to be adequately differentiated into OLs that are positive for specific markers such as MBP and extend processes to ensheath axons (Figure 3B). The co-culture system can robustly boost up the number of synapses, indicating that the iOPCs provide a neuronal support through physical contacts or release of trophic factors (Figure 3C). We can maintain the co-cultures in acceptable health condition for up to 6 weeks and observe that the synapse number and other neuronal attributes plateau around the fifth week. Of note, astrocytes and microglia are not present in our preparations and their absence can be documented by checking the expression of specific markers (Figure 3D).
to:
Co-culturing of iNs and iOPCs
This protocol is optimized specifically for co-culturing iNs and iOPCs and allow our real-time monitoring of the inter-cellular communications between these two cell types along the course of neural development. The ideal plating densities for both cell types need to be decided with a series of cell number titration to achieve proper differentiation (Figure 3A). After 4 weeks in co-cultures, the iOPCs are expected to be adequately differentiated into OLs that are positive for specific markers such as MBP and extend processes to ensheath axons (Figure 3B). The co-culture system can robustly boost up the number of synapses, indicating that the iOPCs provide a neuronal support through physical contacts or release of trophic factors (Figure 3C). We can maintain the co-cultures in acceptable health condition for up to 6 weeks and observe that the synapse number and other neuronal attributes plateau around the fifth week. Of note, astrocytes and microglia are not present in our preparations and their absence can be documented by checking the expression of specific markers (Figure 3D). The iOPCs express a good number of well-characterized genes that can potentially respond to and mediate the activity-dependent signals from neighboring neurons, in a paracrine (e.g. neurotrophins and metabolites) and/or a synaptic manner (Figure 3E and 3F).



