ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Hier beschrijven we een methode om synaptogenese van korrelneuronen in het cerebellum van de muis te visualiseren gedurende het tijdsverloop van de postnatale hersenontwikkeling wanneer deze cellen hun synaptische structuren verfijnen en synapsen vormen om zichzelf te integreren in het algehele hersencircuit.
Abstract
Neuronen ondergaan dynamische veranderingen in hun structuur en functie tijdens de ontwikkeling van de hersenen om geschikte verbindingen met andere cellen te vormen. Het cerebellum van knaagdieren is een ideaal systeem om de ontwikkeling en morfogenese van een enkel celtype, het cerebellaire granulaatneuron (CGN), in de loop van de tijd te volgen. Hier werd in vivo elektroporatie van voorlopers van korrelneuronen in het zich ontwikkelende cerebellum van de muis gebruikt om cellen spaarzaam te labelen voor latere morfologische analyses. De werkzaamheid van deze techniek wordt aangetoond in zijn vermogen om belangrijke ontwikkelingsstadia van CGN-rijping te laten zien, met een specifieke focus op de vorming van dendritische klauwen, gespecialiseerde structuren waar deze cellen het grootste deel van hun synaptische inputs ontvangen. Naast het verstrekken van snapshots van CGN-synaptische structuren tijdens de cerebellaire ontwikkeling, kan deze techniek worden aangepast om granulaatneuronen genetisch te manipuleren op een celautonome manier om de rol van elk interessant gen en het effect ervan op CGN-morfologie, klauwontwikkeling en synaptogenese te bestuderen.
Introduction
Hersenontwikkeling is een langdurig proces dat zich uitstrekt van embryogenese tot postnataal leven. Gedurende deze tijd integreren de hersenen een combinatie van intrinsieke en extrinsieke stimuli die de bedrading van synapsen tussen dendrieten en axonen vormen om uiteindelijk gedrag te sturen. Het cerebellum van knaagdieren is een ideaal modelsysteem om te bestuderen hoe synapsen zich ontwikkelen, omdat de ontwikkeling van een enkel neurontype, het cerebellaire granulaatneuron (CGN), kan worden gevolgd terwijl het overgaat van een voorlopercel naar een volwassen neuron. Dit is deels te wijten aan het feit dat een meerderheid van de cerebellaire cortex zich postnataal ontwikkelt, wat eenvoudige genetische manipulatie en cellabeling na de geboorte mogelijk maakt1.
Bij zoogdieren begint CGN-differentiatie aan het einde van de embryonale ontwikkeling wanneer een subset van proliferatieve cellen in de achterhersenen over de ruitvormige lip migreert om een secundaire kiemzone op het oppervlak van het cerebellum 2,3,4 te vormen. Hoewel ze volledig toegewijd zijn aan een korrelneuron voorloper (GNP) identiteit, blijven deze cellen zich vermenigvuldigen in het buitenste deel van de externe korrellaag (EGL) tot postnatale dag 14 (P14). Proliferatie van deze laag resulteert in een enorme uitbreiding van het cerebellum omdat deze cellen uitsluitend aanleiding geven tot CGN's5. Zodra pasgeboren CGN's de celcyclus in de EGL verlaten, migreren ze naar binnen naar de interne korrellaag (IGL), waarbij ze een axon achterlaten dat zich splitst en reist in de moleculaire laag van het cerebellum, waarbij parallelle vezels worden gevormd die synapseren op Purkinje-cellen6. De positie van deze vezels in de moleculaire laag is afhankelijk van de timing van de uitgang van de celcyclus.
CGN's die differentiëren verlaten eerst hun parallelle vezels naar de onderkant van de moleculaire laag, terwijl de axonen van CGN's die later differentiëren geclusterd zijn op de bovenste 7,8. Zodra de CGN-cellichamen de IGL bereiken, beginnen ze dendrieten uit te werken en synapsen te vormen met nabijgelegen remmende en exciterende neuronen. De volwassen dendritische boom van een CGN vertoont een stereotiepe architectuur met vier hoofdprocessen. In de loop van de CGN-rijping vormen de structuren aan het einde van deze dendrieten een klauw die verrijkt wordt met postsynaptische eiwitten 9,10. Deze gespecialiseerde structuren, dendritische klauwen genoemd, bevatten de meerderheid van de synapsen op korrelneuronen en zijn belangrijk voor het ontvangen van zowel exciterende inputs van mosachtige vezelinnervaties afkomstig van de pons, als remmende inputs van lokale Golgi-cellen. Eenmaal volledig geconfigureerd, stellen de synaptische verbindingen van CGN's deze cellen in staat om inputs van pre-cerebellaire kernen door te geven aan Purkinje-cellen, die vanuit de cerebellaire cortex naar de diepe cerebellaire kernen projecteren.
In vivo postnatale elektroporatie van BNP's is voordelig ten opzichte van andere op etikettering gebaseerde methoden, zoals virale infectie en generatie van transgene muislijnen, omdat de expressie van gewenste constructies op een snelle tijdlijn kan worden bereikt en de methode zich richt op een kleine populatie cellen, nuttig bij het bestuderen van celautonome effecten. Deze methode is in eerdere studies gebruikt om de morfologische ontwikkeling van CGN's te bestuderen; Deze studies hebben zich echter gericht op een enkel tijdstip of een kort tijdvenster 9,10,11,12,13. Deze etiketteringsmethode werd gecombineerd met beeldanalyse om de veranderingen in CGN-morfologie te documenteren die optreden gedurende het gehele tijdsverloop van CGN-differentiatie gedurende de eerste drie weken van het postnatale leven. Deze gegevens onthullen de dynamiek van CGN-dendrietontwikkeling die ten grondslag ligt aan de constructie van cerebellaire circuits.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
OPMERKING: Alle procedures werden uitgevoerd volgens protocollen die zijn goedgekeurd door Duke University Institutional Animal Care and Use Committee (IACUC).
1. DNA-preparaat voor in vivo elektroporatie of IVE (1 dag voor de operatie)
- Verzamel de volgende materialen: gezuiverd DNA (0,5-25 μg per dier), 3 M natriumacetaat, ethanol, Fast Green-kleurstof, ultrapuur gedestilleerd water, fosfaatbufferoplossing (PBS) (zie de materiaaltabel).
OPMERKING: Voor DNA werd een construct dat groen fluorescerend eiwit (GFP) tot expressie brengt onder een humane ubiquitinepromotor verkregen van Addgene (FUGW, https://www.addgene.org/14883/). Elk construct dat GFP of een ander fluorescerend eiwit tot expressie brengt onder controle van een alomtegenwoordige promotor zou moeten werken. CGN-specifieke labeling met deze techniek is niet afhankelijk van de constructie, maar eerder van de elektroporatie. - Bereid DNA voor op elektroporatie door de gewenste hoeveelheid DNA te mengen, 10% van het volume van 3 M natriumacetaat en 250% van het volume van 100% ijskoude ethanol. Merk op dat het DNA onmiddellijk uit de oplossing zal neerslaan.
- Blijf het DNA-mengsel 's nachts neerslaan bij -20 °C of gedurende een uur bij -80 °C.
- Pellet precipiteerde DNA in een tafelcentrifuge op > 16.000 × g en was tweemaal met 70% ethanol.
- Laat de DNA-pellet volledig drogen en reconstitueer in een 1x PBS + 0,02% Fast Green-oplossing.

Figuur 1: Beperking van de injectiediepte tot 1,5 mm met behulp van een afstandhouder. (A) Een segment van 11,2 mm wordt met een scheermesje van een laadpipet afgesneden. (B) De afstandhouder wordt op de punt van de Hamilton-spuit gemonteerd (totale lengte is 1,27 cm of 0,5 inch) en vastgezet met lijm of parafilm. De blootgestelde punt moet 1,5 mm lang zijn. Klik hier om een grotere versie van deze figuur te bekijken.
2. In vivo elektroporatie van korrelneuronvoorlopers bij zeven dagen oude postnatale muizen
OPMERKING: Alle elektroporatie-operaties werden uitgevoerd in een steriele en sterk geventileerde chirurgische suite en al het personeel droeg complete persoonlijke beschermingsmiddelen, waaronder handschoenen, gezichtsmasker, haarkap, japon en schoenovertrekken. Als alternatief kunnen de operaties worden uitgevoerd in een geventileerde en steriele kap.
- Verzamel de volgende materialen: DNA voor elektroporatie, kleine chirurgische schaar, kleine chirurgische pincet, aangepaste Hamilton-spuit, katoentip-applicator, verwarmingspad, betadine, 70% ethanol, 1x PBS, parafilm, weefsellijm (n-butylestercyanoacrylaat), isofluraan, elektroporator en pincet-type elektroden (zie de tabel met materialen).
- Snijd een afstandhouder uit een gesteriliseerde laadpunt om over de Hamilton-spuit te passen om de injectiediepte te beperken tot 1,5 mm (figuur 1A,B). Bevestig de afstandhouder met lijm of parafilm.
- Verdoof de P7-pup in een isofluraankamer met een afgiftesnelheid van 0,8 l/min. Bevestig volledige anesthesie door het dier te controleren op verminderde ademhaling en een gebrek aan een teen- of staartknijpreactie (figuur 2A).
- Zodra het dier volledig is verdoofd, plaatst u de pups op een voetstuk met een neuskegel, dat constant 4% isofluraan afgeeft bij een afgiftesnelheid van 0,8 l / min. Reinig de bovenkant van het hoofd van de pup 3 keer met een steriel wattenstaafje van betadine en vervolgens 70% ethanol, afwisselend tussen de twee, om de site voor te bereiden. Laat de oplossing drogen voordat u verder gaat.
- Maak met behulp van een gesteriliseerde schaar een kleine incisie met één snede die de afstand van de bovenkant tot de basis van de oren overspant om de achterhersenen te onthullen (figuur 2B).
- Lokaliseer het cerebellum (figuur 2C), steek de blootgestelde punt van de Hamilton-spuit door de schedel, loodrecht op de hersenen, en injecteer 1,5 μl DNA-mengsel in het cerebellaire parenchym door langzaam de achterste zuiger van de spuit in te duwen. Trek na toediening van het DNA-mengsel de naald langzaam terug om morsen terug te voorkomen en laat de DNA-oplossing gedurende 30 s diffunderen.
- Schakel de isofluraan uit en plaats de pup op een verwarmingskussen van 37 °C. Bereid de elektrode van het pincettype voor op elektroporatie door beide uiteinden in steriel 1x PBS te dopen.
OPMERKING: Het bevochtigen van de elektrode van het pincettype voorkomt contactverbrandingen op de huid van de pup tijdens het toedienen van de elektrische pulsen. - Richt de pincet-elektrode boven de injectieplaats met het plusuiteinde naar beneden gericht en het negatieve uiteinde boven het hoofd van het dier (figuur 2D). Dien vijf elektrische pulsen toe vanuit de elektroporator met de volgende instellingen: 50 ms, 130 V en 950 ms interpulsinterval.
OPMERKING: Voer indien nodig een testinjectie uit om ervoor te zorgen dat de injectieplaats zich op de cerebellaire vermis bevindt (figuur 2E). - Knijp de incisie dicht en sluit de wond af met een niet-toxische n-butyl-ester cyanoacrylaatweefsellijm. Reinig de wond met 70% ethanol, omdat elke sporenhoeveelheid bloed de kans op ouderlijke kindermoord en kannibalisme verhoogt.
- Laat het dier herstellen op een verwarmingskussen van 37 °C voordat u de pup terugbrengt naar de moeder. Controleer de pup(s) elke 30 minuten gedurende ten minste 2 uur na de operatie om volledig herstel te garanderen.
OPMERKING: Kindermoord door beide ouders komt vrij vaak voor. Om kannibalisme te voorkomen, huisvest u de vader in een andere kooi voordat u met de elektroporatie begint en brengt u altijd schoongemaakte en herstelde pups (d.w.z. geen bloedvlek, volledig mobiel) terug naar de oorspronkelijke kooi op het oorspronkelijke beddengoed. Pups kunnen ook worden afgeveegd met uitwerpselen uit de oorspronkelijke kooi om de geur van bloed te minimaliseren. Het gebruik van een draagmoeder kan nodig zijn als de oorspronkelijke moeder haar pups blijft kannibaliseren.

Figuur 2: In vivo cerebellaire elektroporatie van granule neuron voorlopers in P7 wildtype muizenpups. (A) Pups worden verdoofd met 4% isofluraan met een snelheid van 0,8 l / min om anesthesie te garanderen tijdens de injectie van de DNA-oplossing. Isofluraan wordt toegediend met een snelheid van 0,8 l / min. (B) Na het steriliseren van de muis 3 keer met betadine en 70% ethanol, wordt een incisie gemaakt die de afstand van de oren overspant, waardoor de achterhersenen worden onthuld. (C) Een vergroot beeld van een witte afbakening op de schedel, een oriëntatiepunt voor de injectieplaats. DNA-construct moet binnen 1 mm boven de markering worden geïnjecteerd; stippellijnen omlijnen de afbakening en een zwarte pijl geeft de injectieplaats aan. De richels van de cerebellaire vermis kunnen zichtbaar zijn en kunnen nuttig zijn voor het vinden van de injectieplaats. (D) Elektrodeoriëntatie van het pincettype voor efficiënte elektroporatie. Plus (+) uiteinde moet naar beneden worden gericht om negatief geladen DNA in het cerebellaire parenchym te trekken voorafgaand aan de toediening van elektrische pulsen. (E) Testinjectie van 1 μL van een 0,02% Fast Green-kleurstof toont aan dat de injectie is gelokaliseerd in het midden van de cerebellaire vermis tussen lobben 5-7. Klik hier om een grotere versie van deze figuur te bekijken.
3. Immunohistochemie van geëlektropereerde CGN's
- Verzamel de volgende materialen: isofluraan, 1x PBS, 4% paraformaldehyde (PFA), 30% sucrose, normaal geitenserum, niet-ionisch wasmiddel, glasglaasjes, glazen dekplaten, nagellak, montagemedia, Hoechst nucleaire kleurstof en geschikte primaire en secundaire antilichamen (zie de tabel met materialen).
- Verdoof het proefdier met isofluraan en bevestig volledige anesthesie met een teen- en staartknijp.
- Voer een trans-cardiale perfusie uit door langzaam 1x PBS en 4% PFA in de linkerkamer van het hart van het dier te injecteren. Laat het bloed uit het dier lopen door de vena cava af te snijden.
- Repareer de hersenen 's nachts door ze onder te dompelen in 4% PFA bij 4 °C. Spoel de volgende dag snel de hersenen met 1x PBS en breng de hersenen over in 30% sucrose in 1x PBS voor cryoprotectie gedurende ten minste 24 uur.
- Snijd indien nodig de hersenen in tweeën langs de rostral-caudale as en bevestig de expressie van de getransfecteerde reporterconstructie met behulp van een rechtopstaande fluorescerende ontleedmicroscoop.
OPMERKING: Houd de hersenen ondergedompeld in 1x PBS in een kleine schaal om te voorkomen dat deze uitdroogt. - Monteer de hersenen op een bevriezend microtoom, snijd 25 μm sagittale secties en laat secties zich ontvouwen in een 1: 1 mengsel van 1x PBS en glycerol.
OPMERKING: Secties kunnen in deze cryoprotectieve oplossing bij -20 °C worden bewaard voor langdurige opslag. - Was secties drie keer in 1x PBS gedurende 10 minuten elk om cryoprotectant te verwijderen en blokkeer het weefsel in 1x PBS + 10% normaal geitenserum + 0,2% niet-ionisch reinigingsmiddel op een orbitale shaker bij kamertemperatuur gedurende 1 uur.
- Bereid primaire antilichaamoplossing: 1x PBS, 10% normaal geitenserum, 0,2% niet-ionisch wasmiddel en anti-GFP-antilichaam en centrifugeer de oplossing gedurende 5 minuten bij > 16.000 × g. Incubeer secties in de antilichaamoplossing bij 4 °C op een orbitale shaker gedurende 48 uur.
- Was de primaire antilichaamoplossing gedurende 15 minuten vijf keer af met 1x PBS + 0,2% niet-ionisch reinigingsmiddel.
- Bereid secundaire antilichaamoplossing voor: 1x PBS, 10% normaal geitenserum, 0,2% niet-ionisch wasmiddel en een geschikt secundair antilichaam om GFP te detecteren; Centrifugeer de oplossing bij >16.000 × g. Incubeer secties in de antilichaamoplossing op een orbitale shaker bij kamertemperatuur gedurende 2-3 uur. Bescherm de secties tegen blootstelling aan licht om bleken te voorkomen.
- Was de secundaire antilichaamoplossing driemaal af met 1x PBS + 0,2% niet-ionisch reinigingsmiddel gedurende telkens 15 minuten. Incubeer secties in 1x PBS + Hoechst gedurende 5 minuten om kernen te kleuren.
- Was de Hoechst-oplossing af met 1x PBS + 0,2% niet-ionisch reinigingsmiddel en monteer op glazen dia's. Bedek de secties met bevestigingsmedia, bedek de dia's en sluit de dia af met nagellak om verdamping te voorkomen.
4. Morfologische analyses van CGN's - driedimensionale (3D) reconstructie en oppervlakte en cellulair volume
- Beeld enkele geëlektrporeerde CGN's op een confocale microscoop op 63x objectief met een 2x zoom, het nemen van z-stack beelden met 0,5 μm per stack. Afbeelding van één cel per afbeeldingsvenster voor eenvoudige beeldanalyse en reconstructie.
- Installeer de Simple Neurite Tracer plug-in voor FIJI met behulp van de volgende link (https://imagej.net/Simple_Neurite_Tracer:_Basic_Instructions) om eenvoudig en efficiënt de structuur van geëlektroperde CGN's in de driedimensionale (3D) ruimte te traceren.
OPMERKING: Er is een bijgewerkte versie van de plug-in (https://imagej.net/SNT). - Analyseer de lengte van neuriet en dendritische klauwvorming op een geblindeerde manier met behulp van Simple Neurite Tracer. Upload single-channel z-stack afbeeldingen van geëlektropoeerde CGN's naar FIJI en klik op Plugins | Segmentatie | Eenvoudige Neurite Tracer (Figuur 3D).
- Open het vervolgkeuzemenu en selecteer Nieuwe 3D-viewer maken (afbeelding 3D).
- Scrol naar de basis van een dendriet, waar deze verbinding maakt met de cel soma en start een pad door op de kruising te klikken. Traceer het pad handmatig door door de secties te klikken waar het celvulsignaal het helderst is en druk op [y] om het spoor te behouden. Traceer tot het einde van de dendriet als deze geen klauw bevat of tot de basis van de klauw en bevestig het pad door op [f] te drukken (figuur 4D).
- Traceer vervolgens de klauw door een pad aan de basis van de structuur te starten en te traceren tot het einde van het langste neuriet. Traceer secundaire en tertiaire vertakkingen door [ctrl] ingedrukt te houden in Windows of [alt] op een Mac OS en op het pad te klikken. Bevestig het pad door op [f] te drukken.
- Let erop dat metingen voor de sporen zichtbaar zijn op een apart raam; Tel alle metingen van de klauwtakken (primair, secundair, tertiair) bij elkaar op om de totale lengte voor elke klauw te verkrijgen.
- Voor het analyseren van het oppervlak en het cellulaire volume van geëlektropoeerde CGN's, download Imaris celanalysesoftware (https://imaris.oxinst.com/).
OPMERKING: FIJI kan ook worden gebruikt om cellen in 3D te reconstrueren uit z-stack-afbeeldingen met behulp van direct beschikbare en gratis plug-ins. Bovendien is er een volumetrische weergavefunctie in Simple Neurite Tracer, maar Imaris werd gebruikt om de hieronder beschreven redenen. - Upload z-stack afbeelding van een geëlektropoeerde CGN naar Imaris. Open de toolkit voor 3D-reconstructie door op Surpass te drukken.
- Als u de CGN wilt reconstrueren, drukt u op Oppervlakken en selecteert u een interessegebied dat de hele cel in het afbeeldingsvenster omvat. Als u klaar bent, drukt u op de blauwe pijl naar voren in de rechterbenedenhoek onder Maken.
- Als de afbeelding meerdere kanalen voor verschillende signalen bevat, selecteert u het kanaal met de geëlektroperde CGN en drukt u op de blauwe pijl vooruit.
- Stel met behulp van de schuifbalk een gewenste drempel in die het meest nauwkeurig past bij het signaal van de geëlektroperde cel. Zoom dichter in op het oppervlak van de cel om de drempel nauwkeurig te bepalen. Als u klaar bent, drukt u op de dubbele groene pijl om de cel te reconstrueren en het oppervlak en de volumegrootte uit de metagegevens te halen.

Figuur 3: Immunohistochemische analyse en driedimensionale reconstructie van geëlektroporeerde korrelneuronen. P7 CD-1 muizen werden geëlektropoeerd met een construct dat GFP tot expressie bracht. Hersenen werden verzameld en onderworpen aan immunohistochemie, confocale microscopie en 3D-reconstructie voor morfologische analyse. (A) Tijdlijn van elektroporatie tot beeldverwerking van een 10-DPI muis. (B) Maximaal projectiebeeld van een sagittale doorsnede van geëlektropereerd cerebellum 10-DPI; Witte lijnen bakenen cerebellaire lagen af en de schaalbalk is 25 μm. (C) Maximaal projectiebeeld van een enkel geëlektropoeerd granulaatneuron 10-DPI en het bijbehorende 3D-spoor, schaalbalk is 10 μm. (D) 3D-reconstructies werden gegenereerd met behulp van de FIJI-plug-in Simple Neurite Tracer. Alle metingen werden getraceerd door de z-stack, volgens het celvulsignaal. Voor elke dendriet werden schacht- en klauwmetingen afzonderlijk getraceerd; stippellijn geeft een deel van dendriet binnen het huidige vlak aan. Afkortingen: 3D = driedimensionaal; GFP = groen fluorescerend eiwit; DPI = dagen na injectie; PSD-95 = postsynaptisch dichtheidseiwit 95; BNP's = voorlopers van korrelneuronen; PFA = paraformaldehyde. Klik hier om een grotere versie van deze figuur te bekijken.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results

Figuur 4: Analyse van de morfologie van korrelneuronen tijdens de cerebellaire ontwikkeling. (A) Maximale projectiebeelden van geëlektreerde CGN's van 3-DPI tot 14-DPI (postnatale leeftijd P10 tot P21), kernen (blauw) en GFP (groen); pijlpunten geven individuele dendriet aan en de schaalbalk is 10 μm. (B) Gemiddeld aantal dendrieten. (C) Gemiddelde dendrietlengte gemeten vanaf de basis van de soma tot de punt van de dendriet. (D) Fractie van dendrieten die een klauw bevatten; Een waarde van 1,00 is 100%, d.w.z. alle dendrieten hebben klauw. (E) Totale lengte van de dendritische klauw. N > 30 cellen per aandoening, verzameld van ten minste 4 dieren per aandoening; alle metingen werden geanalyseerd door eenrichtings-ANOVA en ofwel een Dunnett's meervoudige vergelijkingstest (B, C en D) of een Tukey's meervoudige vergelijkingstest (E), **** geeft significantie aan met p <0,0001 in de tijd; foutenbalken zijn S.E.M. Afkortingen: GFP = groen fluorescerend eiwit; DPI = dagen na injectie; PSD-95 = postsynaptisch dichtheidseiwit 95; CGN's = cerebellaire korrelneuronen; ANOVA = variantieanalyse; S.E.M. = standaardfout van het gemiddelde. Klik hier om een grotere versie van deze figuur te bekijken.
Om de ontwikkeling van granulaatneuronmorfologie in vivo te bestuderen, werd een construct dat GFP tot expressie bracht onder controle van een menselijke ubiquitinepromotor (FUGW) geëlektropoeerd in het zich ontwikkelende cerebellum van CD-1-muizen en hersenen verzamelden 3-, 5-, 7-, 10- en 14-dagen na injectie (DPI). Schaarse labeling van cellen door elektroporatie in combinatie met confocale microscopie legt snapshots vast van CGN's tijdens perioden van dendritische snoei, groei en rijping. Om de groei van CGN-synaptische structuren kwantitatief te analyseren en te volgen, werd elke dendriet getraceerd met behulp van de FIJI-plug-in Simple Neurite Tracer (SNT). SNT is een eenvoudige, snelle, efficiënte en direct beschikbare methode om neuriet- en klauwlengte te meten in de driedimensionale (3D) ruimte. Omgekeerd werd Imaris gebruikt voor 3D-reconstructie van CGN's om oppervlakte- en volumemetingen te verkrijgen, omdat het programma een snelle en nauwkeurige weergave van elke cel biedt en de drempelmogelijkheden in staat zijn om gelabelde cellen te isoleren van nabijgelegen gelabeld celafval.
Pasgeboren CGN's ondergaan een uitbundige fase van dendritische groei gevolgd door verfijning van P10 tot P14 (3- tot 7-DPI) die resulteert in het snoeien van meer dan 50% van de overtollige dendrieten (figuur 4B). Deze gebeurtenis valt samen met de geleidelijke verlenging van de resterende priëlen (figuur 4C) en de vorming van klauwachtige structuren aan het einde van elke dendriet (figuur 4D), wat aangeeft dat deze ontwikkelingsprocessen gelijktijdig plaatsvinden. Hoewel klauwen op ongeveer 75% van de dendrieten worden gevonden door P14 (7-DPI), blijven deze structuren in omvang toenemen tot P21 (14-DPI) (figuur 4E).
De veranderingen in dendriet- en klauwmorfologie kunnen een algemene verandering in de totale celgrootte of een herverdeling van het celmembraan weerspiegelen. Om deze vraag te beantwoorden, werd elk gelabeld korrelneuron gereconstrueerd in Imaris om het totale somatodendritische oppervlak en volume te kwantificeren. De CGN-grootte bleef relatief constant gedurende de ontwikkeling (figuur 5A, B), hoewel CGN's bij P14 een significante volumedaling van 20% vertonen in vergelijking met P10, P12 en P17 (3-, 5- en 10-DPI) (figuur 5B). Deze gegevens suggereren dat membraanrecycling van ingetrokken dendrieten bijzonder belangrijk kan zijn voor het mogelijk maken van de vergroting van dendritische uiteinden in klauwen en wijzen op P14 (7-DPI) als een belangrijk tijdstip in de overgang van snoeien naar synapsontwikkeling.

Figuur 5: Analyse van de grootte van het korrelneuron tijdens de cerebellaire ontwikkeling. Geëlektroporeerde CGN's werden gereconstrueerd in Imaris om de cellulaire grootte te bepalen. (A-B) Oppervlakte en volumetrische analyse van korrelneuronen (d.w.z. celsoma en dendrieten) tijdens cerebellaire ontwikkeling. N > 30 cellen per aandoening, verzameld van ten minste 4 dieren per aandoening. Alle metingen werden geanalyseerd door eenrichtings-ANOVA en een Dunnett's meervoudige vergelijkingstest, ** geeft significantie aan met p <0,005; foutbalken zijn S.E.M. Afkortingen: DPI = dagen na injectie; CGN's = cerebellaire korrelneuronen; ANOVA = variantieanalyse; S.E.M. = standaardfout van het gemiddelde. Klik hier om een grotere versie van deze figuur te bekijken.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Cerebellaire korrelneuronen zijn de meest voorkomende neuronen in het zoogdierbrein, die bijna 60-70% uitmaken van de totale neuronenpopulatie in het knaagdierbrein 1,14. Het cerebellum is op grote schaal gebruikt om mechanismen van cellulaire proliferatie, migratie, dendrietvorming en synapsontwikkeling op te helderen 6,9,10,11,15,16,17,18,19,20 . Bovendien hebben tientallen jaren van elektrofysiologische studies geholpen om de rol van granulaatneuronen in de cerebellaire plasticiteit op lange termijn vast te stellen, wat ten grondslag ligt aan de betrokkenheid van het circuit bij aangeleerd motorisch gedrag21,22,23. Korrelneuronen zijn dus een uitstekend modelsysteem om belangrijke vragen over synaps- en circuitontwikkeling te ondervragen.
Het doel van deze studie is om een techniek te benadrukken die gebruik maakt van het cerebellum om de morfologie van een enkel neurontype in vivo te volgen. Elektroporatie van het cerebellum richt zich op delende cellen; Het is dus technisch in staat om zowel korrelneuronvoorlopers als gliacellen te labelen, hoewel omdat korrelneuronvoorlopers zo talrijk zijn, de geëlektropoleerde populatie grotendeels neuronaal is, zelfs zonder de noodzaak van celtypespecifieke promotors. Bovendien kan deze techniek worden aangepast om genen in vivo genetisch te manipuleren om hun rol in de ontwikkeling van CGN te bestuderen. Dit kan worden bereikt door transfectie van een plasmide dat ofwel korthaarspeld of klein-storende RNA's tot expressie brengt om genen neer te halen of een plasmide dat Cre-recombinase tot expressie brengt in een transgene muizenstam om regio's geflankeerd door LoxP-sites te verwijderen en het beoogde gen van belang uit te schakelen10,24.
Elektroporatie heeft zowel sterke als zwakke punten voor genetische studies. Het biedt een snellere methode om genen te manipuleren in vergelijking met traditionele transgene strategieën, hoewel de spaarzaamheid van de elektroporatie het nut ervan beperkt voor gedragsstudies, die grote aantallen genetisch gemodificeerde cellen vereisen om effecten te zien. Een tweede beperking is dat het zich alleen betrouwbaar richt op korrelneuronen tussen lobben 5 en 7, en dit is deels te wijten aan hoe het cerebellum is georiënteerd op de injectieplaats. Binnen het geëlektroforeerde gebied levert deze methode echter een relatief groot aantal individueel gelabelde cellen op, wat het potentieel biedt voor statistisch robuuste metingen. Het was bijvoorbeeld niet alleen mogelijk om de ontwikkeling van dendriet in de loop van de tijd te volgen, maar ook subtiele herverdelingen van membraan tussen de dendrieten en klauwen konden worden gemeten, waardoor eerder gepubliceerde gegevens20 werden uitgebreid. CGN-klauwen zijn bijzonder interessant om te bestuderen, omdat vergroting van deze dendritische structuren extra ruimte biedt voor korrelneuronen om zowel exciterende verbindingen met bemoste vezelterminals en unipolaire borstelcellen als remmende verbindingen met nabijgelegen Golgi-cellen te vormen. Daarom kan het combineren van deze dendritische metingen met immunohistochemische etikettering van specifieke pre- en postsynaptische eiwitten nuttig zijn om de studie van cerebellaire circuitvorming en synapsrijping te bevorderen.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
De auteurs verklaren geen belangenverstrengeling te hebben.
Acknowledgments
Het werk werd ondersteund door NIH-subsidies R01NS098804 (A.E.W.), F31NS113394 (U.C.) en Duke University's Summer Neuroscience Program (D.G.).
Materials
| Name | Company | Catalog Number | Comments |
| Betadine | Purdue Production | 67618-150-17 | |
| Cemented 10 µL needle | Hamilton | 1701SN (80008) | 33 gauge, 1.27 cm (0.5 in), 4 point style |
| Chicken anti-GFP | Millipore Sigma | AB16901 | Our lab uses this antibody at a 1:1000 concentration |
| Cotton-tip applicator | |||
| Donkey anti-chicken Cy2 | Jackson ImmunoResearch | 703-225-155 | Our lab uses this antibody at a 1:500 concentration |
| Ethanol (200 proof) | Koptec | V1016 | |
| Electroporator ECM 830 | BTX Harvard Apparatus | 45-0052 | |
| Fast Green FCF | Sigma | F7252-5G | |
| FUGW plasmid | Addgene | 14883 | |
| Glass slides | VWR | 48311-703 | Superfrost plus |
| Glycerol | Sigma-Aldrich | G5516 | |
| Heating pad | Softheat | ||
| Hoescht 33342 fluorescent dye | Invitrogen | 62249 | |
| Imaris | Bitplane | ||
| Isoflurane | Patterson Veterinary | 07-893-1389 | |
| Micro cover glass | VWR | 48382-138 | |
| Nail polish | Sally Hansen | Color 109 | |
| Normal goat serum | Gibco | 16210064 | |
| O.C.T. embedding compound | Tissue-Tek | 4583 | |
| Olympus MVX10 Dissecting Scope | Olympus | MVX10 | |
| P200 pipette reach tip | Fisherbrand | 02-707-138 | Used for needle spacer |
| Parafilm | Bemis | PM-996 | |
| PBS pH 7.4 (10x) | Gibco | 70011-044 | |
| Simple Neurite Tracer | FIJI | https://imagej.net/Simple_Neurite_Tracer:_Basic_ Instructions |
|
| Sucrose | Sigma | S0389 | |
| Surgical tools | RWD Life Science | Small scissors and tweezers | |
| Triton X-100 | Roche | 11332481001 | non-ionic detergent |
| Tweezertrodes | BTX Harvard Apparatus | 45-0489 | 5 mm, platinum plated tweezer-type electrodes |
| Ultrapure distilled water | Invitrogen | 10977-015 | |
| Vectashield mounting media | Vectashield | H1000 | |
| Vetbond tissue adhesive | 3M | 1469SB | |
| Zeiss 780 Upright Confocal | Zeiss | 780 |
References
- Altman, J., Bayer, S. A. Development of the cerebellar system : in relation to its evolution, structure, and functions. , CRC Press. (1997).
- Rahimi-Balaei, M., Bergen, H., Kong, J., Marzban, H. Neuronal migration during development of the cerebellum. Frontiers in Cellular Neuroscience. 12, 484 (2018).
- Alder, J., Cho, N. K., Hatten, M. E. Embryonic precursor cells from the rhombic lip are specified to a cerebellar granule neuron identity. Neuron. 17 (3), 389-399 (1996).
- Hatten, M. E., Heintz, N. Mechanisms of neural patterning and specification in the developing cerebellum. Annual Review of Neuroscience. 18, 385-408 (1995).
- Ben-Arie, N., et al. Math1 is essential for genesis of cerebellar granule neurons. Nature. 390 (6656), 169-172 (1997).
- Borghesani, P. R., et al. BDNF stimulates migration of cerebellar granule cells. Development. 129 (6), 1435-1442 (2002).
- Espinosa, J. S., Luo, L. Timing neurogenesis and differentiation: insights from quantitative clonal analyses of cerebellar granule cells. Journal of Neuroscience. 28 (10), 2301-2312 (2008).
- Markwalter, K. H., Yang, Y., Holy, T. E., Bonni, A. Sensorimotor coding of vermal granule neurons in the developing mammalian cerebellum. Journal of Neuroscience. 39 (34), 6626-6643 (2019).
- Shalizi, A., et al. PIASx is a MEF2 SUMO E3 ligase that promotes postsynaptic dendritic morphogenesis. Journal of Neuroscience. 27 (37), 10037-10046 (2007).
- Shalizi, A., et al. A Calcium-regulated MEF2 sumoylation switch controls poststynaptic differentiation. Science. 311 (5763), 1012-1017 (2006).
- Konishi, Y., Stegmuller, J., Matsuda, T., Bonni, S., Bonni, A. Cdh1-APC controls axonal growth and patterning in the mammalian brain. Science. 303 (5660), 1026-1030 (2004).
- Holubowska, A., Mukherjee, C., Vadhvani, M., Stegmuller, J. Genetic manipulation of cerebellar granule neurons in vitro and in vivo to study neuronal morphology and migration. Journal of Visualized Experiments: JoVE. (85), e51070 (2014).
- Yang, Y., et al. Chromatin remodeling inactivates activity genes and regulates neural coding. Science. 353 (6296), 300-305 (2016).
- Herculano-Houzel, S. Coordinated scaling of cortical and cerebellar numbers of neurons. Frontiers in Neuroanatomy. 4, 12 (2010).
- Wilson, P. M., Fryer, R. H., Fang, Y., Hatten, M. E. Astn2, a novel member of the astrotactin gene family, regulates the trafficking of ASTN1 during glial-guided neuronal migration. Journal of Neuroscience. 30 (25), 8529-8540 (2010).
- Kokubo, M., et al. BDNF-mediated cerebellar granule cell development is impaired in mice null for CaMKK2 or CaMKIV. Journal of Neuroscience. 29 (28), 8901-8913 (2009).
- Schwartz, P. M., Borghesani, P. R., Levy, R. L., Pomeroy, S. L., Segal, R. A. Abnormal cerebellar development and foliation in BDNF-/- mice reveals a role for neurotrophins in CNS patterning. Neuron. 19 (2), 269-281 (1997).
- Segal, R. A., Pomeroy, S. L., Stiles, C. D. Axonal growth and fasciculation linked to differential expression of BDNF and NT3 receptors in developing cerebellar granule cells. Journal of Neuroscience. 15 (7), Pt 1 4970-4981 (1995).
- Zhou, P., et al. Polarized signaling endosomes coordinate BDNF-induced chemotaxis of cerebellar precursors. Neuron. 55 (1), 53-68 (2007).
- Dhar, M., Hantman, A. W., Nishiyama, H. Developmental pattern and structural factors of dendritic survival in cerebellar granule cells in vivo. Scientific Reports. 8 (1), 17561 (2018).
- Ito, M. Synaptic plasticity in the cerebellar cortex and its role in motor learning. Canadian Journal of Neurological Sciences. 20, Suppl 3 70-74 (1993).
- Jorntell, H., Hansel, C. Synaptic memories upside down: bidirectional plasticity at cerebellar parallel fiber-Purkinje cell synapses. Neuron. 52 (2), 227-238 (2006).
- Nakanishi, S. Genetic manipulation study of information processing in the cerebellum. Neuroscience. 162 (3), 723-731 (2009).
- Chang, C. H., et al. Atoh1 controls primary cilia formation to allow for SHH-triggered granule neuron progenitor proliferation. Developmental Cell. 48 (2), 184-199 (2019).
Tags
Neurowetenschappen Neuronale ontwikkeling cerebellum dendriet synaps granulaatneuron elektroporatieErratum
Formal Correction: Erratum: Utilizing In Vivo Postnatal Electroporation to Study Cerebellar Granule Neuron Morphology and Synapse Development
Posted by JoVE Editors on 04/06/2023.
Citeable Link.
An erratum was issued for: Utilizing In Vivo Postnatal Electroporation to Study Cerebellar Granule Neuron Morphology and Synapse Development. A figure was updated.
Figure 2 was updated from:
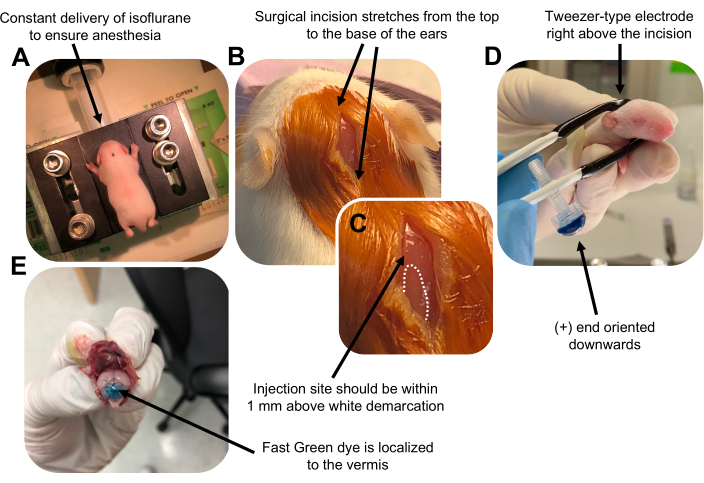
Figure 2: In vivo cerebellar electroporation of granule neuron progenitors in P7 wildtype mouse pups. (A) Pups are anesthetized with 4% isoflurane delivered at a rate of 0.8L/min to ensure anesthesia throughout the injection of the DNA solution. Isoflurane is delivered at a rate of 0.8 L/min. (B) After sterilizing the mouse 3 times with betadine and 70% ethanol, an incision is made that spans the distance of the ears, revealing the hindbrain. (C) A magnified image of a white demarcation on the cranium, a landmark for the injection site. DNA construct should be injected within 1 mm above the mark; dotted lines outline the demarcation, and black arrow denotes the injection site. The ridges of the cerebellar vermis may be visible and can be useful for finding the injection site. (D) Tweezer-type electrode orientation for efficient electroporation. Plus (+) end must be oriented downwards to pull negatively charged DNA into the cerebellar parenchyma prior to administration of electrical pulses. (E) Test injection of 1 µL of a 0.02% Fast Green dye shows injection is localized to the middle of the cerebellar vermis between lobules 5-7. Please click here to view a larger version of this figure.
to:
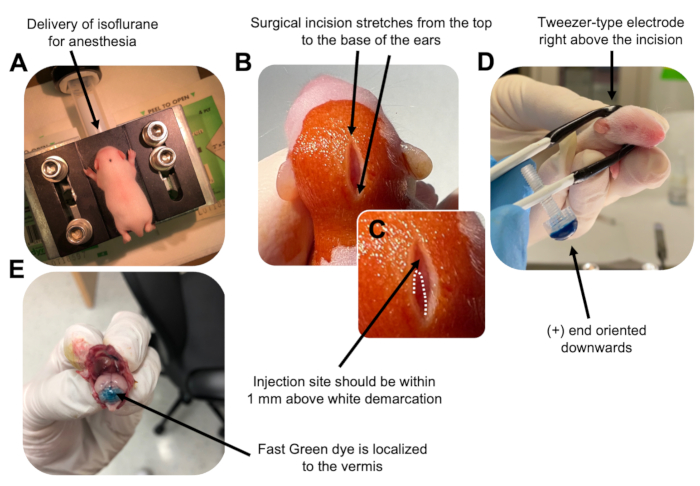
Figure 2: In vivo cerebellar electroporation of granule neuron progenitors in P7 wildtype mouse pups. (A) Pups are anesthetized with 4% isoflurane delivered at a rate of 0.8L/min to ensure anesthesia throughout the injection of the DNA solution. Isoflurane is delivered at a rate of 0.8 L/min. (B) After sterilizing the mouse 3 times with betadine and 70% ethanol, an incision is made that spans the distance of the ears, revealing the hindbrain. (C) A magnified image of a white demarcation on the cranium, a landmark for the injection site. DNA construct should be injected within 1 mm above the mark; dotted lines outline the demarcation, and black arrow denotes the injection site. The ridges of the cerebellar vermis may be visible and can be useful for finding the injection site. (D) Tweezer-type electrode orientation for efficient electroporation. Plus (+) end must be oriented downwards to pull negatively charged DNA into the cerebellar parenchyma prior to administration of electrical pulses. (E) Test injection of 1 µL of a 0.02% Fast Green dye shows injection is localized to the middle of the cerebellar vermis between lobules 5-7. Please click here to view a larger version of this figure.



