ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Aquí describimos un método para visualizar la sinaptogénesis de las neuronas granulares en el cerebelo del ratón durante el curso del desarrollo cerebral postnatal cuando estas células refinan sus estructuras sinápticas y forman sinapsis para integrarse en el circuito cerebral general.
Abstract
Las neuronas experimentan cambios dinámicos en su estructura y función durante el desarrollo del cerebro para formar conexiones apropiadas con otras células. El cerebelo de roedores es un sistema ideal para rastrear el desarrollo y la morfogénesis de un solo tipo de célula, la neurona granulosa cerebelosa (CGN), a través del tiempo. Aquí, la electroporación in vivo de progenitores de neuronas granulares en el cerebelo de ratón en desarrollo se empleó para etiquetar escasamente las células para análisis morfológicos posteriores. La eficacia de esta técnica se demuestra en su capacidad para mostrar las etapas clave del desarrollo de la maduración de CGN, con un enfoque específico en la formación de garras dendríticas, que son estructuras especializadas donde estas células reciben la mayoría de sus entradas sinápticas. Además de proporcionar instantáneas de las estructuras sinápticas de CGN a lo largo del desarrollo cerebeloso, esta técnica se puede adaptar para manipular genéticamente las neuronas granulares de manera autónoma celular para estudiar el papel de cualquier gen de interés y su efecto en la morfología de CGN, el desarrollo de garras y la sinaptogénesis.
Introduction
El desarrollo del cerebro es un proceso prolongado que se extiende desde la embriogénesis hasta la vida postnatal. Durante este tiempo, el cerebro integra una combinación de estímulos intrínsecos y extrínsecos que esculpen el cableado de las sinapsis entre las dendritas y los axones para guiar finalmente el comportamiento. El cerebelo de roedores es un sistema modelo ideal para estudiar cómo se desarrollan las sinapsis porque el desarrollo de un solo tipo de neurona, la neurona granular cerebelosa (CGN), se puede rastrear a medida que pasa de una célula progenitora a una neurona madura. Esto se debe, en parte, al hecho de que la mayoría de la corteza cerebelosa se desarrolla postnatalmente, lo que permite una fácil manipulación genética y etiquetado celular después del nacimiento1.
En los mamíferos, la diferenciación de CGN comienza al final del desarrollo embrionario cuando un subconjunto de células proliferativas en el cerebro posterior migra sobre el labio rómbico para formar una zona germinal secundaria en la superficie del cerebelo 2,3,4. Aunque están totalmente comprometidas con una identidad progenitora de neuronas granulares (GNP), estas células continúan proliferando dentro de la porción externa de la capa granular externa (EGL) hasta el día postnatal 14 (P14). La proliferación de esta capa resulta en una expansión masiva del cerebelo ya que estas células dan lugar exclusivamente a CGNs5. Una vez que las CGN recién nacidas salen del ciclo celular en el EGL, migran hacia el interior hacia la capa granular interna (IGL), dejando atrás un axón que se bifurcará y viajará en la capa molecular del cerebelo, formando fibras paralelas que hacen sinapsis en las células de Purkinje6. La posición de estas fibras dentro de la capa molecular depende del momento de la salida del ciclo celular.
Las CGN que se diferencian primero dejan sus fibras paralelas hacia la parte inferior de la capa molecular, mientras que los axones de CGN que se diferencian más tarde se agrupan en la parte superior 7,8. Una vez que los cuerpos celulares CGN alcanzan el IGL, comienzan a elaborar dendritas y forman sinapsis con neuronas inhibitorias y excitatorias cercanas. El árbol dendrítico maduro de un CGN exhibe una arquitectura estereotipada con cuatro procesos principales. En el transcurso de la maduración de CGN, las estructuras al final de estas dendritas forman una garra que se enriquece con proteínas postsinápticas 9,10. Estas estructuras especializadas, llamadas garras dendríticas, contienen la mayoría de las sinapsis en las neuronas granulares y son importantes para recibir tanto entradas excitatorias de inervaciones de fibras musgosas que se originan en la protuberancia, como entradas inhibitorias de células locales de Golgi. Una vez configuradas completamente, las conexiones sinápticas de las CGN permiten que estas células transmitan entradas desde los núcleos precerebelosos a las células de Purkinje, que se proyectan desde la corteza cerebelosa hacia los núcleos cerebelosos profundos.
La electroporación postnatal in vivo de los PNB es ventajosa sobre otros métodos basados en el etiquetado, como la infección viral y la generación de líneas de ratón transgénico, porque la expresión de las construcciones deseadas se puede lograr en una línea de tiempo rápida, y el método se dirige a una pequeña población de células, útil para estudiar los efectos autónomos celulares. Este método se ha utilizado en estudios previos para estudiar el desarrollo morfológico de las CGN; Sin embargo, estos estudios se han centrado en un solo punto de tiempo o en una ventana corta de tiempo 9,10,11,12,13. Este método de etiquetado se combinó con el análisis de imágenes para documentar los cambios en la morfología de CGN que ocurren a lo largo de todo el curso de tiempo de la diferenciación de CGN durante las primeras tres semanas de vida postnatal. Estos datos revelan la dinámica del desarrollo de las dendritas CGN que subyacen a la construcción de los circuitos cerebelosos.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
NOTA: Todos los procedimientos se realizaron bajo protocolos aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Duke (IACUC).
1. Preparación del ADN para electroporación in vivo o IVE (1 día antes de la cirugía)
- Reúna los siguientes materiales: ADN purificado (0.5-25 μg por animal), acetato de sodio 3 M, etanol, colorante verde rápido, agua destilada ultrapura, solución tampón de fosfato (PBS) (consulte la Tabla de materiales).
NOTA: Para el ADN, se obtuvo de Addgene (FUGW, https://www.addgene.org/14883/) una construcción que expresa la proteína fluorescente verde (GFP) bajo un promotor de ubiquitina humana. Cualquier construcción que exprese GFP u otra proteína fluorescente bajo el control de un promotor ubicuo debería funcionar. El etiquetado específico de CGN con esta técnica no depende del constructo, sino de la electroporación. - Prepare el ADN para la electroporación mezclando la cantidad deseada de ADN, 10% en volumen de acetato de sodio 3 M y 250% en volumen de etanol 100% helado. Tenga en cuenta que el ADN precipitará fuera de la solución inmediatamente.
- Continuar precipitando la mezcla de ADN durante la noche a -20 °C o durante una hora a -80 °C.
- El pellet precipitó ADN en una centrífuga de mesa a >16,000 × g y lavó dos veces con etanol al 70%.
- Deje que el pellet de ADN se seque completamente y reconstituya en una solución 1x PBS + 0.02% Fast Green.

Figura 1: Limitación de la profundidad de inyección a 1,5 mm utilizando un espaciador. (A) Un segmento de 11,2 mm se corta de una pipeta de carga con una cuchilla de afeitar. (B) El espaciador se coloca en la punta de la jeringa Hamilton (la longitud total es de 1,27 cm o 0,5 pulgadas) y se asegura con adhesivo o parapelícula. La punta expuesta debe tener 1,5 mm de longitud. Haga clic aquí para ver una versión más grande de esta figura.
2. Electroporación in vivo de progenitores de neuronas granulares en ratones postnatales de siete días de edad
NOTA: Todas las cirugías de electroporación se realizaron en una sala quirúrgica estéril y altamente ventilada, y todo el personal usó equipo de protección personal completo que incluía guantes, mascarilla, gorro para el cabello, bata y cubiertas para zapatos. Alternativamente, las cirugías se pueden realizar en una campana ventilada y estéril.
- Reúna los siguientes materiales: ADN para electroporación, tijeras quirúrgicas pequeñas, pinzas quirúrgicas pequeñas, jeringa Hamilton personalizada, aplicador de punta de algodón, almohadilla térmica, betadina, etanol al 70%, 1x PBS, parapelícula, adhesivo tisular (cianoacrilato de n-butil-éster), isoflurano, electroporador y electrodos tipo pinza (consulte la Tabla de materiales).
- Corte un espaciador de una punta de carga esterilizada para que quepa sobre la jeringa Hamilton y limite la profundidad de inyección a 1,5 mm (Figura 1A, B). Asegure el espaciador con adhesivo o parafilm.
- Anestesiar al cachorro P7 en una cámara de isoflurano a una velocidad de entrega de 0,8 L/min. Confirme la anestesia completa monitoreando al animal para detectar disminución de la respiración y falta de respuesta de pellizco del dedo del pie o la cola (Figura 2A).
- Una vez que el animal esté completamente anestesiado, coloque a los cachorros en un pedestal equipado con un cono nasal, administrando isoflurano constante al 4% a una velocidad de entrega de 0.8 L / min. Limpie la parte superior de la cabeza del cachorro 3 veces con un hisopo estéril de betadina y luego etanol al 70%, alternando entre los dos, para preparar el sitio. Deje que la solución se seque antes de continuar.
- Usando un par de tijeras esterilizadas, haga una pequeña incisión con un corte que abarque la distancia desde la parte superior hasta la base de las orejas para revelar el cerebro posterior (Figura 2B).
- Localice el cerebelo (Figura 2C), inserte la punta expuesta de la jeringa de Hamilton a través del cráneo, perpendicular al cerebro, e inyecte 1,5 μL de mezcla de ADN en el parénquima cerebeloso empujando lentamente el émbolo posterior de la jeringa. Después de la administración de la mezcla de ADN, tire lentamente de la aguja hacia atrás para evitar derrames de espalda y permita que la solución de ADN se difunda durante 30 s.
- Apague el isoflurano y coloque el cachorro en una almohadilla térmica a 37 °C. Prepare el electrodo tipo pinza para la electroporación sumergiendo ambos extremos en PBS estéril 1x.
NOTA: Mojar el electrodo tipo pinza evitará quemaduras de contacto en la piel del cachorro durante la administración de los pulsos eléctricos. - Oriente la pinza-electrodo por encima del sitio de inyección con el extremo más hacia abajo y el extremo negativo por encima de la cabeza del animal (Figura 2D). Administre cinco pulsos eléctricos desde el electroporador con los siguientes ajustes: intervalo entre pulsos de 50 ms, 130 V y 950 ms.
NOTA: Si es necesario, realice una inyección de prueba para asegurarse de que el sitio de inyección esté ubicado en el vermis cerebeloso (Figura 2E). - Pellizque la incisión cerrada y selle la herida con un adhesivo tisular de cianoacrilato n-butil-éster no tóxico. Limpie la herida con etanol al 70%, ya que cualquier rastro de sangre aumenta la probabilidad de infanticidio y canibalismo parental.
- Deje que el animal se recupere en una almohadilla térmica de 37 ° C antes de devolver el cachorro a la madre. Controle a los cachorros cada 30 minutos durante al menos 2 h después de la cirugía para garantizar una recuperación completa.
NOTA: El infanticidio por cualquiera de los padres es bastante común. Para evitar el canibalismo, aloje al padre en una jaula diferente antes de comenzar la electroporación, y siempre devuelva a los cachorros limpios y recuperados (es decir, sin manchas de sangre, completamente móviles) a la jaula original en la cama original. Los cachorros también se pueden limpiar con excrementos de la jaula original para minimizar el olor a sangre. El uso de una madre sustituta puede ser necesario si la madre original continúa canibalizando a sus cachorros.

Figura 2: Electroporación cerebelosa in vivo de progenitores de neuronas granulares en crías de ratón de tipo salvaje P7. (A) Los cachorros son anestesiados con isoflurano al 4% administrado a una velocidad de 0.8L / min para asegurar la anestesia durante toda la inyección de la solución de ADN. El isoflurano se administra a una velocidad de 0,8 L/min. (B) Después de esterilizar al ratón 3 veces con betadina y etanol al 70%, se realiza una incisión que abarca la distancia de las orejas, revelando el cerebro posterior. (C) Una imagen ampliada de una demarcación blanca en el cráneo, un punto de referencia para el sitio de inyección. La construcción de ADN debe inyectarse dentro de 1 mm por encima de la marca; Las líneas punteadas delinean la demarcación, y la flecha negra denota el sitio de inyección. Las crestas del vermis cerebeloso pueden ser visibles y pueden ser útiles para encontrar el sitio de inyección. (D) Orientación del electrodo tipo pinza para una electroporación eficiente. El extremo más (+) debe estar orientado hacia abajo para atraer ADN cargado negativamente hacia el parénquima cerebeloso antes de la administración de pulsos eléctricos. (E) La inyección de prueba de 1 μL de un colorante verde rápido al 0,02% muestra que la inyección se localiza en el centro del vermis cerebeloso entre los lobulillos 5-7. Haga clic aquí para ver una versión más grande de esta figura.
3. Inmunohistoquímica de CGNs electroporados
- Reúna los siguientes materiales: isoflurano, 1x PBS, 4% de paraformaldehído (PFA), 30% de sacarosa, suero normal de cabra, detergente no iónico, portaobjetos de vidrio, cubreobjetos de vidrio, esmalte de uñas, medios de montaje, tinte nuclear Hoechst y anticuerpos primarios y secundarios apropiados (consulte la Tabla de materiales).
- Anestesiar al animal experimental con isoflurano y confirmar la anestesia completa con un pellizco para el dedo del pie y la cola.
- Realizar una perfusión transcárdica inyectando lentamente 1x PBS y 4% PFA en el ventrículo izquierdo del corazón del animal. Deje que la sangre drene del animal cortando la vena cava.
- Arregle el cerebro durante la noche sumergiéndolo en PFA al 4% a 4 °C. Al día siguiente, enjuague rápidamente el cerebro con 1x PBS y transfiera el cerebro a sacarosa al 30% en 1x PBS para crioprotección durante al menos 24 h.
- Si es necesario, corte el cerebro por la mitad a lo largo del eje rostral-caudal y confirme la expresión de la construcción del reportero transfectado utilizando un microscopio de disección fluorescente vertical.
NOTA: Mantenga el cerebro sumergido en 1x PBS en un plato pequeño para evitar que se seque. - Monte el cerebro en un micrótomo de congelación, corte secciones sagitales de 25 μm y permita que las secciones se desarrollen en una mezcla 1: 1 de PBS y glicerol.
NOTA: Las secciones se pueden almacenar en esta solución crioprotectora a -20 °C para su almacenamiento a largo plazo. - Lave las secciones tres veces en 1x PBS durante 10 minutos cada una para eliminar el crioprotector, y bloquee el tejido en 1x PBS + 10% de suero de cabra normal + 0,2% de detergente no iónico en un agitador orbital a temperatura ambiente durante 1 h.
- Preparar solución primaria de anticuerpos: 1x PBS, suero de cabra normal al 10%, detergente no iónico al 0,2% y anticuerpo anti-GFP, y centrifugar la solución durante 5 min a >16.000 × g. Incubar secciones en la solución de anticuerpos a 4 °C en un agitador orbital durante 48 h.
- Lave la solución de anticuerpos primarios durante 15 minutos cinco veces con 1x PBS + 0,2% de detergente no iónico.
- Preparar solución de anticuerpos secundarios: 1x PBS, suero de cabra normal al 10%, detergente no iónico al 0,2% y un anticuerpo secundario apropiado para detectar GFP; Centrifugar la solución a >16.000 × g. Incubar secciones en la solución de anticuerpos en un agitador orbital a temperatura ambiente durante 2-3 h. Proteja las secciones de la exposición a la luz para evitar el blanqueamiento.
- Lave la solución de anticuerpos secundarios tres veces con 1x PBS + 0.2% de detergente no iónico durante 15 minutos cada vez. Incubar secciones en 1x PBS + Hoechst durante 5 min para teñir núcleos.
- Lave la solución Hoechst con 1x PBS + 0,2% de detergente no iónico y móntela en portaobjetos de vidrio. Cubra las secciones con medios de montaje, cubra los portaobjetos y selle el portaobjetos con esmalte de uñas para evitar la evaporación.
4. Análisis morfológicos de CGNs - reconstrucción tridimensional (3D) y área superficial y volumen celular
- Imagen de CGN electroporadas individuales en un microscopio confocal a un objetivo de 63x con un zoom de 2x, tomando imágenes de pila z a 0,5 μm por pila. Imagen de una celda por ventana de imagen para permitir un fácil análisis y reconstrucción de la imagen.
- Instale el plug-in Simple Neurite Tracer para FIJI utilizando el siguiente enlace (https://imagej.net/Simple_Neurite_Tracer:_Basic_Instructions) para rastrear fácil y eficientemente la estructura de CGN electroporados en el espacio tridimensional (3D).
NOTA: Hay una versión actualizada del plug-in (https://imagej.net/SNT). - Analice la longitud de la neurita y la formación de garras dendríticas de manera ciega utilizando Simple Neurite Tracer. Cargue imágenes z-stack de un solo canal de CGN electroporadas en FIJI y haga clic en Plugins | Segmentación | Trazador simple de neuritas (Figura 3D).
- Acceda al menú desplegable y seleccione Crear nuevo visor 3D (Figura 3D).
- Desplácese hasta la base de una dendrita, donde se conecta al soma celular y comience un camino haciendo clic en la unión. Trace manualmente la ruta haciendo clic en las secciones donde la señal de relleno de celda es más brillante, presionando [y] para mantener la traza. Traza hasta el final de la dendrita si no contiene una garra o hasta la base de la garra y confirma la trayectoria presionando [f] (Figura 4D).
- A continuación, trace la garra comenzando un camino en la base de la estructura y rastreando hasta el final de la neurita más larga. Rastree las ramas secundarias y terciarias manteniendo pulsada la tecla [ctrl] en Windows o [alt] en un Mac OS y haciendo clic en la ruta. Confirme la ruta pulsando [f].
- Observe que las mediciones de las trazas son visibles en una ventana separada; Sume todas las medidas de las ramas de la garra (primaria, secundaria, terciaria) para obtener la longitud total de cada garra.
- Para analizar el área superficial y el volumen celular de CGN electroporadas, descargue el software de análisis celular Imaris (https://imaris.oxinst.com/).
NOTA: FIJI también se puede utilizar para reconstruir celdas en 3D a partir de imágenes z-stack utilizando plug-ins gratuitos y fácilmente disponibles. Además, hay una función de representación volumétrica en Simple Neurite Tracer, pero Imaris se utilizó por las razones que se describen a continuación. - Sube una imagen z-stack de un CGN electroporado en Imaris. Acceda al kit de herramientas de reconstrucción 3D presionando Surpass.
- Para reconstruir el CGN, pulse Superficies y seleccione una región de interés que abarque la totalidad de la celda dentro de la ventana de imagen. Una vez que haya terminado, presione la flecha azul hacia adelante en la esquina inferior derecha debajo de Crear.
- Si la imagen contiene varios canales para diferentes señales, seleccione el canal que contiene el CGN electroporado y pulse la flecha azul hacia adelante.
- Usando la barra deslizante, establezca un umbral deseado que se ajuste con mayor precisión a la señal de la celda electroporada. Acérquese más a la superficie de la celda para determinar con precisión el umbral. Una vez terminado, pulse la doble flecha verde para reconstruir la celda y obtener el área de superficie y el tamaño del volumen a partir de los metadatos.

Figura 3: Análisis inmunohistoquímico y reconstrucción tridimensional de neuronas granulares electroporadas. Los ratones P7 CD-1 fueron electroporados con una construcción que expresa GFP. Los cerebros fueron recolectados y sometidos a inmunohistoquímica, microscopía confocal y reconstrucción 3D para análisis morfológico. (A) Línea de tiempo desde la electroporación hasta el procesamiento de imágenes de un ratón de 10 DPI. (B) Imagen de proyección máxima de una sección transversal sagital del cerebelo electroporado 10-DPI; Las líneas blancas delimitan las capas cerebelosas, y la barra de escala es de 25 μm. (C) Imagen de proyección máxima de una sola neurona granulosa electroporada 10-DPI y la traza 3D correspondiente, barra de escala es de 10 μm. (D) Las reconstrucciones 3D se generaron utilizando el plugin FIJI Simple Neurite Tracer. Todas las mediciones se rastrearon a través de la pila z, siguiendo la señal de llenado de celdas. Las medidas del eje y la garra se trazaron por separado para cada dendrita; La línea punteada denota porción de dendrita dentro del plano actual. Abreviaturas: 3D = tridimensional; GFP = proteína verde fluorescente; DPI = días después de la inyección; PSD-95 = proteína de densidad postsináptica 95; PNB = progenitores de neuronas granulosas; PFA = paraformaldehído. Haga clic aquí para ver una versión más grande de esta figura.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results

Figura 4: Análisis de la morfología de las neuronas granulares durante el desarrollo cerebeloso. (A) Imágenes de proyección máxima de CGN electroporadas de 3-DPI a 14-DPI (edad postnatal P10 a P21), núcleos (azul) y GFP (verde); Las puntas de flecha indican dendritas individuales, y la barra de escala es de 10 μm. (B) Número promedio de dendritas. (C) Longitud media de las dendritas medida desde la base del soma hasta la punta de la dendrita. (D) Fracción de dendritas que contienen una garra; Un valor de 1.00 es 100%, es decir, todas las dendritas tienen garra. (E) Longitud total de la garra dendrítica. N > 30 células por condición, recolectadas de al menos 4 animales por condición; todas las mediciones se analizaron mediante ANOVA unidireccional y una prueba de comparación múltiple de Dunnett (B, C y D) o una prueba de comparación múltiple de Tukey (E), **** denota significación con p <0.0001 a través del tiempo; las barras de errores son S.E.M. Abreviaturas: GFP = proteína verde fluorescente; DPI = días después de la inyección; PSD-95 = proteína de densidad postsináptica 95; CGNs = neuronas granulares cerebelosas; ANOVA = análisis de varianza; S.E.M. = error estándar de la media. Haga clic aquí para ver una versión más grande de esta figura.
Para estudiar el desarrollo de la morfología de las neuronas granulares in vivo, se electroporó una construcción que expresa GFP bajo el control de un promotor de ubiquitina humana (FUGW) en el cerebelo en desarrollo de ratones CD-1 y cerebros recolectados 3, 5, 7, 10 y 14 días después de la inyección (DPI). El marcado disperso de células por electroporación en combinación con microscopía confocal captura instantáneas de CGN durante períodos de poda, crecimiento y maduración dendrítica. Para analizar cuantitativamente y rastrear el crecimiento de las estructuras sinápticas de CGN, se rastreó cada dendrita utilizando el complemento FIJI Simple Neurite Tracer (SNT). SNT es un método fácil, rápido, eficiente y fácilmente disponible para medir la longitud de neuritas y garras en el espacio tridimensional (3D). Por el contrario, Imaris se utilizó para la reconstrucción 3D de CGN para obtener mediciones de área de superficie y volumen porque el programa proporciona una representación rápida y precisa de cada celda, y sus capacidades de umbral pueden aislar células marcadas de restos celulares etiquetados cercanos.
Las CGN recién nacidas experimentan una fase exuberante de crecimiento dendrítico seguida de un refinamiento de P10 a P14 (3 a 7 DPI) que resulta en la poda de más del 50% del exceso de dendritas (Figura 4B). Este evento coincide con el alargamiento gradual de los cenadores restantes (Figura 4C) y la formación de estructuras en forma de garra al final de cada dendrita (Figura 4D), lo que indica que estos procesos de desarrollo están ocurriendo simultáneamente. Sin embargo, mientras que las garras se encuentran en aproximadamente el 75% de las dendritas por P14 (7-DPI), estas estructuras continúan aumentando de tamaño hasta P21 (14-DPI) (Figura 4E).
Los cambios en la morfología de las dendritas y las garras podrían reflejar un cambio general en el tamaño total de la célula o una redistribución de la membrana celular. Para abordar esta pregunta, cada neurona granular marcada se reconstruyó en Imaris para cuantificar el área de superficie y el volumen somatodendríticos totales. El tamaño de CGN se mantuvo relativamente constante a lo largo del desarrollo (Figura 5A, B), aunque en P14, las CGN exhiben una disminución significativa del 20% en el volumen en comparación con P10, P12 y P17 (3, 5 y 10 DPI) (Figura 5B). Estos datos sugieren que el reciclaje de membranas de dendritas retraídas puede ser particularmente importante para permitir la ampliación de las terminaciones dendríticas en garras y apuntan a P14 (7-DPI) como un punto de tiempo clave en la transición de la poda al desarrollo de la sinapsis.

Figura 5: Análisis del tamaño de la neurona granular durante el desarrollo cerebeloso. Las CGN electroporadas se reconstruyeron en Imaris para determinar el tamaño celular. (A-B) Área superficial y análisis volumétrico de neuronas granulares (es decir, soma celular y dendritas) durante el desarrollo cerebeloso. N > 30 células por condición, recolectadas de al menos 4 animales por condición. Todas las mediciones fueron analizadas por ANOVA unidireccional y una prueba de comparación múltiple de Dunnett, ** denota significación con p <0,005; las barras de errores son S.E.M. Abreviaturas: DPI = días después de la inyección; CGNs = neuronas granulares cerebelosas; ANOVA = análisis de varianza; S.E.M. = error estándar de la media. Haga clic aquí para ver una versión más grande de esta figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Las neuronas granulares cerebelosas son las neuronas más abundantes en el cerebro de los mamíferos, constituyendo casi el 60-70% de la población total de neuronas en el cerebro de roedores 1,14. El cerebelo ha sido ampliamente utilizado para dilucidar los mecanismos de proliferación celular, migración, formación de dendritas y desarrollo de sinapsis 6,9,10,11,15,16,17,18,19,20 . Además, décadas de estudios electrofisiológicos han ayudado a establecer el papel de las neuronas granulares en la plasticidad cerebelosa a largo plazo, que subyace a la participación del circuito en los comportamientos motores aprendidos21,22,23. Por lo tanto, las neuronas granulares son un excelente sistema modelo para interrogar preguntas clave sobre la sinapsis y el desarrollo de circuitos.
El objetivo de este estudio es destacar una técnica que aprovecha el cerebelo para rastrear la morfología de un solo tipo de neurona in vivo. La electroporación del cerebelo se dirige a las células en división; Por lo tanto, es técnicamente capaz de etiquetar tanto progenitores de neuronas granulares como células gliales, aunque debido a que los progenitores de neuronas granulares son tan numerosos, la población electroporada es en gran parte neuronal, incluso sin la necesidad de promotores específicos de tipo celular. Además, esta técnica se puede adaptar para manipular genéticamente genes in vivo para estudiar sus roles en el desarrollo de CGN. Esto se puede lograr mediante la transfección de un plásmido que expresa ARN de horquilla corta o de interferencia pequeña para derribar genes o un plásmido que expresa Cre recombinasa en una cepa de ratón transgénico para extirpar regiones flanqueadas por sitios LoxP y eliminar el gen de interés previsto10,24.
La electroporación tiene fortalezas y debilidades para los estudios genéticos. Ofrece un método más rápido para manipular genes en comparación con las estrategias transgénicas tradicionales, aunque la sobriedad de la electroporación limita su utilidad para los estudios de comportamiento, que requieren un gran número de células modificadas genéticamente para ver los efectos. Una segunda limitación es que solo se dirige de manera confiable a las neuronas granulares entre los lóbulos 5 y 7, y esto se debe, en parte, a cómo se orienta el cerebelo en el sitio de inyección. Sin embargo, dentro de la región electroporada, este método produce un número relativamente grande de células marcadas individualmente, lo que brinda el potencial de mediciones estadísticamente robustas. Por ejemplo, no sólo fue posible seguir el desarrollo de las dendritas a lo largo del tiempo, sino que también se pudieron medir redistribuciones sutiles de membrana entre las dendritas y las garras, ampliando los datos previamente publicados20. Las garras CGN son particularmente interesantes de estudiar, ya que la ampliación de estas estructuras dendríticas proporciona un espacio adicional para que las neuronas granulares formen conexiones excitatorias con terminales de fibra musgosa y células de cepillo unipolares, así como conexiones inhibitorias con células de Golgi cercanas. Por lo tanto, la combinación de estas mediciones dendríticas con el marcado inmunohistoquímico de proteínas pre y postsinápticas específicas podría ser útil para avanzar en el estudio de la formación del circuito cerebeloso y la maduración de la sinapsis.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Los autores declaran no tener conflictos de intereses.
Acknowledgments
El trabajo fue apoyado por las subvenciones de los NIH R01NS098804 (A.E.W.), F31NS113394 (U.C.) y el Programa de Neurociencia de Verano (DG) de la Universidad de Duke.
Materials
| Name | Company | Catalog Number | Comments |
| Betadine | Purdue Production | 67618-150-17 | |
| Cemented 10 µL needle | Hamilton | 1701SN (80008) | 33 gauge, 1.27 cm (0.5 in), 4 point style |
| Chicken anti-GFP | Millipore Sigma | AB16901 | Our lab uses this antibody at a 1:1000 concentration |
| Cotton-tip applicator | |||
| Donkey anti-chicken Cy2 | Jackson ImmunoResearch | 703-225-155 | Our lab uses this antibody at a 1:500 concentration |
| Ethanol (200 proof) | Koptec | V1016 | |
| Electroporator ECM 830 | BTX Harvard Apparatus | 45-0052 | |
| Fast Green FCF | Sigma | F7252-5G | |
| FUGW plasmid | Addgene | 14883 | |
| Glass slides | VWR | 48311-703 | Superfrost plus |
| Glycerol | Sigma-Aldrich | G5516 | |
| Heating pad | Softheat | ||
| Hoescht 33342 fluorescent dye | Invitrogen | 62249 | |
| Imaris | Bitplane | ||
| Isoflurane | Patterson Veterinary | 07-893-1389 | |
| Micro cover glass | VWR | 48382-138 | |
| Nail polish | Sally Hansen | Color 109 | |
| Normal goat serum | Gibco | 16210064 | |
| O.C.T. embedding compound | Tissue-Tek | 4583 | |
| Olympus MVX10 Dissecting Scope | Olympus | MVX10 | |
| P200 pipette reach tip | Fisherbrand | 02-707-138 | Used for needle spacer |
| Parafilm | Bemis | PM-996 | |
| PBS pH 7.4 (10x) | Gibco | 70011-044 | |
| Simple Neurite Tracer | FIJI | https://imagej.net/Simple_Neurite_Tracer:_Basic_ Instructions |
|
| Sucrose | Sigma | S0389 | |
| Surgical tools | RWD Life Science | Small scissors and tweezers | |
| Triton X-100 | Roche | 11332481001 | non-ionic detergent |
| Tweezertrodes | BTX Harvard Apparatus | 45-0489 | 5 mm, platinum plated tweezer-type electrodes |
| Ultrapure distilled water | Invitrogen | 10977-015 | |
| Vectashield mounting media | Vectashield | H1000 | |
| Vetbond tissue adhesive | 3M | 1469SB | |
| Zeiss 780 Upright Confocal | Zeiss | 780 |
References
- Altman, J., Bayer, S. A. Development of the cerebellar system : in relation to its evolution, structure, and functions. , CRC Press. (1997).
- Rahimi-Balaei, M., Bergen, H., Kong, J., Marzban, H. Neuronal migration during development of the cerebellum. Frontiers in Cellular Neuroscience. 12, 484 (2018).
- Alder, J., Cho, N. K., Hatten, M. E. Embryonic precursor cells from the rhombic lip are specified to a cerebellar granule neuron identity. Neuron. 17 (3), 389-399 (1996).
- Hatten, M. E., Heintz, N. Mechanisms of neural patterning and specification in the developing cerebellum. Annual Review of Neuroscience. 18, 385-408 (1995).
- Ben-Arie, N., et al. Math1 is essential for genesis of cerebellar granule neurons. Nature. 390 (6656), 169-172 (1997).
- Borghesani, P. R., et al. BDNF stimulates migration of cerebellar granule cells. Development. 129 (6), 1435-1442 (2002).
- Espinosa, J. S., Luo, L. Timing neurogenesis and differentiation: insights from quantitative clonal analyses of cerebellar granule cells. Journal of Neuroscience. 28 (10), 2301-2312 (2008).
- Markwalter, K. H., Yang, Y., Holy, T. E., Bonni, A. Sensorimotor coding of vermal granule neurons in the developing mammalian cerebellum. Journal of Neuroscience. 39 (34), 6626-6643 (2019).
- Shalizi, A., et al. PIASx is a MEF2 SUMO E3 ligase that promotes postsynaptic dendritic morphogenesis. Journal of Neuroscience. 27 (37), 10037-10046 (2007).
- Shalizi, A., et al. A Calcium-regulated MEF2 sumoylation switch controls poststynaptic differentiation. Science. 311 (5763), 1012-1017 (2006).
- Konishi, Y., Stegmuller, J., Matsuda, T., Bonni, S., Bonni, A. Cdh1-APC controls axonal growth and patterning in the mammalian brain. Science. 303 (5660), 1026-1030 (2004).
- Holubowska, A., Mukherjee, C., Vadhvani, M., Stegmuller, J. Genetic manipulation of cerebellar granule neurons in vitro and in vivo to study neuronal morphology and migration. Journal of Visualized Experiments: JoVE. (85), e51070 (2014).
- Yang, Y., et al. Chromatin remodeling inactivates activity genes and regulates neural coding. Science. 353 (6296), 300-305 (2016).
- Herculano-Houzel, S. Coordinated scaling of cortical and cerebellar numbers of neurons. Frontiers in Neuroanatomy. 4, 12 (2010).
- Wilson, P. M., Fryer, R. H., Fang, Y., Hatten, M. E. Astn2, a novel member of the astrotactin gene family, regulates the trafficking of ASTN1 during glial-guided neuronal migration. Journal of Neuroscience. 30 (25), 8529-8540 (2010).
- Kokubo, M., et al. BDNF-mediated cerebellar granule cell development is impaired in mice null for CaMKK2 or CaMKIV. Journal of Neuroscience. 29 (28), 8901-8913 (2009).
- Schwartz, P. M., Borghesani, P. R., Levy, R. L., Pomeroy, S. L., Segal, R. A. Abnormal cerebellar development and foliation in BDNF-/- mice reveals a role for neurotrophins in CNS patterning. Neuron. 19 (2), 269-281 (1997).
- Segal, R. A., Pomeroy, S. L., Stiles, C. D. Axonal growth and fasciculation linked to differential expression of BDNF and NT3 receptors in developing cerebellar granule cells. Journal of Neuroscience. 15 (7), Pt 1 4970-4981 (1995).
- Zhou, P., et al. Polarized signaling endosomes coordinate BDNF-induced chemotaxis of cerebellar precursors. Neuron. 55 (1), 53-68 (2007).
- Dhar, M., Hantman, A. W., Nishiyama, H. Developmental pattern and structural factors of dendritic survival in cerebellar granule cells in vivo. Scientific Reports. 8 (1), 17561 (2018).
- Ito, M. Synaptic plasticity in the cerebellar cortex and its role in motor learning. Canadian Journal of Neurological Sciences. 20, Suppl 3 70-74 (1993).
- Jorntell, H., Hansel, C. Synaptic memories upside down: bidirectional plasticity at cerebellar parallel fiber-Purkinje cell synapses. Neuron. 52 (2), 227-238 (2006).
- Nakanishi, S. Genetic manipulation study of information processing in the cerebellum. Neuroscience. 162 (3), 723-731 (2009).
- Chang, C. H., et al. Atoh1 controls primary cilia formation to allow for SHH-triggered granule neuron progenitor proliferation. Developmental Cell. 48 (2), 184-199 (2019).
Tags
Neurociencia Número 172 Desarrollo neuronal cerebelo dendrita sinapsis neurona granular electroporaciónErratum
Formal Correction: Erratum: Utilizing In Vivo Postnatal Electroporation to Study Cerebellar Granule Neuron Morphology and Synapse Development
Posted by JoVE Editors on 04/06/2023.
Citeable Link.
An erratum was issued for: Utilizing In Vivo Postnatal Electroporation to Study Cerebellar Granule Neuron Morphology and Synapse Development. A figure was updated.
Figure 2 was updated from:
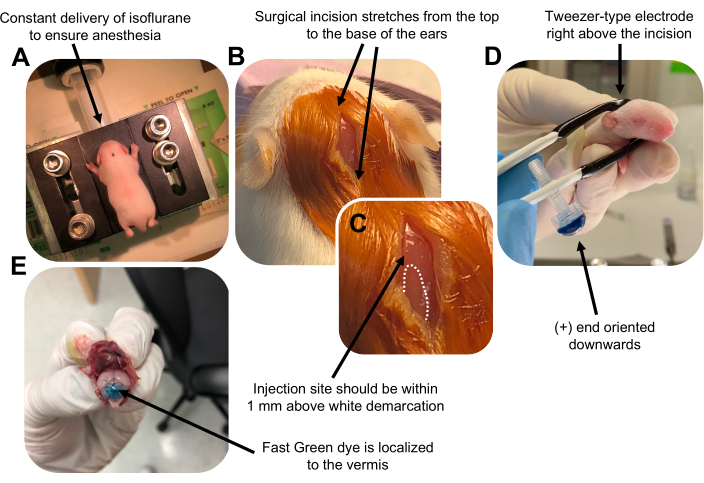
Figure 2: In vivo cerebellar electroporation of granule neuron progenitors in P7 wildtype mouse pups. (A) Pups are anesthetized with 4% isoflurane delivered at a rate of 0.8L/min to ensure anesthesia throughout the injection of the DNA solution. Isoflurane is delivered at a rate of 0.8 L/min. (B) After sterilizing the mouse 3 times with betadine and 70% ethanol, an incision is made that spans the distance of the ears, revealing the hindbrain. (C) A magnified image of a white demarcation on the cranium, a landmark for the injection site. DNA construct should be injected within 1 mm above the mark; dotted lines outline the demarcation, and black arrow denotes the injection site. The ridges of the cerebellar vermis may be visible and can be useful for finding the injection site. (D) Tweezer-type electrode orientation for efficient electroporation. Plus (+) end must be oriented downwards to pull negatively charged DNA into the cerebellar parenchyma prior to administration of electrical pulses. (E) Test injection of 1 µL of a 0.02% Fast Green dye shows injection is localized to the middle of the cerebellar vermis between lobules 5-7. Please click here to view a larger version of this figure.
to:
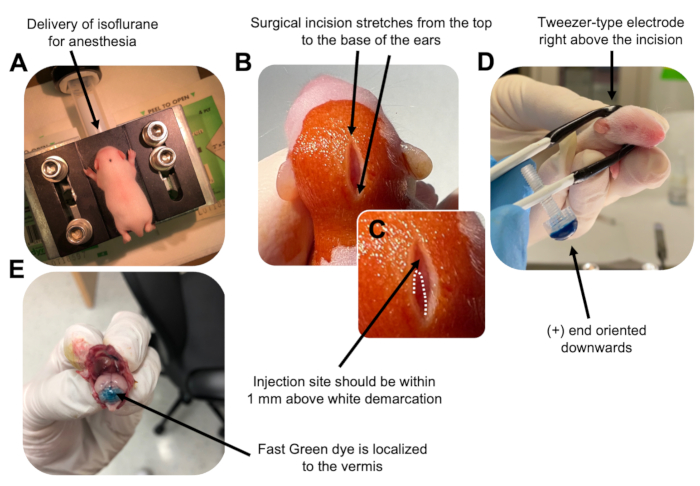
Figure 2: In vivo cerebellar electroporation of granule neuron progenitors in P7 wildtype mouse pups. (A) Pups are anesthetized with 4% isoflurane delivered at a rate of 0.8L/min to ensure anesthesia throughout the injection of the DNA solution. Isoflurane is delivered at a rate of 0.8 L/min. (B) After sterilizing the mouse 3 times with betadine and 70% ethanol, an incision is made that spans the distance of the ears, revealing the hindbrain. (C) A magnified image of a white demarcation on the cranium, a landmark for the injection site. DNA construct should be injected within 1 mm above the mark; dotted lines outline the demarcation, and black arrow denotes the injection site. The ridges of the cerebellar vermis may be visible and can be useful for finding the injection site. (D) Tweezer-type electrode orientation for efficient electroporation. Plus (+) end must be oriented downwards to pull negatively charged DNA into the cerebellar parenchyma prior to administration of electrical pulses. (E) Test injection of 1 µL of a 0.02% Fast Green dye shows injection is localized to the middle of the cerebellar vermis between lobules 5-7. Please click here to view a larger version of this figure.



