ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Här beskriver vi en metod för att visualisera synaptogenes av granulneuroner i musens lillhjärna över tidsförloppet för postnatal hjärnutveckling när dessa celler förfinar sina synaptiska strukturer och bildar synapser för att integrera sig i den övergripande hjärnkretsen.
Abstract
Neuroner genomgår dynamiska förändringar i sin struktur och funktion under hjärnans utveckling för att bilda lämpliga förbindelser med andra celler. Gnagarcerebellum är ett idealiskt system för att spåra utvecklingen och morfogenesen av en enda celltyp, cerebellär granulneuron (CGN), över tiden. Här användes in vivo-elektroporering av granulatneuronprogenitorer i den utvecklande muslillhjärnan för att glest märka celler för efterföljande morfologiska analyser. Effekten av denna teknik demonstreras i dess förmåga att visa upp viktiga utvecklingsstadier av CGN-mognad, med ett specifikt fokus på bildandet av dendritiska klor, vilka är specialiserade strukturer där dessa celler får majoriteten av sina synaptiska ingångar. Förutom att tillhandahålla ögonblicksbilder av CGN-synaptiska strukturer under hela cerebellär utveckling kan denna teknik anpassas för att genetiskt manipulera granulneuroner på ett cellautonomt sätt för att studera rollen för vilken gen som helst av intresse och dess effekt på CGN-morfologi, kloutveckling och synaptogenes.
Introduction
Hjärnans utveckling är en långvarig process som sträcker sig från embryogenes till postnatalt liv. Under denna tid integrerar hjärnan en kombination av inneboende och yttre stimuli som skulpterar ledningarna av synapser mellan dendriter och axoner för att i slutändan styra beteendet. Gnagare cerebellum är ett idealiskt modellsystem för att studera hur synapser utvecklas eftersom utvecklingen av en enda neurontyp, cerebellar granulat neuron (CGN), kan spåras när den övergår från en stamcell till en mogen neuron. Detta beror delvis på det faktum att en majoritet av cerebellär cortex utvecklas postnatalt, vilket möjliggör enkel genetisk manipulation och cellmärkning efter födseln1.
Hos däggdjur börjar CGN-differentiering i slutet av embryonal utveckling när en delmängd av proliferativa celler i bakhjärnan migrerar över den rombiska läppen för att bilda en sekundär germinal zon på ytan av cerebellum 2,3,4. Även om de är helt engagerade i en granulneuronprogenitoridentitet (GNP), fortsätter dessa celler att proliferera inom den yttre delen av det yttre granulatskiktet (EGL) fram till postnatal dag 14 (P14). Proliferation av detta lager resulterar i en massiv expansion av cerebellum eftersom dessa celler ger upphov uteslutande till CGN5. När nyfödda CGN lämnar cellcykeln i EGL migrerar de inåt mot det inre granulatskiktet (IGL) och lämnar efter sig ett axon som kommer att dela sig och resa i molekylskiktet i cerebellum och bilda parallella fibrer som synaps på Purkinje-celler6. Positionen för dessa fibrer inom molekylskiktet är beroende av tidpunkten för cellcykelutgången.
CGN som differentierar först lämnar sina parallella fibrer mot botten av molekylskiktet, medan axonerna av CGN som differentieras senare är grupperade på toppen 7,8. När CGN-cellkropparna når IGL börjar de utarbeta dendriter och bilda synapser med närliggande hämmande och excitatoriska neuroner. Det mogna dendritiska trädet i en CGN uppvisar en stereotyp arkitektur med fyra huvudprocesser. Under CGN-mognaden bildar strukturerna i slutet av dessa dendriter en klo som blir berikad med postsynaptiska proteiner 9,10. Dessa specialiserade strukturer, kallade dendritiska klor, innehåller majoriteten av synapserna på granulneuroner och är viktiga för att ta emot både excitatoriska ingångar från mossiga fiberinnervationer som härrör från pons, såväl som hämmande ingångar från lokala Golgi-celler. När de är helt konfigurerade tillåter de synaptiska anslutningarna av CGN dessa celler att vidarebefordra ingångar från pre-cerebellära kärnor till Purkinje-celler, som projicerar ut ur cerebellär cortex till de djupa cerebellära kärnorna.
In vivo postnatal elektroporering av BNP är fördelaktig jämfört med andra märkningsbaserade metoder, såsom virusinfektion och generering av transgena muslinjer, eftersom uttrycket av önskade konstruktioner kan uppnås på en snabb tidslinje, och metoden riktar sig till en liten population av celler, användbar för att studera cellautonoma effekter. Denna metod har använts i tidigare studier för att studera morfologisk utveckling av CGN; Dessa studier har dock fokuserat på antingen en enda tidpunkt eller ett kort tidsfönster 9,10,11,12,13. Denna märkningsmetod parades ihop med bildanalys för att dokumentera förändringarna i CGN-morfologi som inträffar under hela CGN-differentieringens tidsförlopp under de första tre veckorna av postnatalt liv. Dessa data avslöjar dynamiken i CGN-dendritutveckling som ligger till grund för konstruktion av cerebellära kretsar.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
OBS: Alla procedurer utfördes enligt protokoll godkända av Duke University Institutional Animal Care and Use Committee (IACUC).
1. DNA-preparat för in vivo-elektroporering eller IVE (1 dag före operation)
- Samla följande material: renat DNA (0,5-25 μg per djur), 3 M natriumacetat, etanol, Fast Green-färgämne, ultrarent destillerat vatten, fosfatbuffertlösning (PBS) (se materialtabellen).
OBS: För DNA erhölls en konstruktion som uttrycker grönt fluorescerande protein (GFP) under en human ubiquitinpromotor från Addgene (FUGW, https://www.addgene.org/14883/). Varje konstruktion som uttrycker GFP eller annat fluorescerande protein under kontroll av en allestädes närvarande promotor bör fungera. CGN-specifik märkning med denna teknik är inte beroende av konstruktionen utan snarare av elektroporeringen. - Förbered DNA för elektroporering genom att blanda önskad mängd DNA, 10 volymprocent 3 M natriumacetat och 250 volymprocent 100 volymprocent iskall etanol. Observera att DNA kommer att fällas ut ur lösningen omedelbart.
- Fortsätt att fälla ut DNA-blandningen över natten vid -20 °C eller i en timme vid -80 °C.
- Pellets fällde ut DNA i en bordscentrifug vid > 16 000 × g och tvättades två gånger med 70% etanol.
- Låt DNA-pelleten torka helt och rekonstituera i en 1x PBS + 0,02% Fast Green-lösning.

Figur 1: Begränsning av injektionsdjupet till 1,5 mm med hjälp av ett distansmedel. (A) Ett segment på 11,2 mm skärs av en laddningspipett med ett rakblad. (B) Distansen monteras på spetsen av Hamilton-sprutan (total längd är 1,27 cm eller 0,5 tum) och säkras med antingen lim eller parafilm. Den exponerade spetsen ska vara 1,5 mm lång. Klicka här för att se en större version av denna figur.
2. In vivo elektroporering av granulneuronprogenitorer hos sju dagar gamla postnatala möss
OBS: Alla elektroporeringsoperationer utfördes i en steril och mycket ventilerad kirurgisk svit, och all personal bar komplett personlig skyddsutrustning inklusive handskar, ansiktsmask, hårhuva, klänning och skoskydd. Alternativt kan operationerna utföras i en ventilerad och steril huv.
- Samla följande material: DNA för elektroporering, liten kirurgisk sax, liten kirurgisk pincett, anpassad Hamilton-spruta, bomullsapplikator, värmedyna, betadin, 70% etanol, 1x PBS, parafilm, vävnadslim (n-butylestercyanoakrylat), isofluran, elektroporator och pincettelektroder (se materialtabellen).
- Skär en distans från en steriliserad laddningsspets för att passa över Hamilton-sprutan för att begränsa injektionsdjupet till 1,5 mm (figur 1A, B). Säkra distansen med lim eller parafilm.
- Bedöva P7-ungen i en isoflurankammare med en leveranshastighet på 0,8 l/min. Bekräfta full anestesi genom att övervaka djuret för minskad andning och brist på tå- eller svansklämrespons (figur 2A).
- När djuret är helt bedövat, placera ungarna på en piedestal försedd med en noskon, vilket ger konstant 4% isofluran vid en leveranshastighet på 0,8 l / min. Rengör toppen av valpens huvud 3 gånger med en steril vattpinne betadin och sedan 70% etanol, alternerande mellan de två, för att förbereda platsen. Låt lösningen torka innan du fortsätter.
- Använd en steriliserad sax och gör ett litet snitt med ett snitt som sträcker sig över avståndet från toppen till öronbasen för att avslöja bakhjärnan (figur 2B).
- Leta reda på lillhjärnan (figur 2C), sätt in den exponerade spetsen på Hamilton-sprutan genom skallen, vinkelrätt mot hjärnan och injicera 1,5 μL DNA-blandning i lillhjärnans parenkym genom att långsamt trycka in sprutans bakre kolv. Efter leverans av DNA-blandningen, dra långsamt tillbaka nålen för att förhindra ryggspill och låt DNA-lösningen diffundera i 30 sekunder.
- Stäng av isofluran och placera ungen på en värmedyna på 37 °C. Förbered elektroden av pincetttyp för elektroporering genom att doppa båda ändarna i steril 1x PBS.
OBS: Vätning av pincettelektroden förhindrar kontaktbrännskador på valpens hud under administrering av de elektriska pulserna. - Rikta pincettelektroden ovanför injektionsstället med plusänden nedåt och den negativa änden ovanför djurets huvud (figur 2D). Administrera fem elektriska pulser från elektroporatorn med följande inställningar: 50 ms, 130 V och 950 ms interpulsintervall.
OBS: Om det behövs, utför en testinjektion för att säkerställa att injektionsstället är beläget på lillhjärnans vermis (figur 2E). - Nyp snittet stängt och försegla såret med ett giftfritt n-butylestercyanoakrylatvävnadslim. Rengör såret med 70% etanol eftersom varje spårmängd blod ökar sannolikheten för barnmord och kannibalism.
- Låt djuret återhämta sig på en värmedyna på 37 °C innan ungen återför den till moderdjuret. Övervaka valpen var 30: e minut i minst 2 timmar efter operationen för att säkerställa full återhämtning.
OBS: Barnamord av endera föräldern är ganska vanligt. För att förhindra kannibalism, hysa fadern i en annan bur innan du börjar elektroporeringen och returnera alltid rengjorda och återhämtade valpar (dvs . ingen blodfläck, helt mobil) till den ursprungliga buren på det ursprungliga sängkläderna. Valpar kan också torkas med spillning från den ursprungliga buren för att minimera lukten av blod. Användningen av en surrogatdamm kan vara nödvändig om den ursprungliga dammen fortsätter att kannibalisera sina valpar.

Figur 2: In vivo cerebellär elektroporering av granulneuronprogenitorer i P7 vildtypsmusvalpar. (A) Ungarna bedövas med 4% isofluran levererat med en hastighet av 0,8 l/min för att säkerställa anestesi under hela injektionen av DNA-lösningen. Isofluran levereras med en hastighet av 0,8 l/min. (B) Efter sterilisering av musen 3 gånger med betadin och 70% etanol görs ett snitt som sträcker sig över öronens avstånd och avslöjar bakhjärnan. C) En förstorad bild av en vit avgränsning på kraniet, ett landmärke för injektionsstället. DNA-konstruktion ska injiceras inom 1 mm ovanför märket; Prickade linjer beskriver avgränsningen och svart pil anger injektionsstället. Åsarna på lillhjärnans vermis kan vara synliga och kan vara användbara för att hitta injektionsstället. (D) Elektrodorientering av pincetttyp för effektiv elektroporering. Plus (+) änden måste orienteras nedåt för att dra negativt laddat DNA in i cerebellär parenkym före administrering av elektriska pulser. (E) Testinjektion av 1 μL av ett 0,02% Fast Green-färgämne visar att injektionen är lokaliserad till mitten av cerebellär vermis mellan lobulerna 5-7. Klicka här för att se en större version av denna figur.
3. Immunhistokemi av elektroporerade CGN
- Samla in följande material: isofluran, 1x PBS, 4% paraformaldehyd (PFA), 30% sackaros, normalt getserum, icke-joniskt rengöringsmedel, glasskivor, glastäckglas, nagellack, monteringsmedia, Hoechst nukleärt färgämne och lämpliga primära och sekundära antikroppar (se materialtabellen).
- Bedöva försöksdjuret med isofluran och bekräfta full anestesi med tå och svansnypa.
- Utför en transkardiell perfusion genom att långsamt injicera 1x PBS och 4% PFA i vänster kammare i djurets hjärta. Låt blodet rinna ur djuret genom att skära vena cava.
- Fixera hjärnan över natten genom att sänka ner den i 4% PFA vid 4 ° C. Följande dag, skölj snabbt hjärnan med 1x PBS och överför hjärnan till 30% sackaros i 1x PBS för kryoprotektion i minst 24 timmar.
- Om nödvändigt, skär hjärnan i hälften längs den rostral-kaudala axeln och bekräfta uttrycket av den transfekterade reporterkonstruktionen med hjälp av ett upprätt fluorescerande dissekeringsmikroskop.
OBS: Håll hjärnan nedsänkt i 1x PBS i en liten skål för att förhindra att den torkar ut. - Montera hjärnan på en frysande mikrotom, skiva 25 μm sagittala sektioner och låt sektioner utvecklas i en 1: 1-blandning av 1x PBS och glycerol.
OBS: Sektioner kan förvaras i denna kryoskyddande lösning vid -20 ° C för långvarig lagring. - Tvätta sektioner tre gånger i 1x PBS i 10 minuter vardera för att avlägsna kryoskyddsmedel och blockera vävnaden i 1x PBS + 10% normalt getserum + 0,2% icke-joniskt tvättmedel på en orbitalskakare vid rumstemperatur i 1 timme.
- Förbered primär antikroppslösning: 1x PBS, 10% normalt getserum, 0,2% icke-joniskt tvättmedel och anti-GFP-antikropp och centrifugera lösningen i 5 minuter vid >16 000 × g. Inkubera snitt i antikroppslösningen vid 4 °C i orbitalskakare i 48 timmar.
- Tvätta av primär antikroppslösning i 15 min fem gånger med 1x PBS + 0,2% icke-joniskt tvättmedel.
- Förbered sekundär antikroppslösning: 1x PBS, 10% normalt getserum, 0,2% icke-joniskt tvättmedel och en lämplig sekundär antikropp för att detektera GFP; Centrifugera lösningen vid >16 000 × g. Inkubera sektioner i antikroppslösningen på en orbitalskakare vid rumstemperatur i 2-3 timmar. Skydda sektionerna från ljusexponering för att förhindra blekning.
- Tvätta bort sekundär antikroppslösning tre gånger med 1x PBS + 0,2% icke-joniskt tvättmedel i 15 minuter varje gång. Inkubera sektioner i 1x PBS + Hoechst i 5 minuter för att färga kärnor.
- Tvätta Hoechst-lösningen med 1x PBS + 0,2% icke-joniskt rengöringsmedel och montera på glasskivor. Täck sektionerna med monteringsmedia, täckglid glasen och försegla bilden med nagellack för att förhindra avdunstning.
4. Morfologiska analyser av CGN - tredimensionell (3D) rekonstruktion och ytarea och cellulär volym
- Bild enstaka elektroporerade CGN på ett konfokalmikroskop vid 63x mål med en 2x zoom, tar z-stackbilder vid 0,5 μm per stack. Bild en cell per bildfönster för enkel bildanalys och rekonstruktion.
- Installera plugin-programmet Simple Neurite Tracer för FIJI med hjälp av följande länk (https://imagej.net/Simple_Neurite_Tracer:_Basic_Instructions) för att enkelt och effektivt spåra strukturen hos elektroporerade CGN i tredimensionellt (3D) utrymme.
Det finns en uppdaterad version av plugin-programmet (https://imagej.net/SNT). - Analysera neuritlängd och dendritisk klobildning på ett blindat sätt med hjälp av Simple Neurite Tracer. Ladda upp enkanals z-stack-bilder av elektroporerade CGN på FIJI och klicka på Plugins | Segmentering | Enkel neuritspårare (figur 3D).
- Öppna rullgardinsmenyn och välj Skapa ny 3D-visning (bild 3D).
- Bläddra till basen av en dendrit, där den ansluter till cellen soma och starta en väg genom att klicka på korsningen. Spåra banan manuellt genom att klicka dig igenom de avsnitt där cellfyllningssignalen är ljusast och tryck på [y] för att behålla spåret. Spåra till slutet av dendrit om den inte innehåller en klo eller till klobasen och bekräfta vägen genom att trycka på [f] (figur 4D).
- Spåra sedan kloen genom att starta en väg vid basen av strukturen och spåra till slutet av den längsta neuriten. Spåra sekundära och tertiära grenar genom att hålla ned [ctrl] i Windows eller [alt] på ett Mac OS och klicka på sökvägen. Bekräfta sökvägen genom att trycka på [f].
- Observera att mätningar för spåren är synliga på ett separat fönster; Lägg ihop alla mått på klogrenarna (primär, sekundär, tertiär) för att få den totala längden för varje klo.
- För att analysera ytarea och cellulär volym av elektroporerade CGN, ladda ner Imaris cellanalysprogramvara (https://imaris.oxinst.com/).
FIJI kan också användas för att rekonstruera celler i 3D från z-stack-bilder med hjälp av lättillgängliga och gratis plug-ins. Dessutom finns det en volymetrisk renderingsfunktion i Simple Neurite Tracer men Imaris användes av de skäl som beskrivs nedan. - Ladda upp z-stack-bild av ett elektroporerat CGN till Imaris. Öppna verktygslådan för 3D-rekonstruktion genom att trycka på Surpass.
- Om du vill rekonstruera CGN trycker du på Ytor och väljer ett intresseområde som omfattar hela cellen i bildfönstret. När du är klar trycker du på den blå framåtpilen längst ned till höger under Skapa.
- Om bilden innehåller flera kanaler för olika signaler väljer du kanalen som innehåller CGN och trycker på den blå framåtpilen.
- Använd skjutreglaget och ställ in ett önskat tröskelvärde som mest exakt passar signalen från den elektroporerade cellen. Zooma in närmare cellens yta för att exakt bestämma tröskelvärdet. När du är klar trycker du på den dubbla gröna pilen för att rekonstruera cellen och få ytan och volymstorleken från metadata.

Figur 3: Immunohistokemisk analys och tredimensionell rekonstruktion av elektroporerade granulatneuroner. P7 CD-1-möss elektroporerades med en konstruktion som uttryckte GFP. Hjärnor samlades in och utsattes för immunhistokemi, konfokalmikroskopi och 3D-rekonstruktion för morfologisk analys. (A) Tidslinje från elektroporering till bildbehandling av en mus med 10 DPI. (B) Maximal projektionsbild av ett sagittalt tvärsnitt av elektroporerad cerebellum 10-DPI; Vita linjer avgränsar cerebellära lager och skalstången är 25 μm. (C) Maximal projektionsbild av en enda elektroporerad granulatneuron 10-DPI och motsvarande 3D-spår, skalstapel är 10 μm. (D) 3D-rekonstruktioner genererades med hjälp av FIJI-plugin Simple Neurite Tracer. Alla mätningar spårades genom z-stacken, efter cellfyllningssignalen. Axel- och klomätningar spårades separat för varje dendrit; Prickad linje betecknar en del av dendrit inom det aktuella planet. Förkortningar: 3D = tredimensionell; GFP = grönt fluorescerande protein; DPI = dagar efter injektionen; PSD-95 = postsynaptiskt densitetsprotein 95; BNP = granulneuronprogenitorer; PFA = paraformaldehyd. Klicka här för att se en större version av denna figur.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results

Figur 4: Analys av granulneuronmorfologi under cerebellär utveckling. (A) Maximala projektionsbilder av elektroporerade CGN från 3-DPI till 14-DPI (postnatal ålder P10 till P21), kärnor (blå) och GFP (grön); Pilspetsar indikerar individuell dendrit och skalstången är 10 μm. (B) Genomsnittligt antal dendriter. (C) Genomsnittlig dendritlängd mätt från basen av soma till spetsen av dendrit. d) Fraktion av dendriter som innehåller en klo. Ett värde på 1,00 är 100%, dvs alla dendriter har klo. (E) Total längd av dendritisk klo. N > 30 celler per tillstånd, insamlade från minst 4 djur per tillstånd. alla mätningar analyserades med enkelriktad ANOVA och antingen ett Dunnetts multipeljämförelsetest (B, C och D) eller ett Tukeys multipeljämförelsetest (E), **** betecknar signifikans med p <0,0001 över tiden; felstaplar är S.E.M. Förkortningar: GFP = grönt fluorescerande protein; DPI = dagar efter injektionen; PSD-95 = postsynaptiskt densitetsprotein 95; CGN = cerebellära granulneuroner; ANOVA = variansanalys; S.E.M. = medelfelets standardfel. Klicka här för att se en större version av denna figur.
För att studera utvecklingen av granulneuronmorfologi in vivo elektroporerades en konstruktion som uttrycker GFP under kontroll av en human ubiquitinpromotor (FUGW) in i den utvecklande lillhjärnan hos CD-1-möss och hjärnor som samlats in 3-, 5-, 7-, 10- och 14-dagars efter injektion (DPI). Gles märkning av celler genom elektroporering i kombination med konfokalmikroskopi fånga ögonblicksbilder av CGN under perioder av dendritisk beskärning, tillväxt och mognad. För att kvantitativt analysera och spåra tillväxten av CGN-synaptiska strukturer spårades varje dendrit med hjälp av FIJI-plugin Simple Neurite Tracer (SNT). SNT är en enkel, snabb, effektiv och lättillgänglig metod för att mäta neurit och klolängd i tredimensionellt (3D) utrymme. Omvänt användes Imaris för 3D-rekonstruktion av CGN för att erhålla ytarea- och volymmätningar eftersom programmet ger snabb och exakt återgivning av varje cell, och dess tröskelfunktioner kan isolera märkta celler från närliggande märkta cellskräp.
Nyfödda CGN genomgår en sprudlande fas av dendritisk tillväxt följt av förfining från P10 till P14 (3- till 7-DPI) som resulterar i beskärning av mer än 50% av överskott av dendriter (figur 4B). Denna händelse sammanfaller med den gradvisa förlängningen av de återstående arborsna (Figur 4C) och bildandet av kloliknande strukturer i slutet av varje dendrit (Figur 4D), vilket indikerar att dessa utvecklingsprocesser sker samtidigt. Men medan klor finns på ungefär 75% av dendriter av P14 (7-DPI), fortsätter dessa strukturer att öka i storlek tills P21 (14-DPI) (figur 4E).
Förändringarna i dendrit och klomorfologi kan återspegla antingen en övergripande förändring i total cellstorlek eller en omfördelning av cellmembranet. För att ta itu med denna fråga rekonstruerades varje märkt granulatneuron i Imaris för att kvantifiera den totala somatodendritiska ytan och volymen. CGN-storleken förblev relativt konstant under hela utvecklingen (figur 5A, B), men vid P14 uppvisar CGN en signifikant volymminskning på 20% jämfört med P10, P12 och P17 (3-, 5- och 10-DPI) (figur 5B). Dessa data tyder på att membranåtervinning från indragna dendriter kan vara särskilt viktigt för att möjliggöra utvidgning av dendritiska ändar till klor och pekar på P14 (7-DPI) som en viktig tidpunkt i övergången från beskärning till synapsutveckling.

Figur 5: Analys av granulneuronstorlek under cerebellär utveckling. Elektroporerade CGN rekonstruerades i Imaris för att bestämma cellstorleken. (A–B) Ytarea och volymetrisk analys av granulneuroner (dvs cellsoma och dendriter) under cerebellär utveckling. N > 30 celler per tillstånd, insamlade från minst 4 djur per tillstånd. Alla mätningar analyserades med enkelriktad ANOVA och ett Dunnetts multipeljämförelsetest, ** betecknar signifikans med p <0,005; felstaplar är S.E.M. Förkortningar: DPI = dagar efter injektion; CGN = cerebellära granulneuroner; ANOVA = variansanalys; S.E.M. = medelfelets standardfel. Klicka här för att se en större version av denna figur.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Cerebellar granulat neuroner är de vanligaste neuronerna i däggdjurshjärnan och utgör nästan 60-70% av den totala neuronpopulationen i gnagarhjärnan 1,14. Lillhjärnan har i stor utsträckning använts för att belysa mekanismer för cellulär proliferation, migration, dendritbildning och synapsutveckling 6,9,10,11,15,16,17,18,19,20 . Dessutom har årtionden av elektrofysiologiska studier hjälpt till att fastställa granulatneuronernas roll i långsiktig cerebellär plasticitet, vilket ligger till grund för kretsens engagemang i inlärda motoriska beteenden21,22,23. Således är granulatneuroner ett utmärkt modellsystem för att förhöra viktiga frågor om synaps och kretsutveckling.
Målet med denna studie är att lyfta fram en teknik som utnyttjar cerebellum för att spåra morfologin hos en enda neurontyp in vivo. Elektroporering av cerebellum riktar sig mot delande celler; Således är det tekniskt kapabelt att märka både granulneuronprogenitorer och glialceller, men eftersom granulneuronprogenitorer är så många är den elektroporerade populationen till stor del neuronal även utan behov av celltypspecifika promotorer. Dessutom kan denna teknik anpassas för att genetiskt manipulera gener in vivo för att studera deras roller i CGN-utveckling. Detta kan uppnås genom transfektion av en plasmid som uttrycker antingen korthårnål eller småinterfererande RNA för att slå ner gener eller en plasmid som uttrycker Cre-rekombinas till en transgen musstam till punktskatteregioner flankerade av LoxP-platser och slå ut den avsedda genen av intresse10,24.
Elektroporering har både styrkor och svagheter för genetiska studier. Det erbjuder en snabbare metod för att manipulera gener jämfört med traditionella transgena strategier, även om elektroporeringens sparsamhet begränsar dess användbarhet för beteendestudier, vilket kräver ett stort antal genetiskt modifierade celler för att se effekter. En andra begränsning är att den endast på ett tillförlitligt sätt riktar sig mot granulneuroner mellan lobulerna 5 och 7, och detta beror delvis på hur cerebellum är orienterat vid injektionsstället. Men inom det elektroporerade området ger denna metod ett relativt stort antal individuellt märkta celler, vilket ger potential för statistiskt robusta mätningar. Till exempel var det inte bara möjligt att följa dendritutvecklingen över tid, utan även subtila omfördelningar av membran mellan dendrit och klor kunde mätas, vilket utvidgade tidigare publicerade data20. CGN-klor är särskilt intressanta att studera eftersom utvidgningen av dessa dendritiska strukturer ger ytterligare fastigheter för granulatneuroner att bilda både excitatoriska förbindelser med mossiga fiberterminaler och unipolära borstceller samt hämmande förbindelser med närliggande Golgi-celler. Därför kan kombinationen av dessa dendritiska mätningar med immunohistokemisk märkning av specifika pre- och postsynaptiska proteiner vara användbar för att främja studien av cerebellär kretsbildning och synapsmognad.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Författarna deklarerar inga intressekonflikter.
Acknowledgments
Arbetet stöddes av NIH-bidrag R01NS098804 (A.E.W.), F31NS113394 (U.C.) och Duke University's Summer Neuroscience Program (D.G.).
Materials
| Name | Company | Catalog Number | Comments |
| Betadine | Purdue Production | 67618-150-17 | |
| Cemented 10 µL needle | Hamilton | 1701SN (80008) | 33 gauge, 1.27 cm (0.5 in), 4 point style |
| Chicken anti-GFP | Millipore Sigma | AB16901 | Our lab uses this antibody at a 1:1000 concentration |
| Cotton-tip applicator | |||
| Donkey anti-chicken Cy2 | Jackson ImmunoResearch | 703-225-155 | Our lab uses this antibody at a 1:500 concentration |
| Ethanol (200 proof) | Koptec | V1016 | |
| Electroporator ECM 830 | BTX Harvard Apparatus | 45-0052 | |
| Fast Green FCF | Sigma | F7252-5G | |
| FUGW plasmid | Addgene | 14883 | |
| Glass slides | VWR | 48311-703 | Superfrost plus |
| Glycerol | Sigma-Aldrich | G5516 | |
| Heating pad | Softheat | ||
| Hoescht 33342 fluorescent dye | Invitrogen | 62249 | |
| Imaris | Bitplane | ||
| Isoflurane | Patterson Veterinary | 07-893-1389 | |
| Micro cover glass | VWR | 48382-138 | |
| Nail polish | Sally Hansen | Color 109 | |
| Normal goat serum | Gibco | 16210064 | |
| O.C.T. embedding compound | Tissue-Tek | 4583 | |
| Olympus MVX10 Dissecting Scope | Olympus | MVX10 | |
| P200 pipette reach tip | Fisherbrand | 02-707-138 | Used for needle spacer |
| Parafilm | Bemis | PM-996 | |
| PBS pH 7.4 (10x) | Gibco | 70011-044 | |
| Simple Neurite Tracer | FIJI | https://imagej.net/Simple_Neurite_Tracer:_Basic_ Instructions |
|
| Sucrose | Sigma | S0389 | |
| Surgical tools | RWD Life Science | Small scissors and tweezers | |
| Triton X-100 | Roche | 11332481001 | non-ionic detergent |
| Tweezertrodes | BTX Harvard Apparatus | 45-0489 | 5 mm, platinum plated tweezer-type electrodes |
| Ultrapure distilled water | Invitrogen | 10977-015 | |
| Vectashield mounting media | Vectashield | H1000 | |
| Vetbond tissue adhesive | 3M | 1469SB | |
| Zeiss 780 Upright Confocal | Zeiss | 780 |
References
- Altman, J., Bayer, S. A. Development of the cerebellar system : in relation to its evolution, structure, and functions. , CRC Press. (1997).
- Rahimi-Balaei, M., Bergen, H., Kong, J., Marzban, H. Neuronal migration during development of the cerebellum. Frontiers in Cellular Neuroscience. 12, 484 (2018).
- Alder, J., Cho, N. K., Hatten, M. E. Embryonic precursor cells from the rhombic lip are specified to a cerebellar granule neuron identity. Neuron. 17 (3), 389-399 (1996).
- Hatten, M. E., Heintz, N. Mechanisms of neural patterning and specification in the developing cerebellum. Annual Review of Neuroscience. 18, 385-408 (1995).
- Ben-Arie, N., et al. Math1 is essential for genesis of cerebellar granule neurons. Nature. 390 (6656), 169-172 (1997).
- Borghesani, P. R., et al. BDNF stimulates migration of cerebellar granule cells. Development. 129 (6), 1435-1442 (2002).
- Espinosa, J. S., Luo, L. Timing neurogenesis and differentiation: insights from quantitative clonal analyses of cerebellar granule cells. Journal of Neuroscience. 28 (10), 2301-2312 (2008).
- Markwalter, K. H., Yang, Y., Holy, T. E., Bonni, A. Sensorimotor coding of vermal granule neurons in the developing mammalian cerebellum. Journal of Neuroscience. 39 (34), 6626-6643 (2019).
- Shalizi, A., et al. PIASx is a MEF2 SUMO E3 ligase that promotes postsynaptic dendritic morphogenesis. Journal of Neuroscience. 27 (37), 10037-10046 (2007).
- Shalizi, A., et al. A Calcium-regulated MEF2 sumoylation switch controls poststynaptic differentiation. Science. 311 (5763), 1012-1017 (2006).
- Konishi, Y., Stegmuller, J., Matsuda, T., Bonni, S., Bonni, A. Cdh1-APC controls axonal growth and patterning in the mammalian brain. Science. 303 (5660), 1026-1030 (2004).
- Holubowska, A., Mukherjee, C., Vadhvani, M., Stegmuller, J. Genetic manipulation of cerebellar granule neurons in vitro and in vivo to study neuronal morphology and migration. Journal of Visualized Experiments: JoVE. (85), e51070 (2014).
- Yang, Y., et al. Chromatin remodeling inactivates activity genes and regulates neural coding. Science. 353 (6296), 300-305 (2016).
- Herculano-Houzel, S. Coordinated scaling of cortical and cerebellar numbers of neurons. Frontiers in Neuroanatomy. 4, 12 (2010).
- Wilson, P. M., Fryer, R. H., Fang, Y., Hatten, M. E. Astn2, a novel member of the astrotactin gene family, regulates the trafficking of ASTN1 during glial-guided neuronal migration. Journal of Neuroscience. 30 (25), 8529-8540 (2010).
- Kokubo, M., et al. BDNF-mediated cerebellar granule cell development is impaired in mice null for CaMKK2 or CaMKIV. Journal of Neuroscience. 29 (28), 8901-8913 (2009).
- Schwartz, P. M., Borghesani, P. R., Levy, R. L., Pomeroy, S. L., Segal, R. A. Abnormal cerebellar development and foliation in BDNF-/- mice reveals a role for neurotrophins in CNS patterning. Neuron. 19 (2), 269-281 (1997).
- Segal, R. A., Pomeroy, S. L., Stiles, C. D. Axonal growth and fasciculation linked to differential expression of BDNF and NT3 receptors in developing cerebellar granule cells. Journal of Neuroscience. 15 (7), Pt 1 4970-4981 (1995).
- Zhou, P., et al. Polarized signaling endosomes coordinate BDNF-induced chemotaxis of cerebellar precursors. Neuron. 55 (1), 53-68 (2007).
- Dhar, M., Hantman, A. W., Nishiyama, H. Developmental pattern and structural factors of dendritic survival in cerebellar granule cells in vivo. Scientific Reports. 8 (1), 17561 (2018).
- Ito, M. Synaptic plasticity in the cerebellar cortex and its role in motor learning. Canadian Journal of Neurological Sciences. 20, Suppl 3 70-74 (1993).
- Jorntell, H., Hansel, C. Synaptic memories upside down: bidirectional plasticity at cerebellar parallel fiber-Purkinje cell synapses. Neuron. 52 (2), 227-238 (2006).
- Nakanishi, S. Genetic manipulation study of information processing in the cerebellum. Neuroscience. 162 (3), 723-731 (2009).
- Chang, C. H., et al. Atoh1 controls primary cilia formation to allow for SHH-triggered granule neuron progenitor proliferation. Developmental Cell. 48 (2), 184-199 (2019).
Tags
Neurovetenskap Utgåva 172 Neuronal utveckling cerebellum dendrit synaps granulneuron elektroporeringErratum
Formal Correction: Erratum: Utilizing In Vivo Postnatal Electroporation to Study Cerebellar Granule Neuron Morphology and Synapse Development
Posted by JoVE Editors on 04/06/2023.
Citeable Link.
An erratum was issued for: Utilizing In Vivo Postnatal Electroporation to Study Cerebellar Granule Neuron Morphology and Synapse Development. A figure was updated.
Figure 2 was updated from:
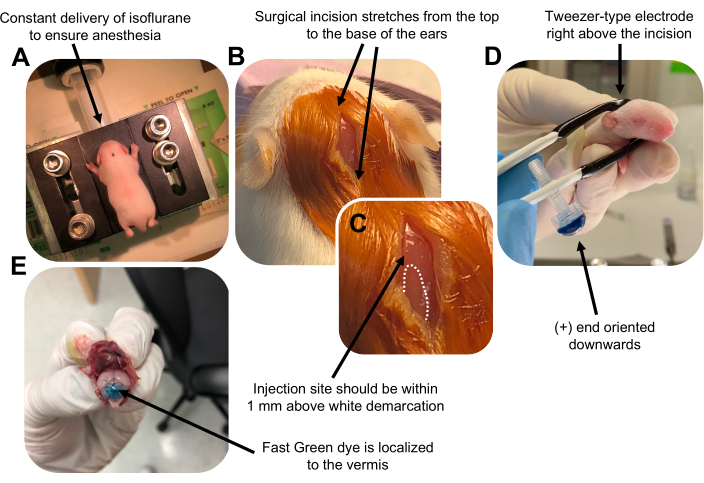
Figure 2: In vivo cerebellar electroporation of granule neuron progenitors in P7 wildtype mouse pups. (A) Pups are anesthetized with 4% isoflurane delivered at a rate of 0.8L/min to ensure anesthesia throughout the injection of the DNA solution. Isoflurane is delivered at a rate of 0.8 L/min. (B) After sterilizing the mouse 3 times with betadine and 70% ethanol, an incision is made that spans the distance of the ears, revealing the hindbrain. (C) A magnified image of a white demarcation on the cranium, a landmark for the injection site. DNA construct should be injected within 1 mm above the mark; dotted lines outline the demarcation, and black arrow denotes the injection site. The ridges of the cerebellar vermis may be visible and can be useful for finding the injection site. (D) Tweezer-type electrode orientation for efficient electroporation. Plus (+) end must be oriented downwards to pull negatively charged DNA into the cerebellar parenchyma prior to administration of electrical pulses. (E) Test injection of 1 µL of a 0.02% Fast Green dye shows injection is localized to the middle of the cerebellar vermis between lobules 5-7. Please click here to view a larger version of this figure.
to:
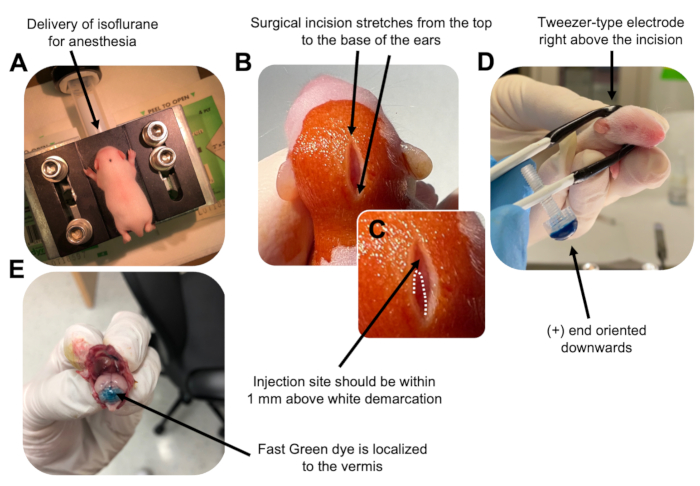
Figure 2: In vivo cerebellar electroporation of granule neuron progenitors in P7 wildtype mouse pups. (A) Pups are anesthetized with 4% isoflurane delivered at a rate of 0.8L/min to ensure anesthesia throughout the injection of the DNA solution. Isoflurane is delivered at a rate of 0.8 L/min. (B) After sterilizing the mouse 3 times with betadine and 70% ethanol, an incision is made that spans the distance of the ears, revealing the hindbrain. (C) A magnified image of a white demarcation on the cranium, a landmark for the injection site. DNA construct should be injected within 1 mm above the mark; dotted lines outline the demarcation, and black arrow denotes the injection site. The ridges of the cerebellar vermis may be visible and can be useful for finding the injection site. (D) Tweezer-type electrode orientation for efficient electroporation. Plus (+) end must be oriented downwards to pull negatively charged DNA into the cerebellar parenchyma prior to administration of electrical pulses. (E) Test injection of 1 µL of a 0.02% Fast Green dye shows injection is localized to the middle of the cerebellar vermis between lobules 5-7. Please click here to view a larger version of this figure.



