ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Detta protokoll visar robot ultraljud (USA) som ett praktiskt, kostnadseffektivt och snabbt alternativ till traditionella icke-invasiva bild modaliteter.
Abstract
Vanliga metoder för in vivo imaging av gnagare inkluderar positron emission tomography (PET), datortomografi (CT), magnetisk resonans imaging (MRI) och ultraljud (USA). Varje metod har begränsningar och fördelar, inklusive tillgänglighet, användarvänlighet, kostnad, storlek och användning av joniserande strålning eller magnetfält. Detta protokoll beskriver användningen av 3D robot us för in vivo imaging av gnagare njurar och hjärta, efterföljande data analys och möjliga forskningsapplikationer. Praktiska tillämpningar av robotiska USA är kvantifiering av total njurvolym (TKV), liksom mätning av cystor, tumörer och vaskulatur. Även om upplösningen inte är lika hög som andra metoder, möjliggör robot-USA mer praktisk datainsamling med hög genomströmning. Med hjälp av amerikansk M-lägesavbildning kan hjärtfunktionen dessutom kvantifieras. Eftersom njurarna får 20-25% av hjärtproduktionen är bedömning av hjärtfunktionen avgörande för förståelsen av njurfysiologi och patofysiologi.
Introduction
De vanligaste formerna för in vivo gnagare imaging inkluderar positron emission tomography (PET), optisk avbildning (OI), datortomografi (CT), magnetisk resonans imaging (MRI) och ultraljud (USA). Dessa tekniker ger högupplösta in vivo-bilder, vilket gör det möjligt för prövare att kvantitativt bedöma och longitudinellt följa sjukdomsmodeller icke-invasivt1. Även om varje bildframställning modalitet har begränsningar, ger de också ovärderliga verktyg för preklinisk forskning.
Här beskriver studien ett amerikanskt system och presenterar protokollet för robot- och 3D-gnagare. Amerikanska vågor produceras av en sond som kallas en givare, som vanligtvis hålls för hand. Ljudvågor reflekteras tillbaka när de interagerar med vävnader, och ekon rekonstrueras till bilder2. Protokollet som beskrivs här kommer att fokusera på njur- och hjärtavbildning med hjälp av en robotiskt kontrollerad givare och med hjälp av programvara som möjliggör snabb 3D-rekonstruktion för kvantitativ bedömning.
Robotic US är en snabb, pålitlig och icke-invasiv bildframställning modalitet som gör det möjligt för forskare att genomföra hög genomströmning och longitudinella studier. Jämfört med handhållna amerikanska metoder är den robotiska amerikanska metoden tidseffektiv, eftersom upp till tre djur kan skannas på några minuter. Hög genomströmning för njurmätningar tyder på att upp till 20 möss per timme kan avbildas. Robottransduktörerna är placerade under de akustiska membranen och rör sig oberoende av djuret med två frihetsgrader (figur 1A). Detta gör det möjligt för nybörjare att få högkvalitativa bilder, medan handhållna amerikanska metoder är mer mottagliga för användarfel. Den kopplade programvaran möjliggör effektiv 3D-njurrekonstruktion i realtid. Tidigare har magnetisk resonans imaging (MRI) varit en utbredd metod för icke-invasiva imaging på grund av den utmärkta mjukvävnad kontrast, brist på radioaktivitet och penetration djup. MRT kräver dock ofta långa förvärvstider och är kostsamt att utföra. USA har utvärderats som ett tillförlitligt och snabbare alternativ till MRT vid bedömning av total njurvolym (TKV)3.
Protocol
Alla steg i detta protokoll följer Mayo Clinic (Rochester, MN) djuranvändningsriktlinjer och har godkänts av Mayo Clinic Institutional Animal Care and Use Committee.
1. Djurmodell
- Få möss från kommersiella källor.
OBS: C57BL/6J (ålder = 18 månader; n = 22 (7 män, 15 kvinnor)) (Tabell över material) och Pkd1(RC/RC) (ålder = 18 månader; n = 9 (3 män, 6 kvinnor))4 användes för studien.
2. Hårborttagning
- Bedöva djuret med förångad isofluran (2%-3%) i en anestesikammare. Se till att djuret är tillräckligt sövd genom att utföra en bitpupp. Se till att musen andas med en hastighet av cirka 60-90 andetag/min utan uppenbar luft gulning.
OBS: Förångad isofluran valdes på grund av förmågan att kontrollera och finjustera djurets anestesinivå. Isofluran blandat med 100% syre användes. - Använd en rakhyvel för att raka önskad hudyta för amerikanska mätningar.
OBS: I denna studie ligger fokus på njur- och hjärtmätningar, så djurets bröst och rygg rakades. - Applicera den depilatoriska krämen på djurets rakade hud med en bomullsspetsad applikator. Torka av grädden efter 30-60 s med en torr pappershandduk. Fortsätt sedan att torka bort depilatoriska gräddrester med våta gasvävskuddar. Se till att hårborttagningen är klar innan skanningarna påbörjas.
OBS: Eventuellt återstående hår kommer att störa bildkvaliteten; fullständig hårborttagning är avgörande. Det är dock nödvändigt att torka av depilatory krämen inom en minut för att förhindra att djurets hud skadas. Överbliven depilatorisk kräm på djuret kan färga den amerikanska maskinens bildmembran. Se till att djuret rengörs korrekt med hjälp av våta gasvävskuddar.
3. Djurpositionering
- Slå på den amerikanska maskinen och strömbrytaren för det interna värmeelementet för de amerikanska facken. Slå på lämpliga anestesiventiler för motsvarande amerikanska fack som ska användas.
OBS: Den amerikanska maskinen måste vara påslagen innan den amerikanska programvaran startas. - Fyll vikarna med tillräckligt med vatten för att täcka membranet. Placera det sövda djuret i noskonen.
- För hjärtmätningar, placera djuret i ett benägen läge och vinkla det cirka 30° åt höger.
- För njurmätningar, placera djuret i en rak och supin position. Platta försiktigt till djurets kropp för att minimera luftfickorna mellan djuret och membranet (figur 1B).
OBS: Att köra ett finger bredvid djurets kropp kan ta bort alla luftbubblor som sitter fast vid huden, vilket kommer att störa avbildningen. Använd vatten eller amerikansk saltlösning gel som amerikanskt medium; men vatten underlättar den snabba avbildning som diskuteras här.
4. Ultraljudsmätningar
- I den amerikanska programvaran för avbildning väljer du US Acquisition och låter instrumentet initieras.
- Njuravbildning med B-läge.
- Ange ett namn för studien i lämplig dialogruta.
- Ange djur-ID:t i lämplig dialogruta.
OBS: Upp till tre djur kan avbildas sekventiellt. - Klicka på fliken märkt 3D för att initiera 3D-skanning.
- Använd livekameramatningen och flytta rutan roi (region of interest) för att innehålla njurarna.
OBS: Storleken på avkastningen kan justeras beroende på storleken på bildmålet. Om du ökar storleken på avkastningen ökar skanningstiden något (bild 1C). Beroende på ROI-storlek justerar skannern automatiskt antalet pass som krävs för att givaren ska kunna skanna hela AVKASTNINGEN. - Beroende på vilken typ av bild som önskas väljer du Linjär matris eller Wobbler för att välja givaren. Välj mellan Snabbsökning eller Optimerad för endera givaren.
OBS: Linjär matris är snabbare och ger vanligtvis tillräcklig avbildning. Wobbler-givaren kan användas om den inte kan få önskad bildkvalitet med den linjära matrisen. Wobbler-givaren använder en våglängd med högre frekvens och ger därför mer definition i bilder. Alternativet Fast Scan får bilder av medelhög kvalitet utan andningskorrigering med högre hastighet. Även om alternativet Optimerad kräver lite mer tid, ger det bättre bildkvalitet och möjliggör andningskorrigering. Detta manuskript kommer att fokusera på att använda den optimerade linjära matrisförinställningen. - Klicka på livevyn för att se en livebild av önskat visningsområde.
- Om du vill flytta givaren klickar du på den cirkulära knappen Gå till och klickar sedan på det område på musen som ska avbildas. Använd riktningspilarna med förutbestämda stegstorlekar för att finjustera givarens position.
- Klicka på pilen vid sidan av Kontrollpanelens fönster för att öppna inställningsfältet. Klicka på Scan Protocol för att öppna skanningsinställningarna.
- Bestäm det ideala brännvidden och justera skjutreglagen för TGC (tidsförstärkningskompensation) för att ändra bildkontrasten för att bäst visa njurarna. När du har uppnått önskade inställningar klickar du på pilen igen för att stänga inställningsfältet.
- Tryck på knappen Hämta statisk för att påbörja 3D-skanning.
OBS: Förloppet för skanningen indikeras via en förloppsindikator längst ner till vänster i programvaran. - När skanningen är klar kontrollerar du bildkvaliteten genom att klicka på den blå nedladdningspilen för att öppna skanningen i förhandsgranskningsläge. Gå igenom skanningens 3D-bildrutor genom att dra den röda pilen högst upp i fönstret. Om du vill zooma in eller ut håller du ned Ctrl-tangenten och använder rullningsknappen på musen.
- Om du vill skanna ytterligare djur uppdaterar du dialogrutorna för djur-ID, matar in de nya ID:erna och upprepar sedan stegen ovan.
OBS: När skanningarna är klara, torka av djuren och återför dem till sina hemburar.
- Hjärtbild med M-läge.
OBS: M-läge är visningen av en ultraljudsvåg längs en specifik, vald ultraljudslinje.- Klicka på fliken M-läge för att aktivera hjärtavbildning.
OBS: Endast ett djur kan avbildas åt gången. - Se till att djuret beger sig i lämplig position för hjärtskanningar (steg 2.2). Flytta ROI till hjärtats ungefärliga plats.
- Tryck på heart finder-knappen för att hitta hjärtat. Använd värmekartan för att optimera givarens placering. Använd den cirkulära knappen Gå till för att flytta givaren till vänster kammare (bild 2A).
- Gå till Live View och använd pilknapparna för att placera givaren mellan papillärmusklerna (bild 2B). För att kontrollera att givaren har placeras korrekt, se spårningen av M-läge i realtid (bild 2D).
- När givaren är i rätt position klickar du på Förvärva sekvens. Klicka på den blå nedladdningspilen för att se den färdiga skanningen.
- Klicka på fliken M-läge för att aktivera hjärtavbildning.
5. Njuranalys (analysmekanik)
- Öppna fliken Bildanalys och välj knappen Läs in volym(er) för att mata in bildfilerna/mapparna.
- Segmentering
- Flytta de färgade linjerna som representerar olika plan för att hitta njuren i alla plan.
- Klicka på Lägg till för att lägga till en ny segmentering. Ange ett påläggsnamn för filen.
- Använd surface cut-knappen för att lägga till punkter runt njurens ytterkant i flera plan. Klicka på Använd för att generera segmentering genom hela njuren (figur 3A).
- Bläddra igenom de olika bildrutorna i varje plan och redigera eventuella felaktiga regioner genom att klicka på Redigera och dra punkterna till rätt plats.
- Alternativt, om njuren är oregelbunden i form, använd funktionen Rita för att skapa ett oregelbundet format spår runt njuren. Klicka antingen på punkter runt kanten eller håll vänsterklick för att rita spårningen frihand.
- Om du vill slutföra spårningen med knappen Rita högerklickar du med musen. Rulla framåt flera bildrutor och upprepa spårningsprocessen.
- Upprepa tills bildrutorna har spårats i hela den av intresseområdet.
- Om funktionen Rita används väljer du Fyll mellan segment för att kontrollera och justera spårningen. Klicka på Initiera för att se en förhandsgranskning. Om förhandsgranskningen är acceptabel klickar du på Verkställ. Om inte, klicka på Avbryt och ändra spårningarna.
Knappen Radera gör det möjligt att ta bort en region inom en spårning. Knappen Utjämna jämnar ut de ojämna kanterna på ett spår. - När bildanalysen är tillfredsställande väljer du Spara för att spara analysen i den ursprungliga bildfilen.
- Mätning
- Använd funktionen Calipers för att mäta funktioner i bilden. Klicka på knappen Bromsok och vänster klicka på de två punkterna på det avstånd som ska mätas (bild 3B).
- Spara mätningen genom att klicka på diskknappen högst upp på skärmen.
- Segmentering
6. Hjärtanalys
- Välj Läs in volymer för att mata in de filer som ska analyseras.
- Välj alternativet Lägg till .
- Använd punktplaceringsverktyget för att spåra systole och diastole för varje lager av hjärtvävnad. Fortsätt med de andra lagren av hjärtvävnad. Använd funktionen Redigera för att ändra spåren (bild 2C,D).
OBS: Om M-lägesspårningen är mycket tydlig använder du knappen Lägg till (auto) för att automatiskt generera spårningar av varje lager. - Välj Använd om du vill beräkna hjärtparametrarna. Visa fliken Kvantifiera och välj Exportera statistik om du vill exportera alla data som en *.csv fil (bild 2E).
Representative Results
Resultat av njuranalys
Yt- och volymdata erhålls från segmenteringen av njurarna. Denna information kan användas för att jämföra experimentella modeller och kontrollmodeller eller spåra förändringar över tid. Kaliberverktyget är användbart för att snabbt mäta avvikelser (dvs. cystor, tumörer) och hur de förändras i längd över tid. Figur 3 tyder på att både segmenterings- och bromsokmetoderna kan användas för att mäta cystvolymerna noggrant. Figur 4 visar en tydlig skillnad i total njurvolym (TKV) mellan åldersmatchade kontrollmöss och experimentella (Pkd1RC/RC) möss. 3D-visualisering av dessa volymåtergivningar kan utföras inom systemet, inklusive rotationer inom 3D-rymden (bild 5). Dessa 3D-rekonstruktioner används sedan för att beräkna TKV (mm3; Bild 4) samt individuell stor cystvolym.
Resultat av hjärtanalys
Många användbara parametrar förvärvas från analysen av M Mode-bilder. Dessa data ger en bra ögonblicksbild av den vänstra ventrikulära (LV) hjärt funktionen vid den tidpunkten. Datautgången inkluderar LV inre diameter, LV bakre vägg, LV främre väggdiameter, utmatningsfraktion, fraktionerad förkortning, strokevolym, hjärtfrekvens, hjärtutgång, LV-volym och LV-massa. Framgången för hjärtanalys är beroende av korrekt segmentering av lagren på M Mode-bilden. De flesta kardiovaskulära resultat beräknas av topp systoliska och diastoliska faserna i de bakre och främre endokardiallagren. Det bakre epidekortsskiktet ser ljusvitt ut och följer ett liknande mönster som det bakre endokardlagret. Spårningen för det bakre endokardskiktet ska placeras på den lägsta konturen. Det främre endokardskiktet bör spåras längs det högsta konturen av det lagret. Det främre epicentrumskiktet verkar linjärt längst ner i bilden på grund av djurets benägen positionering (figur 2D). Figur 6 visar ett exempel på en studie utan signifikant skillnad i hjärtproduktion mellan försöksmöss och kontrollmöss. Precis som vid njuravbildning är 3D-hjärtvisualisering möjlig. Ändå tillåter en 4D-visualisering av hjärtcykeln (kompletterande figur 1) prövaren att visualisera och fastställa både morfologiska och cykeldynamiska avvikelser i det bedömda djuret.
Morfologi bedömning
För snabb och billig bedömning kan USA effektivt övervaka fysiologiska parametrar längsgående. Emellertid, många studier vill dessutom fastställa finare morfologiska egenskaper, t.ex. antal och storlekar av cystor, förkalkningar (njursten), vaskulärisering eller grad av fibros. Figur 7 jämför en normal mus njure med en cystisk mus njure med en måttligt förkalkad mus njure. Genom att öka den amerikanska centerfrekvensen (10 MHz med den linjära matrisen) till 35 MHz (wobblerförstärkare) kan bilder av ökande detalj erhållas.

Bild 1: Ultraljudssystem och musplacering. (A) Diagram över ultraljudssystem och placering av givare. (B) Vy över möss i supin position på ultraljudsplattformen. C) Exempel på region av intresse (ROI) för intresseområde (njurar) med djur-ID. Klicka här för att se en större version av den här figuren.

Bild 2: Hjärt ultraljud imaging för att erhålla fysiologiska parametrar. (A) Användning av Heart Finder värmekarta bild för att placera givaren i den vänstra ventrikeln för M-Mode imaging. Givarens placering i vänster kammare indikeras av den stora gröna pricken. (B) Vy över givaren när den placeras korrekt över papillärmusklerna (prickad låda). (C) Exempel på lager som behövs för att mäta hjärtparametrar. (D) Vy över live M-Mode-bild med lager som anges som i panel C. (Lager uppifrån och ned: bakre epicardial, bakre endokardial, främre endokardial och främre epicardial.) (E) Exempel på statistik som genererats från hjärtmätningar. Klicka här för att se en större version av den här figuren.

Figur 3: Användning av segmenterings- och kalibrerverktyg för att mäta njurar och cysta. (A) Exempelsegmenteringar (axiell vy) av både njurar (blå och orange skuggning) och en stor cyste (gul) med volymer listade nedan. Icke-segmenterade vyer visas under så att det oskyddade USA kan visas. (B) Exempel på användning av bromsok för att mäta samma cysta (sagitalvy) från figur 3A med mätningar nedan. Volymen beräknades med hjälp av formeln för en ellips (volym = (4/3)π x x b x c, där a, b, c är relativa x, y, z). Klicka här för att se en större version av den här figuren.

Figur 4: TKV-fördelningar av WT och cystiska mus njurar. Representation av TV-apparater för vilda (WT) (C57BL/6J) och sjuka (Pkd1RC/RC) möss. n = 22 (WT) n = 9 (Pkd1RC/RC); Resultat av t-test med två svansar: p < 0,0001. Box visar 25-75: e percentilvärden och morrhår visar 1,5 gånger interquartile intervall. Klicka här för att se en större version av den här figuren.

Figur 5: Animerad 3D-rekonstruktion av segmenterade njurar och cysta. Med hjälp av programvaran kan 3D-projektionerna av njurarna och cysten roteras eller vaggas i 3D-utrymmet (blå = vänster njure; gul = stor cyste; orange = höger njure). Klicka här för att ladda ner den här siffran.

Figur 6: Hjärtfysiologiska parametrar från amerikanska mätningar. Representation av hjärtutgång (mL/min) för WT- möss (Pkd1RC/RC). n = 22 (WT) n = 9 (Pkd1RC/RC). De lägre tabelldata visar att det inte finns någon signifikant skillnad för dessa två grupper i utmatningsfraktion, strokevolym, puls (HR) eller hjärtutgång (CO). Resultat av tvåsidigt t-test: p > 0,05. Rutan visar 25-75:e percentilvärdena. Klicka här för att se en större version av den här figuren.

Figur 7: Jämförelse av amerikanska sagittal sektioner av normala och två patologier. (A) Vild typ (C57BL/6J stam) njure (TKV = 143,202 mm3). B) Cystisk njure med ökad TKV (Pkd1RC/RC-mus ) (TKV = 333,158 mm3). Cystor indikeras av gula pilar. (C) Njure med kärlförkalkningar (Modell = Low-Density Lipoprotein Receptor Deficient, Apolipoprotein B100-only mus matas en västerländsk diet i 12 månader5) (TKV = 127.376 mm3). Njurstenar indikeras av gröna pilar. Klicka här för att se en större version av den här figuren.
Kompletterande figur 1: 4D hjärtcykelfilm från amerikanska mätningar. Med hjälp av programvaran fångas en representation av det bultande hjärtat i 3D US och projiceras genom hjärtcykeln. Den gröna pilen anger aortaventilen. (Modell = Low-Density Lipoprotein Receptor Deficient, Apolipoprotein B100-only mouse, matas en västerländsk diet i 12 månader5). Denna modell genererar vaskulär förkalkningar möjliggör enklare visualisering av hjärtat och ventilerna på grund av den större akustiska reflektiviteten hos förkalkningarna i USA. Liknande 4D-rekonstruktioner är möjliga med WT-möss; Den fångade akustiska kontrasten kommer dock inte att vara lika hög. Klicka här för att ladda ner den här filen.
Discussion
Ultraljud använder ljudvågor, och eventuella hinder för ljudvågsutbredning kommer att störa bildkvaliteten. Således är fullständig hårborttagning av det område som ska avbildas kritisk. Det är också viktigt att säkerställa fullständig borttagning av depilatorisk kräm eftersom det kan orsaka brännskador / irritation av djurets hud och missfärga skannerns genomskinliga membran. Tillräckliga vattennivåer i vikarna är nödvändiga för optimal spridning av ljudvågor, vilket krävs för att få högsta bildupplösning. Men när djuret är i ett benägen läge, se till att djurets nos är över vattennivån eller att djuret riskerar att bli inandat av vatten. Optimering av bildparametrar, särskilt brännvidd, är avgörande för att få högkvalitativa bilder. Ändringar av parametrar kan vara nödvändiga för enskilda djur.
Robotic US ger många fördelar jämfört med traditionella handhållna amerikanska metoder. Först använder systemet ett enkelt peka-och-klicka-kamerabaserat gränssnitt. Den här funktionen åtgärdar komplexiteten i konventionella AMERIKANSKA och producerar konsekventa data även när den drivs av en nybörjare6. För det andra tillåter systemet användning av vatten snarare än traditionell amerikansk gel som akustiskt medium. Tidigare tillät användningen av amerikansk gel bildandet av bubblor som störde kvalitetsbildförvärv. Dessutom är den amerikanska gelen rörig och ger utmaningar för sanering. Vidare värms vattnet av värmelampan och hjälper till att upprätthålla djurets kroppstemperatur. För det tredje är robot-USA snabbare, så artefakter från andningsrörelser är inte problematiska. Den ökade bildhastigheten gör det möjligt att praktiskt slutföra datainsamling med högt genomströmning. För det fjärde får robot-USA 3D-bilder och gör därför 3D-rekonstruktion av objekt enkel (figur 4). MRI och andra modaliteter är dyra, tidskrävande och inte alltid tillgängliga. Viktigt är att det amerikanska robotsystemet passar på ett bord eller en bänk och är mer kostnadseffektivt. Slutligen visade tidigare arbete att robot-USA kunde tillhandahålla jämförbara mätdata med dyrare modaliteter, såsom MRI3.
Även om bildkvaliteten och upplösningen på det robotiska amerikanska systemet som beskrivs i detta arbete var tillräcklig för den föreslagna applikationen (figur 7), finns det flera sätt att förbättra bildkvaliteten i framtiden. Till exempel skulle användning av högre frekvensgivare (t.ex. 50-70 MHz) resultera i bilder med högre upplösning med bättre funktionsdefinition. Medan användning av högre frekvenser skulle resultera i ett sämre penetrationsdjup, bör bilderna vara tillräckliga för in vivo-avbildning av ytliga organ, såsom mus njuren. Liksom med andra bildframställningsmetoder kan kontrastmedel användas för att förbättra specifika funktioner. För USA innebär detta vanligtvis att använda något som är mycket reflekterande av ljudvågor. Intravaskulära mikrobubblor där lipider omger mycket små gasbubblor är ett sådant medel. De mikronstora gasbubblorna är mycket reflekterande och ger därmed en andra distinkt signal som översätts till en högupplöst vaskulatur7. Även om denna akustiska kontrastteknik kan vara ganska användbar, kan den ha flera nackdelar. Först måste mikrobubblorna göras färska och endast kvarstå in vivo i 5-10 min. För det andra, in vivo intravaskulära injektion kräver vanligtvis svans slöja catheterization för injektion, och detta kan vara tekniskt utmanande. Under vissa omständigheter och pulserande regimer kan mikrobubble imaging i sig leda till njurmedicinska vaskulatur skador8.
Det finns också några mer allmänna begränsningar för det specifika amerikanska systemet som används. För det första ingår endast en linjär matris (centrerad vid 18 MHz) i robotchassit, så det är för närvarande inte möjligt att byta till högre eller lägre frekvenssonder. Detta kan påverka bredden på modeller (antingen större eller mindre) som kan utvärderas med systemet. Framtida iterationer av instrumentet bör omfatta flera linjära matriser för att täcka hela skalan av prekliniska djurmodeller. För det andra kan givarens vinkel i förhållande till djurpersonen inte kontrolleras. Att utföra vinkelberoende avbildningstekniker, såsom Doppler, eller att uppnå alternativa sikt i plan av vissa organ (t.ex. lång axelvy av njure) kräver därför ompositionering av djuret och kan vara svårt att uppnå. Ytterligare frihetsgrader skulle kunna läggas till robotrörelsen för att förbättra denna utmaning. För det tredje har vi ibland observerat efterklangsartefakter som härrör från det akustiska membranet som skiljer djuret från givaren som kan dölja visualisering av ytliga funktioner och gränser. I dessa fall kan användning av en gel standoff för att höja djuret bort från membranet åtgärda situationen. Slutligen är temperaturreglering via värmelampa oprecis, och därför måste noggrann uppmärksamhet ägnas åt djurets kärnkroppstemperatur vid avbildning. Mer kontrollerade uppvärmningsmekanismer, såsom en integrerad värmeplatta, kommer sannolikt att förbättra homeostashantering och bildgenomströmning.
Användningen av robot-USA kan vara tillämplig på olika forskningsområden. Denna teknik möjliggör visualisering av brutto vävnad strukturer, således kan användas för att spåra tumör progression och potentiella terapier6,9 samt njurmorfologi som presenteras här. Förmågan att segmentera bildernas specifika egenskaper gör det till ett attraktivt verktyg för att studera modeller av polycystisk njursjukdom (PKD)3. M-läge bilder möjliggör enkel kvantifiering av många viktiga hjärtparametrar möjliggör in vivo bedömning av hjärtfysiologi. Eftersom njurarna får 20-25% av hjärtproduktionen10 är det viktigt att förstå hjärtfunktionen under den longitudinella bedömningen av njurpatologi. Genom dessa amerikanska protokoll har vi försökt illustrera att amerikansk avbildning inte bara är praktisk för in vivo- och longitudinella njurstudier utan också att allt mer amerikanska verktyg möjliggör både morfologisk och fysiologisk bedömning av möss i prekliniska studier.
Disclosures
Flera författare är antingen anställda av, har ett betydande ekonomiskt intresse i eller är meduppfinnare på patent licensierade av SonoVol, Inc. (CJM, RCG, TJC).
Acknowledgments
Detta arbete stöddes av NIH (R43-DK126607, TJC, TLK, MFR) och Mayo Foundation.
Materials
| Name | Company | Catalog Number | Comments |
| Electric Razor | Braintree Scientific, Inc | CLP-9868 14 | |
| C57bk6j | The Jackson laboratory | https://www.jax.org/ | |
| Cotton gauze pads | Fisher Scientific | ||
| Cotton tipped applicators | Fisher Scientific | ||
| Depilatory cream | N/a | N/a | This study used Nair |
| Heat lamp | Included with SonoVol Vega system | ||
| Robotic Ultrasound System | SonoVol Inc | SonoVol Vega system includes anesthesia system | |
| SonoEQ Software | SonoVol | Included with SonoVol Vega system | |
| TERRELL Isoflurane | Piramal Critical Care, Inc | NDC 66794-019-10 |
References
- Cunha, L., et al. Preclinical imaging: an essential ally in modern biosciences. Molecular Diagnostics & Therapy. 18 (2), 153-173 (2014).
- Ultrasound. NIBIB. , Available from: https://www.nibib.nih.gov/science-education/science-topics/ultrasound#pid-936 (2016).
- Beaumont, N. J., et al. Assessing polycystic kidney disease in rodents: Comparison of robotic 3d ultrasound and magnetic resonance imaging. Kidney360. 1 (10), 1128-1136 (2020).
- Hopp, K., et al. Functional polycystin-1 dosage governs autosomal dominant polycystic kidney disease severity. The Journal of Clinical Investigation. 122 (11), 4257-4273 (2012).
- Weiss, R. M., Ohashi, M., Miller, J. D., Young, S. G., Heistad, D. D. Calcific aortic valve stenosis in old hypercholesterolemic mice. Circulation. 114 (19), 2065-2069 (2006).
- Czernuszewicz, T. J., et al. A new preclinical ultrasound platform for widefield 3D imaging of rodents. Review of Scientific Instruments. 89 (7), 075107 (2018).
- Chong, W. K., Papadopoulou, V., Dayton, P. A. Imaging with ultrasound contrast agents: current status and future. Abdominal Radiology (NY). 43 (4), 762-772 (2018).
- Nyankima, A. G., Kasoji, S., Cianciolo, R., Dayton, P. A., Chang, E. H. Histological and blood chemistry examination of the rodent kidney after exposure to flash-replenishment ultrasound contrast imaging. Ultrasonics. 98, 1-6 (2019).
- Rojas, J. D., et al. Ultrasound measurement of vascular density to evaluate response to anti-angiogenic therapy in renal cell carcinoma. IEEE Transactions on Biomedical Engineering. 66 (3), 873-880 (2019).
- Boron, W. F., Boulpaep, E. L. Medical Physiology. 3rd edn. , Elsevier. (2017).
Tags
Medicin nummer 174Erratum
Formal Correction: Erratum: Use of 3D Robotic Ultrasound for In Vivo Analysis of Mouse Kidneys
Posted by JoVE Editors on 10/06/2021.
Citeable Link.
An erratum was issued for: Use of 3D Robotic Ultrasound for In Vivo Analysis of Mouse Kidneys. An author name was updated, along with the Protocol and Representative Results sections.
The name of an author was updated from:
Ryan C. Gesser
to:
Ryan C. Gessner
Step 3.1 of the Protocol was updated from:
Turn on the US machine and the heat lamp above the US platforms. Turn on the appropriate anesthesia valves for the corresponding US bays that will be used.
to:
Turn on the US machine and the switch for the internal heating element for the US bays. Turn on the appropriate anesthesia valves for the corresponding US bays that will be used.
Figue 1 in the Representative Results was updated from:
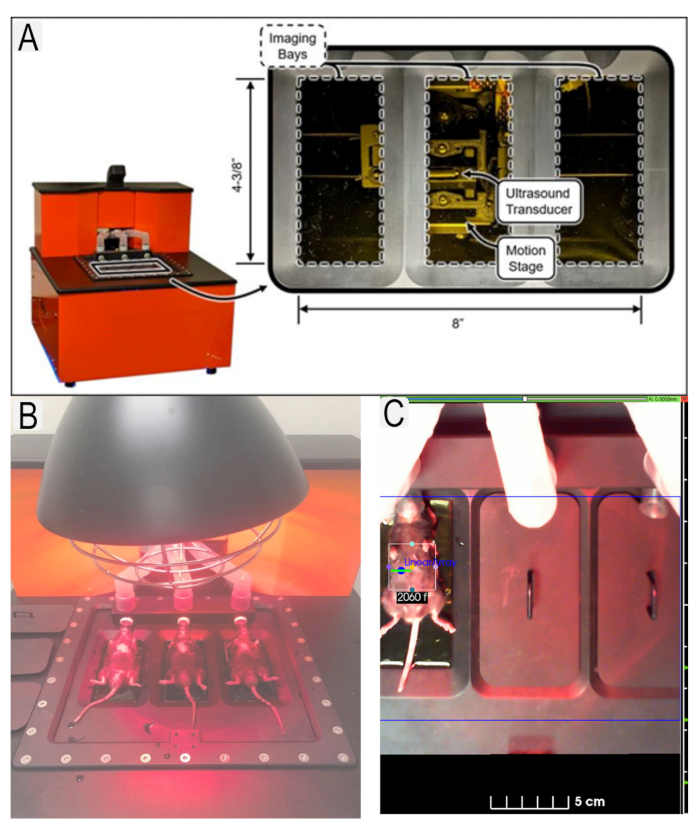
Figure 1: Ultrasound system and mouse placement. (A) Diagram of ultrasound system and location of transducers. (B) View of mice in supine position on ultrasound platform with heat lamp. (C) Example of region of interest (ROI)s in place for area of interest (kidneys) with animal IDs. Please click here to view a larger version of this figure.
to:

Figure 1: Ultrasound system and mouse placement. (A) Diagram of ultrasound system and location of transducers. (B) View of mice in supine position on ultrasound platform. (C) Example of region of interest (ROI)s in place for area of interest (kidneys) with animal IDs. Please click here to view a larger version of this figure.



