ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
该协议表明,机器人超声(US)是传统非侵入性影像模式的实用、经济高效且快速的替代方案。
Abstract
啮齿动物 体内 成像的常见方式包括正电子发射断层扫描 (PET)、计算机断层扫描 (CT)、磁共振成像 (MRI) 和超声 (US)。每种方法都有局限性和优点,包括可用性、易用性、成本、尺寸以及电离辐射或磁场的使用。该协议描述了3D机器人US用于啮齿动物肾脏和心脏的 体内 成像,随后的数据分析以及可能的研究应用。机器人US的实际应用是肾总体积(TKV)的定量,以及囊肿,肿瘤和脉管系统的测量。虽然分辨率不如其他模式高,但机器人美国允许更实用的高通量数据收集。此外,使用US M模式成像,可以量化心脏功能。由于肾脏接受20%-25%的心输出量,因此评估心脏功能对于了解肾脏生理学和病理生理学至关重要。
Introduction
体内啮齿动物成像最常见的方式包括正电子发射断层扫描 (PET)、光学成像 (OI)、计算机断层扫描 (CT)、磁共振成像 (MRI) 和超声 (US)。这些技术提供高分辨率的体内图像,使研究人员能够定量评估和纵向跟踪疾病模型,非侵入性1。虽然每种成像方式都有局限性,但它们也为临床前研究提供了宝贵的工具。
在这里,该研究详细介绍了美国系统,并提出了机器人和3D啮齿动物成像的协议。美国波由称为传感器的探头产生,该探头通常是手持式的。声波在与组织相互作用时被反射回来,回波被重建成图像2。这里描述的协议将侧重于使用机器人控制的传感器和允许快速3D重建以进行定量评估的软件进行肾脏和心脏成像。
Robotic US是一种快速,可靠和非侵入性的成像方式,允许研究人员进行高通量和纵向研究。与手持式美国方法相比,机器人美国方法具有时效性,因为在几分钟内可以扫描多达三只动物。肾脏测量的高通量表明,每小时最多可以对20只小鼠进行成像。机器人换能器位于声膜下方,以两个自由度独立于动物移动(图1A)。这允许新手用户获得高质量的图像,而手持式美国方法更容易受到用户错误的影响。耦合的软件可实现高效、实时的 3D 肾脏重建。以前,磁共振成像(MRI)由于具有出色的软组织对比度,缺乏放射性和穿透深度,因此一直是非侵入性成像的流行方法。然而,MRI通常需要较长的采集时间,并且执行成本高昂。US 已被评估为在评估总肾容量 (TKV) 方面可靠且更快速的 MRI 替代方案 3。
Protocol
本协议中的所有步骤均符合梅奥诊所(明尼苏达州罗切斯特)动物使用指南,并已获得梅奥诊所机构动物护理和使用委员会的批准。
1. 动物模型
- 从商业来源获取小鼠。
注:C57BL/6J(年龄=18个月;n=22(7名男性,15名女性))(材料表)和Pkd1(RC/RC) (年龄=18个月;n=9(3名男性,6名女性))4 用于研究。
2. 脱毛
- 在麻醉室中使用汽化的异氟醚(2%-3%)麻醉动物。通过进行脚趾捏,确保动物充分麻醉。确保鼠标以大约60-90次呼吸/分钟的速率呼吸,没有明显的空气吞噬。
注意:选择汽化异氟醚是因为能够控制和微调动物的麻醉水平。利用异氟醚与100%氧气混合。 - 使用电动剃须刀剃须所需的皮肤区域,以便进行美国测量。
注意:在这项研究中,重点是肾脏和心脏测量,因此动物的胸部和背部被剃光。 - 用棉头涂抹器将脱毛霜涂抹在动物剃须的皮肤上。30-60秒后,用干纸巾擦拭奶油。然后,继续使用湿纱布垫擦去脱毛膏残留物。在开始扫描之前,确保脱毛完成。
注意:任何剩余的头发都会干扰图像质量;完全脱毛至关重要。但是,有必要在一分钟内擦掉脱毛膏,以防止伤害动物的皮肤。动物身上残留的脱毛膏会弄脏美国机器的成像膜。确保使用湿纱布垫正确清洁动物。
3. 动物定位
- 打开美国机器和美国托架内部加热元件的开关。为将要使用的相应美国舱打开适当的麻醉瓣膜。
注:在启动美国成像软件之前,必须打开美国计算机。 - 用足够的水填充托架以覆盖膜。将麻醉的动物放入鼻锥中。
- 对于心脏测量,将动物置于俯卧位置,并将其向右倾斜约30°。
- 对于肾脏测量,将动物置于直卧位。轻轻地使动物的身体变平,以尽量减少动物和膜之间的气穴(图1B)。
注意:用手指在动物的身体旁边移动可以去除粘附在皮肤上的任何气泡,这些气泡会干扰成像。使用水或美国盐水凝胶作为美国培养基;但水有助于这里讨论的快速成像。
4. 超声测量
- 在"美国成像"软件中,选择" 美国采集" 并允许仪器初始化。
- 使用B模式进行肾脏成像。
- 在相应的对话框中输入算例的名称。
- 在相应的对话框中输入动物 ID。
注意:最多可以按顺序对三只动物进行成像。 - 单击标有 3D 的选项卡以初始化3D扫描。
- 使用实时摄像机馈送,移动感兴趣区域 (ROI) 框以容纳肾脏。
注意:ROI 的大小可能会根据图像目标的大小进行调整。增加ROI的大小将略微增加扫描时间(图1C)。根据ROI大小,扫描仪将自动调整传感器扫描整个ROI所需的通过次数。 - 根据所需图像类型,选择" 线性阵列" 或" 摆动器"以选择传感器。从 快速扫描 或针对任一传感器 优化 中选择。
注:线性阵列速度更快,通常提供足够的成像。如果无法通过线性阵列获得所需的图像质量,则可以使用摆动探头。摆动探头利用更高的频率波长,因此在图像中提供更多清晰度。"快速扫描"选项可以更高的速度获取中等质量的图像,无需呼吸校正。虽然"优化"选项需要稍多一些时间,但它提供了更好的图像质量并允许呼吸校正。本手稿将重点介绍如何使用优化的线性阵列预设。 - 单击 实时视图 以查看所需查看区域的实时图像。
- 要移动探头,请单击圆形的" 转到 "按钮,然后单击要成像的鼠标区域。使用具有预定步长的方向箭头来微调传感器位置。
- 单击" 控制面板" 窗口一侧的箭头以打开 设置托盘。单击" 扫描协议" 以打开扫描设置。
- 确定理想的焦距深度并调整TGC(时间增益补偿)的滑块,以更改图像对比度以最佳方式查看肾脏。达到所需设置后,再次单击箭头以关闭 设置托盘。
- 按 "获取静态 "按钮开始 3D 扫描。
注:扫描进度通过软件左下角的进度条指示。 - 扫描完成后,单击蓝色下载箭头以在 预览模式下打开扫描,检查图像质量。通过拖动窗口顶部的红色箭头在扫描的 3D 帧中移动。若要放大或缩小,请按住 Ctrl 键并使用鼠标上的滚动按钮。
- 若要扫描其他动物,请刷新"动物 ID"对话框,输入新 ID,然后重复上述步骤。
注意:扫描完成后,将动物晾干并将它们放回家笼。
- 使用M模式进行心脏成像。
注:M 模式是沿特定所选超声线显示超声波。- 单击 M模式 选项卡以激活心脏成像。
注意:一次只能对一只动物进行成像。 - 确保动物处于心脏扫描的适当位置(步骤2.2)。将 ROI 移动到心脏的大致位置。
- 按下 心脏查找器 按钮以定位心脏。使用热图优化传感器的位置。使用圆形的 "转到 "按钮将换能器移动到左心室(图2A)。
- 转到 实时视图 ,然后使用箭头按钮将换能器放置在肌之间( 图 2B )。要验证探头的正确位置,请查看实时M模式迹线(图2D)。
- 传感器处于适当位置后,单击" 获取序列"。单击蓝色下载箭头以查看已完成的扫描。
- 单击 M模式 选项卡以激活心脏成像。
5. 肾脏分析(分析力学)
- 打开 "图像分析 "选项卡,然后选择" 加载卷 "按钮以输入图像文件/文件夹。
- 分割
- 移动代表各种平面的彩色线条,以在所有平面中找到肾脏。
- 单击" 添加" 以添加新的细分。提供文件的标记名称。
- 使用" 表面切割 "按钮在多个平面上添加肾脏外缘周围的点。单击" 应用 "以在整个肾脏中生成分割(图3A)。
- 滚动浏览每个平面中的不同帧,并通过单击"编辑"并将点拖动到正确的位置来 编辑 任何不准确的区域。
- 或者,如果肾脏形状不规则,请使用 Draw 功能在肾脏周围创建形状不规则的痕迹。单击边缘周围的点,或按住左键单击以徒手绘制轨迹。
- 若要使用" 绘制 "按钮完成跟踪,请用鼠标右键单击。向前滚动多个帧并重复跟踪过程。
- 重复此步骤,直到在整个感兴趣区域中跟踪帧。
- 如果使用 "绘制" 功能,请选择" 在切片之间填充 "以检查和调整迹线。单击 "初始化" 以查看预览。如果预览是可以接受的,请单击" 应用"。如果没有,请单击" 取消" 并修改跟踪。
注意:" 擦除 "按钮将允许删除跟踪中的区域。" 平滑 "按钮可平滑迹线的锯齿状边缘。 - 当图像分析令人满意时,选择 保存 以将分析保存到原始图像文件中。
- 测量
- 使用 卡尺 功能测量图像中的特征。单击 卡钳 按钮,然后左键单击要测量的距离的两个点(图3B)。
- 通过单击屏幕顶部的磁盘按钮保存测量值。
- 分割
6. 心脏分析
- 选择" 加载卷 "以输入要分析的文件。
- 选择" 添加" 选项。
- 使用" 点放置" 工具跟踪每层心脏组织的收缩期和舒张期。继续使用其他心脏组织层。使用 编辑 功能修改迹线(图2C,D)。
注: 如果 M 模式追踪非常清晰,请使用 添加(自动) 按钮自动生成每个图层的追踪。 - 选择 应用 以计算心脏参数。查看 "量化 "选项卡,然后选择" 导出统计信息 "以将所有数据导出为 *.csv文件(图 2E)。
Representative Results
肾脏分析结果
表面积和体积数据是从肾脏分割中获取的。此信息可用于比较实验模型和对照模型或跟踪随时间的变化。卡尺工具可用于快速测量异常(即囊肿,肿瘤)以及它们如何随时间变化。 图3 表明,分割和卡尺方法都可用于准确测量囊肿体积。 图4 显示了年龄匹配对照组和实验性(Pkd1RC / RC)小鼠之间总肾体积(TKV)的明显差异。这些体积渲染的3D可视化可以在系统内执行,包括在3D空间内的旋转(图5)。然后使用这些3D重建来计算TKV(mm3; 图 4)以及单个大囊肿体积。
心脏分析结果
从M模式图像的分析中获取了许多有用的参数。这些数据提供了当时左心室(LV)心脏功能的良好快照。数据输出包括左心室内径、左心室后壁、左心室前壁直径、射血分数、分数缩短、每搏量、心率、心输出量、左心室体积和左心室肿块。心脏分析的成功取决于对M Mode图像上各层的精确分割。大多数心血管结果是通过心内膜后层和前部的收缩期和舒张期峰值来计算的。心外膜后层呈亮白色,并遵循与心内膜后层相似的模式。心内膜后层的示踪应放置在最低轮廓上。前心内膜层应沿着该层的最高轮廓进行追踪。由于动物俯卧位,心外膜前层在图像底部呈线性(图2D)。 图6 显示了一项研究的示例,实验小鼠和对照组小鼠之间的心输出量没有显着差异。与肾脏成像一样,3D心脏可视化是可能的。然而,心脏周期的4D可视化(补充图1)允许研究者可视化和精确定位被评估动物的形态和周期动态异常。
形态学评估
为了快速和廉价的评估,US可以有效地纵向监测生理参数。然而,许多研究希望另外确定更精细的形态学特征,例如囊肿的数量和大小,钙化(肾结石),血管形成或纤维化程度。 图7 比较了正常的小鼠肾脏与囊性小鼠肾脏和中度钙化的小鼠肾脏。通过将美国中心频率(线性阵列为10 MHz)增加到35 MHz(摆动放大器),可以获得增加细节的图片。

图1:超声系统和鼠标放置。 (A)超声系统和换能器位置图。(B)超声平台上仰卧位小鼠的视图。(C)具有动物ID的感兴趣区域(肾脏)的感兴趣区域(ROI)示例。 请点击此处查看此图的放大版本。

图2:心脏超声成像以获得生理参数。 (A)使用 心脏查找器 热图图像将换能器定位在左心室进行M模式成像。左心室中的换能器位置由大绿点指示。( B )正确放置在肌上时换能器的视图(虚线框)。(C)测量心脏参数所需的图层的示例视图。(D) 实时 M-Mode 图像视图,其图层指定为 C 图(从上到下的图层:心外膜后部、心内膜后部、心内膜前部和心外膜前部。(E) 心脏测量产生的统计数据的示例输出。 请点击此处查看此图的放大版本。

图3:使用分割和卡尺工具测量肾脏和囊肿(A)示例分割(轴向视图)和大囊肿(黄色)的两个肾脏(蓝色和橙色阴影)和下面列出的体积。非分割视图显示在下方,以便可以查看未遮挡的美国。(B)使用卡尺测量图3A中的相同囊肿(矢状面图)的示例,测量结果如下。使用椭圆的公式计算体积(体积 = (4/3)π x a x b x c,其中 a、b、c 分别是相对 x、y、z)。请点击此处查看此图的放大版本。

图4:WT和囊性小鼠肾脏的TKV分布。 野生型(WT)(C57BL / 6J)和患病(Pkd1RC / RC)小鼠的TKV的表示。n = 22 (WT) n = 9 (Pkd1RC/RC);双尾 t检验结果:p<0.0001。Box 显示 25-75 个 百分位值,晶须显示 1.5 倍的四分位间距。 请点击此处查看此图的放大版本。

图5:分割性肾脏和囊肿的动画3D重建。 使用该软件,肾脏和囊肿的3D投影可以在3D空间中旋转或摇摆(蓝色=左肾;黄色=大囊肿;橙色=右肾)。 请点击此处下载此图。

图6:来自美国测量的心脏生理参数。 WT和患病(Pkd1RC / RC)小鼠的心输出量(mL / min)的表示。n = 22 (WT) n = 9 (Pkd1RC/RC)。下表显示,这两组在射血分数、每搏量、心率 (HR) 或心输出量 (CO) 方面没有显著差异。双尾 t检验结果:p>0.05。框显示第 25-75 个 百分位值。 请点击此处查看此图的放大版本。

图7:美国正常和两种病理的矢状面切片的比较。 (A)野生型(C57BL / 6J菌株)肾脏(TKV = 143.202 mm3)。(B)囊性肾伴TKV升高(Pkd1RC / RC 小鼠)(TKV = 333.158 mm3)。囊肿由黄色箭头表示。(C)肾脏伴血管钙化(模型=低密度脂蛋白受体缺乏,载脂蛋白B100仅小鼠喂养西方饮食12个月5)(TKV = 127.376 mm3)。肾结石由绿色箭头表示。 请点击此处查看此图的放大版本。
补充图1:来自美国测量的4D心脏周期视频。使用该软件,在3D US中捕获跳动的心脏的表示,并通过心脏周期进行投影。绿色箭头表示主动脉瓣。(模型=低密度脂蛋白受体缺乏,载脂蛋白B100仅小鼠,喂食西方饮食12个月5)。该模型产生血管钙化,由于美国钙化的声学反射率更高,因此更容易地可视化心脏和瓣膜。WT小鼠可以进行类似的4D重建;但是,捕获的声学对比度不会那么高。 请点击此处下载此文件。
Discussion
超声波利用声波,任何阻碍声波传播的障碍都会干扰图像质量。因此,要成像区域的完全脱毛至关重要。确保完全去除脱毛膏也很重要,因为它会导致动物皮肤的灼伤/刺激,并使扫描仪的透明膜变色。海湾中足够的水位对于最佳声波传播是必要的,因此是获得最高图像分辨率所必需的。但是,当动物处于俯卧姿势时,请确保动物的鼻子高于水位,否则动物有吸入水的风险。优化成像参数,尤其是焦深,对于获得高质量图像至关重要。对于单个动物,可能需要修改参数。
与传统的手持式美国模式相比,Robotic US具有许多优势。首先,系统使用基于摄像头的简单点击界面。此功能解决了传统 US 的复杂性,即使由新手用户操作,也能生成一致的数据6。其次,该系统允许使用水而不是传统的美国凝胶作为声学介质。以前,使用美国凝胶允许形成干扰高质量图像采集的气泡。此外,美国凝胶很乱,为清理提供了挑战。此外,水通过加热灯加热,有助于保持动物的体温。第三,机器人美国速度更快,因此呼吸运动的伪影没有问题。提高的成像速度允许实际完成高通量数据收集。第四,机器人US获得3D图像,因此使物体的3D重建变得简单(图4)。MRI和其他方式昂贵,耗时,并且并不总是可用。重要的是,机器人美国系统适合在桌子或长凳上,并且更具成本效益。最后,先前的研究表明,Robotic US可以提供与更昂贵的模式(如MRI3)相当的测量数据。
虽然这项工作中描述的美国机器人系统的图像质量和分辨率足以满足所提出的应用(图7),但未来有几种方法可以提高图像质量。例如,利用更高频率的传感器(例如,50-70 MHz)将产生具有更好特征清晰度的更高分辨率图像。虽然使用更高的频率会导致较差的穿透深度,但图像应足以进行表面器官(如小鼠肾脏)的 体内 成像。与其他影像学检查方式一样,造影剂可用于增强特定特征。对于美国来说,这通常意味着使用高度反射声波的东西。血管内微气泡,其中脂质包围非常小的气泡就是这样一种剂。微米级的气泡具有高反射性,因此可提供第二个不同的信号,从而转化为高分辨率的脉管系统7。虽然这种声学对比技术可能非常有用,但它可能有几个缺点。首先,微气泡必须新鲜,并且仅在 体内 持续5-10分钟。其次, 体内 血管内注射通常需要尾部面纱导管注射,这在技术上可能具有挑战性。在某些情况下和脉动状态下,微气泡成像本身可导致肾血管系统损伤8。
所使用的特定美国系统也有一些更一般的限制。首先,机器人机箱中仅包含一个线性阵列(以18 MHz为中心),因此目前无法切换到更高或更低频率的探头。这可能会影响可以使用系统评估的模型的广度(无论更大或更小)。仪器的未来迭代应包括多个线性阵列,以涵盖所有临床前动物模型。其次,换能器相对于动物主体的角度无法控制。因此,执行角度依赖性成像技术(如多普勒)或实现某些器官的替代面内视图(例如,肾脏的长轴视图)需要重新定位动物,并且可能难以实现。可以在机器人运动中添加额外的自由度,以改善这一挑战。第三,有时,我们观察到由将动物与换能器分开的声膜产生的混响伪影,这些音质可能会模糊表面特征和边界的可视化。在这些情况下,使用凝胶支座将动物抬高远离膜可以补救这种情况。最后,通过加热灯进行温度控制是不精确的,因此在成像时必须密切关注动物的核心体温。更受控的加热机制,如集成加热垫,可能会改善稳态管理和成像吞吐量。
机器人US的使用可能适用于各个研究领域。该技术能够可视化粗大组织结构,因此可用于跟踪肿瘤进展和潜在疗法6,9 以及此处介绍的肾脏形态。分割图像特定特征的能力使其成为研究多囊肾病(PKD)模型的有吸引力的工具3。M模式图像允许对许多重要的心脏参数进行简单定量,从而实现心脏生理学的 体内 评估。由于肾脏接受20%-25%的心输出量10,因此在肾脏病理学纵向评估期间了解心脏功能非常重要。通过这些美国方案,我们试图说明美国成像不仅对 体内 和纵向肾脏研究是实用的,而且越来越多的美国工具能够在临床前研究中对小鼠进行形态学和生理学评估。
Disclosures
几位作者要么受雇于SonoVol,Inc.(CJM,RCG,TJC)许可的专利,要么拥有重大经济利益,要么是共同发明人。
Acknowledgments
这项工作得到了NIH(R43-DK126607,TJC,TLK,MFR)和梅奥基金会的支持。
Materials
| Name | Company | Catalog Number | Comments |
| Electric Razor | Braintree Scientific, Inc | CLP-9868 14 | |
| C57bk6j | The Jackson laboratory | https://www.jax.org/ | |
| Cotton gauze pads | Fisher Scientific | ||
| Cotton tipped applicators | Fisher Scientific | ||
| Depilatory cream | N/a | N/a | This study used Nair |
| Heat lamp | Included with SonoVol Vega system | ||
| Robotic Ultrasound System | SonoVol Inc | SonoVol Vega system includes anesthesia system | |
| SonoEQ Software | SonoVol | Included with SonoVol Vega system | |
| TERRELL Isoflurane | Piramal Critical Care, Inc | NDC 66794-019-10 |
References
- Cunha, L., et al. Preclinical imaging: an essential ally in modern biosciences. Molecular Diagnostics & Therapy. 18 (2), 153-173 (2014).
- Ultrasound. NIBIB. , Available from: https://www.nibib.nih.gov/science-education/science-topics/ultrasound#pid-936 (2016).
- Beaumont, N. J., et al. Assessing polycystic kidney disease in rodents: Comparison of robotic 3d ultrasound and magnetic resonance imaging. Kidney360. 1 (10), 1128-1136 (2020).
- Hopp, K., et al. Functional polycystin-1 dosage governs autosomal dominant polycystic kidney disease severity. The Journal of Clinical Investigation. 122 (11), 4257-4273 (2012).
- Weiss, R. M., Ohashi, M., Miller, J. D., Young, S. G., Heistad, D. D. Calcific aortic valve stenosis in old hypercholesterolemic mice. Circulation. 114 (19), 2065-2069 (2006).
- Czernuszewicz, T. J., et al. A new preclinical ultrasound platform for widefield 3D imaging of rodents. Review of Scientific Instruments. 89 (7), 075107 (2018).
- Chong, W. K., Papadopoulou, V., Dayton, P. A. Imaging with ultrasound contrast agents: current status and future. Abdominal Radiology (NY). 43 (4), 762-772 (2018).
- Nyankima, A. G., Kasoji, S., Cianciolo, R., Dayton, P. A., Chang, E. H. Histological and blood chemistry examination of the rodent kidney after exposure to flash-replenishment ultrasound contrast imaging. Ultrasonics. 98, 1-6 (2019).
- Rojas, J. D., et al. Ultrasound measurement of vascular density to evaluate response to anti-angiogenic therapy in renal cell carcinoma. IEEE Transactions on Biomedical Engineering. 66 (3), 873-880 (2019).
- Boron, W. F., Boulpaep, E. L. Medical Physiology. 3rd edn. , Elsevier. (2017).
Tags
医学,第174期,Erratum
Formal Correction: Erratum: Use of 3D Robotic Ultrasound for In Vivo Analysis of Mouse Kidneys
Posted by JoVE Editors on 10/06/2021.
Citeable Link.
An erratum was issued for: Use of 3D Robotic Ultrasound for In Vivo Analysis of Mouse Kidneys. An author name was updated, along with the Protocol and Representative Results sections.
The name of an author was updated from:
Ryan C. Gesser
to:
Ryan C. Gessner
Step 3.1 of the Protocol was updated from:
Turn on the US machine and the heat lamp above the US platforms. Turn on the appropriate anesthesia valves for the corresponding US bays that will be used.
to:
Turn on the US machine and the switch for the internal heating element for the US bays. Turn on the appropriate anesthesia valves for the corresponding US bays that will be used.
Figue 1 in the Representative Results was updated from:
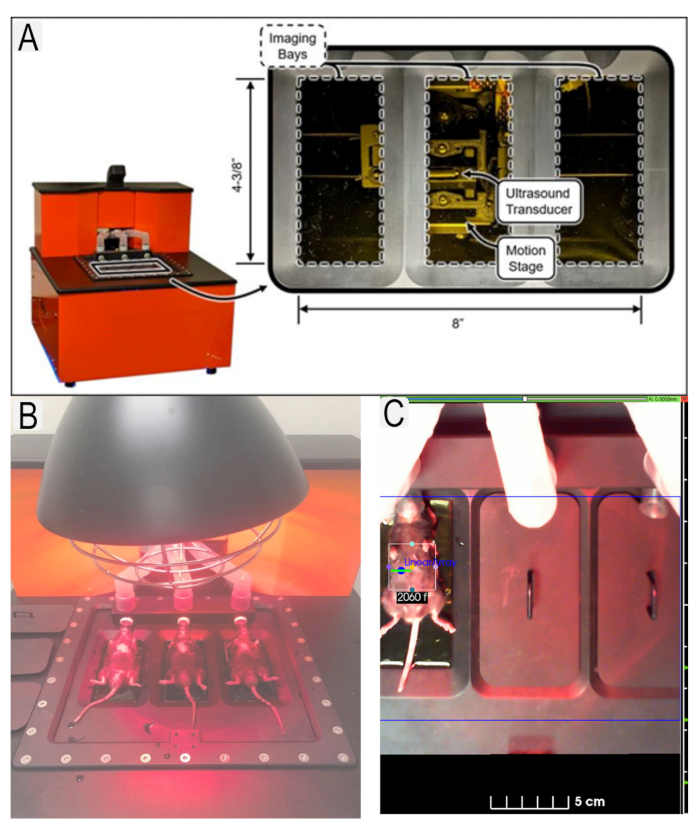
Figure 1: Ultrasound system and mouse placement. (A) Diagram of ultrasound system and location of transducers. (B) View of mice in supine position on ultrasound platform with heat lamp. (C) Example of region of interest (ROI)s in place for area of interest (kidneys) with animal IDs. Please click here to view a larger version of this figure.
to:

Figure 1: Ultrasound system and mouse placement. (A) Diagram of ultrasound system and location of transducers. (B) View of mice in supine position on ultrasound platform. (C) Example of region of interest (ROI)s in place for area of interest (kidneys) with animal IDs. Please click here to view a larger version of this figure.



