ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Dieses Protokoll demonstriert Roboterultraschall (US) als praktische, kostengünstige und schnelle Alternative zu herkömmlichen nicht-invasiven Bildmodalitäten.
Abstract
Übliche Modalitäten für die In-vivo-Bildgebung von Nagetieren sind Positronen-Emissions-Tomographie (PET), Computertomographie (CT), Magnetresonanztomographie (MRT) und Ultraschall (US). Jede Methode hat Einschränkungen und Vorteile, einschließlich Verfügbarkeit, Benutzerfreundlichkeit, Kosten, Größe und die Verwendung von ionisierender Strahlung oder Magnetfeldern. Dieses Protokoll beschreibt die Verwendung von 3D-Roboter-US für die In-vivo-Bildgebung von Nagetiernieren und -herzen, die anschließende Datenanalyse und mögliche Forschungsanwendungen. Praktische Anwendungen von Robotic US sind die Quantifizierung des Gesamtnierenvolumens (TKV) sowie die Messung von Zysten, Tumoren und Gefäßsystemen. Obwohl die Auflösung nicht so hoch ist wie bei anderen Modalitäten, ermöglicht Robotic US eine praktischere Datenerfassung mit hohem Durchsatz. Darüber hinaus kann mit Hilfe der US-amerikanischen M-Mode-Bildgebung die Herzfunktion quantifiziert werden. Da die Nieren 20% -25% des Herzzeitvolumens erhalten, ist die Beurteilung der Herzfunktion entscheidend für das Verständnis der Nierenphysiologie und Pathophysiologie.
Introduction
Zu den gebräuchlichsten Modalitäten für die In-vivo-Bildgebung von Nagetieren gehören die Positronen-Emissions-Tomographie (PET), die optische Bildgebung (OI), die Computertomographie (CT), die Magnetresonanztomographie (MRT) und der Ultraschall (US). Diese Techniken liefern hochauflösende In-vivo-Bilder , die es den Forschern ermöglichen, Krankheitsmodelle nicht-invasiv quantitativ zu bewerten und longitudinal zu verfolgen1. Während jede Bildgebungsmodalität Einschränkungen aufweist, bieten sie auch unschätzbare Werkzeuge für die präklinische Forschung.
Hier beschreibt die Studie ein US-System und stellt das Protokoll für die Roboter- und 3D-Nagetierbildgebung vor. US-Wellen werden von einer Sonde erzeugt, die als Wandler bezeichnet wird und typischerweise in der Hand gehalten wird. Schallwellen werden zurückreflektiert, wenn sie mit Geweben interagieren, und die Echos werden in Bilder rekonstruiert2. Das hier beschriebene Protokoll konzentriert sich auf die Nieren- und Herzbildgebung unter Verwendung eines robotergesteuerten Wandlers und unter Verwendung einer Software, die eine schnelle 3D-Rekonstruktion für die quantitative Bewertung ermöglicht.
Robotic US ist eine schnelle, zuverlässige und nicht-invasive Bildgebungsmodalität, die es Forschern ermöglicht, Hochdurchsatz- und Längsschnittstudien durchzuführen. Im Vergleich zu tragbaren US-Methoden ist die robotergestützte US-Methode zeiteffizient, da bis zu drei Tiere in wenigen Minuten gescannt werden können. Ein hoher Durchsatz für Nierenmessungen deutet darauf hin, dass bis zu 20 Mäuse pro Stunde abgebildet werden können. Die Roboterwandler befinden sich unter den akustischen Membranen und bewegen sich unabhängig vom Tier mit zwei Freiheitsgraden (Abbildung 1A). Dies ermöglicht es unerfahrenen Benutzern, qualitativ hochwertige Bilder zu erhalten, während tragbare US-Methoden anfälliger für Benutzerfehler sind. Die gekoppelte Software ermöglicht eine effiziente Echtzeit-3D-Nierenrekonstruktion. Bisher war die Magnetresonanztomographie (MRT) aufgrund des hervorragenden Weichteilkontrasts, der fehlenden Radioaktivität und der Eindringtiefe eine weit verbreitete Methode für die nicht-invasive Bildgebung. Die MRT erfordert jedoch oft lange Erfassungszeiten und ist teuer in der Durchführung. DIE USA wurden als zuverlässige und schnellere Alternative zur MRT bei der Beurteilung des Gesamtnierenvolumens (TKV)3 bewertet.
Protocol
Alle Schritte in diesem Protokoll entsprechen den Richtlinien der Mayo Clinic (Rochester, MN) für Tiere und wurden vom Mayo Clinic Institutional Animal Care and Use Committee genehmigt.
1. Tiermodell
- Erhalten Sie Mäuse aus kommerziellen Quellen.
ANMERKUNG: C57BL/6J (Alter = 18 Monate; n = 22 (7 Männer, 15 Frauen)) (Materialtabelle) und Pkd1(RC/RC) (Alter = 18 Monate; n = 9 (3 Männer, 6 Frauen))4 wurden für die Studie verwendet.
2. Haarentfernung
- Betäuben Sie das Tier mit verdampftem Isofluran (2% -3%) in einer Anästhesiekammer. Stellen Sie sicher, dass das Tier ausreichend betäubt ist, indem Sie eine Zehenzange durchführen. Stellen Sie sicher, dass die Maus mit einer Geschwindigkeit von ca. 60-90 Atemzügen/min atmet, ohne dass offensichtliche Luft geschluckt wird.
HINWEIS: Verdampftes Isofluran wurde aufgrund der Fähigkeit gewählt, das Anästhesieniveau des Tieres zu kontrollieren und zu verfeinern. Isofluran gemischt mit 100% Sauerstoff wurde verwendet. - Verwenden Sie einen elektrischen Rasierer, um den gewünschten Hautbereich für US-Messungen zu rasieren.
HINWEIS: In dieser Studie liegt der Schwerpunkt auf Nieren- und Herzmessungen, so dass Brust und Rücken des Tieres rasiert wurden. - Tragen Sie die Enthaarungscreme mit einem Applikator mit Baumwollspitze auf die rasierte Haut des Tieres auf. Wischen Sie die Creme nach 30-60 s mit einem trockenen Papiertuch ab. Wischen Sie dann die Rückstände der Enthaarungscreme mit feuchten Mullbinden ab. Stellen Sie sicher, dass die Haarentfernung abgeschlossen ist, bevor Sie mit den Scans beginnen.
HINWEIS: Verbleibende Haare beeinträchtigen die Bildqualität. eine vollständige Haarentfernung ist entscheidend. Es ist jedoch notwendig, die Enthaarungscreme innerhalb einer Minute abzuwischen, um eine Verletzung der Haut des Tieres zu vermeiden. Übrig gebliebene Enthaarungscreme auf dem Tier kann die Bildmembran der US-Maschine verfärben. Stellen Sie sicher, dass das Tier mit nassen Mullbinden ordnungsgemäß gereinigt wird.
3. Positionierung der Tiere
- Schalten Sie die US-Maschine und den Schalter für das interne Heizelement für die US-Buchten ein. Schalten Sie die entsprechenden Anästhesieventile für die entsprechenden US-Buchten ein, die verwendet werden.
HINWEIS: Das US-Gerät muss vor dem Starten der US-Imaging-Software eingeschaltet sein. - Füllen Sie die Buchten mit genügend Wasser, um die Membran zu bedecken. Legen Sie das betäubte Tier in den Nasenkegel.
- Für Herzmessungen das Tier in Bauchlage bringen und ca. 30° nach rechts neigen.
- Für Nierenmessungen stellen Sie das Tier in eine gerade und rückende Position. Drücken Sie den Körper des Tieres vorsichtig ab, um die Lufteinschlüsse zwischen dem Tier und der Membran zu minimieren (Abbildung 1B).
HINWEIS: Wenn Sie mit einem Finger neben dem Körper des Tieres fahren, können Luftblasen entfernt werden, die an der Haut haften, was die Bildgebung beeinträchtigt. Verwenden Sie Wasser oder US-Salzgel als US-Medium; aber Wasser erleichtert die hier diskutierte schnelle Bildgebung.
4. Ultraschallmessungen
- Wählen Sie in der US-Imaging-Software DIE Option US-Erfassung aus, und lassen Sie das Gerät initialisieren.
- Nierenbildgebung im B-Modus.
- Geben Sie im entsprechenden Dialogfenster einen Namen für die Studie ein.
- Geben Sie die Tier-ID in das entsprechende Dialogfeld ein.
HINWEIS: Bis zu drei Tiere können nacheinander abgebildet werden. - Klicken Sie auf die Registerkarte 3D , um das 3D-Scannen zu initialisieren.
- Verschieben Sie mit dem Live-Kamera-Feed die Region of Interest (ROI) -Box, um die Nieren zu enthalten.
HINWEIS: Die Größe des ROI kann in Abhängigkeit von der Größe des Bildziels angepasst werden. Wenn Sie die Größe des ROI erhöhen, wird die Scanzeit leicht verlängert (Abbildung 1C). Abhängig von der ROI-Größe passt der Scanner automatisch die Anzahl der Durchgänge an, die der Aufnehmer benötigt, um den gesamten ROI zu scannen. - Wählen Sie je nach Gewünschtem Bildtyp Linear Array oder Wobbler, um den Aufnehmer auszuwählen. Wählen Sie zwischen Fast Scan oder Optimized für einen der beiden Messumformer.
HINWEIS: Das lineare Array ist schneller und bietet in der Regel eine angemessene Bildgebung. Der Wobbler-Wandler kann verwendet werden, wenn die gewünschte Bildqualität mit dem linearen Array nicht erreicht werden kann. Der Wobbler-Wandler verwendet eine höhere Frequenzwellenlänge und bietet daher mehr Definition in Bildern. Die Option "Schneller Scan" erfasst Bilder mittlerer Qualität ohne Atemkorrektur bei höherer Geschwindigkeit. Während die Option Optimiert etwas mehr Zeit in Anspruch nimmt, bietet sie eine bessere Bildqualität und ermöglicht eine Atemkorrektur. Dieses Manuskript konzentriert sich auf die Verwendung der Voreinstellung "Optimiertes lineares Array". - Klicken Sie auf die Live-Ansicht , um ein Live-Bild des gewünschten Betrachtungsbereichs zu sehen.
- Um den Messumformer zu bewegen, klicken Sie auf die kreisförmige Schaltfläche Gehe zu und dann auf den Bereich der Maus, der abgebildet werden soll. Verwenden Sie die Richtungspfeile mit vorgegebenen Schrittweiten, um die Position des Messumformers fein einzustellen.
- Klicken Sie auf den Pfeil an der Seite des Systemsteuerungsfensters , um die Einstellungsleiste zu öffnen. Klicken Sie auf Scanprotokoll , um die Scaneinstellungen zu öffnen.
- Bestimmen Sie die ideale Fokustiefe und passen Sie die Schieberegler für die TGC (Time Gain Compensation) an, um den Bildkontrast so zu ändern, dass die Nieren optimal angezeigt werden. Nachdem Sie die gewünschten Einstellungen vorgenommen haben, klicken Sie erneut auf den Pfeil, um die Einstellungsleiste zu schließen.
- Drücken Sie die Taste Static erfassen , um den 3D-Scan zu starten.
HINWEIS: Der Fortschritt des Scans wird über einen Fortschrittsbalken unten links in der Software angezeigt. - Sobald der Scanvorgang abgeschlossen ist, überprüfen Sie die Bildqualität, indem Sie auf den blauen Download-Pfeil klicken, um den Scan im Vorschaumodus zu öffnen. Bewegen Sie sich durch die 3D-Frames des Scans, indem Sie den roten Pfeil oben im Fenster ziehen. Halten Sie zum Vergrößern oder Verkleinern die Strg-Taste gedrückt und verwenden Sie die Bildlauftaste der Maus.
- Um weitere Tiere zu scannen, aktualisieren Sie die Dialogfelder mit der Tier-ID, geben Sie die neuen IDs ein, und wiederholen Sie dann die obigen Schritte.
HINWEIS: Wenn die Scans abgeschlossen sind, trocknen Sie die Tiere ab und bringen Sie sie in ihre Heimkäfige zurück.
- Kardiale Bildgebung im M-Modus.
HINWEIS: Der M-Modus ist die Anzeige einer Ultraschallwelle entlang einer bestimmten, ausgewählten Ultraschalllinie.- Klicken Sie auf die Registerkarte M-Modus , um die kardiale Bildgebung zu aktivieren.
HINWEIS: Es kann jeweils nur ein Tier abgebildet werden. - Stellen Sie sicher, dass sich das Tier in der für Herzuntersuchungen geeigneten Position befindet (Schritt 2.2). Verschieben Sie den ROI an die ungefähre Position des Herzens.
- Drücken Sie die Herz-Finder-Taste , um das Herz zu lokalisieren. Verwenden Sie die Heatmap, um die Position des Wandlers zu optimieren. Verwenden Sie die kreisförmige Schaltfläche Gehe zu , um den Wandler in den linken Ventrikel zu bewegen (Abbildung 2A).
- Wechseln Sie zur Live-Ansicht , und platzieren Sie den Wandler mithilfe der Pfeiltasten zwischen den Papillarmuskeln (Abbildung 2B). Um die korrekte Platzierung des Wandlers zu überprüfen, zeigen Sie die Live-Spur des M-Modus an (Abbildung 2D).
- Sobald sich der Aufnehmer in der entsprechenden Position befindet, klicken Sie auf Sequenz erfassen. Klicken Sie auf den blauen Download-Pfeil, um den abgeschlossenen Scan anzuzeigen.
- Klicken Sie auf die Registerkarte M-Modus , um die kardiale Bildgebung zu aktivieren.
5. Nierenanalyse (Mechanik der Analyse)
- Öffnen Sie die Registerkarte Bildanalyse und wählen Sie die Schaltfläche Volume(s) laden , um die Bilddateien/-ordner einzugeben.
- Segmentierung
- Bewegen Sie die farbigen Linien, die verschiedene Ebenen darstellen, um die Niere in allen Ebenen zu finden.
- Klicken Sie auf Hinzufügen , um eine neue Segmentierung hinzuzufügen. Geben Sie einen Markupnamen für die Datei an.
- Verwenden Sie die Schaltfläche Flächenschnitt (Surface Cut ), um Punkte um den äußeren Rand der Niere in mehreren Ebenen hinzuzufügen. Klicken Sie auf Anwenden , um eine Segmentierung durch die gesamte Niere zu generieren (Abbildung 3A).
- Scrollen Sie durch die verschiedenen Frames in jeder Ebene und bearbeiten Sie ungenaue Bereiche, indem Sie auf Bearbeiten klicken und die Punkte an die richtige Position ziehen.
- Alternativ, wenn die Niere unregelmäßig in der Form ist, verwenden Sie die Draw-Funktion , um eine unregelmäßig geformte Spur um die Niere zu erstellen. Klicken Sie entweder auf Punkte um den Rand oder halten Sie die linke Maustaste gedrückt, um die Ablaufverfolgung freihändig zu zeichnen.
- Um die Ablaufverfolgung mit der Schaltfläche Zeichnen abzuschließen, klicken Sie mit der rechten Maustaste. Führen Sie einen Bildlauf um mehrere Frames durch, und wiederholen Sie den Ablaufverfolgungsvorgang.
- Wiederholen Sie diesen Vorgang, bis die Frames im gesamten interessierenden Bereich nachgezeichnet sind.
- Wenn die Funktion Zeichnen verwendet wird, wählen Sie "Zwischen Segmenten füllen ", um die Leiterbahn zu überprüfen und anzupassen. Klicken Sie auf Initialisieren , um eine Vorschau anzuzeigen. Wenn die Vorschau akzeptabel ist, klicken Sie auf Übernehmen. Wenn nicht, klicken Sie auf Abbrechen und ändern Sie die Ablaufverfolgungen.
HINWEIS: Die Schaltfläche Löschen ermöglicht das Löschen eines Bereichs innerhalb einer Ablaufverfolgung. Mit der Schaltfläche "Glätten " werden die gezackten Kanten einer Leiterbahn geglättet. - Wenn die Bildanalyse zufriedenstellend ist, wählen Sie Speichern aus, um die Analyse in der ursprünglichen Bilddatei zu speichern.
- Messung
- Verwenden Sie die Calipers-Funktion , um Features im Bild zu messen. Klicken Sie auf die Schaltfläche Messschieber und klicken Sie mit der linken Maustaste auf die beiden Punkte der zu messenden Entfernung (Abbildung 3B).
- Speichern Sie die Messung, indem Sie oben auf dem Bildschirm auf die Schaltfläche Diskette klicken.
- Segmentierung
6. Herzanalyse
- Wählen Sie Volumes laden aus, um die zu analysierende(n) Datei(en) einzugeben.
- Wählen Sie die Option Hinzufügen aus .
- Verwenden Sie das Point Placement-Werkzeug, um die Systole und diastole für jede Schicht herzgewebe zu verfolgen. Fahren Sie mit den anderen Schichten des Herzgewebes fort. Verwenden Sie die Edit-Funktion, um die Ablaufverfolgungen zu ändern (Abbildung 2C,D).
HINWEIS: Wenn die M-Modus-Ablaufverfolgung sehr klar ist, verwenden Sie die Schaltfläche Hinzufügen (automatisch), um automatisch Ablaufverfolgungen für jede Ebene zu generieren. - Wählen Sie Anwenden aus, um die Herzparameter zu berechnen. Zeigen Sie die Registerkarte Quantifizieren an, und wählen Sie Statistik exportieren aus, um alle Daten als *.csv Datei zu exportieren (Abbildung 2E).
Representative Results
Ergebnisse der Nierenanalyse
Oberflächen- und Volumendaten werden aus der Segmentierung der Nieren gewonnen. Diese Informationen können verwendet werden, um experimentelle und Kontrollmodelle zu vergleichen oder Änderungen im Laufe der Zeit zu verfolgen. Das Messschieber-Tool ist nützlich, um Anomalien (z. B. Zysten, Tumore) schnell zu messen und wie sich ihre Länge im Laufe der Zeit ändert. Abbildung 3 legt nahe, dass sowohl die Segmentierungs- als auch die Bremssattelmethode verwendet werden können, um das Zystenvolumen genau zu messen. Abbildung 4 zeigt einen deutlichen Unterschied im Gesamtnierenvolumen (TKV) zwischen altersangepassten Kontroll- und experimentellen (Pkd1RC/RC) Mäusen. Die 3D-Visualisierung dieser Volumen-Renderings kann innerhalb des Systems durchgeführt werden, einschließlich Drehungen innerhalb des 3D-Raums (Abbildung 5). Diese 3D-Rekonstruktionen werden dann verwendet, um TKV (mm3; Abbildung 4) sowie individuelles großes Zystenvolumen.
Ergebnisse der Herzanalyse
Viele nützliche Parameter werden aus der Analyse von M Mode-Bildern gewonnen. Diese Daten liefern eine gute Momentaufnahme der linksventrikulären (LV) Herzfunktion zu diesem Zeitpunkt. Die Datenausgabe umfasst LV-Innendurchmesser, LV-Hinterwand, LV-Vorderwanddurchmesser, Auswurffraktion, fraktionierte Verkürzung, Schlagvolumen, Herzfrequenz, Herzzeitvolumen, LV-Volumen, LV-Volumen und LV-Masse. Der Erfolg der Herzanalyse hängt von der genauen Segmentierung der Schichten auf dem M-Mode-Bild ab. Die meisten kardiovaskulären Ergebnisse werden durch die systolischen und diastolischen Spitzenphasen der hinteren und vorderen Endokardschichten berechnet. Die hintere epikardiale Schicht erscheint hellweiß und folgt einem ähnlichen Muster wie die hintere Endokardschicht. Die Spur für die hintere Endokardschicht sollte auf der untersten Kontur platziert werden. Die vordere Endokardschicht sollte entlang der höchsten Kontur dieser Schicht verfolgt werden. Die vordere Epikardschicht erscheint aufgrund der bauchfreien Positionierung des Tieres linear am unteren Bildrand (Abbildung 2D). Abbildung 6 zeigt ein Beispiel für eine Studie ohne signifikanten Unterschied im Herzzeitvolumen zwischen experimentellen und Kontrollmäusen. Wie bei der nierenalen Bildgebung ist eine 3D-Herzvisualisierung möglich. Dennoch ermöglicht eine 4D-Visualisierung des Herzzyklus (Ergänzende Abbildung 1) dem Prüfarzt, sowohl morphologische als auch zyklusdynamische Anomalien im untersuchten Tier zu visualisieren und zu lokalisieren.
Morphologische Beurteilung
Für eine schnelle und kostengünstige Beurteilung können die USA physiologische Parameter längs effektiv überwachen. Viele Studien möchten jedoch zusätzlich feinere morphologische Merkmale bestimmen, z. B. Anzahl und Größe von Zysten, Verkalkungen (Nierensteine), Vaskularisierung oder Fibrosegrad. Abbildung 7 vergleicht eine normale Mausniere mit einer zystischen Mausniere mit einer mäßig verkalkten Mausniere. Durch Erhöhung der US-Mittelfrequenz (10 MHz mit dem linearen Array) auf 35 MHz (Wobbler-Verstärker) können Bilder mit zunehmender Detailtreue erhalten werden.

Abbildung 1: Ultraschallsystem und Mausplatzierung. (A) Diagramm des Ultraschallsystems und Lage der Schallwandler. (B) Ansicht von Mäusen in Rückenlage auf der Ultraschallplattform. (C) Beispiel für region of interest (ROI) für das Interessengebiet (Nieren) mit Tier-IDs. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Herzultraschallbildgebung zur Ermittlung physiologischer Parameter. (A) Verwendung des Heatmap-Bildes des Heart Finders zur Positionierung des Schallkopfes in der linken Herzkammer für die M-Mode-Bildgebung. Die Position des Wandlers in der linken Herzkammer wird durch den großen grünen Punkt angezeigt. (B) Ansicht des Schallkopfes bei richtiger Platzierung über den Papillarmuskeln (gepunkteter Kasten). (C) Beispielansicht von Schichten, die zur Messung von Herzparametern benötigt werden. (D) Ansicht des Live-M-Mode-Bildes mit Schichten, die wie in Panel C bezeichnet sind. (Schichten von oben nach unten: posterior epicardial, posterior endocardial, anterior endocardial und anterior epicardial.) (E) Beispielausgabe von Statistiken, die aus Herzmessungen generiert wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Verwendung von Segmentierungs- und Messschieberwerkzeugen zur Messung von Nieren und Zysten. (A) Beispielsegmentierungen (axiale Ansicht) beider Nieren (blaue und orange Schattierung) und einer großen Zyste (gelb) mit unten aufgeführten Volumina. Darunter werden nicht segmentierte Ansichten angezeigt, damit die nicht verdeckten USA angezeigt werden können. (B) Beispiel für die Verwendung von Messschiebern zur Messung derselben Zyste (sagittale Ansicht) aus Abbildung 3A mit messungen unten. Das Volumen wurde nach der Formel für eine Ellipse berechnet (Volumen = (4/3)π x a x b x c, wobei a, b, c relativ x, y, z sind). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: TKV-Verteilungen von WT und zystischen Mausnieren. Darstellung von TKVs für Wildtyp( WT) (C57BL/6J) und erkrankte (Pkd1RC/RC) Mäuse. n = 22 (WT) n = 9 (Pkd1RC/RC); Ergebnisse des zweiseitigen t-Tests: p < 0,0001. Box zeigt 25-75. Perzentilwerte und Schnurrhaare zeigen 1,5-fachen Interquartilsbereich. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Animierte 3D-Rekonstruktion von segmentierten Nieren und Zysten. Mit der Software können die 3D-Projektionen der Nieren und zysten im 3D-Raum gedreht oder geschaukelt werden (blau = linke Niere; gelb = große Zyste; orange = rechte Niere). Bitte klicken Sie hier, um diese Abbildung herunterzuladen.

Abbildung 6: Herzphysiologische Parameter aus US-Messungen. Darstellung des Herzzeitvolumens (ml/min) für WT- und erkrankte (Pkd1RC/RC) Mäuse. n = 22 (WT) n = 9 (Pkd1RC/RC). Die niedrigeren tabellarischen Daten zeigen, dass es für diese beiden Gruppen keinen signifikanten Unterschied in der Ejektionsfraktion, dem Schlagvolumen, der Herzfrequenz (HR) oder dem Herzzeitvolumen (CO) gibt. Ergebnisse des zweiseitigen t-Tests: p > 0,05. Das Feld zeigt 25-75. Perzentilwerte an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Vergleich von US-Sagittalschnitten normaler und zweier Pathologien. (A) Wildtyp(C57BL/6J-Stamm) Niere (TKV = 143.202 mm3). (B) Zystische Niere mit erhöhter TKV (Pkd1RC/RC-Maus ) (TKV = 333,158 mm3). Zysten sind durch gelbe Pfeile gekennzeichnet. (C) Niere mit Gefäßverkalkungen (Modell = Low-Density Lipoprotein Receptor Deficient, Apolipoprotein B100-only Maus gefüttert eine westliche Diät für 12 Monate5) (TKV = 127,376 mm3). Nierensteine sind durch grüne Pfeile gekennzeichnet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung 1: 4D-Herzzyklusfilm aus US-Messungen. Mit der Software wird eine Darstellung des schlagenden Herzens in 3D US erfasst und durch den Herzzyklus projiziert. Der grüne Pfeil zeigt die Aortenklappe an. (Modell = Low-Density Lipoprotein Receptor Deficient, Apolipoprotein B100-only Maus, gefüttert eine westliche Diät für 12 Monate5). Dieses Modell erzeugt Gefäßverkalkungen, die eine einfachere Visualisierung des Herzens und der Klappen aufgrund der größeren akustischen Reflektivität der Verkalkungen in den USA ermöglichen. Ähnliche 4D-Rekonstruktionen sind mit WT-Mäusen möglich; Der erfasste akustische Kontrast ist jedoch nicht so hoch. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Discussion
Ultraschall verwendet Schallwellen, und alle Barrieren für die Ausbreitung von Schallwellen beeinträchtigen die Bildqualität. Daher ist eine vollständige Haarentfernung des abzubildenden Bereichs von entscheidender Bedeutung. Es ist auch wichtig, die vollständige Entfernung der Enthaarungscreme sicherzustellen, da dies zu Verbrennungen / Reizungen der Haut des Tieres führen und die transparente Membran des Scanners verfärben kann. Ausreichende Wasserstände in den Buchten sind für eine optimale Schallwellenausbreitung notwendig und somit erforderlich, um die höchste Bildauflösung zu erhalten. Wenn sich das Tier jedoch in bauchiger Position befindet, stellen Sie sicher, dass sich die Schnauze des Tieres über dem Wasserstand befindet oder das Tier gefahrlos ist, dass Wasser eingeatmet wird. Die Optimierung der Bildgebungsparameter, insbesondere der Fokustiefe, ist entscheidend für die Erzielung qualitativ hochwertiger Bilder. Für einzelne Tiere können Änderungen der Parameter erforderlich sein.
Robotic US bietet viele Vorteile gegenüber herkömmlichen HANDHELD-US-Modalitäten. Erstens verwendet das System eine einfache Point-and-Click-Kamera-basierte Schnittstelle. Diese Funktion adressiert die Komplexität herkömmlicher USA und erzeugt konsistente Daten, selbst wenn sie von einem unerfahrenen Benutzer bedient wird6. Zweitens ermöglicht das System die Verwendung von Wasser anstelle von herkömmlichem US-Gel als akustisches Medium. Zuvor ermöglichte die Verwendung von US-Gel die Bildung von Blasen, die die Bildqualität beeinträchtigten. Außerdem ist das US-Gel unordentlich und bietet Herausforderungen für die Reinigung. Außerdem wird das Wasser durch die Wärmelampe erwärmt und hilft, die Körpertemperatur des Tieres aufrechtzuerhalten. Drittens ist die Roboter-USA schneller, so dass Artefakte aus Atembewegungen nicht problematisch sind. Die erhöhte Bildgebungsgeschwindigkeit ermöglicht die praktische Durchführung der Datenerfassung mit hohem Durchsatz. Viertens erhält der Roboter US 3D-Bilder und vereinfacht daher die 3D-Rekonstruktion von Objekten (Abbildung 4). MRT und andere Modalitäten sind teuer, zeitaufwendig und nicht immer verfügbar. Wichtig ist, dass das US-Robotersystem auf einen Tisch oder eine Bank passt und kostengünstiger ist. Schließlich zeigten frühere Arbeiten, dass Roboter-USA vergleichbare Messdaten wie teurere Modalitäten wie MRT3 liefern können.
Während die Bildqualität und Auflösung des in dieser Arbeit beschriebenen US-Robotersystems für die vorgeschlagene Anwendung ausreichend waren (Abbildung 7), gibt es mehrere Möglichkeiten, wie die Bildqualität in Zukunft verbessert werden kann. Zum Beispiel würde die Verwendung von Wandlern mit höherer Frequenz (z. B. 50-70 MHz) zu Bildern mit höherer Auflösung und besserer Merkmalsdefinition führen. Während die Verwendung höherer Frequenzen zu einer schlechteren Eindringtiefe führen würde, sollten die Bilder für die In-vivo-Bildgebung von oberflächlichen Organen wie der Mausniere ausreichen. Wie bei anderen Bildgebungsmodalitäten können Kontrastmittel verwendet werden, um bestimmte Merkmale zu verbessern. Für die USA bedeutet dies in der Regel, etwas zu verwenden, das Schallwellen stark reflektiert. Intravaskuläre Mikrobläschen, in denen Lipide sehr kleine Gasblasen umgeben, sind ein solches Mittel. Die mikrometergroßen Gasblasen sind stark reflektierend und liefern somit ein zweites deutliches Signal, das sich in eine hochauflösende Gefäßstruktur niederschlägt7. Während diese akustische Kontrasttechnik sehr nützlich sein kann, kann sie mehrere Nachteile haben. Zuerst müssen die Mikrobläschen frisch gemacht werden und bleiben nur in vivo für 5-10 min bestehen. Zweitens erfordert die intravaskuläre In-vivo-Injektion typischerweise eine Schwanzschleierkatheterisierung für die Injektion, und dies kann technisch schwierig sein. Unter bestimmten Umständen und pulsierenden Regimen kann die Mikroblasenbildgebung selbst zu Nierengefäßschäden führen8.
Es gibt auch einige allgemeinere Einschränkungen des jeweiligen verwendeten US-Systems. Erstens ist nur ein lineares Array (zentriert bei 18 MHz) im Robot-Chassis enthalten, so dass ein Umschalten auf sonden mit höherer oder niedrigerer Frequenz derzeit nicht möglich ist. Dies kann sich auf die Breite der Modelle (entweder größer oder kleiner) auswirken, die mit dem System ausgewertet werden können. Zukünftige Iterationen des Instruments sollten mehrere lineare Arrays enthalten, um das gesamte Spektrum präklinischer Tiermodelle abzudecken. Zweitens kann der Wandlerwinkel relativ zum Tierischen Subjekt nicht kontrolliert werden. Daher erfordert die Durchführung winkelabhängiger bildgebender Verfahren wie Doppler oder das Erreichen alternativer In-Plane-Ansichten bestimmter Organe (z. B. Langachsenansicht der Niere) eine Neupositionierung des Tieres und kann schwierig zu erreichen sein. Zusätzliche Freiheitsgrade könnten der Roboterbewegung hinzugefügt werden, um diese Herausforderung zu verbessern. Drittens haben wir gelegentlich Nachhallartefakte beobachtet, die von der akustischen Membran ausgehen, die das Tier vom Wandler trennt und die Visualisierung oberflächlicher Merkmale und Grenzen verdecken kann. In diesen Fällen kann die Verwendung eines Gel-Abstands, um das Tier von der Membran wegzuheben, die Situation beheben. Schließlich ist die Temperaturregelung über die Wärmelampe ungenau und daher muss bei der Bildgebung genau auf die Körperkerntemperatur des Tieres geachtet werden. Kontrolliertere Heizmechanismen, wie ein integriertes Heizkissen, werden wahrscheinlich das Homöostasemanagement und den Bildgebungsdurchsatz verbessern.
Der Einsatz von Robotic US kann auf verschiedene Forschungsbereiche anwendbar sein. Diese Technologie ermöglicht die Visualisierung von groben Gewebestrukturen und kann somit verwendet werden, um das Fortschreiten des Tumors und mögliche Therapien6,9 sowie die Nierenmorphologie, wie hier vorgestellt, zu verfolgen. Die Fähigkeit, die spezifischen Merkmale der Bilder zu segmentieren, macht es zu einem attraktiven Werkzeug für die Untersuchung von Modellen der polyzystischen Nierenerkrankung (PKD)3. M-Mode-Bilder ermöglichen eine einfache Quantifizierung vieler wichtiger kardialer Parameter, die eine In-vivo-Beurteilung der Herzphysiologie ermöglichen. Da die Nieren 20%-25% des Herzzeitvolumens10 erhalten, ist es wichtig, die Herzfunktion während der longitudinalen Beurteilung der Nierenpathologie zu verstehen. Durch diese US-Protokolle haben wir versucht zu veranschaulichen, dass die US-Bildgebung nicht nur für In-vivo- und Longitudinal-Nierenstudien praktikabel ist, sondern auch, dass zunehmend US-amerikanische Werkzeuge sowohl die morphologische als auch die physiologische Beurteilung von Mäusen in präklinischen Studien ermöglichen.
Disclosures
Mehrere Autoren sind entweder bei SonoVol, Inc. (CJM, RCG, TJC) lizenzierten Patenten beschäftigt, haben ein erhebliches finanzielles Interesse daran oder sind Miterfinder von Patenten, die von SonoVol, Inc. lizenziert wurden.
Acknowledgments
Diese Arbeit wurde vom NIH (R43-DK126607, TJC, TLK, MFR) und der Mayo Foundation unterstützt.
Materials
| Name | Company | Catalog Number | Comments |
| Electric Razor | Braintree Scientific, Inc | CLP-9868 14 | |
| C57bk6j | The Jackson laboratory | https://www.jax.org/ | |
| Cotton gauze pads | Fisher Scientific | ||
| Cotton tipped applicators | Fisher Scientific | ||
| Depilatory cream | N/a | N/a | This study used Nair |
| Heat lamp | Included with SonoVol Vega system | ||
| Robotic Ultrasound System | SonoVol Inc | SonoVol Vega system includes anesthesia system | |
| SonoEQ Software | SonoVol | Included with SonoVol Vega system | |
| TERRELL Isoflurane | Piramal Critical Care, Inc | NDC 66794-019-10 |
References
- Cunha, L., et al. Preclinical imaging: an essential ally in modern biosciences. Molecular Diagnostics & Therapy. 18 (2), 153-173 (2014).
- Ultrasound. NIBIB. , Available from: https://www.nibib.nih.gov/science-education/science-topics/ultrasound#pid-936 (2016).
- Beaumont, N. J., et al. Assessing polycystic kidney disease in rodents: Comparison of robotic 3d ultrasound and magnetic resonance imaging. Kidney360. 1 (10), 1128-1136 (2020).
- Hopp, K., et al. Functional polycystin-1 dosage governs autosomal dominant polycystic kidney disease severity. The Journal of Clinical Investigation. 122 (11), 4257-4273 (2012).
- Weiss, R. M., Ohashi, M., Miller, J. D., Young, S. G., Heistad, D. D. Calcific aortic valve stenosis in old hypercholesterolemic mice. Circulation. 114 (19), 2065-2069 (2006).
- Czernuszewicz, T. J., et al. A new preclinical ultrasound platform for widefield 3D imaging of rodents. Review of Scientific Instruments. 89 (7), 075107 (2018).
- Chong, W. K., Papadopoulou, V., Dayton, P. A. Imaging with ultrasound contrast agents: current status and future. Abdominal Radiology (NY). 43 (4), 762-772 (2018).
- Nyankima, A. G., Kasoji, S., Cianciolo, R., Dayton, P. A., Chang, E. H. Histological and blood chemistry examination of the rodent kidney after exposure to flash-replenishment ultrasound contrast imaging. Ultrasonics. 98, 1-6 (2019).
- Rojas, J. D., et al. Ultrasound measurement of vascular density to evaluate response to anti-angiogenic therapy in renal cell carcinoma. IEEE Transactions on Biomedical Engineering. 66 (3), 873-880 (2019).
- Boron, W. F., Boulpaep, E. L. Medical Physiology. 3rd edn. , Elsevier. (2017).
Tags
Medizin Heft 174Erratum
Formal Correction: Erratum: Use of 3D Robotic Ultrasound for In Vivo Analysis of Mouse Kidneys
Posted by JoVE Editors on 10/06/2021.
Citeable Link.
An erratum was issued for: Use of 3D Robotic Ultrasound for In Vivo Analysis of Mouse Kidneys. An author name was updated, along with the Protocol and Representative Results sections.
The name of an author was updated from:
Ryan C. Gesser
to:
Ryan C. Gessner
Step 3.1 of the Protocol was updated from:
Turn on the US machine and the heat lamp above the US platforms. Turn on the appropriate anesthesia valves for the corresponding US bays that will be used.
to:
Turn on the US machine and the switch for the internal heating element for the US bays. Turn on the appropriate anesthesia valves for the corresponding US bays that will be used.
Figue 1 in the Representative Results was updated from:
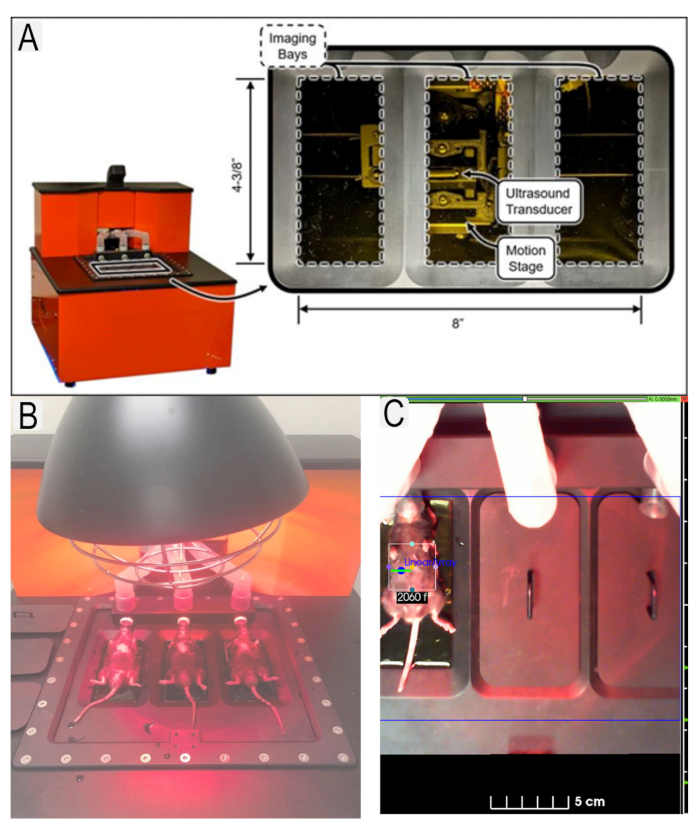
Figure 1: Ultrasound system and mouse placement. (A) Diagram of ultrasound system and location of transducers. (B) View of mice in supine position on ultrasound platform with heat lamp. (C) Example of region of interest (ROI)s in place for area of interest (kidneys) with animal IDs. Please click here to view a larger version of this figure.
to:

Figure 1: Ultrasound system and mouse placement. (A) Diagram of ultrasound system and location of transducers. (B) View of mice in supine position on ultrasound platform. (C) Example of region of interest (ROI)s in place for area of interest (kidneys) with animal IDs. Please click here to view a larger version of this figure.



