ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Ce protocole démontre l’échographie robotique (US) comme une alternative pratique, rentable et rapide aux modalités d’image non invasives traditionnelles.
Abstract
Les modalités courantes pour l’imagerie in vivo des rongeurs comprennent la tomographie par émission de positons (TEP), la tomodensitométrie (CT), l’imagerie par résonance magnétique (IRM) et l’échographie (US). Chaque méthode présente des limites et des avantages, notamment la disponibilité, la facilité d’utilisation, le coût, la taille et l’utilisation de rayonnements ionisants ou de champs magnétiques. Ce protocole décrit l’utilisation de la robotique 3D US pour l’imagerie in vivo des reins et du cœur des rongeurs, l’analyse ultérieure des données et les applications de recherche possibles. Les applications pratiques de la robotique américaine sont la quantification du volume total des reins (TKV), ainsi que la mesure des kystes, des tumeurs et du système vasculaire. Bien que la résolution ne soit pas aussi élevée que d’autres modalités, la robotique américaine permet une collecte de données à haut débit plus pratique. De plus, en utilisant l’imagerie en mode M américain, la fonction cardiaque peut être quantifiée. Étant donné que les reins reçoivent 20% à 25% du débit cardiaque, l’évaluation de la fonction cardiaque est essentielle à la compréhension de la physiologie et de la physiopathologie rénales.
Introduction
Les modalités les plus courantes pour l’imagerie in vivo des rongeurs comprennent la tomographie par émission de positons (TEP), l’imagerie optique (OI), la tomodensitométrie (CT), l’imagerie par résonance magnétique (IRM) et l’échographie (US). Ces techniques fournissent des images in vivo à haute résolution, ce qui permet aux chercheurs d’évaluer quantitativement et de suivre longitudinalement des modèles de maladie de manière non invasive1. Bien que chaque modalité d’imagerie ait des limites, elle fournit également des outils inestimables pour la recherche préclinique.
Ici, l’étude détaille un système américain et présente le protocole pour l’imagerie robotique et 3D des rongeurs. Les ondes américaines sont produites par une sonde appelée transducteur, qui est généralement tenue à la main. Les ondes sonores sont réfléchies lorsqu’elles interagissent avec les tissus, et les échos sont reconstruits en images2. Le protocole décrit ici se concentrera sur l’imagerie rénale et cardiaque à l’aide d’un transducteur contrôlé par robot et à l’aide d’un logiciel permettant une reconstruction 3D rapide pour une évaluation quantitative.
Robotic US est une modalité d’imagerie rapide, fiable et non invasive qui permet aux chercheurs de mener des études longitudinales et à haut débit. Comparée aux méthodes américaines portatives, la méthode robotique américaine est rapide, car jusqu’à trois animaux peuvent être scannés en quelques minutes. Un débit élevé pour les mesures rénales suggère que jusqu’à 20 souris par heure peuvent être imagées. Les transducteurs robotiques sont situés sous les membranes acoustiques et se déplacent indépendamment de l’animal avec deux degrés de liberté (Figure 1A). Cela permet aux utilisateurs novices d’obtenir des images de haute qualité, tandis que les méthodes américaines portables sont plus sensibles aux erreurs de l’utilisateur. Le logiciel couplé permet une reconstruction rénale 3D efficace et en temps réel. Auparavant, l’imagerie par résonance magnétique (IRM) était une méthode répandue pour l’imagerie non invasive en raison de l’excellent contraste des tissus mous, du manque de radioactivité et de la profondeur de pénétration. Cependant, l’IRM nécessite souvent de longs temps d’acquisition et est coûteuse à effectuer. Les États-Unis ont été évalués comme une alternative fiable et plus rapide à l’IRM dans l’évaluation du volume total des reins (TKV)3.
Protocol
Toutes les étapes de ce protocole sont conformes aux directives d’utilisation des animaux de la Mayo Clinic (Rochester, MN) et ont été approuvées par le Comité institutionnel de soins et d’utilisation des animaux de la Mayo Clinic.
1. Modèle animal
- Obtenir des souris de sources commerciales.
NOTE : C57BL/6J (âge = 18 mois; n = 22 (7 hommes, 15 femmes)) (Table des matières) et Pkd1(RC/RC) (âge = 18 mois; n = 9 (3 hommes, 6 femmes))4 ont été utilisés pour l’étude.
2. Épilation
- Anesthésier l’animal à l’aide d’isoflurane vaporisé (2%-3%) dans une chambre d’anesthésie. Assurez-vous que l’animal est suffisamment anesthésié en effectuant un pincement des orteils. Assurez-vous que la souris respire à une vitesse d’environ 60 à 90 respirations / min sans avaler d’air évidente.
REMARQUE: L’isoflurane vaporisé a été choisi en raison de la capacité de contrôler et d’affiner le niveau d’anesthésie de l’animal. L’isoflurane mélangé à 100% d’oxygène a été utilisé. - Utilisez un rasoir électrique pour raser la zone de peau souhaitée pour les mesures américaines.
REMARQUE: Dans cette étude, l’accent est mis sur les mesures rénales et cardiaques, de sorte que la poitrine et le dos de l’animal ont été rasés. - Appliquez la crème dépilatoire sur la peau rasée de l’animal avec un applicateur à pointe de coton. Essuyez la crème après 30-60 s à l’aide d’une serviette en papier sec. Ensuite, continuez à essuyer les résidus de crème dépilatoire à l’aide de tampons de gaze humides. Assurez-vous que l’épilation est complète avant de commencer les scans.
REMARQUE: Tous les cheveux restants interféreront avec la qualité de l’image; l’épilation complète est cruciale. Cependant, il est nécessaire d’essuyer la crème dépilatoire en une minute pour éviter de blesser la peau de l’animal. Les restes de crème dépilatoire sur l’animal peuvent tacher la membrane d’imagerie de la machine américaine. Assurez-vous d’un nettoyage approprié de l’animal à l’aide de tampons de gaze humides.
3. Positionnement des animaux
- Allumez la machine américaine et l’interrupteur de l’élément chauffant interne pour les baies américaines. Allumez les valves d’anesthésie appropriées pour les baies américaines correspondantes qui seront utilisées.
REMARQUE: La machine américaine doit être allumée avant de démarrer le logiciel d’imagerie américain. - Remplissez les baies avec suffisamment d’eau pour couvrir la membrane. Placez l’animal anesthésié dans le cône du nez.
- Pour les mesures cardiaques, placez l’animal en position couchée et inclinez-le d’environ 30° vers la droite.
- Pour les mesures rénales, placez l’animal en position droite et couchée. Aplatir doucement le corps de l’animal pour minimiser les poches d’air entre l’animal et la membrane (Figure 1B).
REMARQUE: Passer un doigt le long du corps de l’animal peut éliminer toutes les bulles d’air adhérant à la peau, ce qui interférera avec l’imagerie. Utilisez de l’eau ou du gel salin américain comme milieu américain; mais l’eau facilite l’imagerie rapide dont il est question ici.
4. Mesures échographiques
- Dans le logiciel d’imagerie US, sélectionnez US Acquisition et autorisez l’initialisation de l’instrument.
- Imagerie rénale en mode B.
- Entrez un nom pour l’étude dans la boîte de dialogue appropriée.
- Entrez l’ID de l’animal dans la boîte de dialogue appropriée.
REMARQUE: Jusqu’à trois animaux peuvent être imagés séquentiellement. - Cliquez sur l’onglet intitulé 3D pour initialiser le scan 3D.
- À l’aide du flux de caméra en direct, déplacez la zone de région d’intérêt (ROI) pour contenir les reins.
REMARQUE: La taille du retour sur investissement peut être ajustée en fonction de la taille de la cible de l’image. L’augmentation de la taille du retour sur investissement augmentera légèrement le temps d’analyse (Figure 1C). En fonction de la taille du retour sur investissement, le scanner ajustera automatiquement le nombre de passes requises pour que le transducteur analyse l’intégralité du retour sur investissement. - Selon le type d’image souhaité, sélectionnez Linear Array ou Wobbler, pour choisir le transducteur. Sélectionnez Analyse rapide ou Optimisé pour l’un ou l’autre transducteur.
REMARQUE: Le réseau linéaire est plus rapide et fournit généralement une imagerie adéquate. Le transducteur oscillant peut être utilisé s’il n’est pas en mesure d’acquérir la qualité d’image souhaitée avec le réseau linéaire. Le transducteur oscillant utilise une longueur d’onde de fréquence plus élevée et fournit donc plus de définition dans les images. L’option Fast Scan permet d’acquérir des images de qualité moyenne sans correction respiratoire à une vitesse plus élevée. Bien que l’option Optimisé nécessite un peu plus de temps, elle offre une meilleure qualité d’image et permet une correction de la respiration. Ce manuscrit se concentrera sur l’utilisation du préréglage de tableau linéaire optimisé. - Cliquez sur la vue en direct pour voir une image en direct de la zone de visualisation souhaitée.
- Pour déplacer le transducteur, cliquez sur le bouton circulaire Aller à , puis cliquez sur la zone de la souris à imager. Utilisez les flèches directionnelles avec des tailles de pas prédéterminées pour ajuster finement la position du transducteur.
- Cliquez sur la flèche sur le côté de la fenêtre du Panneau de configuration pour ouvrir la barre des paramètres. Cliquez sur Scan Protocol pour ouvrir les paramètres de numérisation.
- Déterminez la profondeur focale idéale et ajustez les curseurs pour le TGC (compensation du gain de temps) afin de modifier le contraste de l’image pour mieux visualiser les reins. Après avoir atteint les paramètres souhaités, cliquez à nouveau sur la flèche pour fermer la barre des paramètres.
- Appuyez sur le bouton Acquérir statique pour lancer la numérisation 3D.
REMARQUE: La progression de l’analyse est indiquée via une barre de progression en bas à gauche du logiciel. - Une fois la numérisation terminée, vérifiez la qualité de l’image en cliquant sur la flèche bleue de téléchargement pour ouvrir la numérisation en mode Aperçu. Parcourez les images 3D du scan en faisant glisser la flèche rouge en haut de la fenêtre. Pour effectuer un zoom avant ou arrière, maintenez la touche Ctrl enfoncée et utilisez le bouton de défilement de la souris.
- Pour analyser d’autres animaux, actualisez les boîtes de dialogue ID d’animal, entrez les nouveaux ID, puis répétez les étapes ci-dessus.
REMARQUE: Lorsque les scans sont terminés, séchez les animaux et retournez-les dans leurs cages d’origine.
- Imagerie cardiaque en mode M.
REMARQUE: Le mode M est l’affichage d’une onde ultrasonore le long d’une ligne d’échographie spécifique choisie.- Cliquez sur l’onglet Mode M pour activer l’imagerie cardiaque.
REMARQUE: Un seul animal peut être imagé à la fois. - S’assurer que l’animal est dans la position appropriée pour les scintigraphies cardiaques (étape 2.2). Déplacez le retour sur investissement à l’emplacement approximatif du cœur.
- Appuyez sur le bouton Heart Finder pour localiser le cœur. Utilisez la carte thermique pour optimiser l’emplacement du transducteur. Utilisez le bouton circulaire Aller à pour déplacer le transducteur vers le ventricule gauche (Figure 2A).
- Accédez à la vue en direct et utilisez les boutons fléchés pour placer le transducteur entre les muscles papillaires (Figure 2B). Pour vérifier le bon emplacement du transducteur, affichez la trace en mode M en direct (Figure 2D).
- Une fois que le transducteur est dans la position appropriée, cliquez sur Acquérir la séquence. Cliquez sur la flèche bleue de téléchargement pour afficher l’analyse terminée.
- Cliquez sur l’onglet Mode M pour activer l’imagerie cardiaque.
5. Analyse rénale (mécanique d’analyse)
- Ouvrez l’onglet Analyse d’image et sélectionnez le bouton Charger le(s) volume(s) pour saisir les fichiers/dossiers image.
- Segmentation
- Déplacez les lignes colorées représentant différents plans pour trouver le rein dans tous les plans.
- Cliquez sur Ajouter pour ajouter une nouvelle segmentation. Fournissez un nom de balisage pour le fichier.
- Utilisez le bouton Coupe de surface pour ajouter des points autour du bord extérieur du rein dans plusieurs plans. Cliquez sur Appliquer pour générer une segmentation à travers l’ensemble du rein (Figure 3A).
- Faites défiler les différentes images de chaque plan et modifiez les régions inexactes en cliquant sur Modifier et en faisant glisser les points vers le bon emplacement.
- Alternativement, si le rein est de forme irrégulière, utilisez la fonction Draw pour créer une trace de forme irrégulière autour du rein. Cliquez sur des points autour du bord ou maintenez le clic gauche enfoncé pour dessiner la trace à main levée.
- Pour terminer la trace à l’aide du bouton Dessiner , cliquez avec le bouton droit de la souris. Faites défiler plusieurs images et répétez le processus de suivi.
- Répétez l’opération jusqu’à ce que les images soient tracées dans toute la région d’intérêt.
- Si la fonction Dessiner est utilisée, sélectionnez Remplir entre les tranches pour vérifier et ajuster la trace. Cliquez sur Initialiser pour voir un aperçu. Si l’aperçu est acceptable, cliquez sur Appliquer. Sinon, cliquez sur Annuler et modifiez les tracés.
REMARQUE: Le bouton Effacer permettra la suppression d’une région dans une trace. Le bouton Lisse lisse les bords déchiquetés d’une trace. - Lorsque l’analyse d’image est satisfaisante, sélectionnez Enregistrer pour enregistrer l’analyse dans le fichier image d’origine.
- Mesure
- Utilisez la fonction Étriers pour mesurer les caractéristiques de l’image. Cliquez sur le bouton Étriers et cliquez avec le bouton gauche sur les deux points de la distance à mesurer (Figure 3B).
- Enregistrez la mesure en cliquant sur le bouton du disque en haut de l’écran.
- Segmentation
6. Analyse cardiaque
- Sélectionnez Charger les volumes pour saisir le(s) fichier(s) à analyser.
- Sélectionnez l’option Ajouter .
- Utilisez l’outil Placement de point pour tracer la systole et la diastole pour chaque couche de tissu cardiaque. Continuez avec les autres couches de tissu cardiaque. Utilisez la fonction Modifier pour modifier les traces (Figure 2C,D).
REMARQUE: Si la trace en mode M est très claire, utilisez le bouton Ajouter (auto) pour générer automatiquement des traces de chaque calque. - Sélectionnez Appliquer pour calculer les paramètres cardiaques. Affichez l’onglet Quantifier et sélectionnez Exporter les statistiques pour exporter toutes les données sous forme de fichier *.csv (Figure 2E).
Representative Results
Résultats de l’analyse rénale
Les données de surface et de volume sont acquises à partir de la segmentation des reins. Ces informations peuvent être utilisées pour comparer des modèles expérimentaux et de contrôle ou pour suivre les changements au fil du temps. L’outil des étriers est utile pour mesurer rapidement les anomalies (kystes, tumeurs) et leur évolution au fil du temps. La figure 3 suggère que les méthodes de segmentation et d’étrier peuvent être utilisées pour mesurer avec précision les volumes de kystes. La figure 4 montre une nette différence de volume rénal total (TKV) entre les souris témoins appariées selon l’âge et les souris expérimentales (Pkd1RC/RC). La visualisation 3D de ces rendus de volume peut être effectuée dans le système, y compris les rotations dans l’espace 3D (Figure 5). Ces reconstructions 3D sont ensuite utilisées pour calculer le TKV (mm3; Graphique 4) ainsi que le grand volume de kyste individuel.
Résultats de l’analyse cardiaque
De nombreux paramètres utiles sont acquis à partir de l’analyse des images du mode M. Ces données fournissent un bon aperçu de la fonction cardiaque ventriculaire gauche (LV) à ce moment-là. La sortie de données comprend le diamètre interne LV, la paroi postérieure LV, le diamètre de la paroi antérieure LV, la fraction d’éjection, le raccourcissement fractionnaire, le volume de l’AVC, la fréquence cardiaque, le débit cardiaque, le volume LV et la masse LV. Le succès de l’analyse cardiaque dépend de la segmentation précise des couches sur l’image du mode M. La plupart des résultats cardiovasculaires sont calculés par les phases systolique et diastolique maximale des couches endocardiques postérieures et antérieures. La couche épicardique postérieure apparaît d’un blanc éclatant et suit un motif similaire à celui de la couche endocardique postérieure. Le tracé de la couche endocardique postérieure doit être placé sur le contour le plus bas. La couche endocardique antérieure doit être tracée le long du contour le plus élevé de cette couche. La couche épicardique antérieure apparaît linéaire en bas de l’image en raison du positionnement couché de l’animal (Figure 2D). La figure 6 montre un exemple d’étude sans différence significative de débit cardiaque entre les souris expérimentales et les souris témoins. Comme pour l’imagerie rénale, la visualisation cardiaque 3D est possible. Néanmoins, une visualisation 4D du cycle cardiaque (figure supplémentaire 1) permet à l’investigateur de visualiser et d’identifier les anomalies morphologiques et dynamiques du cycle chez l’animal évalué.
Évaluation de la morphologie
Pour une évaluation rapide et peu coûteuse, les États-Unis peuvent surveiller efficacement les paramètres physiologiques longitudinalement. Cependant, de nombreuses études souhaitent en outre déterminer des caractéristiques morphologiques plus fines, par exemple, le nombre et la taille des kystes, les calcifications (calculs rénaux), la vascularisation ou le degré de fibrose. La figure 7 compare un rein de souris normal à un rein de souris kystique à un rein de souris modérément calcifié. En augmentant la fréquence centrale américaine (10 MHz avec le réseau linéaire) à 35 MHz (amplificateur oscillant), des images de détails croissants peuvent être obtenues.

Figure 1: Système à ultrasons et placement de la souris. (A) Diagramme du système à ultrasons et emplacement des transducteurs. (B) Vue de souris en position couchée sur une plate-forme à ultrasons. (C) Exemple de région d’intérêt (ROI) en place pour la zone d’intérêt (reins) avec des identifiants d’animaux. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Imagerie par ultrasons cardiaques pour obtenir des paramètres physiologiques. (A) Utilisation de l’image de la carte thermique du Heart Finder pour positionner le transducteur dans le ventricule gauche pour l’imagerie en mode M. L’emplacement du transducteur dans le ventricule gauche est indiqué par le grand point vert. (B) Vue du transducteur lorsqu’il est placé correctement sur les muscles papillaires (boîte en pointillés). (C) Exemple de vue des couches nécessaires pour mesurer les paramètres cardiaques. (D) Vue de l’image en mode M en direct avec des couches désignées comme dans le panneau C. (Couches de haut en bas: épicardique postérieure, endocardique postérieure, endocardique antérieure et épicardique antérieure.) (E) Exemple de résultats de statistiques générées à partir de mesures cardiaques. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Utilisation d’outils de segmentation et d’étriers pour mesurer les reins et les kystes. (A) Exemples de segmentations (vue axiale) des deux reins (nuances bleues et oranges) et d’un gros kyste (jaune) avec les volumes énumérés ci-dessous. Les vues non segmentées sont affichées ci-dessous afin que les États-Unis non masqués puissent être visualisés. (B) Exemple d’utilisation d’étriers pour mesurer le même kyste (vue sagittale) de la figure 3A avec les mesures ci-dessous. Le volume a été calculé à l’aide de la formule d’une ellipse (volume = (4/3)π x a x b x c, où a, b, c sont relatifs x, y, z, respectivement). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Distributions TKV des reins WT et kystiques de souris. Représentation des TKV pour les souris de type sauvage (WT) (C57BL/6J) et malades (Pkd1RC/RC). n = 22 (WT) n = 9 (Pkd1RC/RC); Résultats du test t à deux queues: p < 0,0001. La case indique les valeurs du 25e au 75e centile et les moustaches indiquent une plage interquartile de 1,5 fois. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Reconstruction 3D animée de reins segmentés et de kystes. En utilisant le logiciel, les projections 3D des reins et du kyste peuvent être tournées ou bercées dans l’espace 3D (bleu = rein gauche; jaune = gros kyste; orange = rein droit). Veuillez cliquer ici pour télécharger cette figure.

Figure 6 : Paramètres physiologiques cardiaques d’après les mesures américaines. Représentation du débit cardiaque (mL/min) pour les souris WT et malades (Pkd1RC/RC). n = 22 (WT) n = 9 (Pkd1RC/RC). Les données tabulaires inférieures montrent qu’il n’y a pas de différence significative pour ces deux groupes en termes de fraction d’éjection, de volume d’AVC, de fréquence cardiaque (HR) ou de débit cardiaque (CO). Résultats du test t à deux queues: p > 0,05. L’encadré indique les valeurs du 25e au 75e centile. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 7 : Comparaison des coupes sagittales américaines de pathologies normales et de deux pathologies. (A) Rein de type sauvage (souche C57BL/6J) (TKV = 143,202 mm3). (B) Rein kystique avec augmentation de la TKV (souris Pkd1RC/RC) (TKV = 333,158 mm3). Les kystes sont indiqués par des flèches jaunes. (C) Rein avec calcifications vasculaires (Modèle = Déficient en récepteurs des lipoprotéines de basse densité, souris apolipoprotéine B100 uniquement nourrie avec un régime occidental pendant 12 mois5) (TKV = 127,376 mm3). Les calculs rénaux sont indiqués par des flèches vertes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure supplémentaire 1: Film du cycle cardiaque 4D à partir de mesures américaines. À l’aide du logiciel, une représentation du cœur battant est capturée en 3D US et projetée à travers le cycle cardiaque. La flèche verte indique la valve aortique. (Modèle = Déficient en récepteurs des lipoprotéines de basse densité, souris apolipoprotéine B100 uniquement, nourrie avec un régime occidental pendant 12 mois5). Ce modèle génère des calcifications vasculaires permettant une visualisation plus facile du cœur et des valves en raison de la plus grande réflectivité acoustique des calcifications aux États-Unis. Des reconstructions 4D similaires sont possibles avec des souris WT; cependant, le contraste acoustique capturé ne sera pas aussi élevé. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Les ultrasons utilisent des ondes sonores, et toute barrière à la propagation des ondes sonores interférera avec la qualité de l’image. Ainsi, l’épilation complète de la zone à imager est essentielle. Il est également important d’assurer l’élimination complète de la crème dépilatoire car elle peut causer des brûlures / irritations de la peau de l’animal et décolorer la membrane transparente du scanner. Des niveaux d’eau adéquats dans les baies sont nécessaires pour une propagation optimale des ondes sonores, donc nécessaire pour obtenir la plus haute résolution d’image. Cependant, lorsque l’animal est en position couchée, assurez-vous que le museau de l’animal est au-dessus du niveau de l’eau ou que l’animal risque d’inhaler de l’eau. L’optimisation des paramètres d’imagerie, en particulier de la profondeur focale, est essentielle pour obtenir des images de haute qualité. Des modifications des paramètres peuvent être nécessaires pour des animaux individuels.
Robotic US offre de nombreux avantages par rapport aux modalités traditionnelles des États-Unis portables. Tout d’abord, le système utilise une interface simple basée sur une caméra pointer-cliquer. Cette fonctionnalité répond à la complexité des États-Unis conventionnels et produit des données cohérentes même lorsqu’elle est exploitée par un utilisateur novice6. Deuxièmement, le système permet l’utilisation d’eau plutôt que de gel américain traditionnel comme support acoustique. Auparavant, l’utilisation de gel américain permettait la formation de bulles qui interféraient avec l’acquisition d’images de qualité. En outre, le gel américain est désordonné et présente des défis pour le nettoyage. De plus, l’eau est réchauffée par la lampe chauffante et aide à maintenir la température corporelle de l’animal. Troisièmement, les États-Unis robotiques sont plus rapides, de sorte que les artefacts du mouvement respiratoire ne sont pas problématiques. L’augmentation de la vitesse d’imagerie permet d’achever la collecte de données à haut débit. Quatrièmement, les États-Unis robotisés obtiennent des images 3D et simplifient ainsi la reconstruction 3D d’objets (Figure 4). L’IRM et d’autres modalités sont coûteuses, prennent beaucoup de temps et ne sont pas toujours disponibles. Il est important de noter que le système robotique américain s’adapte à une table ou à un banc et est plus rentable. Enfin, des travaux antérieurs ont démontré que les États-Unis robotiques pouvaient fournir des données de mesure comparables à des modalités plus coûteuses, telles que l’IRM3.
Bien que la qualité d’image et la résolution du système robotique américain décrit dans ce travail aient été adéquates pour l’application proposée (Figure 7), il existe plusieurs façons d’améliorer la qualité d’image à l’avenir. Par exemple, l’utilisation de transducteurs à haute fréquence (p. ex., 50-70 MHz) donnerait des images de plus haute résolution avec une meilleure définition des caractéristiques. Bien que l’utilisation de fréquences plus élevées entraînerait une profondeur de pénétration plus faible, les images devraient être suffisantes pour l’imagerie in vivo d’organes superficiels, tels que le rein de la souris. Comme pour d’autres modalités d’imagerie, les agents de contraste peuvent être utilisés pour améliorer des caractéristiques spécifiques. Pour les États-Unis, cela signifie généralement utiliser quelque chose de très réfléchissant des ondes sonores. Les microbulles intravasculaires dans lesquelles les lipides entourent de très petites bulles de gaz sont l’un de ces agents. Les bulles de gaz de la taille d’un micron sont très réfléchissantes et fournissent ainsi un deuxième signal distinct qui se traduit par une haute résolution de vascularisation7. Bien que cette technique de contraste acoustique puisse être très utile, elle peut avoir plusieurs inconvénients. Tout d’abord, les microbulles doivent être fraîches et ne persistent in vivo que pendant 5 à 10 minutes. Deuxièmement, l’injection intravasculaire in vivo nécessite généralement un cathétérisme du voile caudale pour l’injection, ce qui peut être techniquement difficile. Dans certaines circonstances et régimes pulsés, l’imagerie par microbulles peut elle-même entraîner des lésions vasculaires rénales8.
Il existe également des limites plus générales du système américain particulier utilisé. Tout d’abord, un seul réseau linéaire (centré à 18 MHz) est inclus dans le châssis robotique, de sorte qu’il n’est pas possible de passer à des sondes de fréquence plus ou moins élevées n’est actuellement pas possible. Cela peut avoir une incidence sur l’étendue des modèles (plus grands ou plus petits) qui peuvent être évalués avec le système. Les futures itérations de l’instrument devraient inclure plusieurs réseaux linéaires pour couvrir toute la gamme des modèles animaux précliniques. Deuxièmement, l’angle du transducteur par rapport au sujet animal ne peut pas être contrôlé. Par conséquent, l’exécution de techniques d’imagerie dépendantes de l’angle, telles que le Doppler, ou l’obtention d’autres vues dans le plan de certains organes (par exemple, une vue à long axe du rein) nécessite un repositionnement de l’animal et peut être difficile à réaliser. Des degrés de liberté supplémentaires pourraient être ajoutés au mouvement robotique pour améliorer ce défi. Troisièmement, à l’occasion, nous avons observé des artefacts de réverbération provenant de la membrane acoustique qui sépare l’animal du transducteur et qui peuvent obscurcir la visualisation des caractéristiques et des limites superficielles. Dans ces cas, l’utilisation d’un gel pour éloigner l’animal de la membrane peut remédier à la situation. Enfin, le contrôle de la température via une lampe chauffante est imprécis et, par conséquent, une attention particulière doit être portée à la température corporelle centrale de l’animal lors de l’imagerie. Des mécanismes de chauffage plus contrôlés, tels qu’un coussin chauffant intégré, amélioreront probablement la gestion de l’homéostasie et le débit d’imagerie.
L’utilisation de la robotique américaine peut être applicable à divers domaines de recherche. Cette technologie permet de visualiser les structures tissulaires globales, ce qui peut être utilisé pour suivre la progression tumorale et les thérapies potentielles6,9 ainsi que la morphologie rénale telle que présentée ici. La possibilité de segmenter les caractéristiques spécifiques des images en fait un outil attrayant pour l’étude des modèles de maladie polykystique du rein (PKD)3. Les images en mode M permettent une quantification simple de nombreux paramètres cardiaques importants permettant une évaluation in vivo de la physiologie cardiaque. Comme les reins reçoivent 20 % à 25 % du débit cardiaque10, il est important de comprendre la fonction cardiaque lors de l’évaluation longitudinale de la pathologie rénale. Grâce à ces protocoles américains, nous avons essayé d’illustrer que l’imagerie américaine est non seulement pratique pour les études rénales in vivo et longitudinales, mais aussi que de plus en plus d’outils américains permettent une évaluation morphologique et physiologique des souris dans les études précliniques.
Disclosures
Plusieurs auteurs sont soit employés par, ont un intérêt financier important dans, ou sont co-inventeurs de brevets concédés sous licence par SonoVol, Inc. (CJM, RCG, TJC).
Acknowledgments
Ce travail a été soutenu par le NIH (R43-DK126607, TJC, TLK, MFR) et la Fondation Mayo.
Materials
| Name | Company | Catalog Number | Comments |
| Electric Razor | Braintree Scientific, Inc | CLP-9868 14 | |
| C57bk6j | The Jackson laboratory | https://www.jax.org/ | |
| Cotton gauze pads | Fisher Scientific | ||
| Cotton tipped applicators | Fisher Scientific | ||
| Depilatory cream | N/a | N/a | This study used Nair |
| Heat lamp | Included with SonoVol Vega system | ||
| Robotic Ultrasound System | SonoVol Inc | SonoVol Vega system includes anesthesia system | |
| SonoEQ Software | SonoVol | Included with SonoVol Vega system | |
| TERRELL Isoflurane | Piramal Critical Care, Inc | NDC 66794-019-10 |
References
- Cunha, L., et al. Preclinical imaging: an essential ally in modern biosciences. Molecular Diagnostics & Therapy. 18 (2), 153-173 (2014).
- Ultrasound. NIBIB. , Available from: https://www.nibib.nih.gov/science-education/science-topics/ultrasound#pid-936 (2016).
- Beaumont, N. J., et al. Assessing polycystic kidney disease in rodents: Comparison of robotic 3d ultrasound and magnetic resonance imaging. Kidney360. 1 (10), 1128-1136 (2020).
- Hopp, K., et al. Functional polycystin-1 dosage governs autosomal dominant polycystic kidney disease severity. The Journal of Clinical Investigation. 122 (11), 4257-4273 (2012).
- Weiss, R. M., Ohashi, M., Miller, J. D., Young, S. G., Heistad, D. D. Calcific aortic valve stenosis in old hypercholesterolemic mice. Circulation. 114 (19), 2065-2069 (2006).
- Czernuszewicz, T. J., et al. A new preclinical ultrasound platform for widefield 3D imaging of rodents. Review of Scientific Instruments. 89 (7), 075107 (2018).
- Chong, W. K., Papadopoulou, V., Dayton, P. A. Imaging with ultrasound contrast agents: current status and future. Abdominal Radiology (NY). 43 (4), 762-772 (2018).
- Nyankima, A. G., Kasoji, S., Cianciolo, R., Dayton, P. A., Chang, E. H. Histological and blood chemistry examination of the rodent kidney after exposure to flash-replenishment ultrasound contrast imaging. Ultrasonics. 98, 1-6 (2019).
- Rojas, J. D., et al. Ultrasound measurement of vascular density to evaluate response to anti-angiogenic therapy in renal cell carcinoma. IEEE Transactions on Biomedical Engineering. 66 (3), 873-880 (2019).
- Boron, W. F., Boulpaep, E. L. Medical Physiology. 3rd edn. , Elsevier. (2017).
Tags
Médecine numéro 174Erratum
Formal Correction: Erratum: Use of 3D Robotic Ultrasound for In Vivo Analysis of Mouse Kidneys
Posted by JoVE Editors on 10/06/2021.
Citeable Link.
An erratum was issued for: Use of 3D Robotic Ultrasound for In Vivo Analysis of Mouse Kidneys. An author name was updated, along with the Protocol and Representative Results sections.
The name of an author was updated from:
Ryan C. Gesser
to:
Ryan C. Gessner
Step 3.1 of the Protocol was updated from:
Turn on the US machine and the heat lamp above the US platforms. Turn on the appropriate anesthesia valves for the corresponding US bays that will be used.
to:
Turn on the US machine and the switch for the internal heating element for the US bays. Turn on the appropriate anesthesia valves for the corresponding US bays that will be used.
Figue 1 in the Representative Results was updated from:
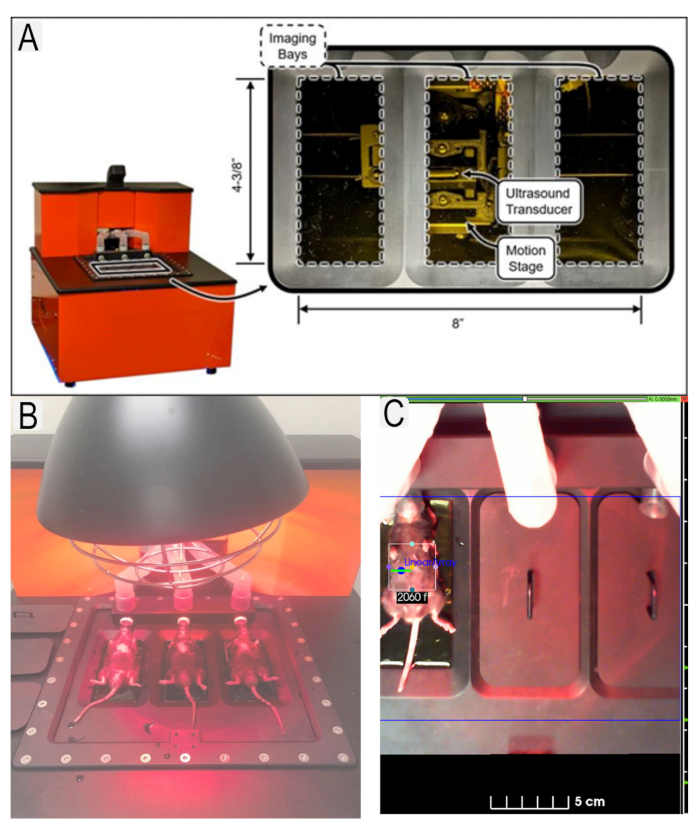
Figure 1: Ultrasound system and mouse placement. (A) Diagram of ultrasound system and location of transducers. (B) View of mice in supine position on ultrasound platform with heat lamp. (C) Example of region of interest (ROI)s in place for area of interest (kidneys) with animal IDs. Please click here to view a larger version of this figure.
to:

Figure 1: Ultrasound system and mouse placement. (A) Diagram of ultrasound system and location of transducers. (B) View of mice in supine position on ultrasound platform. (C) Example of region of interest (ROI)s in place for area of interest (kidneys) with animal IDs. Please click here to view a larger version of this figure.



