Microtubule Plus-End Dynamics Visualisering i Huntingtons Sygdom Model baseret på Human Primary Skin Fibroblasts
Summary
Denne protokol er dedikeret til microtubule plus-end visualisering af EB3 protein transfection at studere deres dynamiske egenskaber i primær cellekultur. Protokollen blev implementeret på humane primære hudfibroblaster fra patienter med Huntingtons Sygdom.
Abstract
Transfection med et fluorescerende mærket markørprotein af interesse i kombination med time-lapse videomikroskopi er en klassisk metode til at studere cytoskeletons dynamiske egenskaber. Denne protokol tilbyder en teknik til human primær fibroblast transfection, som kan være vanskeligt på grund af detaljerne i primære celle dyrkning betingelser. Derudover kræver cytoskeleton dynamisk ejendomsvedligeholdelse et lavt niveau af transfection for at opnå et godt signal-til-støj-forhold uden at forårsage mikrotubulestabilisering. Det er vigtigt at træffe foranstaltninger til at beskytte cellerne mod lys-induceret stress og fluorescerende farvestof fading. I løbet af vores arbejde testede vi forskellige transfection metoder og protokoller samt forskellige vektorer for at vælge den bedste kombination af betingelser egnet til humane primære fibroblast undersøgelser. Vi analyserede de resulterende time-lapse videoer og beregnet microtubule dynamik ved hjælp af ImageJ. Dynamikken i mikrotubules plus-enderne i de forskellige celledele er ikke ens, så vi opdelte analysen i undergrupper – centrosome-regionen, lamellaen og halen af fibroblaster. Især kan denne protokol bruges til in vitro-analyse af cytoskeleton dynamik i patientprøver, hvilket gør det muligt for det næste skridt i retning af at forstå dynamikken i de forskellige sygdomsudvikling.
Introduction
Huntingtons Sygdom (HS) er en uhelbredelig neurodegenerativ patologi forårsaget af et mutationsgenkodningsjægerprotein (HTT). HTT er primært forbundet med vesikler og mikrotubuler og er sandsynligvis involveret i mikrotubuleafhængige transportprocesser1,2. For at studere indflydelsen af mutant HTT på mikrotubuledynamikken brugte vi in vitro-visualiseringen af EB3-proteinet, der regulerer mikrotubulernes dynamiske egenskaber ved at binde og stabilisere de voksende plus-ends. For at indlæse fluorescerende mærket EB3 i human hud fibroblaster, plasmid transfection blev anvendt. Vi brugte den primære fibroblastkultur, der blev opnået fra HS-patienternes hudbiopsi, til denne undersøgelse.
Mutationen i HTT-proteingenet fører til forlængelse af polyglutaminkanalen3. HTT har en rolle i sådanne cellulære processer som endokytose4, celletransport1,2, proteinforringelse5osv. Væsentlig del af disse processer involverer forskellige elementer i cellen cytoskeleton, herunder mikrotubuler.
Menneskelige primære celler er den bedste model til at reproducere hændelser, der forekommer i patientceller så tæt som muligt. For at skabe sådanne modeller skal man isolere celler fra humant biopsimateriale (f.eks. fra kirurgiske prøver). Den resulterende primære cellelinje er egnet til at studere patogenese ved hjælp af forskellige genetiske, biokemiske, molekylære og cellebiologiske metoder. Også menneskelige primære cellekulturer tjener som en forløber for at skabe forskellige transdifferentierede og transgene kulturer6.
Men i modsætning til udødeliggjorte cellekulturer er den betydelige ulempe ved primære celler deres begrænsede passagekapacitet. Derfor anbefaler vi at bruge celler i de tidlige passager fase (op til 15). Ældre kulturer degenererer meget hurtigt og mister deres unikke egenskaber. Således bør de nyerhvervede primære celler holdes frosne til langtidsopbevaring.
Primære cellekulturer er modtagelige for dyrkningsforhold. Derfor kræver de ofte unikke tilgange og optimering af vækstbetingelser. Især er den menneskelige hud primære fibroblaster, der anvendes i vores eksperimenter krævende på substratet. Derfor brugte vi forskellige ekstra belægninger (f.eks. gelatine eller fibronectin) afhængigt af eksperimenttypen.
Cellen cytoskeleton bestemmer celleform, mobilitet og bevægelse. Dynamikken i cytoskeleton er afgørende for mange intracellulære processer både i interfase og mitose. Især cytoskeleton polymeriseret fra tubulin, er meget dynamiske og polære strukturer, der muliggør motor protein-medieret rettet intracellulær transport. Mikrotubulernes ender er i konstant omlejring, deres samlingsfaser veksler med demonteringsfaserne, og denne funktionsmåde kaldes “dynamisk ustabilitet”7,8,9. Forskellige tilknyttede proteiner flytter ligevægten i polymeriseringsreaktionen, hvilket fører enten til polymerdannelsen eller proteinmonomerdannelsen. Tilsætning af tubulinunderenheder forekommer hovedsageligt i plus-enden af mikrotubuler10. Den endelige-bindende (EB) proteiner familie består af tre medlemmer: EB1, EB2, og EB3. De tjener som plus-end-tracking proteiner (+TIPs) og regulerer mikrotubulernes dynamiske egenskaber ved at binde og stabilisere deres voksende plus-ends11.
Mange undersøgelser bruger fluorescerende molekyle-mærket tubulin mikroinjection eller transfection med time-lapse imaging og video analyse til at visualisere mikrotubules in vitro. Disse metoder kan være invasive og skadelige for celler, især primære menneskelige celler. Det mest udfordrende skridt er at finde betingelser for celletransfekt. Vi forsøgte at nå det højest mulige niveau af transfection uden at påvirke levedygtigheden og native cellemorfologi. Denne undersøgelse anvender den klassiske metode til at studere forskellene i mikrotubuledynamikken i hudfibroblaster hos raske donorer og patienter med Huntingtons Sygdom.
Protocol
Representative Results
Discussion
Bedre kvalitetsresultater til mikrotubules dynamikanalyse kan fås fra mikroskopiske billeder af høj kvalitet. Det er vigtigt at overholde alle de nødvendige betingelser for time-lapse imaging af levende celler og at justere billeddannelsesparametrene korrekt. Brug af specielle cellekulturretter med en glasbund (konfokale retter) er vigtigt, da glas har et andet brydningsindeks for lys end plast. Tykkelsen af glasset og dets ensartethed over hele dets område er også ekstremt vigtigt, da disse parametre er afgørende …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Denne forskning blev finansieret af Ministeriet for Videnskab og Videregående Uddannelse i Den Russiske Føderation, tilskud nr. 075-15-2019-1669 (transfection af fibroblaster), af Den Russiske Videnskabsfond, tilskud nr. 19-15-00425 (alle andre værker om dyrkning af fibroblaster in vitro). Det blev delvist støttet af Lomonosov Moskva State University Development program PNR5.13 (billedbehandling og analyse). Forfatterne anerkender støtte fra Nikon Center of Excellence på A. N. Belozersky Institute of Physico-Chemical Biology. Vi ønsker at tilbyde vores særlige tak til Ekaterina Taran for hendes hjælp med stemmeskuespil. Forfatterne takker også Pavel Belikov for hans hjælp med videoredigeringen. Figurer i manuskriptet blev skabt med BioRender.com.
Materials
| Instrumentation | |||
| Camera iXon DU897 EMCCD | Andor Technology | ||
| Eppendorf Centrifuge 5804 R | Eppendorf Corporate | ||
| Fluorescence filter set HYQ FITC | Nikon | Alternative: Leica, Olympus, Zeiss | |
| LUNA-II Automated Cell Counte | Logos Biosystems | L40002 | |
| Microscope incubator for lifetime filming | Okolab | Temperature controller H301-T-UNIT-BL-PLUS | |
| Gas controller CO2-O2-UNIT-BL | |||
| Objective lens CFI Plan Apo Lambda 60x Oil 1.4 (WD 0.13) | Nikon | Alternative: Leica, Olympus, Zeiss | |
| Widefield fluorescence light microscope Eclipse Ti-E | Nikon | Alternative: Leica, Olympus, Zeiss | |
| Software | |||
| Fiji (Image J version 2.1.0/1.53c) | Open source image processing software | ||
| NIS Elements | Nikon | Alternative: Leica, Olympus, Zeiss | |
| Additional reagents | |||
| Mineral oil (Light white oil) | MP | 151694 | |
| Cell culture dish | |||
| Cell Culture Dish | SPL Lifesciences | 20035 | |
| Confocal Dish (glass thickness 170 µm) | SPL Lifesciences | 211350 | Alternative: MatTek |
| Conical Centrifuge tube | SPL Lifesciences | 50015 | |
| Cryogenic Vials | Corning-Costar | 430659 | |
| Microcentrifuge Tube | Nest | 615001 | |
| Cultivation | |||
| Lipofectamine 3000 Transfection Reagent | Thermo Fisher Scientific | L3000001 | |
| Dimethyl sulfoxide | PanEko | 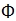 135 135 |
|
| DMEM (Dulbecco's Modified Eagle Media) | PanEko | C420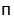 |
|
| DPBS (Dulbecco's phosphate-salt solution) | PanEko | P060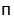 |
|
| Fetal bovine serum (FBS) | Hyclone | K053/SH30071.03 | |
| Gelatin (bovine skin) | PanEko | 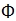 070 070 |
|
| GlutaMAX | Thermo Fisher Scientific | 35050038 | |
| Opti-MEM (1x) + Glutamax | Gibco | 519850026 | |
| Penicillin-streptomycin | PanEko | A063 |
|
| Trypsin-EDTA (0.25%) | Thermo Fisher Scientific | 25200072 | |
| Transfection | |||
| Plasmid DNA with EB3-GFP | Kind gift of Dr. I. Kaverina [Vanderbilt University, Nashville] with permission from Dr. A. Akhmanova [Erasmus University, Rotterdam] |
Stepanova et al., 2003 DOI: 10.1523/JNEUROSCI.23-07-02655.2003 |
References
- Engelender, S., et al. Huntingtin-associated Protein 1 (HAP1) Interacts with the p150 Glued Bubunit of Dynactin. Human Molecular Genetics. 6 (13), 2205-2212 (1997).
- Caviston, J. P., Ross, J. L., Antony, S. M., Tokito, M., Holzbaur, E. L. Huntingtin facilitates dynein/dynactin-mediated vesicle transport. Proceedings of the National Academy of Sciences. 104 (24), 10045-10050 (2007).
- MacMillan, J. C., et al. Molecular analysis and clinical correlations of the Huntington’s disease mutation. The Lancet. 342 (8877), 954-958 (1993).
- Proskura, A. L., Vechkapova, S. O., Zapara, T. A., Ratushniak, A. S. Protein-protein interactions of huntingtin in the hippocampus. Molecular Biology. 51 (4), 647-653 (2017).
- Steffan, J. S., et al. The Huntington’s disease protein interacts with p53 and CREB-binding protein and represses transcription. Proceedings of the National Academy of Sciences. 97 (12), 6763-6768 (2000).
- Nekrasov, E. D., et al. Manifestation of Huntington’s disease pathology in human induced pluripotent stem cell-derived neurons. Molecular Neurodegeneration. 11 (1), 1-15 (2016).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Walker, R. A., et al. Dynamic instability of individual microtubules analyzed by video light microscopy: rate constants and transition frequencies. The Journal of Cell Biology. 107 (4), 1437-1448 (1988).
- Desai, A., Mitchison, T. J. Microtubule polymerization dynamics. Annual Review of Cell and Developmental Biology. 13 (1), 83-117 (1997).
- Allen, C., Borisy, G. G. Structural polarity and directional growth of microtubules of Chlamydomonas flagella. Journal of Molecular Biology. 90 (2), 381-402 (1974).
- Stepanova, T., et al. Visualization of microtubule growth in cultured neurons via the use of EB3-GFP (end-binding protein 3-green fluorescent protein). Journal of Neuroscience. 23 (7), 2655-2664 (2003).
- Shelden, E., Wadsworth, P. Observation and quantification of individual microtubule behavior in vivo: microtubule dynamics are cell-type specific. Journal of Cell Biology. 120 (4), 935-945 (1993).
- O’Brien, E. T., Salmon, E. D., Walker, R. A., Erickson, H. P. Effects of magnesium on the dynamic instability of individual microtubules. Biochemistry. 29 (28), 6648-6656 (1990).
- Drechsel, D. N., Hyman, A. A., Cobb, M. H., Kirschner, M. W. Modulation of the dynamic instability of tubulin assembly by the microtubule-associated protein tau. Molecular Biology of the Cell. 3 (10), 1141-1154 (1992).
- Gildersleeve, R. F., Cross, A. R., Cullen, K. E., Fagen, A. P., Williams, R. C. Microtubules grow and shorten at intrinsically variable rates. Journal of Biological Chemistry. 267 (12), 7995-8006 (1992).
- Penazzi, L., Bakota, L., Brandt, R. Microtubule dynamics in neuronal development, plasticity, and neurodegeneration. International Review of Cell and Molecular Biology. 321, 89-169 (2016).
- van de Willige, D., Hoogenraad, C. C., Akhmanova, A. Microtubule plus-end tracking proteins in neuronal development. Cellular and Molecular Life Sciences. 73 (10), 2053-2077 (2016).
- Applegate, K. T., et al. plusTipTracker: Quantitative image analysis software for the measurement of microtubule dynamics. Journal of Structural Biology. 176 (2), 168-184 (2011).
- Komarova, Y. A., Vorobjev, I. A., Borisy, G. G. Life cycle of MTs: persistent growth in the cell interior, asymmetric transition frequencies and effects of the cell boundary. Journal of Cell Science. 115 (17), 3527-3539 (2002).
- Nahidiazar, L., Agronskaia, A. V., Broertjes, J., vanden Broek, B., Jalink, K. Optimizing imaging conditions for demanding multi-color super resolution localization microscopy. PLoS One. 11 (7), 0158884 (2016).
- Dixit, R., Cyr, R. Cell damage and reactive oxygen species production induced by fluorescence microscopy: effect on mitosis and guidelines for non-invasive fluorescence microscopy. The Plant Journal. 36 (2), 280-290 (2003).
- Grzelak, A., Rychlik, B., Bartosz, G. Light-dependent generation of reactive oxygen species in cell culture media. Free Radical Biology and Medicine. 30 (12), 1418-1425 (2001).

