Summary
Dans ce protocole, la technologie de traitement de l’huile de mouton d’Epimedii folium (EF) a été optimisée en appliquant une méthodologie expérimentale de surface de conception-réponse de Box-Behnken, et l’effet de l’EF brut et optimisé extrait à l’eau sur le développement embryonnaire du poisson zèbre a été étudié au préalable.
Abstract
En tant que médecine traditionnelle chinoise (MTC), Epimedii folium (EF) a une histoire en médecine et en alimentation vieille de > 2 000 ans. Cliniquement, EF traité avec de l’huile de mouton est souvent utilisé comme médicament. Ces dernières années, les rapports de risques pour la sécurité et de réactions indésirables des produits qui utilisent l’EF comme matière première ont progressivement augmenté. Le traitement peut améliorer efficacement la sécurité de la MTC. Selon la théorie de la MTC, le traitement de l’huile de mouton peut réduire la toxicité de l’EF et renforcer son effet tonifiant sur les reins. Cependant, il y a un manque de recherche et d’évaluation systématiques de la technologie de traitement de l’huile de mouton EF. Dans cette étude, nous avons utilisé la méthodologie expérimentale de la surface de conception-réponse de Box-Behnken pour optimiser les paramètres clés de la technologie de traitement en évaluant le contenu de plusieurs composants. Les résultats ont montré que la technologie optimale de traitement de l’huile de mouton d’EF était la suivante: chauffer l’huile de mouton à 120 ° C ± 10 ° C, ajouter l’EF brut, la faire sauter doucement à 189 ° C ± 10 ° C jusqu’à ce qu’elle soit uniformément brillante, puis la retirer et la refroidir. Pour 100 kg d’EF, 15 kg d’huile de mouton doivent être utilisés. Les toxicités et les tératogénicités d’un extrait aqueux d’EF traité à l’huile brute et à l’huile de mouton ont été comparées dans un modèle de développement embryonnaire de poisson zèbre. Les résultats ont montré que le groupe des herbes brutes était plus susceptible de causer des malformations du poisson zèbre et que sa concentration d’EF létale à moitié maximale était plus faible. En conclusion, la technologie optimisée de traitement de l’huile de mouton était stable et fiable, avec une bonne répétabilité. À une certaine dose, l’extrait aqueux d’EF était toxique pour le développement des embryons de poisson zèbre, et la toxicité était plus forte pour le médicament brut que pour le médicament transformé. Les résultats ont montré que le traitement de l’huile de mouton réduisait la toxicité de l’EF brut. Ces résultats peuvent être utilisés pour améliorer la qualité, l’uniformité et la sécurité clinique de l’EF traité à l’huile de mouton.
Introduction
Epimedii folium (EF) est les feuilles séchées d’Epimedium brevicornu Maxim., Epimedium sagittatum (Sieb. et Zucc.) Maxim., Epimedium pubescens Maxim., ou Epimedium koreanum Nakai. EF peut être utilisé pour traiter l’ostéoporose, le syndrome ménopausique, les masses mammaires, l’hypertension, les maladies coronariennes et d’autres maladies1. En tant que médecine traditionnelle chinoise (MTC), EF a une histoire de plus de 2 000 ans dans la médecine et l’alimentation. En raison de son faible prix et de son effet remarquable de tonifier les reins, il est largement utilisé dans les médicaments et les aliments santé. L’EF est traité en le faisant sauter avec de l’huile de mouton, un processus décrit pour la première fois dans la théorie du traitement du Lei Gong écrite par Lei Xiao dans la période2 de Liu Song. Les efficacités de l’EF brut et de l’EF sauté sont très différentes. L’EF brut dissipe principalement les rhumatismes, tandis que le FE sauté réchauffe les reins pour renforcer le yang3. À l’heure actuelle, l’EF est largement utilisé comme matière première dans les médicaments et les aliments santé; il y a 399 médicaments brevetés chinois répertoriés, neuf aliments santé importés et 455 aliments santé nationaux avec EF comme matière première4. Ce médicament a de grandes perspectives d’application. Cependant, au cours des dernières années, de plus en plus de réactions indésirables et de lésions hépatiques humaines causées par des aliments santé et des médicaments brevetés chinois utilisant l’EF comme matière première, et des études de toxicité connexes 5,6,7 ont indiqué que l’EF en tant que matière première présente des risques potentiels pour la sécurité.
Le traitement médicinal chinois fait référence aux techniques pharmaceutiques qui peuvent réduire ou éliminer efficacement la toxicité et améliorer la sécurité des MTC. La méthode de traitement traditionnelle de l’EF est la friture avec de l’huile de mouton, ce qui réduit la toxicité de l’EF et renforce son effet de réchauffement des reins et de promotion du yang8. Cette méthode de traitement est incluse dans la pharmacopée chinoise et diverses spécifications de traitement1. Le procédé d’EF n’est spécifié que comme suit: pour chaque 100 kg d’EF, 20 kg d’huile amniotique (raffinée) sont ajoutés et elle est cuite doucement jusqu’à uniformité et brillante1. Il n’y a pas de paramètres stricts de méthode de traitement EF dans les normes ci-dessus, de sorte que les spécifications de traitement locales n’ont pas été unifiées pour assurer la cohérence. Par conséquent, il serait utile de mener une étude systématique du processus d’EE. Dans cet article, la méthode expérimentale de la surface de conception-réponse de Box-Behnken a été utilisée pour optimiser la technologie de traitement de l’EF.
Le plan expérimental de Box-Behnken est une méthode généralement utilisée pour optimiser les facteurs d’un processus. Les paramètres d’extraction peuvent être optimisés en établissant la relation fonctionnelle entre les facteurs d’ajustement des équations de régression multiples et les valeurs d’effet. Récemment, cette méthode a été largement utilisée pour étudier l’extractionde la MTC 5,6,7 et le traitement9,10,11. Diverses études ont rapporté des méthodes de préparation de la MTC impliquant le traitement du sel, le traitement du vin et le sauté suivant une conception Box-Behnken, telles que pour Psoraleae fructus 12 traité au sel, Cnidii fructus13 traité au vin et Cinnamomi ramulus14 torréfié. Cette méthode a réduit le temps de test, une précision de test élevée et convient aux tests multi-facteurs et multi-niveaux. La méthode est plus simple que la méthode d’essai de conception orthogonale et plus complète que la méthode de conception uniforme15. Les relations obtenues peuvent déterminer la valeur prédite de n’importe quel point de test dans la plage de test, ce qui est un grand avantage. Un modèle de poisson zèbre peut être utilisé pour tester si l’EF est moins toxique après traitement.
Dans les études de toxicité de la MTC, le modèle du poisson zèbre présente le double avantage du débit élevé des expériences cellulaires et des similitudes avec les expériences sur les rongeurs16. Ce modèle se caractérise par sa petite taille, son taux de frai élevé, son cycle de reproduction court et sa facilité de reproduction. Le modèle peut être utilisé dans des expériences synchrones à grande échelle dans des plaques de culture cellulaire, et le dosage du médicament expérimental est faible, le cycle expérimental est court, le coût est faible et l’ensemble du processus expérimental est facile à observer et à utiliser17. Les embryons de poisson zèbre sont transparents et se développent rapidement. Par conséquent, la toxicité et les effets tératogènes des médicaments sur les tissus viscéraux à différents stades de développement peuvent être directement observés au microscope18. L’homologie génétique entre le poisson zèbre et les humains atteint 85 %18. La voie de transduction du signal du poisson zèbre est similaire à celle de l’homme18. La structure biologique et la fonction physiologique du poisson zèbre sont très similaires à celles des mammifères18. Par conséquent, un modèle de poisson zèbre pour les tests de dépistage de drogues peut fournir des animaux de laboratoire fiables et pleinement applicables aux humains19.
Dans cette étude, nous avons utilisé la méthodologie de surface de conception-réponse de Box-Behnken pour optimiser la quantité et la température de l’huile de mouton et la température de friture utilisée dans la technologie de traitement EF, avec les teneurs en icariin, épimédine A, épimédine B, épimédine C et baohuoside I comme indices d’évaluation. Le modèle du poisson-zèbre a été utilisé pour explorer de manière préliminaire l’effet d’un extrait d’eau EF sur le développement embryonnaire du poisson zèbre avant et après le traitement afin d’évaluer l’effet d’atténuation du traitement sur le FE.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Toutes les expériences sur les animaux ont été menées avec l’approbation du Comité d’éthique des expériences de l’Institut de MTC de Chongqing (numéro de certificat d’examen éthique des animaux de laboratoire : ZJS2022-03).
1. Détermination des composants bioactifs
NOTE: L’espèce utilisée dans cette recherche était Epimedium sagittatum, et les échantillons ont été collectés dans le comté de Fengdu, Chongqing. L’échantillon a été identifié comme une partie sèche du sol d’E. sagittatum (Sieb. et Zucc.) Sentence. par des chercheurs de l’Institut de médecine biologique de l’Institut de médecine traditionnelle chinoise de Chongqing.
- Préparer la solution du produit antiparasitaire en pesant avec précision la quantité appropriée de chaque substance de référence, à savoir l’icariine, l’épimédine A (EA), l’épimédine B (EB), l’épimédine C (EC) et le baohuoside I (BI), à l’aide d’une balance analytique électronique, et la dissoudre dans du méthanol. À l’aide de ceux-ci, préparer une solution mère de référence mélangée contenant 381,61 μg/mL d’icariin, 124,14 μg/mL d’EA, 110,24 μg/mL d’EB, 1091,75 μg/mL EC et 184,98 μg/mL de BI.
- Préparer la solution du produit d’essai en écrasant EF à travers un tamis no 3. Placer environ 0,2 g (à l’aide d’une balance analytique électronique) de FE broyé dans un erlenmeyer bouché, ajouter 20 mL d’éthanol dilué, puis ultrasons à une puissance de 400 W et à une fréquence de 50 kHz pendant 1 h. Bien agiter et passer à travers un filtre à membrane de 0,22 μm pour obtenir la solution d’essai.
- Effectuez la chromatographie comme suit. Utiliser la chromatographie liquide à haute performance (CLHP) avec une colonne C18 avec des dimensions de 4,6 mm x 250 mm et un diamètre intérieur de 5 μm. Utiliser l’acétonitrile comme phase mobile A et l’eau ultrapure comme phase mobile B. Utiliser les paramètres d’élution de gradient suivants : 0-30 min, 24 % A à 26 % A; 30-31 min, 26% A à 45% A; 31-45 min, 45% A à 47% A. Utiliser une longueur d’onde de détection de 220 nm (pour le détecteur utilisé, voir Tableau des matériaux). Maintenez la température de la colonne à 30 °C et la vitesse du courant à 1,0 mL/min, et utilisez un échantillon de 10 μL.
- Pour étudier la relation linéaire, utilisez la solution de référence mixte comme à l’étape 1.1 diluée 2 fois, 4 fois, 8 fois, 16 fois et 32 fois, pour icariin, EA, EB, EC et BI, respectivement. Utilisez l’acétonitrile comme phase mobile A et l’eau ultrapure comme phase mobile B.
- Utiliser les paramètres d’élution de gradient suivants : 0-30 min, 24 % A à 26 % A; 30-31 min, 26% A à 45% A; 31-45 min, 45% A à 47% A. Utiliser une longueur d’onde de détection de 220 nm (pour le détecteur utilisé, voir Tableau des matériaux). Maintenez la température de la colonne à 30 °C et la vitesse du courant à 1,0 mL/min et utilisez un échantillon de 10 μL. Enfin, notez les zones de pointe. Tracer la régression linéaire avec la concentration de référence (axe des abscisses, μg/mL) comme abscisse et l’aire du pic (axe des y) comme ordonnée à l’aide d’un logiciel professionnel (voir le tableau des matériaux).
- Effectuer l’essai de précision en mesurant la solution témoin mélangée six fois consécutives par CLHP en utilisant les conditions chromatographiques indiquées à l’étape 1.3. Enregistrer le temps de détection et les zones de pic de chaque composition chimique, et calculer les écarts-types relatifs (DSR) des zones de pics pour évaluer la précision (reproductibilité) à l’aide de la formule ci-dessous:
RSD% = écart type (ET)/moyenne arithmétique des résultats calculés (X) x 100 % - Pour effectuer l’essai de reproductibilité, peser avec précision la poudre EF et préparer six parties de la solution du produit d’essai en parallèle selon la méthode décrite à l’étape 1.2. Soumettre les solutions préparées à la CLHP dans les conditions chromatographiques présentées à l’étape 1.3. Enregistrer les temps de rétention et les zones de pics de chaque composition chimique et calculer les quantités de chaque composé à partir d’une courbe standard (zones de pics par rapport aux concentrations). Calculez le RSD% comme ci-dessus.
- Pour effectuer l’essai de stabilité, conserver les solutions d’essai à température ambiante et mesurer leur contenu par la méthode CLHP décrite à l’étape 1.3 à 0 h, 2 h, 4 h, 8 h, 12 h et 24 h après la préparation pour évaluer la stabilité. Enregistrer les temps de rétention et les zones de pic de chaque composition chimique et calculer le pourcentage RSD% des zones de pics comme ci-dessus.
- Pour effectuer l’essai de récupération de l’échantillon, peser 0,2 g de poudre EF dans un erlenmeyer bouché pour six répétitions. Ajouter une quantité appropriée de la solution de référence (la quantité de substance de référence ajoutée à l’échantillon équivaut à 100 % de la teneur connue de l’échantillon) et préparer la solution d’essai selon la méthode présentée à l’étape 1.2.
- Injecter les échantillons dans le chromatographe et analyser selon les conditions chromatographiques de l’étape 1.3. Enregistrez les zones de pointe et calculez les valeurs moyennes de récupération et de RSD% comme ci-dessous:
Taux de récupération de l’échantillon avec pic = (contenu de l’échantillon enrichi − contenu de l’échantillon)/quantité d’échantillon x 100 %
2. Optimisation de la technologie de traitement de l’huile de mouton EF à l’aide de la méthodologie de surface de conception-réponse de Box-Behnken
- Sélectionnez les paramètres clés du traitement EF, tels que la quantité d’huile de mouton (A; 15%-35%), la température de l’huile de mouton (B; 50-120 °C) et la température de friture (C; 80-300 °C), comme facteurs influents. Utilisez les scores complets du contenu icariin, EA, EB, EC et BI comme indices d’évaluation. Le pourcentage d’huile de mouton ici est le pourcentage de masse.
- Utilisez le logiciel d’analyse de surface de réponse (voir Tableau des matériaux) pour concevoir les expériences de surface de réponse de Box-Behnken, explorer la surface de réponse quadratique et construire un modèle polynomial de second ordre. Sélectionnez le nouveau dessin Box-Behnken et définissez l’option Facteurs numériques sur 3 ; Définissez les facteurs A, B et C. Cliquez sur Continuer. Définissez l’option Réponses sur 1 (qui était le score complet). Cliquez sur Continuer pour terminer la conception. Au total, 17 expériences étaient prévues (voir tableau 1).
REMARQUE : Pour les variables indépendantes et dépendantes, ainsi que leurs niveaux faible, moyen et élevé, voir le tableau 2. - Traiter l’EE selon les paramètres spécifiques du tableau 1; par exemple, pour l’ordre numéro 1, pesez l’huile de mouton raffinée à 15 % v/v, puis chauffez-la à 50 °C pour la faire fondre. Ajouter l’EF brut au mouton fondu, faire sauter sur un feu doux (190 °C) jusqu’à ce qu’il soit uniformément brillant, puis retirer et laisser refroidir. Réalisation de 17 opérations expérimentales. Au total, 17 groupes de produits transformés par EE ont été obtenus dans le cadre de ce travail.
NOTE: L’huile de mouton est solide à température ambiante (25 ° C) et fond en liquide lorsqu’elle est chauffée. L’huile de mouton à l’état liquide peut être utilisée comme excipient. - Préparer les solutions d’essai des produits transformés selon la méthode décrite à l’étape 1.2. Ensuite, analysez-les à l’aide de la CLHP selon les conditions chromatographiques décrites à l’étape 1.3. Enregistrer les temps de rétention et les zones de pic de chaque composition chimique et calculer les teneurs en icariin, EA, EB, EC et BI dans chaque solution d’essai par rapport à une courbe étalon externe. Utilisez la formule de calcul du score complet ci-dessous pour calculer les scores complets des 17 groupes expérimentaux :
Score complet = Z/Z max × 0,5 + BI/BImax × 0,5
où Z est la somme des teneurs en icariin, EA, EB et EC; Zmax est la valeur maximale de la somme des teneurs en icariin, EA, EB et EC dans les 17 groupes expérimentaux; BI est le contenu BI ; et BImax est la valeur maximale de la teneur en BI dans les 17 groupes expérimentaux. - Importez les résultats de notation complets pour les 17 groupes d’expériences dans le logiciel d’analyse des données (voir le tableau des matériaux) pour analyser les données expérimentales. Sous les éléments d’évaluation, sélectionnez l’option d’ordre de processus quadratique et l’option de type de modèle polynomial.
3. Tester l’effet de la transformation sur le développement embryonnaire du poisson zèbre
- Préparation des échantillons
- Broyer le brut et le FE traité à l’aide d’un tamis no 3 (voir le tableau des matériaux). À 100 g de chaque échantillon de FE, ajouter 1 000 mL d’eau ultrapure. Faire tremper l’EF pendant 0,5 h, faire bouillir l’eau deux fois pendant 30 min chacune, puis filtrer avec du papier filtre.
- Mélanger les filtrat et concentrer l’échantillon par chauffage. Ajouter de l’eau ultrapure à un volume final de 100 mL pour obtenir les solutions mères EF (PEF, 1 g/mL) et EF brutes (CEF, 1 g/mL). Mesurer la quantité de médicament cru dans chaque solution mère.
- Placer des aliquotes de 1 mL, 1,5 mL, 2,5 mL, 5 mL et 7,5 mL de solutions mères dans des fioles jaugées de 10 mL, puis ajouter de l’eau ultrapure au volume pour préparer les solutions d’essai à des concentrations de 100 mg/mL, 150 mg/mL, 200 mg/mL, 250 mg/mL, 500 mg/mL et 750 mg/mL pour l’étude d’embryotoxicité du poisson zèbre.
NOTE: Les concentrations des solutions d’essai ont été préparées en se référant à la littérature pertinente 20,21 et en effectuant des expériences préliminaires pour obtenir le gradient de concentration de10 fois utilisé en toxicologie normale. Le CEF était un échantillon non transformé, et le PEF était un échantillon préparé avec la meilleure technologie de transformation décrite à la section 2.
- Élevage de poissons zèbres et traitement des embryons21
- Adaptez le poisson-zèbre de type sauvage (voir le tableau des matériaux) à une température contrôlée pendant 2 jours, gardez-le dans un aquarium à flux continu à un pH de 7,0 à 7,4 et nourrissez-le deux fois par jour.
NOTE: L’inhibition de la formation de mélanine chez le poisson zèbre a été obtenue en ajoutant 1-phényl-2-thiourée à une concentration de 0,003% (masse / volume) au milieu de culture, ce qui a gardé leur corps transparent pour l’observation morphologique. - Sélectionnez le poisson zèbre fertile adulte de type sauvage le soir et séparez-le en utilisant des chicanes dans les boîtes d’accouplement. Retirez les chicanes le lendemain matin et laissez les poissons frayer pendant 30 minutes. Recueilli les œufs fécondés avec un compte-gouttes toutes les 15 minutes. Au total, 520 embryons sains de type sauvage ont été collectés. Conserver les embryons de poisson-zèbre dans un incubateur à 28,5 °C pendant 24 h.
- Assigner au hasard les embryons sains à 24 heures après la fécondation (HPF) à 13 groupes et, avec un groupe témoin, tremper séparément dans 10 mL de chacune des solutions suivantes dans une boîte de culture : EEP : 100 μg/mL, 150 μg/mL, 200 μg/mL, 250 μg/mL, 500 μg/mL, 750 μg/mL; CEF : 100 μg/mL, 150 μg/mL, 200 μg/mL, 250 μg/mL, 500 μg/mL, 750 μg/mL. Traiter le groupe témoin blanc avec le milieu comme solution. Chaque groupe contenait 40 embryons dans cette étude.
NOTE: La composition du milieu est de 0,15 M NaCl, 5 mM KCl, 0,25 mMNa2 HPO 4, 0,45 mM KH 2 PO 4, 1,3 mM CaCl2, 1,0 mM MgSO 4 et 4 mM NaHCO3. - Cultivez le poisson zèbre dans un incubateur à température constante jusqu’à 120 hpf. Compter le nombre de larves mortes chaque jour, observer la morphologie des organes principaux des larves dans chaque groupe expérimental au stéréomicroscope (barre d’échelle = 500 μm, voir le tableau des matériaux) et calculer la concentration de demi-mort (CL50) du poisson zèbre à 72 hpf à l’aide d’un logiciel d’analyse de données (voir le tableau des matériaux).
- Adaptez le poisson-zèbre de type sauvage (voir le tableau des matériaux) à une température contrôlée pendant 2 jours, gardez-le dans un aquarium à flux continu à un pH de 7,0 à 7,4 et nourrissez-le deux fois par jour.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Résultats de l’enquête méthodologique
Une relation linéaire entre la concentration d’icariin, EA, EB, EC, BI et les zones de pics chromatographiques a été observée (voir le tableau 3). Les valeurs RSD% (n = 6) des zones de pics chromatographiques de l’icariin, EA, EB, EC et BI étaient respectivement de 0,28%, 1,22%, 0,65%, 1,67% et 1,06%, ce qui indique que la précision des mesures HPLC était bonne. Les valeurs RSD% (n = 6) des teneurs en icariin, EA, EB, EC et BI étaient respectivement de 1,59%, 1,46%, 1,86%, 2,29% et 0,98%, ce qui indique que la méthode avait une bonne répétabilité. Les valeurs de RSD% (n = 6) des zones de pic d’icariin, EA, EB, EC et BI dans les échantillons étaient respectivement de 1,49%, 1,96%, 1,42%, 0,96% et 0,81%, indiquant que la solution échantillon était stable en 24 heures. Les taux de récupération moyens de l’icariin, de l’EA, EB, EC et BI étaient respectivement de 99,98%, 100,14%, 100,09%, 100,75% et 100,94%, et les valeurs RSD% étaient de 0,56%, 0,78%, 0,84%, 1,10% et 1,47%, respectivement (voir tableau 4). Ces résultats montrent que la précision de la méthode répondait aux exigences.
Les résultats expérimentaux ci-dessus ont montré que la méthode d’analyse fournissait des résultats d’excellente précision, reproductibilité et exactitude et étaient acceptables pour l’analyse de la qualité des produits transformés par EE.
Optimisation de la technologie de traitement de l’huile de mouton d’EF par l’application de la méthodologie de surface de conception-réponse de Box-Behnken
Nous avons effectué un ajustement de régression polynomiale quadratique des données ci-dessus pour obtenir le modèle suivant : Y = 0,86 − 0,11 x A + 0,025 x B − 0,078 x C − 0,023 x A x B − 0,037 x A x C + 0,037 x B x C − 0,045 x A 2 + 2,5 x 10-3 x B 2 − 0,14 x C2. L’analyse de la variance a donné une valeur de P < 0,01, ce qui indique que le modèle était significatif. La valeur P de l’absence d’ajustement était de P > 0,05, ce qui indique que l’absence d’ajustement n’était pas significative. La valeur R2 était de 0,9300, ce qui indique que l’ajustement du modèle était bon et que l’erreur était faible. Il a été possible d’utiliser ce modèle pour analyser et prédire l’effet de la composition chimique du FE sauté à l’huile de mouton. De plus, A 2 et D2 ont eu un effet sur la teneur des produits transformés, et la différence était statistiquement significative (P < 0,01). Les effets de A et C du terme d’un degré et de C2 du terme de second ordre sur le score global étaient significatifs. Le terme d’un degré B, le deuxième ordre A 2, B2 et tous les éléments d’interaction n’ont pas eu d’effet significatif sur le score global. L’analyse des valeurs P a montré que, parmi les paramètres expérimentaux, la quantité d’huile de mouton (A) avait le plus grand effet sur le score global, suivie de la température de friture (C), puis de la température de l’huile de mouton (B). Les résultats ci-dessus sont présentés dans le tableau 5.
Le logiciel a été utilisé pour définir la quantité d’huile de mouton, la température de l’huile de mouton et la température de friture sur les médianes et pour utiliser le score global comme indice pour dessiner un diagramme d’influence à facteur unique d’un facteur (Figure 1). L’augmentation de la température de friture a d’abord augmenté le score global, puis l’a diminué (Figure 1). La température de l’huile de mouton a eu un effet négligeable sur le score global. La quantité d’huile de mouton a été le principal facteur important qui a affecté la variation du score global, et à mesure que la quantité augmentait, le contenu avait tendance à diminuer.
Pour aider à mieux comprendre les résultats, les modèles prédits sont présentés à la figure 2 sous forme de diagrammes de surface de réponse 3D. En termes de pente de la surface de réponse, plus l’importance de l’effet d’interaction entre les facteurs est grande, plus la pente est douce et moins l’effet est significatif. Une ellipse en forme de courbe de niveau indique une forte interaction entre les facteurs, tandis qu’un cercle indique le contraire. La surface de réponse de la quantité d’huile de mouton et la température de friture étaient plus raides que les autres facteurs testés, et les courbes de niveau avaient tendance à être plus elliptiques (voir la figure 2C,D), ce qui indique que l’interaction entre ces deux facteurs était plus significative; en revanche, les interactions entre les autres facteurs n’étaient pas significatives (voir la figure 2A,B,E,F).
La technologie optimale de traitement de l’huile de mouton d’EF a été sélectionnée comme suit : une quantité d’huile de mouton de 15 % ; une température de l’huile de mouton de 120 °C; et une température de friture de 189 °C. Étant donné que la température ne peut pas être contrôlée avec beaucoup de précision en fonctionnement réel, la valeur de température est spécifiée comme variable ±10 °C. Par conséquent, les paramètres finaux étaient les suivants: une quantité d’huile de mouton de 15%; une température de l’huile de mouton comprise entre 120 °C ± 10 °C; et une température de friture de 189 °C ± 10 °C. Le procédé optimal était le suivant : chauffer l’huile de mouton à 120 °C ± 10 °C, ajouter l’EF brut, la faire frire à feu doux (189 °C ± 10 °C) jusqu’à ce qu’elle soit uniformément brillante, l’enlever et la refroidir. Pour chaque tranche de 100 kg d’EF, 15 kg d’huile de mouton (huile raffinée) doivent être utilisés. En utilisant ces conditions, trois expériences parallèles ont été menées et les scores obtenus étaient de 0,96, 0,97 et 0,94 (DSR = 1,60%), indiquant des conditions stables et réalisables. Les chromatogrammes CLHP typiques des substances de référence brutes, traitées et mélangées de l’EE sont présentés à la figure 3.
Test de l’effet du traitement sur le développement embryonnaire du poisson zèbre
Le poisson zèbre a éclos en juvéniles à 72 hpf. Le développement de chaque organe était pratiquement terminé. Les corps des poissons sont restés transparents et il était facile de les poser sur le côté sur la lame de verre. Les formes des organes étaient faciles à observer et à identifier lorsqu’elles étaient observées au microscope. Le groupe témoin blanc n’a présenté aucun décès ni toxicité pour un organe pendant la période d’administration. Par rapport au groupe témoin, à une concentration de médicament de 100 μg/mL, aucune anomalie évidente n’a été observée dans le groupe EF brut (S) et le groupe traité (P) à 72 hpf. À 96 hpf et plus tard, l’incomplétude de la vessie natatoire et la perte de la vessie natatoire étaient plus fréquentes chez les poissons juvéniles du groupe brut, mais rares chez les poissons juvéniles du groupe transformé. À une concentration de médicament de 150 μg/mL, des déformations évidentes de la colonne vertébrale, des déformations de courbure corporelle, un œdème péricardique et une déformation hépatique ont été observés chez les poissons juvéniles du groupe brut à 72 hpf, mais ces changements étaient rares chez les poissons juvéniles du groupe transformé, et le degré de tératogénicité était plus faible que celui du groupe brut. À une concentration de médicament de 200 μg/mL, tous les poissons juvéniles du groupe brut sont morts, et une tératogénicité évidente est apparue chez les poissons juvéniles du groupe transformé. À une concentration de médicament de 250 μg/mL, un petit nombre de poissons-zèbres ont survécu dans le groupe traité. Les résultats de l’examen microscopique du poisson zèbre sont présentés à la figure 4.
Les taux de mortalité du poisson zèbre dans les groupes d’herbes Epimedium brutes et transformées dépendaient de la concentration et du moment de l’administration. La relation temps-dose-mortalité est illustrée à la figure 5. Les résultats de mortalité du poisson zèbre ont montré que 24 heures après l’administration (48 hpf), à une concentration de médicament de 200 μg / mL, tous les poissons zèbres du groupe des médicaments bruts sont morts, alors que la mortalité dans le groupe traité n’était que de 6,67%. 48 heures après l’administration d’EF (72 hpf), la concentration qui a causé la mort de tous les poissons-zèbres du groupe des drogues brutes était de 200 μg/mL, et la concentration qui a causé la mort de tous les poissons-zèbres du groupe traité était de 500 μg/mL. La concentration létale médiane des deux groupes expérimentaux à 72 hpf a été calculée. Les résultats ont montré que la CL50 (voir la figure 6) était de 151,3 μg/mL dans le groupe brut (S) et de 219,8 μg/mL dans le groupe traité (P).

Figure 1 : Analyse univariée. La figure montre le diagramme d’influence à facteur unique. A est le résultat à facteur unique de la quantité d’huile de mouton (suif); B est le résultat à facteur unique de la température de l’huile de mouton (suif); et C est le résultat à facteur unique de la température de friture. Avec une température de friture croissante, le score global augmente d’abord, puis diminue. La température de l’huile de mouton a peu d’effet sur le score. La quantité d’huile de mouton a été le principal facteur significatif influençant la variation du score global, et la teneur a montré une tendance à la baisse avec une quantité croissante d’huile de mouton. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Surface de réponse et courbe de niveau de l’influence des interactions de différents facteurs sur le score global. (A) Cette figure montre un diagramme de surface de réponse 3D de l’interaction entre la quantité d’huile de mouton et la température. (B) Cette figure montre un courbe de niveau de l’interaction entre la quantité d’huile de mouton et la température. (C) Cette figure montre un graphique de surface de réponse 3D de l’interaction entre la quantité d’huile de mouton et la température de traitement. (D) Cette figure montre un courbe de niveau de l’interaction entre le dosage de l’huile de mouton et la température de traitement. (E) Cette figure montre un graphique de surface de réponse 3D de l’interaction entre la quantité d’huile de mouton et la température de traitement. (F) Cette figure montre un courbe de niveau de l’interaction entre la quantité d’huile de mouton et la température de traitement. Le résultat montre que la surface de réponse de la quantité d’huile de mouton et de la température de friture était raide que les autres paramètres testés et que les courbes de niveau avaient tendance à être elliptiques (voir C, D), ce qui indique que l’interaction entre ces deux facteurs était significative, alors que les interactions entre les autres facteurs n’étaient pas significatives (voir A, B, E, F). Le terme d’huile de suif utilisé dans la figure fait référence à l’huile de mouton. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3: Chromatogrammes CLHP des substances de référence brutes, transformées et mélangées de FE . (A) Cette figure montre le chromatogramme CLHP de la substance de référence mélangée. (B) Cette figure montre le chromatogramme CLHP du folium brut d’Epimedii. (C) Cette figure montre le chromatogramme CLHP des produits transformés Epimedii folium. Ces trois images démontrent que la teneur en BI dans l’EF brut est faible, alors qu’elle augmente après traitement. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Micrographies du poisson zèbre. Cette figure montre des micrographies du poisson zèbre. (A) Cette figure montre les résultats de l’observation du poisson zèbre au microscope dans le groupe blanc. (B) Cette figure montre les résultats de l’observation du poisson zèbre au microscope dans le groupe brut. (C) Cette figure montre les résultats de l’observation du poisson zèbre au microscope dans le groupe traité. Le groupe témoin blanc n’a présenté aucun décès ni toxicité pour un organe pendant la période d’administration. À une concentration de médicament FE de 150 μg/mL, des déformations évidentes de la colonne vertébrale, une courbure corporelle, un œdème péricardique et une déformation hépatique ont été observés chez les poissons juvéniles du groupe brut à 72 hpf, alors que ces changements étaient rares chez les poissons juvéniles du groupe traité et que le degré de tératogénicité était plus faible que celui du groupe brut. À une concentration de médicament de 200 μg/mL, tous les poissons juvéniles du groupe brut sont morts, et une tératogénicité évidente est apparue dans le groupe traité. À une concentration de médicament de 250 μg/mL, seul un petit nombre de poissons-zèbres ont survécu dans le groupe transformé. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Relation dose-dose-mortalité entre le dosage et la dose. Cette figure montre la relation dose-dose-mortalité entre le dosage et la dose. (A) Cette figure montre la relation dose-dose-mortalité du groupe brut. (B) Cette figure montre la relation dose-dose-mortalité du groupe traité. n = 40. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Diagramme LC50 de l’EF brut et transformé. Le diagramme LC50 de l’EF brut et traité est montré. Les concentrations létales médianes des deux groupes expérimentaux à 72 hpf ont été calculées. La CL50 était de 151,3 μg/mL dans le groupe brut (S) et de 219,8 μg/mL dans le groupe de traitement (P). n = 40. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Plan expérimental et résultats de la méthode de surface de réponse de Box-Behnken des 17 groupes d’expériences. Le tableau 1 montre les 17 groupes d’expériences conçus par la méthode de surface de conception-réponse de Box-Behnken et leurs résultats de score complets. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2 : Variables utilisées dans le plan Box-Behnken. Les variables indépendantes et dépendantes sont répertoriées ici avec leurs niveaux faible, moyen et élevé. La conception Box-Behnken a permis d’identifier les facteurs les plus influents dans le traitement EF, avec la quantité d’huile de mouton (A) (15%-35%), la température de l’huile de mouton (B) (50 ° C -120 ° C) et la température de friture (C) (80 ° C -300 ° C) comme facteurs d’influence. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 3 : Équations de régression et plages linéaires des constituants chimiques de la FE. Les résultats de l’équation de régression et de la plage linéaire de la composition chimique EF montrent qu’il y avait une bonne linéarité entre chacune des concentrations d’icariin, EA, EB, EC et BI et leurs zones de pics chromatographiques. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 4 : Taux d’essai de récupération de l’échantillon. Les taux de récupération moyens de l’icariin, de l’EA, EB, EC et BI étaient respectivement de 99,98%, 100,14%, 100,09%, 100,75% et 100,94%, et les valeurs RSD% étaient de 0,56%, 0,78%, 0,84%, 1,10% et 1,47%, respectivement. Les résultats montrent que la précision de la méthode était appropriée. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 5 : Coefficients de régression du modèle quadratique prédit. La valeur P du modèle était de P < 0,01, ce qui indique que le modèle était significatif. La valeur P de l’absence d’ajustement était de P > 0,05, ce qui indique que l’absence d’ajustement n’était pas significative. La valeur R2 était de 0,9300, indiquant que l’ajustement du modèle était bon et que l’erreur était faible, de sorte que le modèle convenait à l’analyse et à la prédiction de l’effet de la composition chimique du FE sauté à l’huile de mouton. En outre, A 2 et D2 ont eu des effets significatifs sur la teneur en produits transformés (P < 0,01). Les influences de A et C du terme d’un degré et de C2 du terme de second ordre sur le score global étaient significatives. Le terme B d’un degré, le terme de deuxième ordre A 2, B2 et tous les éléments d’interaction n’ont eu aucun effet significatif sur le score global. L’analyse de la valeur P a montré que, parmi les paramètres expérimentaux, la quantité d’huile de mouton (A) avait la plus grande influence sur le score global, suivie de la température de friture (C), puis de la température de l’huile de mouton (B). Veuillez cliquer ici pour télécharger ce tableau.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Variables indépendantes et détermination de leurs niveaux
La technologie de traitement EF n’est décrite que dans l’édition 2020 de la pharmacopée chinoise et les spécifications de traitement de la médecine chinoise locale publiées par 26 provinces, municipalités et régions autonomes à travers le pays1. La description comprend les étapes suivantes: prendre de l’huile de mouton et la chauffer pour la faire fondre, ajouter des lambeaux EF, faire sauter à feu lent jusqu’à ce qu’elle soit uniforme et brillante, la retirer et la laisser refroidir. De plus, 20 kg (abrégé en 20%) d’huile de mouton (raffinée) sont utilisés pour 100 kg d’Epimedium. Cependant, les paramètres du processus de traitement de EF ne sont pas spécifiés. Parmi les variables indépendantes de cette expérience, trois facteurs clés ont pu être quantifiés dans le processus de production: le dosage de l’huile de mouton, la température de l’huile de mouton et la température de friture. La plage de valeurs doit être définie conformément à la description ci-dessus. D’après les résultats du test préliminaire, on peut voir que lorsque la quantité d’huile de mouton est de 15%, les feuilles EF peuvent être uniformément enduites d’huile de mouton. Lorsque le dosage dépasse 35%, il y a trop d’huile de mouton. Enfin, la fourchette de la quantité d’huile de mouton devrait être comprise entre 15% et 35%. Lorsque la température atteint 50 °C, l’huile de mouton fond. Lorsque la température atteint >120 °C, l’huile de mouton commence à fumer et la température est trop élevée. Par conséquent, la plage de température de l’huile de mouton doit être comprise entre 50 °C et 120 °C. L’édition 2020 de la pharmacopée chinoise stipule que l’EF doit être sauté à feu lent. Le feu lent ne doit pas dépasser 200 °C et la température de friture doit varier entre 80 °C et 300 °C.
Notation complète
Au cours du traitement d’Epimedium, les liaisons glycosidiques sont rompues et les composants glycosidiques sont transformés en composants glycosidiques inférieurs. La détermination de la teneur en produits transformés par EE dans l’édition 2020 de la pharmacopée chinoise est basée sur la détermination de la teneur totale en icariin, EA, EB et EC dans les matières médicinales d’origine, et un composant monoglycoside, BI, est répertorié séparément comme indicateur. Dans cette expérience, le poids total de l’icariin, de l’EA, de l’EB et de la CE dans le FE traité était de 50%, le poids du BI était de 50% et le score global a été établi sur la base de ces valeurs.
La méthodologie de surface de réponse (RSM) est une technique statistique permettant d’identifier les paramètres optimaux du procédé et de résoudre des problèmes multivariés. Dans cette technique, un plan expérimental raisonnable est utilisé pour obtenir certaines données par le biais d’expériences, et une équation de régression quadratique multivariée est utilisée pour dériver une relation fonctionnelle entre les facteurs et les réponses22. La conception uniforme et l’optimisation des processus de conception orthogonale sont couramment utilisées, mais leur précision de test n’est pas élevée et le modèle mathématique n’est pas très prévisible. Le modèle mathématique qui sous-tend RSM est hautement prévisible. La RSM nécessite moins d’expériences et des cycles plus courts, ce qui peut non seulement éliminer les problèmes associés aux statistiques mathématiques traditionnelles, mais peut également clarifier les relations entre les facteurs et les réponses23. RSM conceptualise la réponse du système en fonction d’un ou plusieurs facteurs et utilise des techniques graphiques pour afficher cette relation fonctionnelle afin d’aider l’utilisateur à sélectionner les conditions optimales dans le plan expérimental par observation visuelle intuitive. Ces avantages ont conduit à une large utilisation de cette méthode dans l’industrie chimique24, le génie biologique, l’industrie alimentaire25, l’industrie pharmaceutique et les préparations de MTC.
Bien que la RSM puisse identifier la relation fonctionnelle entre les réponses (indices à étudier) et les facteurs (variables indépendantes), toutes les expériences ne conviennent pas à l’optimisation de la surface de réponse car il n’y a pas toujours une relation fonctionnelle forte entre la réponse et les facteurs. RSM obtient souvent des relations de fonctions continues, qui exigent que tous les facteurs soient des variables continues. Néanmoins, tous les facteurs à étudier ne sont pas des variables continues ou n’ont pas d’effets significatifs sur les valeurs de réponse au début de la conception expérimentale. Pour réduire le nombre d’expériences et améliorer la précision de la modélisation de la surface de réponse, un criblage est nécessaire pour sélectionner les facteurs significatifs et déterminer leurs niveaux par plan factoriel, plan uniforme ou plan orthogonal avant d’effectuer une méthodologie de conception de surface de réponse. Le plus grand avantage de la méthodologie de surface de réponse est qu’une fois le modèle correctement établi, la valeur de réponse dans n’importe quelle combinaison de conditions peut être prédite et la relation fonctionnelle peut être vue de manière plus intuitive et visuelle à travers la surface de réponse 3D. Cette visualisation est d’une grande aide pour les chercheurs dans la recherche des conditions de traitement optimales26.
Cette étude a utilisé le principe de conception de Box-Behnken de RSM pour concevoir 17 expériences combinées en utilisant le score complet de contenu chimique de EF comme valeur de réponse. Enfin, les meilleurs résultats d’optimisation des procédés ont été obtenus par analyse de régression. La technologie de traitement a été optimisée comme suit : chauffage de l’huile de mouton à 120 °C ± 10 °C, ajout de l’EF brut, friture à feu doux (189 °C ± 10 °C) jusqu’à ce qu’elle soit uniformément brillante, puis retrait et refroidissement. Pour chaque tranche de 100 kg d’EF, 15 kg d’huile de mouton (huile raffinée) doivent être utilisés. Nos résultats ont montré que le processus EF était stable, fiable et reproductible. De plus, les interactions factorielles ont été analysées, et l’interaction entre la quantité d’huile de mouton et la température de friture, mais pas les interactions entre d’autres facteurs, était significative. Cette étude a démontré que la conception de la surface de réponse, en tant que méthode d’analyse des interactions entre les facteurs et des relations entre les facteurs et leurs valeurs de surface de réponse, permettait d’optimiser les conditions de traitement dans un court laps de temps avec un nombre minimal d’expériences. Les facteurs sélectionnés dans cette étude étaient les facteurs clés identifiés dans l’expérience de dépistage à facteur unique, et leurs niveaux ont été déterminés dans une expérience préliminaire. Les échantillons d’essai étaient conformes aux caractéristiques de la méthode de la surface de réponse, de sorte que l’étude a pu utiliser la méthodologie de la surface de réponse pour établir un modèle prédictif. Les résultats expérimentaux peuvent fournir une référence pour améliorer la qualité et l’uniformité de l’EF traité.
Les embryons de poisson-zèbre sont utilisés comme organismes modèles dans le domaine de la génétique du développement parce qu’ils sont transparents, se développent in vitro et sont faciles à observer27. Les indicateurs de toxicité couramment utilisés dans les études de toxicité pour le développement comprennent la mortalité embryonnaire, le taux de malformation embryonnaire, l’œdème du sac vitellin, la formation de pigments, la condensation des œufs, l’extension de la queue, la morphologie de la tête et la formation du segment corporel, entre autres28. Par rapport aux techniques d’évaluation de la toxicité chez les mammifères, la spécificité des embryons de poisson-zèbre pour la détection de la toxicité des composés est de 70 % à 80 %, et la sensibilité dépasse 80 %18. Ton et coll.29 ont constaté que l’exactitude de l’évaluation de la toxicité pour le développement de composés non tératogènes avec des embryons de poisson zèbre était de 75 %. Les composés tératogènes ont été évalués avec une précision de 100% ici. Bien que la MTC présente les caractéristiques de composants complexes et d’organes cibles de toxicité peu clairs, les embryons de poisson zèbre peuvent encore être utilisés comme modèle animal expérimental pour l’évaluation précise et rapide de la toxicité pour le développement. Il et al.30 ont constaté que l’émodine affectait la survie et les taux d’éclosion des embryons de poisson zèbre, provoquant une flexion du tronc et un œdème du sac vitellin. Chen et coll.31 ont constaté que le muscone causait un œdème péricardique embryonnaire de poisson zèbre, une courbure de la colonne vertébrale et un œdème du sac vitellin. Lui et coll.32 ont constaté qu’Arnebiae Radix avait des effets mortels sur le poisson zèbre à tous les stades de développement, et que 1,0 mg/L d’Arnebiae Radix inhibait le développement embryonnaire, entraînant une réduction du nombre de somites, de malformations de la queue, de flexion du corps et de mélanine réduite chez les embryons de poisson zèbre.
Pour étudier les effets de l’EF brut et traité sur le développement embryonnaire du poisson zèbre, une expérience de toxicité pour le développement de l’embryon de poisson zèbre a été menée dans cette étude. Les données ont montré que les valeurs CL50 étaient de 151,3 μg/mL pour le groupe brut (S) et de 219,8 μg/mL pour le groupe traité (P). L’observation des corps de poisson-zèbre dans chaque groupe expérimental à l’aide d’un microscope a montré un degré évident de tératogénicité du poisson zèbre dans le groupe brut. La plupart des poissons présentaient divers degrés de tératogénicité, y compris une déformation de la colonne vertébrale, une déformation de la courbure corporelle, un œdème péricardique, une incomplétude de la vessie natatoire ou une déformation du foie, et ces observations étaient rares dans le groupe traité. Ces expériences ont montré que la toxicité de l’EF était significativement réduite après le traitement, ce qui suggère que le traitement pourrait réduire la toxicité des médicaments chez l’homme. Les résultats expérimentaux fournissent une référence pour améliorer la sécurité médicamenteuse clinique de l’EF traité à l’huile de mouton.
La médecine traditionnelle chinoise suggère que la fonction du rein est étroitement liée à la croissance, au développement et à la reproduction du corps humain33. Les anciens livres de médecine traditionnelle chinoise rapportent que le rein est la moelle osseuse du corps. Le rein stocke l’essence, et la moelle réside dans la cavité osseuse pour nourrir l’os. Lorsque l’essence rénale est déficiente, la moelle osseuse est réduite34. La médecine traditionnelle chinoise de tonification du rein yang peut traiter la débilité lombaire, l’ostéoporose, l’impuissance, l’éjaculation précoce et l’infertilité utérineau froid 35. EF est l’un des matériaux médicinaux représentatifs pour tonifier le yang rénal. Des études pharmacologiques modernes ont montré que l’EF a des effets évidents sur le système squelettique, le système immunitaire, le système reproducteur, le système cardiovasculaire et le système nerveux, ainsi que des effets antitumoraux36. En termes d’activité sur le système squelettique, l’icariine37 peut améliorer le taux de sérum E2 chez les rats ovariectomisés et réguler positivement l’expression de l’ARNm ERβ dans le tissu osseux de rats ovariectomisés. La synthèse de ERβ est augmentée, améliorant ainsi l’effet biologique de ER, affaiblissant l’activité de résorption osseuse des ostéoclastes et améliorant la formation osseuse des ostéoblastes. Les changements dans la résorption osseuse sont plus importants que l’équilibre négatif du métabolisme osseux. L’épimédine A peut améliorer la microstructure osseuse et les marqueurs de renouvellement osseux sérique chez les souris modèles d’ostéoporose en inhibant la formation d’ostéoclastes, la différenciation et la résorption osseuse et en jouant un rôle dans la protection osseuse38. L’épimédine C a une activité anti-ostéoporose évidente, principalement en termes d’augmentation de la masse osseuse et d’amélioration de la microstructure trabéculaire pour finalement augmenter la solidité osseuse39. D’autres études ont montré que l’épimédine B40 et le baohuoside I41 ont une activité anti-ostéoporose.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Les auteurs ne déclarent aucun conflit d’intérêts.
Acknowledgments
Ce travail est soutenu par le projet commercial de recherche scientifique fondamentale de l’Académie de médecine traditionnelle chinoise de Chongqing (numéro de projet: jbky20200013), le projet d’orientation des incitations à la performance des institutions de recherche scientifique de Chongqing (numéro de projet: cstc2021jxjl 130025) et le projet de construction de disciplines clés de la Commission municipale de santé de Chongqing de Chinese Materia Medica Processing.
Materials
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Fisher | 197164 | |
Baohuoside 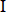 (B (B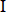 ) ) |
Chengdu Manst Biotechnology Co., Ltd. | MUST-20042402 | |
| Chromatographic column | Waters Corporation | Symmetry C18 | |
| Design Expert software | Stat- Ease Inc., Minneapolis, MN | Trial Version8.0.6.1 | |
| Detector | Waters Corporation | 2998 | |
| Disintegrator | Hefei Rongshida Small Household Appliance Co., Ltd. | S-FS553 | |
| Electronic analytical balance | Mettler-Toledo International Inc. | MS205DU | |
| Epimedin A (EA) | Chengdu Manst Biotechnology Co., Ltd. | MUST-21112118 | |
| Epimedin B (EB) | Chengdu Manst Biotechnology Co., Ltd. | MUST-20080403 | |
| Epimedin C (EC) | Chengdu Manst Biotechnology Co., Ltd. | MUST-20080310 | |
| Ethanol | Chongqing Chuandong Chemical ( Group ) Co., Ltd. | 20180801 | |
| Graphpad software | GraphPad Software Inc., San Diego, CA, USA | 6.02 | |
| High Performance Liquid Chromatography (HPLC) | Waters Corporation | 2695 | |
| Icariin | Chengdu Glip Biotechnology Co., Ltd. | 21091401 | |
| Methanol | Chongqing Chuandong Chemical (Group) Co., Ltd. | 20171101 | |
| Microporous membrane | Tianjin Jinteng Experimental Equipment Co., Ltd. | 0.22μm | |
| Mutton oil | Kuoshan Zhiniu Fresh Food Store | 20211106 | |
| Office Excel office software | Microsoft | Office Excel 2021 | |
| Pharmacopoeia sieve | Shaoxing Shangyu Huafeng Hardware Instrument Co., Ltd. | R40/3 | |
| Pure water machine | Chongqing Andersen Environmental Protection Equipment Co., Ltd. | AT Sro 10A | |
| Qualitative filter paper | Shanghai Leigu Instrument Co., Ltd. | 18cm | |
| Stereomicroscope | Carl Zeiss, Oberkochen, Germany | Stemi 2000 | |
| Ultrasonic cleaner | Branson Ultrasonics (Shanghai) Co.,Ltd. | BUG25-12 | |
| Zebrafish | China Zebrafish Resource Center (CZRC) | The AB strain |
References
- Chinese Pharmacopoeia Commission. Chinese Pharmacopoeia. Volume I. , China Medical Science and Technology Press. Beijing, China. (2020).
- Wang, X. T. Collection of Traditional Chinese Medicine Processing Methods. , Nanchang Science and Technology Press. Jiangxi, China. (1998).
- Chen, L. L., Jia, X. B., Jia, D. S. Advances in studies on processing mechanism of Epimedii Folium. Chinese Traditional and Herbal Drugs. 12 (12), 2108-2111 (2010).
- Zhao, W., et al. Optimized extraction of polysaccharides from corn silk by pulsed electric field and response surface quadratic design. Journal of The Science of Food and Agriculture. 91 (12), 2201-2209 (2011).
- Zhao, L. C., et al. The use of response surface methodology to optimize the ultrasound-assisted extraction of five anthraquinones from Rheum palmatum L. Molecules. 16 (7), 5928-5937 (2011).
- Mao, W. H., Han, L. J., Shi, B. Optimization of microwave assisted extraction of flavonoid from Radix Astragali using response surface methodology. Separation Science and Technology. 43 (12), 671-681 (2008).
- Liu, W., et al. Optimization of total flavonoid compound extraction from Gynura medica leaf using response surface methodology and chemical composition analysis. International Journal of Molecular Sciences. 11 (11), 4750-4763 (2010).
- Guo, G. L., et al. Research progress on processing mechanism of Epimedium fried with sheep fat oil based on warming kidney and promoting yang. Journal of Liaoning University of TCM. 22 (07), 1-5 (2020).
- Shen, X. J., Zhou, Q., Sun, L. -L., Dai, Y. -P., Yan, X. -S. Optimization for cutting procedure of astragali radix with Box-Behnken design and response surface method. China Journal of Chinese Materia Medica. 39 (13), 2498-2503 (2014).
- Wang, L. H., et al. Optimization of processing technology of honey wheat bran based on Box-Behnken response surface methodology. Chinese Traditional and Herbal Drugs. 52 (12), 3538-3543 (2021).
- Zhang, J. B., et al. Study on integrated process of producing area and processing production for Paeoniae Radix Alba based on Box-Behnken response surface methodology. Chinese Traditional and Herbal Drugs. 53 (18), 5657-5662 (2022).
- Li, N., Zhang, X. M., Yao, Y. Y., Chen, Y. L., Fan, Q. Optimization of processing technology for Psoraleae Fructus by D-optimal response surface methodology with UHPLC. Chinese Traditional and Herbal Drugs. 39 (05), 42-44 (2022).
- Jia, Y. Q., et al. Optimization of processing technology with wine of Cnidii Fructus by AHP-entropy weight method combined with response surface method. Journal of Chinese Medicinal Materials. 10, 2338-2343 (2022).
- Chen, F. G., et al. Optimization of the baked drying technology of Cinnamomi Ramulus based on CRITIC combined with Box-Behnken response surface method. Journal of Chinese Medicinal Materials. 2022 (08), 1838-1842 (2022).
- Wang, W. D., et al. Optimization extraction of effective constituents from Epimedii Herba based on central composite design-response surface methodology and orthogonal experimental design. Lishizhen Medicine and Materia Medica. 21 (11), 2766-2768 (2010).
- Yang, L., et al. Zebrafish embryos as models for embryotoxic and teratological effects of chemicals. Reproductive Toxicology. 28 (2), 245-253 (2009).
- Kanungo, J., Cuevas, E., Ali, S. F., Paule, M. G. Zebrafish model in drug safety assessment. Current Pharmaceutical Design. 20 (34), 5416-5429 (2014).
- Jayasinghe, C. D., Jayawardena, U. A. Toxicity assessment of herbal medicine using zebrafish embryos: A systematic review. Evidence-Based Complementary and Alternative Medicine. 2019, 7272808 (2019).
- Scholz, S. Zebrafish embryos as an alternative model for screening of drug induced organ toxicity. Archives of Toxicology. 87 (5), 767-769 (2013).
- Ling, J., et al. Analysis of Folium Epimedium toxicity in combination with Radix Morindae Officinalis based on zebrafish toxicity/metabolism synchronization. Acta Pharmaceutica Sinica. 53 (1), 74 (2018).
- Wang, Y., et al. Tri-n-butyl phosphate delays tissue repair by dysregulating neutrophil function in zebrafish. Toxicology and Applied Pharmacology. 449, 116114 (2022).
- Sheng, Z. L., Li, J. C., Li, Y. H. Optimization of forsythoside extraction from Forsythia suspensa by Box-Behnken design. African Journal of Biotechnology. 10 (55), 11728-11737 (2011).
- Pang, X., et al. Prenylated flavonoids and dihydrophenanthrenes from the leaves of Epimedium brevicornu and their cytotoxicity against HepG2 cells. Natural Product Research. 32 (19), 2253-2259 (2018).
- Zhong, R., et al. The toxicity and metabolism properties of Herba Epimedii flavonoids on laval and adult zebrafish. Evidence-Based Complementary and Alternative Medicine. 2019, 3745051 (2019).
- Zhang, L., et al. Effect of 2" -O-rhamnosyl icariside II, baohuoside I and baohuoside II in Herba Epimedii on cytotoxicity indices in HL-7702 and HepG2 cells. Molecules. 24 (7), 1263 (2019).
- Chen, Y., Yang, R. J., Yu, M., Ding, S. L., Chen, R. Q. Application of response surface methodology in modern production process optimization. Science & Technology Vision. 2016 (19), 36-39 (2016).
- Zhang, Y., et al. Progress in using zebrafish as a toxicological model for traditional Chinese medicine. Journal of Ethnopharmacology. 282, 114638 (2022).
- Oliveira, R., Domingues, I., Grisolia, C. K., Soares, A. M. V. M. Effects of triclosan on zebrafish early-life stages and adults. Environmental Science and Pollution Research. 16 (6), 679-688 (2009).
- Ton, C., Lin, Y., Willett, C. Zebrafish as a model for developmental neurotoxicity testing. Birth Defects Research. Part A, Clinical and Molecular Teratology. 76 (7), 553-567 (2006).
- He, Q., et al. Toxicity induced by emodin on zebrafish embryos. Drug and Chemical Toxicology. 35 (2), 149-154 (2012).
- Chen, Y., et al. Developmental toxicity of muscone on zebrafish embryos. Chinese Journal of Pharmacology and Toxicology. (6), 267-273 (2014).
- He, Y. L., et al. Effects of shikonin on zebrafish's embryo and angiogenesis. Chinese Traditional Patent Medicine. 38 (2), 241-245 (2016).
- Zhou, Y. The transformation research on the chemical compositions in the processing of Epimedium. , Kunming University of Science and Technology. Kunming, China. (2016).
- Xiao, Y. P., Zeng, J., Jiao, L. -N., Xu, X. -Y. Review for treatment effect and signaling pathway regulation of kidney-tonifying traditional Chinese medicine on osteoporosis. China Journal of Chinese Materia Medica. 43 (1), 21-30 (2018).
- Wang, R. H. Study on modern pharmacological effects of traditional Chinese medicine for tonifying kidney yang. Journal of Hubei University of Chinese Medicine. 13 (04), 63-66 (2011).
- Luo, L., et al. Advances in the chemical constituents and pharmacological studies of Epimedium. Asia-Pacific Traditional Medicine. 15 (6), 190-194 (2019).
- Liu, S., et al. Effects of icariin on ERβ gene expression and serum estradiol level in ovariectomized rats. Hunan Journal of Traditional Chinese Medicine. 32 (1), 150-152 (2016).
- Liu, Y., et al. Effects of epimedin A on osteoclasts and osteoporotic male mice. Chinese Journal of Veterinary Science. 41 (07), 1359-1364 (2021).
- Liu, Y. L., et al. Effects of icariin and epimedium C on microstructure of bone tissue in glucocorticoid osteoporosis model mice based on Micro-CT technique. Drug Evaluation Research. 43 (09), 1733-1739 (2020).
- Zhan, Y. Evaluation of antiosteoporotic activity for micro amount icariin and epimedin B based on the osteoporosis model using zebrafish. Chinese Pharmaceutical Journal. (24), 30-35 (2014).
- Zhan, Y., Wei, Y. -J., Sun, E., Xu, F. -J., Jia, X. -B. Two-dimensional zebrafish model combined with hyphenated chromatographic techniques for evaluation anti-osteoporosis activity of epimendin A and its metabolite baohuoside I. Acta Pharmaceutica Sinica. 49 (06), 932-937 (2014).



