Overview
Fonte: Laboratorio del Dr. Michael Evans — Georgia Institute of Technology
La costante di equilibrio, K, per un sistema chimico è il rapporto tra le concentrazioni di prodotto e le concentrazioni di reagente all'equilibrio, ciascuna elevata alla potenza dei rispettivi coefficienti stechiometrici. La misurazione di K comporta la determinazione di queste concentrazioni per sistemi in equilibrio chimico.
I sistemi di reazione contenenti un singolo componente colorato possono essere studiati spettrofotometricamente. La relazione tra assorbanza e concentrazione per il componente colorato viene misurata e utilizzata per determinarne la concentrazione nel sistema di reazione di interesse. Le concentrazioni dei componenti incolori possono essere calcolate indirettamente utilizzando l'equazione chimica bilanciata e la concentrazione misurata del componente colorato.
In questo video, la curva della legge di Beer per Fe(SCN)2+ è determinata empiricamente e applicata alla misura di K per la seguente reazione:
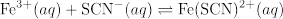
Vengono studiati quattro sistemi di reazione con diverse concentrazioni iniziali di reagenti per illustrare che K rimane costante indipendentemente dalle concentrazioni iniziali.
Principles
Ogni reazione chimica è associata a una costante di equilibrio K, che riflette il rapporto tra le concentrazioni del prodotto e le concentrazioni del reagente all'equilibrio chimico. Per la reazione generica a A + b B  c C + d D, la costante di equilibrio è definita come
c C + d D, la costante di equilibrio è definita come

dove le concentrazioni sul lato destro dell'equazione sono molarità all'equilibrio. Questa equazione è nota come espressione di equilibrio per la reazione. Nei sistemi chimici che non sono in equilibrio, le reazioni avanti e indietro avvengono a velocità diverse fino a quando le concentrazioni di reagenti e prodotti soddisfano l'espressione di equilibrio.
Per misurare il valore di K per un sistema in equilibrio chimico, è necessario determinare le concentrazioni di reagenti e prodotti direttamente o indirettamente. I metodi spettrofotometrici per la determinazione di K comportano la misurazione diretta della concentrazione di un componente colorato e la misurazione indiretta degli altri. La spettroscopia visibile del componente colorato a concentrazioni note rivela la relazione tra assorbanza e concentrazione per questo componente. Secondo la legge di Beer, questa relazione ha la forma

dove e è l'assorbimento molare del componente in L/mol-cm, l è la lunghezza del percorso della luce attraverso il campione in cm, c è la molarità del componente in mol/L e A è l'assorbanza.
La curva della legge di Beer per la componente colorata può essere applicata ad un sistema di reazione in equilibrio per determinare la concentrazione di questo componente dalle misure di assorbanza (Figura 1). Le concentrazioni dei reagenti e dei prodotti rimanenti possono quindi essere calcolate regolando le concentrazioni iniziali in base alla molarità misurata delle specie colorate.
Il sistema qui studiato è la reazione del catione di ferro (III) con l'anione tiocianato per formare un complesso di tiocianato di ferro (III).

L'espressione di equilibrio per questo sistema di reazione è

dove il pedice eq denota le concentrazioni di equilibrio. Il prodotto di tiocianato di ferro (III) è arancione, ma entrambi i reagenti sono incolori in soluzione acquosa. Quindi, [Fe(SCN)2+]eq può essere determinato direttamente dalle misurazioni dell'assorbanza.

Le concentrazioni di equilibrio dei reagenti possono essere calcolate sottraendo la concentrazione di equilibrio del prodotto dalle concentrazioni iniziali dei reagenti. Una tabella INITIAL-Change-Equilibrium (ICE) illustra come le concentrazioni iniziali e di equilibrio sono correlate (Tabella 1).

Prove ripetute di questo esperimento che coinvolgono diverse concentrazioni iniziali di reagenti dovrebbero produrre lo stesso valore di K, poiché il valore di K è indipendente dalla concentrazione.

Figura 1. Curva della legge della birra per il tiocianato di ferro (III).
| Fe3+ | SCN– | Fe(SCN)2+ | |
| Iniziale | [Fe3+] i | [SCN–] i | 0 |
| Cambiare | –[Fe(SCN)2+]eq | –[Fe(SCN)2+]eq | +[Fe(SCN)2+]eq |
| Equilibrio | [Fe3+] i – [Fe(SCN)2+]eq | [SCN–] i – [Fe(SCN)2+]eq | [Fe(SCN)2+] eq |
Tabella 1. Una tabella ICE (Initial-Change-Equilibrium) che illustra come le concentrazioni iniziali e di equilibrio sono correlate.
Subscription Required. Please recommend JoVE to your librarian.
Procedure
1. Determinazione della curva della legge della birra per Fe (SCN)2+
- Calibrare uno spettrofotometro visibile utilizzando acqua distillata come un bianco.
- Aggiungere 1,0 mL di 1,0 × 10-4 M Fe (NO3)3 soluzione a una provetta.
- Alla stessa provetta, aggiungere 5,0 mL di soluzione KSCN da 0,50 M.
- Alla stessa provetta, aggiungere 4,0 ml di soluzione HNO3 da 0,10 M. Coprire il tubo con un dito guantato e agitare delicatamente per mescolare.
- Utilizzare una pipetta Pasteur per trasferire una piccola quantità della soluzione in una cuvetta. Assicurarsi che il livello del liquido sia superiore al percorso del fascio di luce nello spettrofotometro.
- Posizionare la cuvetta nello spettrofotometro, in modo che la luce passi attraverso i lati trasparenti.
- Acquisire uno spettro e registrare il valoreλ max e l'assorbanza a λmax.
- Per costruire una curva della legge di Beer, è necessario preparare e misurare soluzioni aggiuntive con concentrazioni note di Fe (SCN)2+. Ripetere i passaggi da 2 a 7 utilizzando i volumi delle soluzioni Fe(NO3)3,KSCN e HNO3 nella Tabella 2. Assicurati di utilizzare la stessa cuvetta per tutte le misurazioni, risciacquando 3 volte con acqua distillata tra ogni campione.
- Tracciare l'assorbanza misurata rispetto alle concentrazioni di Fe(SCN)2+ in ciascuna provetta e determinare la linea di misura migliore per i dati. La pendenza di questa linea è l'assorbimento molare e la lunghezza del percorso è di 1 cm.
2. Misurazione K per il sistema di tiocianato di ferro (III)
- Preparare 4 provette medie contenenti i volumi indicati di 0,0025 M Fe(NO3)3,0,0025 M KSCN e 0,10 M HNO3 soluzioni nella Tabella 3.
- Coprire ogni tubo con un dito e agitare delicatamente per mescolare. Lasciali riposare per almeno 10 minuti. Questo periodo di riposo assicura che le soluzioni siano all'equilibrio chimico.
- Utilizzare una pipetta Pasteur per trasferire una piccola quantità di soluzione 6 in una cuvetta. Assicurarsi che il livello del liquido sia superiore al percorso del fascio di luce nello spettrofotometro.
- Acquisire uno spettro e registrare l'assorbanza a λmax.
- Reazioni multiple con diverse concentrazioni iniziali di reagenti possono essere studiate per illustrare che K non dipende dalla concentrazione. Per determinare K per diverse condizioni iniziali, ripetere i passaggi 3 e 4 per le soluzioni 7 – 9.
| Numero del tubo | Volume 1,0 x 10–4 M Fe(NO3)3 (ml) |
Volume 0,50 M KSCN (mL) |
Volume 0,10 M HNO3 (ml) |
| 1 | 1.0 | 5.0 | 4.0 |
| 2 | 2.0 | 5.0 | 3.0 |
| 3 | 3.0 | 5.0 | 2.0 |
| 4 | 4.0 | 5.0 | 1.0 |
| 5 | 5.0 | 5.0 | 0.0 |
Tabella 2. Volumi appropriati di soluzioni Fe(NO3)3,KSCN e HNO3 da collocare nei tubi 2 - 5.
| Numero del tubo | Volume 0,0025 M Fe(NO3)3 (mL) |
Volume 0,0025 M KSCN (mL) |
Volume 0,10 M HNO3 (ml) |
| 6 | 1.0 | 1.0 | 5.0 |
| 7 | 1.0 | 2.0 | 4.0 |
| 8 | 2.0 | 2.0 | 3.0 |
| 9 | 2.0 | 3.0 | 2.0 |
Tabella 3. Volumi appropriati di 0,0025 M Fe (NO3)3, 0,0025 M KSCN e 0,10 M HNO3 soluzioni.
Determinare la costante di equilibrio di una reazione chimica può fornire informazioni importanti sulla misura in cui formerà prodotti nel tempo.
Ogni reazione chimica è associata a una costante di equilibrio, K, che riflette il rapporto tra le concentrazioni dei prodotti e dei reagenti quando la reazione ha smesso di progredire. Per misurare K, queste concentrazioni devono essere determinate.
Se una reazione contiene un singolo componente colorato, la sua interazione con la luce può essere misurata per discernere la sua concentrazione. Le concentrazioni dei componenti non colorati possono quindi essere calcolate indirettamente utilizzando l'equazione chimica bilanciata. Questo video illustrerà l'uso di uno spettrofotometro per determinare empiricamente la costante di equilibrio per una reazione tiocianante di ferro.
La maggior parte delle reazioni chimiche procede sia in avanti che in senso inverso. Man mano che la reazione progredisce, raggiunge un punto in cui le reazioni avanti e indietro si verificano alla stessa velocità. Questo è noto come equilibrio chimico. A questo stato stazionario, il rapporto tra le concentrazioni di prodotto e le concentrazioni di reagenti, ciascuna elevata alla potenza dei propri coefficienti stechiometrici, corrisponde alla costante di equilibrio, K. Per misurare K per un sistema di interesse, i coefficienti devono essere noti e le concentrazioni devono essere determinate, direttamente o indirettamente. Secondo la legge di Beer-Lambert, la concentrazione di una specie colorata è proporzionale alla sua assorbanza, che è la quantità di energia che assorbe a una specifica lunghezza d'onda della luce. Questo può essere espresso matematicamente, dove A è assorbanza, epsilon è il coefficiente di attenuazione molare, che è specifico del composto, l è la lunghezza del percorso attraverso il campione e c è la concentrazione. Una curva di calibrazione viene creata testando più soluzioni di concentrazione nota e tracciando i valori di assorbanza risultanti. Con questa curva di calibrazione, è possibile studiare soluzioni di concentrazione sconosciuta. Le misurazioni dell'assorbanza vengono utilizzate per determinare la concentrazione delle specie colorate. Quindi, è possibile calcolare le concentrazioni dei reagenti e dei prodotti rimanenti. La seguente procedura studierà la reazione del ferro tre con il tiocianato per formare un complesso di tiocianato di ferro.
Una volta determinate le concentrazioni, il valore per K può essere calcolato con una tabella Initial-Change-Equilibrium, o ICE, che sarà spiegata ulteriormente nei risultati.
Ora che hai capito come i metodi spettrofotometrici possono essere utilizzati per determinare la costante di equilibrio, sei pronto per iniziare la procedura.
Prima di misurare il campione, è necessario generare una curva di calibrazione.
Per iniziare, azzerare uno spettrofotometro UV-vis che utilizza acqua distillata come un bianco per rappresentare nessuna assorbanza. Quando si inserisce una cuvetta nello spettrofotometro, assicurarsi che sia orientata in modo che la luce passi attraverso i lati trasparenti e che il livello del liquido sia al di sopra del percorso del fascio.
Quindi, preparare 5 provette contenenti i volumi indicati di ciascuna soluzione reagente come mostrato nel protocollo di testo, che produrrà concentrazioni variabili del prodotto. Coprire ogni tubo con un dito guantato e agitare delicatamente per mescolare. Lasciare riposare i tubi per 10 minuti.
Utilizzare una pipetta Pasteur per trasferire una piccola quantità del campione a media concentrazione, soluzione 3, in una cuvetta e posizionarla nello spettrofotometro. Acquisisci uno spettro e registra λmax (lunghezza d'onda massima), lambda max e la sua assorbanza. Quindi, iniziando con la soluzione più diluita, misurare l'assorbanza di tutte le soluzioni rimanenti al λmax (lambda max). Utilizzare la stessa cuvetta per tutte le misurazioni, assicurandosi di risciacquare 3 volte tra un campione e l'altro. Ripetere questo processo per le soluzioni 2 – 5.
Tracciare l'assorbanza misurata rispetto alla concentrazione di tiocianato di ferro per ogni soluzione. Determinare la linea di soluzione migliore per i dati. La pendenza di questa linea è il coefficiente di attenuazione molare.
Ora che i dati per le soluzioni standard sono stati acquisiti, preparare quattro provette medie contenenti i volumi di soluzioni indicati come mostrato nel protocollo di testo.
Coprire ogni tubo con un dito e agitare delicatamente per mescolare. Lasciali riposare per almeno 10 minuti. Questo periodo di riposo permette alle soluzioni di raggiungere l'equilibrio chimico.
Utilizzare una pipetta Pasteur per trasferire una piccola quantità di soluzione 6 alla cuvetta e posizionarla nello spettrofotometro. Acquisire uno spettro e registrare l'assorbanza misurata al predeterminato λmax. Ripetere questo processo per le soluzioni da 7 a 9.
Una volta misurati tutti i campioni, è possibile analizzare i dati di molarità e assorbanza per le soluzioni 1 – 5. Un grande eccesso di tiocianato è stato utilizzato per garantire che tutto il ferro reagisse, il che semplifica l'analisi.
I dati vengono tracciati per creare una curva di calibrazione. La lunghezza del percorso della luce, l, è in genere di 1 cm e può essere fattorizzata dai calcoli. La pendenza della linea, che è stata calcolata in 7600, è quindi il coefficiente di attenuazione. Per le soluzioni di prova 6 – 9, questo valore e l'assorbanza vengono utilizzati per calcolare le concentrazioni di tiocianato di ferro all'equilibrio. Con questi dati, la tabella ICE potrebbe quindi essere utilizzata.
Le concentrazioni iniziali di reagente si basano sulle molarità note di ferro e tiocianato aggiunte alla soluzione e sul volume totale della reazione. Poiché il prodotto è formato dalla reazione 1:1 di ferro e tiocianato, la concentrazione di equilibrio di ciascuno diminuisce della quantità di prodotto formato. La concentrazione di equilibrio di ciascuna specie è ora nota. Questi valori vengono utilizzati per calcolare la costante di equilibrio per ogni soluzione. I valori sono approssimativamente costanti nell'intervallo di concentrazioni studiate.
Il concetto di costante di equilibrio è importante per una vasta gamma di campi scientifici. La costante di equilibrio può essere utilizzata per fornire informazioni utili sulla misura in cui una reazione formerà prodotti nel tempo. In questo esempio, sono state osservate due reazioni contenenti cristallo viola.
La prima soluzione era composta da cristallo viola e idrossido di sodio. Il colore è stato osservato cambiare rapidamente da viola a incolore. Questa reazione ha un valore K molto grande, che indica che i prodotti si formano quasi completamente nel tempo.
Il viola cristallino è stato quindi reagito con acetato di sodio. Questa soluzione è rimasta viola a tempo indeterminato. Questa reazione ha un valore K molto basso, quindi non procede in avanti in misura significativa.
Infine, la costante di dissociazione – un tipo specifico di costante di equilibrio – può essere utilizzata per descrivere il comportamento delle proteine. In questo esempio, i cambiamenti nella struttura dell'RNA sono stati monitorati nei tamponi di reazione del magnesio.
L'RNA purificato è stato miscelato in soluzione con concentrazioni note di magnesio e ha permesso di raggiungere l'equilibrio. Quindi, è stata tracciata la struttura dell'RNA risultante.
In questo caso, concentrazioni più elevate di magnesio hanno fatto sì che i siti reattivi sull'RNA fossero meno protetti, producendo un Kd che era la metà del valore.
Hai appena visto l'introduzione di JoVE alla determinazione spettrofotometrica della costante di equilibrio. Ora dovresti capire la relazione definita dalla legge di Beer-Lambert, come determinare la concentrazione dall'assorbanza usando uno spettrofotometro e come calcolare una costante di equilibrio usando le concentrazioni di equilibrio.
Grazie per l'attenzione!
Subscription Required. Please recommend JoVE to your librarian.
Results
La tabella 4 elenca i dati di assorbanza e concentrazione per le soluzioni 1 – 5. Le concentrazioni di Fe(SCN)2+ sono state determinate dalle concentrazioni iniziali di Fe3+ nell'ipotesi che tutto il Fe3+ venga convertito in Fe(SCN)2+. Un grande eccesso di SCN- è stato utilizzato nei tubi 1 - 5 per garantire che questa ipotesi sia vera.
La molarità [Fe(SCN)2+] e l'assorbanza sono tracciate nella Figura 2. Le assorbanze misurate concordano bene con la legge di Beer.
La tabella 5 elenca le assorbanze misurate e i valori K calcolati per i tubi 6 – 9. I valori K sono stati determinati utilizzando il metodo della tabella ICE. Le concentrazioni iniziali di reagente erano basate sulle molarità note di Fe3+ e SCN- nelle soluzioni reagenti e sul volume totale della reazione (10 ml). La concentrazione di equilibrio di Fe(SCN)2+ è stata determinata dividendo l'assorbanza misurata per l'assorbività molare di Fe(SCN)2+. Poiché tutto il prodotto è stato formato dalla reazione 1:1 di Fe3+ e SCN-, la concentrazione di equilibrio di Fe(SCN)2+ corrisponde alla diminuzione della concentrazione dei reagenti. La tabella 6 mostra il processo per la provetta 6.
La costante di equilibrio è calcolata dalle concentrazioni nella riga di equilibrio. Per la provetta 6,

Il valore medio di K era 147 ± 11, illustrando che K è approssimativamente costante nell'intervallo di concentrazioni studiate.

Figura 2. Grafico a linee di assorbanza rispetto alla concentrazione per Fe(SCN)2+.
| Tubo | [Fe(SCN)2+] (mol/L) | Assorbanza |
| 1 | 1,00 x 10–5 | 0.10 |
| 2 | 2,00 x 10–5 | 0.20 |
| 3 | 3,00 x 10–5 | 0.25 |
| 4 | 4,00 x 10–5 | 0.32 |
| 5 | 5,00 x 10–5 | 0.42 |
Tabella 4. Dati di assorbanza rispetto alla concentrazione per Fe(SCN)2+.
| Tubo | Assorbanza | Okay |
| 6 | 0.120 | 136 |
| 7 | 0.268 | 161 |
| 8 | 0.461 | 142 |
| 9 | 0.695 | 150 |
Tabella 5. Valori di assorbanza misurati e K calcolati per la reazione del ferro (III) con il tiocianato.
| [Fe3+] (mol/L) | [SCN–] (mol/L) | [Fe(SCN)2+] (mol/L) | |
| Iniziale | 3,57 x 10–4 | 3,57 x 10–4 | 0 |
| Cambiare | –1,58 x 10–5 | –1,58 x 10–5 | +1,58 x 10–5 |
| Equilibrio | 3,41 x 10–4 | 3,41 x 10–4 | 1,58 x 10–5 |
Tabella 6. La tabella ICE che illustra il processo utilizzato per la provetta 6.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
La costante di equilibrio fornisce informazioni utili sulla misura in cui una reazione procederà a formare prodotti nel tempo. Le reazioni con un grande valore di K,molto più grande di 1, formeranno prodotti quasi completi dato un tempo sufficiente (Figura 3). Le reazioni con un valore di K inferiore a 1 non procederanno in modo significativo. La costante di equilibrio serve quindi come misura della fattibilità di una reazione chimica.

Figura 3. La costante di equilibrio di questa reazione è maggiore di 1. Una quantità significativa di prodotti colorati forma in ogni caso, anche se le concentrazioni iniziali di reagenti differiscono.
La costante di equilibrio fornisce anche utili informazioni termodinamiche sui cambiamenti di energia libera, entalpia ed entropia nel corso di una reazione chimica. La costante di equilibrio è correlata al cambiamento di energia libera della reazione:

Il cambiamento di energia libera della reazione è a sua volta correlato ai cambiamenti di entalpia ed entropia della reazione:

Le misurazioni della dipendenza dalla temperatura di K possono rivelare il cambiamento di entalpia ΔH e il cambiamento di entropia ΔS per una reazione. Oltre a fornire ai chimici informazioni sui modelli di comportamento molecolare, le tabelle di dati termodinamici possono essere utilizzate per identificare reazioni con proprietà termodinamiche favorevoli. Ad esempio, le reazioni redox che rilasciano grandi quantità di energia (associate a valori ΔG negativi) sono candidati interessanti per le batterie.
I valori di K per le reazioni di dissociazione acida ( valoriKa) sono utili per prevedere gli esiti delle reazioni acido-base, che sono controllate termodinamicamente. Gli acidi forti sono associati a grandi valori di Ka e acidi deboli con piccoli valori di Ka. Gli indicatori di pH sono acidi deboli con forme acide e basiche di colore diverso, e il pKa (il logaritmo negativo base-10 di Ka ) diunindicatore rappresenta il pH al quale si verifica un cambiamento di colore quando un acido o una base viene aggiunto a una soluzione dell'indicatore.
Allo stesso modo, i valori Ka vengono utilizzati nella preparazione di soluzioni tampone per raggiungere un valore di pH target. Il pKa di un acido debole rappresenta il pH al quale l'acido e la sua base coniugata sono presenti nella soluzione in concentrazioni uguali. Quando quantità uguali di un acido debole e della sua base coniugata vengono disciolte in una soluzione, il pH della soluzione è uguale al pKa dell'acido debole.
Subscription Required. Please recommend JoVE to your librarian.




