재결정화로 화합물 정화
English
Share
Overview
출처: 지미 프랑코 박사 연구소 – 메리맥 칼리지
재결정화는 고체 화합물을 정화하는 데 사용되는 기술입니다. 1 고형체는 차가운 액체보다 뜨거운 액체에서 더 용해되는 경향이 있습니다. 재결정화 하는 동안, 불순한 고체 화합물은 용액이 포화 될 때까지 뜨거운 액체에 용해되고 액체가 냉각 될 수 있습니다. 2 화합물은 상대적으로 순수한 결정을 형성해야합니다. 이상적으로, 존재하는 모든 불순물이 용액에 남아 있으며 성장하는 결정(도 1)에통합되지 않습니다. 그런 다음 수정을 여과하여 용액에서 제거할 수 있습니다. 모든 화합물을 복구할 수 있는 것은 아닙니다 – 일부는 용액에 남아 분실됩니다.
재결정화는 일반적으로 분리 기술로 생각되지 않습니다. 오히려 소량의 불순물이 화합물로부터 제거되는 정화 기술이다. 그러나, 두 화합물의 용해도 특성이 충분히 다른 경우, 재결정화는 거의 동일한 양으로 존재하는 경우에도 이를 분리하는 데 사용될 수 있다. 대부분의 불순물이 이미 추출 또는 기둥 크로마토그래피와 같은 다른 방법에 의해 제거되었을 때 재결정화가 가장 효과적입니다.
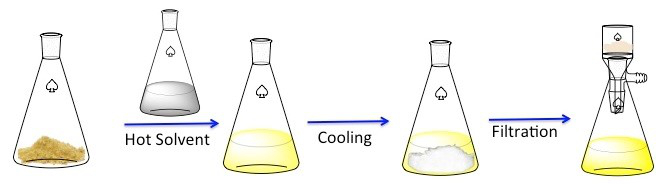
그림 1. 재결정에 대한 일반적인 계획입니다.
Principles
성공적인 재결정화는 용매의 적절한 선택에 따라 달라집니다. 화합물은 뜨거운 용매에 용해되어야하며 추울 때 동일한 용매에서 용해되지 않아야합니다. 재결정화를 목적으로, 수용성과 불용성 사이의 구분선을 3% w/v로 고려하십시오: 3g의 화합물이 용매의 100mL에서 용해되면 용해성으로 간주됩니다. 용매를 선택할 때, 뜨거운 용해도와 차가운 용해도의 차이가 클수록 재결정화에서 더 많은 제품을 회수할 수 있습니다.
냉각 속도는 결정의 크기와 품질을 결정합니다: 빠른 냉각은 작은 결정을 선호하며, 느린 냉각은 크고 일반적으로 순수한 결정의 성장을 선호합니다. 재결정화의 비율은 일반적으로 물질의 융점 아래 약 50 °C에서 가장 크다; 결정의 최대 형성은 융점 아래 약 100 °C에서 발생합니다.
“결정화”와 “재결정화”라는 용어는 때때로 상호 교환적으로 사용되지만 기술적으로 다른 프로세스를 참조합니다. 결정화는 화학 반응에 의한 새로운 용해성 제품의 형성을 말합니다. 이 제품은 많은 갇힌 불순물을 포함하는 무정형 고체로서 반응 용액에서 침전됩니다. 재결정화는 화학 반응을 포함하지 않습니다; 원유 제품은 단순히 용액에 용해되고 결정이 다시 형성될 수 있도록 조건이 변경됩니다. 재결정화는 보다 순수한 최종 제품을 생산합니다. 이러한 이유로, 결정화에 의해 고체 제품을 생산하는 실험 절차는 일반적으로 순수한 화합물을 제공하기 위해 최종 재결정화 단계를 포함한다.
Procedure
Results
An example of the results of recrystallization is shown in Figure 2. The yellow impurities present in the crude compound have been removed, and the pure product is left as an off-white solid. The purity of the recrystallized compound can now be verified by nuclear magnetic resonance (NMR) spectroscopy or, if it is a compound with a published melting point, by how similar its melting point is to the literature melting point. If necessary, multiple recrystallizations can be performed until the purity is acceptably high.

Figure 2. 2a) A crude compound (left), 2b) recrystallized product before filtration (middle), and 2c) the same compound after recrystallization (right).
Applications and Summary
Recrystallization is a method of purifying a compound by removing any impurities that might be mixed with it. It works best when the compound is very soluble in a hot solvent, but very insoluble in the cold version of the same solvent. The compound must be a solid at room temperature. Recrystallization is often used as a final clean-up step, after other methods (such as extraction or column chromatography) that are effective at removing larger amounts of impurities, but that do not raise the purity of the final compound to a sufficiently high level.
Recrystallization is the only technique that can produce absolutely pure, perfect single crystals of a compound. These crystals can be used for X-ray analysis, which is the ultimate authority in determining the structure and three-dimensional shape of a molecule. In these cases, the recrystallization is allowed to proceed very slowly, over the course of weeks to months, to allow the crystal lattice to form without the inclusion of any impurities. Special glassware is needed to allow the solvent to evaporate as slowly as possible during this time, or to allow the solvent to very slowly mix with another solvent in which the compound is insoluble (called antisolvent addition).
The pharmaceutical industry also makes heavy use of recrystallization, since it is a means of purification more easily scaled up than column chromatography.3 The importance of recrystallization in industrial applications has triggered educators to emphasize recrystallization in the laboratory curriculum.4 For example, the drug Stavudine, which is used to reduce the effects of HIV, is typically isolated by crystallization.5 Often, molecules have multiple different crystal structures available, so it is necessary for research to evaluate and understand which crystal form is isolated under what conditions, such as cooling rate, solvent composition, and so forth. These different crystal forms might have different biological properties or be absorbed into the body at different rates.
A more common use of recrystallization is in making rock candy. Rock candy is made by dissolving sugar in hot water to the point of saturation. Wooden sticks are placed into the solution and the solution is allowed to cool and evaporate slowly. After several days, large crystals of sugar have grown all over the wooden sticks.
Disclosures
- Mayo, D. W.; Pike, R. M.; Forbes, D. C., Microscale organic laboratory : with multistep and multiscale syntheses. 5th ed.; J. Wiley & Sons: Hoboken, NJ, p xxi, 681 p (2011).
- Armarego, W. L. F.; Chai, C. L. L., Purification of laboratory chemicals. 5th ed.; Butterworth-Heinemann: Amsterdam ; Boston; p xv, 609 p (2003).
- Ray, P. C.; Tummanapalli, J. M. C.; Gorantla, S. R., Process for the large scale production of Stavudine. Google Patents: (2011).
- Hightower, T. R.; Heeren, J. D., Using a Simulated Industrial Setting for the Development of an Improved Solvent System for the Recrystallization of Benzoic Acid: A Student-Centered Project. Journal of Chemical Education 83 (11), 1663 (2006).
- Rohani, S.; Horne, S.; Murthy, K., Control of Product Quality in Batch Crystallization of Pharmaceuticals and Fine Chemicals. Part 1: Design of the Crystallization Process and the Effect of Solvent. Organic Process Research & Development 9 (6), 858-872 (2005).
References
- Mayo, D. W.; Pike, R. M.; Forbes, D. C., Microscale organic laboratory : with multistep and multiscale syntheses. 5th ed.; J. Wiley & Sons: Hoboken, NJ, p xxi, 681 p (2011).
- Armarego, W. L. F.; Chai, C. L. L., Purification of laboratory chemicals. 5th ed.; Butterworth-Heinemann: Amsterdam ; Boston; p xv, 609 p (2003).
- Ray, P. C.; Tummanapalli, J. M. C.; Gorantla, S. R., Process for the large scale production of Stavudine. Google Patents: (2011).
- Hightower, T. R.; Heeren, J. D., Using a Simulated Industrial Setting for the Development of an Improved Solvent System for the Recrystallization of Benzoic Acid: A Student-Centered Project. Journal of Chemical Education 83 (11), 1663 (2006).
- Rohani, S.; Horne, S.; Murthy, K., Control of Product Quality in Batch Crystallization of Pharmaceuticals and Fine Chemicals. Part 1: Design of the Crystallization Process and the Effect of Solvent. Organic Process Research & Development 9 (6), 858-872 (2005).
Transcript
Recrystallization is a purification technique for solid compounds.
To perform recrystallization, an impure solid compound is mixed with hot solvent to form a saturated solution. As this solution cools, the solubility of the compound decreases, and pure crystals grow from solution.
Recrystallization is often used as a final step after other separation methods such as extraction, or column chromatography. Recrystallization may also be used to separate two compounds with very different solubility properties. This video will illustrate solvent selection for recrystallization, purification of an organic compound from solution, and will introduce a few applications in chemistry.
Crystallization begins with nucleation. Solute molecules come together to form a stable small crystal, which is followed by crystal growth. Nucleation occurs faster on nucleation sites such as seed crystals, scratches, or solid impurities than spontaneously in solution. Agitation may also encourage rapid nucleation. However, rapid growth can lead to incorporation of impurities if not grown in optimal conditions.
The solubility of a compound tends to increase with temperature, and is highly dependent on the choice of solvent. The greater the difference in solubility at high and low temperature, the more likely it is for the solute to come out of the solution as it cools, and form crystals.
The solvent chosen should have a boiling point of at least 40 °C so there is a significant temperature difference between boiling and room temperature. The solvent’s boiling point must also be below the melting point of the solute to enable crystallization. Rapid cooling of the solution induces the formation of many nucleation sites, thus favors the growth of many small crystals. However, slow cooling induces the formation of fewer nucleation sites, and favors larger and purer crystals. Thus, slow cooling is preferred.
Additionally, a solvent can be selected to minimize impurities. If a solution impurity is more soluble than the solute itself, it can be washed off of the fully formed crystals with cold solvent. However, if an impurity is less soluble, it will crystalize first, and can then be filtered out of the heated solution, prior to recrystallization of the solute.
If no single solvent has the necessary properties, a mixture of solvents can be used. For a solvent pair, the first solvent should readily dissolve the solid. The second solvent must have a lower solubility for the solute and be miscible with the first solvent. Common solvent pairs include ethyl acetate and hexane, toluene and hexane, methanol and dichloromethane, and water and ethanol.
Now that you understand the principles of recrystallization, let’s go through a procedure for purification of an organic compound by recrystallization.
To begin this procedure, place 50 mg of the sample in a glass test tube.
Add 0.5 mL of room temperature solvent. If the compound dissolves completely, the solubility in the cold solvent is too high to be used for recrystallization. Otherwise, heat the mixture in the test tube to boiling.
If the compound does not dissolve completely in the boiling solvent, heat another portion of solvent to boiling. Add the boiling solvent dropwise to the test tube until the solid dissolves completely or until the test tube contains 3 mL of solvent. If the solid still does not dissolve, then its solubility in this solvent is too low.
Confirm that impurities are either insoluble in the hot solvent so they can be filtered out after dissolution or soluble in the cold solvent so they remain in solution after recrystallization is complete. If a solvent meets all criteria, it is suitable for recrystallization.
To start recrystallization, heat the solvent to boiling on a hot plate in an Erlenmeyer flask with a stir bar. Place the compound to be recrystallized in another Erlenmeyer flask at room temperature.
Next, add a small portion of hot solvent to the compound. Swirl the mixture in the flask and then place it on the hot plate as well. Repeat this process until the sample has completely dissolved or until addition of solvent causes no further dissolution.
Add a 10% excess of hot solvent to the solution to account for evaporation. Place filter paper in a Büchner funnel setup. Filter the solution to remove insoluble impurities. If crystals form during filtration, dissolve them with drops of hot solvent.
Cool the solution on the benchtop. Cover the flask to prevent solvent loss to evaporation and to keep particulates out of the solution.
Leave the flask undisturbed until it has cooled to room temperature. Agitation during cooling may cause rapid crystallization, yielding less pure crystals. If no crystal formation is evident upon cooling, induce crystallization by gently scratching the inside walls of the flask with a glass rod or adding a small seed crystal of the compound being recrystallized.
If crystal formation cannot be induced, reheat the solution to boil off some of the solvent, and then cool the solvent to room temperature once more.
Once crystals have formed, prepare an ice bath. Keeping the solution covered, cool the solution in the ice bath until crystallization appears to be complete.
Clamp a filtration flask to a ring stand and connect the flask to a vacuum line. Set a Büchner funnel and adapter in the mouth of the flask.
Pour the mixture of solution and crystals into the funnel and begin vacuum filtration. Rinse any crystals remaining in the flask into the funnel with cold solvent. Wash the crystals on the funnel with cold solvent to remove soluble impurities.
Continue drawing air through the funnel to dry the crystals and then turn off the vacuum pump. If necessary, the crystals may be allowed to stand at room temperature to air dry or placed in a desiccator before storing the crystallized solid.
The yellow impurities present in the crude compound have been removed, yielding an off-white solid. Based on the identity of the compound and the impurities, the purity of the crystals can be verified by NMR spectroscopy, melting point measurements, or visual inspection.
Purification by recrystallization is an important tool for chemical synthesis and analysis.
X-ray crystallography is a powerful characterization technique that identifies the three-dimensional atomic structure of a molecule. This requires a pure single crystal, which is obtained by recrystallization. Some classes of molecules such as proteins are difficult to crystallize, but their structures are extremely important for understanding their chemical functions. With careful selection of recrystallization conditions, even these classes of molecules can be analyzed by X-ray crystallography. To learn more about this process, see this collection’s video on growing crystals for crystallography.
Impure reactants can cause unwanted side reactions. Purifying reactants by recrystallization improves product purity and yield. Once a solid product has been isolated and washed, reaction yield can also be increased by removing volatiles from the filtrate and recrystallizing the product from the resulting solid. Antifreeze proteins, or AFPs, are expressed in many organisms that live in icy environments. AFPs hinder internal ice growth by binding to ice planes, inhibiting recrystallization into larger ice crystals. Different AFPs bind to different types of ice crystal planes. Investigating AFP binding mechanisms involves adsorbing them onto single ice crystals. Proper growth of a single ice crystal is essential for clear and informative results. These proteins have applications from the engineering of cold-resistant crops to cryosurgery.
You’ve just watched JoVE’s introduction to purifying compounds by recrystallization. You should now be familiar with the principles of the technique, a purification procedure, and some applications of recrystallization in chemistry.
Thanks for watching!
