Overview
Fonte: Tonya J. Webb1
1 Departamento de Microbiologia e Imunologia, Faculdade de Medicina da Universidade de Maryland e o Centro de Câncer Integral Marlene e Stewart Greenebaum, Baltimore, Maryland 21201
ELISPOT é um ensaio padronizado e reprodutível usado para detectar respostas imunes celulares. O ensaio utiliza um ensaio imunossorbente ligado à enzima (ELISA) para detectar respostas imunes unicelulares que podem ser visualizadas por manchas, daí o nome ELISPOT. Elispot foi descrito pela primeira vez em 1983, por Czerkinsky, como um método de enumerar o número de híbridos de células B produzindo imunoglobulinas específicas de antígeno (1). O mesmo grupo desenvolveu o ensaio para medir a frequência de linfócitos T produtores de citocinas. Agora elispot tornou-se um padrão-ouro para medir a imunidade de células T específica de antígeno em ensaios clínicos e candidatos a vacinas. Por exemplo, após a vacinação ou durante uma infecção, células plasmáticas e células B de memória secretam anticorpos que fornecem proteção. Normalmente, essas respostas de células B são avaliadas medindo títulos de soro de anticorpos específicos de antígeno. No entanto, esse tipo de análise, tipicamente medida pela ELISA, pode não incluir células B de memória, que podem estar presentes mesmo na ausência de níveis detectáveis de anticorpos séricos. Além disso, foi bem estabelecido que as células B da memória circulante são importantes para a resposta rápida e protetora de anticorpos observada após a reexposição do patógeno, portanto, é fundamental ser capaz de detectar essas células. Portanto, para avaliar claramente as respostas de células B de memória específicas do antígeno, tanto a ELISA quanto o ELISPOT devem ser utilizados (2).
O ensaio ELISPOT usa uma placa contendo poços forrados de membrana que são revestidos com anticorpos, a fim de capturar proteínas secretas de interesse. Em seguida, a placa é carregada com células e estímulos para induzir a produção de proteínas. As proteínas secretas são capturadas pelos anticorpos revestidos na superfície. Após o tempo de incubação apropriado, as células são removidas e a molécula secretada é detectada usando um anticorpo biotinilado que é específico para um epítope diferente, em comparação com o anticorpo de captura. Em seguida, é adicionado streptavidin peroxidase, seguido pela adição de um substrato que permite a detecção das manchas (Figura 1). A força deste ensaio é que permite quantificar o número de células que produzem a proteína de interesse. É importante avaliar se há mudanças no número total de células que produzem uma proteína específica ou se as células individuais dentro de uma população estão produzindo mais proteína. Além disso, pode fornecer informações sobre cinética e pode ser usado para avaliar a ativação imune global (estimulação mitogótica) em relação às respostas específicas do antígeno (simulação de antígeno). O ensaio ELISPOT permitirá a detecção de uma célula ativada entre 300.000 células após ativação mitogênica ou específica de antígeno.
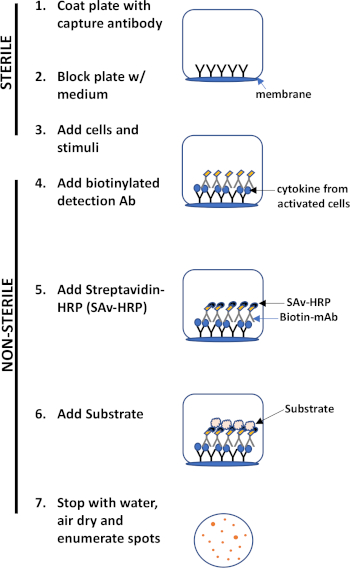
Figura 1: Visão geral do protocolo ELISPOT.
As principais vantagens deste ensaio são suas. Simplicidade- o protocolo é relativamente simples e simples. Não requer perícia técnica, b. Sensibilidade- permite a detecção de células imunes no nível único celular e requer muito poucas células em comparação com outros métodos como citometria de fluxo, c. Funcionalidade- fornece dados quantitativos sobre a função imunológica.
Este exercício de laboratório demonstra o protocolo ELISPOT para detecção de ifn-γ secretando splenócitos, mas como mencionado acima deste ensaio também pode ser usado para avaliar a secreção de anticorpos por células B (3).
Procedure
1. Configuração
Tampões e reagentes
- Salina tamponada de fosfato estéril (PBS) sem cálcio ou magnésio
- Tampão de revestimento- PBS estéril ou tampão de carbonato
- Ensaio diluído- 10% soro bovino fetal (FBS) na PBS
- Cultura celular média- RPMI 1640 com 10% de FBS, penicilina/estreptomicina, & L-glutamina
- Tampão de lavagem- PBS contendo 0,05% Tween20
- Dupla água destilada (ddH2O)
- Substrato de detecção- 100 mg AEC (3-amino-9-etil-carbazole) em 10 mL DMF (N,N, Dimetilformamida).
Equipamento
- Capa de fluxo laminar
- Incubadora umidificada (fixada em 37°C, 5% CO2)
- Leitor ELISPOT automatizado ou microscópio de dissecação
Materiais
- Placas ELISPOT
- Reservatórios estéreis e não tésteres
- Pipettors e dicas
- Pipetas sorológicas estéreis
- Tubos estéreis e cônicos de polipropileno
- Duas garrafas de espremer para lavagem de pratos
Reagentes específicos de ensaio
- Células- células primárias ou linhas celulares (aqui, esplenócitos de C57BL/6 camundongos foram usados)
- Estimulantes- mitogênio ou antígeno (aqui, phorbol 12-myristate 13-acetato (PMA, 50 ng/mL) e ionomicina (1 μM) foram usados)
- Anticorpo primário- biotinilado anti-citocinas detectando anticorpos (diluídos a 2 μg/mL em diluente de ensaio)
- Anticorpo secundário- streptavidin-rabanete peroxidase (SAv-HRP)
2. Procedimento
Revestimento
- Mantendo as condições estéreis e dentro de uma coifa de fluxo laminar, diluir o anticorpo purificado anti-citocina capturar a uma concentração final de 0,5-4,0 μg/mL em tampão de revestimento estéril. (Nota: para IFN- γ e IL-6 use 5 μg/mL).
- Transfira a solução de anticorpos de captura, 100 μL/well, para a placa ELISPOT.
- Cubra a placa com uma tampa de placa e sele-a para evitar a evaporação.
- Incubar a placa durante a noite a 4°C.
Bloqueio
- No dia seguinte, descubra a placa ELISPOT no capô de fluxo laminar. Inverta rapidamente a placa em lenços estéreis para remover a solução de anticorpos de captura de cada poço.
- Em seguida, adicione 200 μL de cultura celular média a cada poço. Esta etapa bloqueará a vinculação não específica durante o ensaio.
- Substitua a tampa da placa e incubar a placa por 2 horas a 37°C.
Células de revestimento e ativação
- Enquanto a placa estiver incubando, prepare uma solução 2X mitogen contendo 50 ng/mL PMA e 1 μM de ionomicina em meio de cultura celular.
- Em seguida, prepare as suspensões celulares de destino para uma concentração de estoque de 2 x 106 células/mL.
- Depois que a incubação estiver completa, remova o meio de cultura celular de cada poço, invertendo rapidamente a placa em lenços estéreis dentro da capa de fluxo laminar.
- Em seguida, gere uma diluição serial 2X da solução de suspensão de células de estoque. Para isso, adicione primeiro 200 μL da solução de estoque de suspensão celular preparada nos poços na linha superior da placa ELISPOT.
- Em seguida, adicione 100 μL de cultura de célula simples ao próximo cinco linhas da placa abaixo das linhas que contêm solução de estoque celular.
- Depois disso, realize uma diluição serial 2X ao pipetar 100 μL da suspensão celular da linha superior para a linha superior diretamente abaixo. Certifique-se de uma mistura adequada, encanar suavemente esta solução para cima e para baixo para garantir a distribuição uniforme das células.
- Repita este processo para as quatro linhas restantes.
- Deixe a sexta fila apenas com o meio de cultura. Servirá como controle experimental.
- Em seguida, adicione 100 μL da solução mitogênio preparada aos poços experimentais das cinco primeiras linhas da placa. Nos poços de controle e na sexta linha, adicione 100 μL da mídia de cultura celular sem mitogênio.
- Substitua a tampa da placa e incuba a placa de 37°C, 5% DE CO2 em uma incubadora por 20-48 horas. (Nota: 20-24 horas é normalmente suficiente para detectar IL-2 e TNF-α, enquanto 48 horas é ideal para IL-4 e IFN-γ).
Detecção
Anticorpo primário
- Prepare o anticorpo biotinína anti-citocina detectador para uma concentração de 2 μg/mL em diluente de ensaio.
- Prepare 20-25 mL de tampão de lavagem neste momento misturando 0,05% Tween-20 em PBS.
- Depois que a incubação estiver completa, desprezam a placa e invertam-na rapidamente sobre uma pia para remover todo o líquido dos poços. (Nota: Após este ponto a placa não precisa mais ser mantida estéril).
- Em seguida, lave a placa adicionando ~200 μL de tampão de lavagem a cada poço. Expulse este líquido invertendo rapidamente e movendo a placa sobre uma pia. Repita este processo para um total de cinco lavagens.
- Em seguida, adicione 100 μL da solução de anticorpos biotiniladas diluídas que detectam anticorpos a cada poço. Incubar em temperatura ambiente por 2 horas em temperatura ambiente ou durante a noite a 4°C.
Anticorpo secundário
- Após a incubação ser concluída, expulse o anticorpo de detecção invertendo e sacudindo a placa sobre a pia.
- Como antes, lave a placa 5 vezes com ~200 μL de tampão de lavagem, expelindo o líquido entre cada lavagem.
- Em seguida, adicione 100 μL de solução de peroxidase de streptavidin-rabanete diluída a cada poço (diluído à sua concentração ideal pré-determinada no diluente do ensaio).
- Substitua a tampa da placa e incubar à temperatura ambiente por 1,5-2 horas a 37°C.
Substrato
- Após a incubação, não mais do que 15 minutos antes do uso, ative primeiro a solução de substrato AEC de acordo com as instruções do fabricante.
- Em seguida, descarte o conteúdo dos poços e lave a placa cinco vezes com tampão de lavagem, como antes.
- Em seguida, adicione imediatamente 100 μL de solução de substrato AEC preparada em cada poço.
- Incubar a placa em temperatura ambiente por ~10-20 minutos enquanto monitora o desenvolvimento do local.
- Pare a reação enxaguando a placa com água e jogando a placa sobre a pia.
- Borrique a placa em toalhas de papel e deixe a placa secar durante a noite ou até que esteja completamente seca. A remoção da bandeja de plástico sob a placa facilitará a secagem.
3. Aquisição e Análise de Dados
- Após a secagem, as manchas estão prontas para serem contadas com um leitor automático de placas. Aqui, o leitor CTL Immunospot é usado, mas este protocolo pode ser adaptado para qualquer leitor.
- Primeiro ligue o instrumento, depois o computador. Em seguida, abra o programa CTL e clique em "contagem de varredura".
- Empurre "ejetar" para que a bandeja se estenda da máquina. Em seguida, remova o adaptador plástico e alinhe a linha "A" na placa e adaptador ELISPOT.
- Escolha um nome de arquivo e localização para que o arquivo seja salvo e carregue a placa na bandeja.
- Em seguida, clique em "carregar" no software e feche a porta na lateral da máquina.
- Pressione "start-after count". Certifique-se de que o arquivo está salvo e, em seguida, abra o software de controle de qualidade "QC" para analisar os dados e contar o número de pontos.
Anotações:
- O número mínimo de células deve ser determinado em experimentos preliminares. O número ideal de pontos é ~50/bem. Se muitas células estiverem carregadas, será difícil detectar pontos distintos. Além disso, as células se sobreporão e não podem formar uma monocamada na membrana, assim o nível de detecção pode ser reduzido.
- Ao otimizar o experimento, considere o nível de expressão esperado da proteína alvo. Quanto menor a expressão, maior o número de células exigidas por poço.
- Ao contrário da ELISA, é melhor lavar a placa à mão em vez de usar uma arruela de placa. As placas ELISPOT são mais delicadas e deve-se evitar perfurar a membrana PVDF.
- Deve-se limitar o movimento da placa durante o período de incubação, pois pode fazer com que as manchas borrem.
- As placas devem ser armazenadas no escuro, pois a exposição à luz direta faz com que as manchas desapareçam.
O Imunospot ligado à enzima, ou ELISPOT, é um método para analisar a resposta imune a um patógeno ou dano celular. Permite quantificar a ativação de diferentes células imunes detectando proteínas específicas que secretam. Por exemplo, o ELISPOT é comumente usado para medir respostas de células T após a exposição a um antígeno estranho, detectando citocinas secretadas.
Para um ensaio ELISPOT baseado em citocinas, o processo começa com o revestimento de uma microplacã ELISPOT com um anticorpo de captura, que é específico para a citocina alvo. Após o revestimento de anticorpos, as células T são adicionadas aos poços e estimuladas por um agente externo, como o anticorpo anti-CD3, por exemplo. As células então secretam a citocina alvo, que imediatamente é imobilizada pelo anticorpo de captura. Uma vez que a proteína é capturada instantaneamente após a secreção de células vivas, sem diluição ou degradação, este ensaio tem uma alta precisão. Depois que a citocina alvo é imobilizada, um anticorpo de detecção é adicionado, que também se liga à citocina capturada.
A técnica ELISPOT também pode ser usada para quantificar as células B da memória após uma infecção ou vacinação, analisando sua produção de anticorpos específicos. Em um ELISPOT baseado em anticorpos, um antígeno específico é usado em vez de um anticorpo para a etapa de captura, onde o antígeno será vinculado à placa, ou na etapa de detecção, onde o antígeno detecta o anticorpo alvo após a captura. Em todas as variações do processo, para células T ou células B, o anticorpo ou antígeno de detecção é biotiningado, o que permite que ele se ligue a uma enzima de detecção conjugada streptavidin, como peroxidase de rabanete. Em seguida, após a adição do substrato da peroxidase, AEC, é produzido um precipitado escuro e insolúvel. Este precipitado marca a localização da proteína capturada, e cada célula secretal resulta em um ponto visível, que pode ser quantificado usando um leitor ELISPOT ou um microscópio. O tamanho das manchas é uma estimativa relativa da quantidade de proteína secretada de cada célula. Este ensaio pode detectar respostas imunes de células únicas, mesmo em subpopulações relativamente pequenas de células secretas, tornando-a útil para estudar respostas imunes no nível celular.
Neste vídeo, você aprenderá como realizar um ensaio ELISPOT e, em seguida, quantificar as manchas que representam as células secretary.
Durante todo o experimento, garanta condições estéreis trabalhando em um capô de fluxo laminar e usando luvas.
Todos os cálculos neste protocolo são baseados no volume necessário para uma placa de 96 poços.
Primeiro, diluir o anticorpo anti-citocinas. Para isso, transfira 10 mililitros de tampão para um tubo cônico de 15 mililitros estéril. Em seguida, use uma pipeta para adicionar 10 microlitradores de um miligrama por mililitro de anticorpo monoclonal ao buffer para criar uma solução com uma concentração final de um micrograma por mililitro. Em seguida, despeje a solução de anticorpos de captura em um reservatório estéril e, usando uma pipeta multicanal, distribua 100 microliters em cada poço de uma placa ELISPOT de 96 poços.
Cubra a placa com uma tampa de placa, sele-a para evitar a evaporação e incuba durante a noite a quatro graus Celsius. No dia seguinte, descubra a placa ELISPOT no capô de fluxo laminar. Inverta rapidamente a placa em lenços estéreis para remover a solução de anticorpos de captura de cada poço. Em seguida, use uma pipeta multicanal para adicionar 200 microliters de meio de cultura celular a cada poço. Esta etapa bloqueará a vinculação não específica durante o ensaio. Substitua a tampa da placa e incuba em uma incubadora de 37 graus Celsius por duas horas.
Enquanto a placa está incubando, prepare uma solução mitogótica 2X adicionando um microlitr de PMA e 20 microliters de ionomicina a 10 mililitros de cultura celular para alcançar uma concentração final de 15 nanogramas por PMA mililitro e uma ionomicina micromolar.
As suspensões celulares de esplenócitos de rato também devem ser preparadas neste momento em um capô estéril. Usando um microscópio e hemótmetro, meça a concentração das células e ajuste o volume total até que uma concentração de estoque de dois milhões de células por mililitro seja atingida.
Depois que a incubação estiver completa, inverta rapidamente a placa em lenços estéreis para remover o meio de cultura celular de cada poço. Em seguida, adicione 200 microliters da solução de estoque de suspensão celular preparada aos poços na linha superior da placa ELISPOT. Configure o experimento em triplicado, de modo que cada tipo de célula testada seja emplacado em um conjunto de três colunas agrupadas. Abaixo disso, adicione 100 microliters de meio de cultura celular simples às próximas cinco linhas da placa, abaixo das linhas que contêm solução de estoque celular.
Em seguida, realize uma diluição serial ao pipetar 100 microliters da suspensão celular da linha superior para a linha diretamente abaixo, encanar suavemente a solução para cima e para baixo para distribuir uniformemente as células. Repita este processo para as linhas restantes, movendo 100 microliters da linha anterior para a linha abaixo em cada etapa, continuando até que a quinta linha tenha sido diluída em série. Deixe a sexta fila apenas com meio de cultura celular, para servir como controle. Para estimular as células nos poços experimentais da placa, adicione 100 microliters da solução mitogênio preparada às suspensões celulares em cada poço de linhas de uma a cinco linhas. Certifique-se de deixar a sexta fila, que servirá como controle, sem estimulação. Substitua a tampa e incuba a placa a 37 graus Celsius e 5% de CO2 por 24 a 48 horas.
Prepare o anticorpo biotinína diluído que detecta anticorpos. Primeiro, prepare 50 mililitros de diluente de ensaio adicionando 5 mililitros de soro bovino fetal de 10% a 45 mililitros de PBS. Em seguida, diluir o anticorpo detectador para uma concentração de 2 microgramas por mililitro no ensaio diluído. Além disso, prepare 20 a 25 mililitros de tampão de lavagem neste momento, misturando 0,05% Tween-20 e PBS.
Depois que a incubação estiver completa, desprezam a placa e invertam-na rapidamente para remover todo o líquido dos poços. Lave a placa adicionando cerca de 200 microliters de tampão de lavagem a cada poço. Expulse este líquido invertendo rapidamente e movendo a placa sobre uma pia. Repita este processo mais quatro vezes para um total de cinco lavagens. Em seguida, adicione 100 microliters da solução de anticorpos de detecção diluída a cada poço, substitua a tampa e incubar à temperatura ambiente por duas horas. Após a incubação, expulse a solução de anticorpos de detecção dos poços da placa invertendo e sacudindo a placa sobre a pia.
Como antes, lave a placa cinco vezes com tampão de lavagem, expelindo o líquido entre cada lavagem. Após a lavagem final, prepare a solução de peroxidase streptavidin-rabanete diluindo-a de acordo com as instruções do fabricante. Em seguida, com os poços da placa vazios, adicione 100 microliters de solução de peroxidase de streptavidin diluído para cada poço. Coloque a tampa de volta na placa e incubar em temperatura ambiente por duas horas.
Após a incubação, não mais do que 15 minutos antes do uso, ative a solução de substrato AEC pré-fabricado. Descarte o conteúdo dos poços e lave a placa cinco vezes com tampão de lavagem, como antes. Em seguida, adicione imediatamente 100 microliters de solução de substrato AEC preparada em cada poço. Deixe a placa em temperatura ambiente para se desenvolver por aproximadamente 10 a 20 minutos, enquanto monitora o desenvolvimento do local. Essas manchas aparecerão como pequenos círculos escurecidos na superfície dos poços. Em seguida, pare a reação enxaguando a placa com água e jogando-a sobre a pia. Borrique a placa em toalhas de papel e deixe secar durante a noite ou até secar completamente. A remoção da bandeja de plástico sob a placa facilitará a secagem. Após a secagem, as manchas estão prontas para serem contadas com um leitor automático de placas.
Aqui, o leitor CTL ImmunoSpot é usado, mas este protocolo pode ser adaptado para qualquer leitor. Em seguida, abra o programa CTL e clique em Contagem de Varredura. Empurre ejetar para que a bandeja se estenda da máquina. Em seguida, remova o adaptador plástico e alinhe a linha A na placa e adaptador ELISPOT. Escolha um nome e localização do arquivo para que o arquivo seja salvo e carregue a placa e o adaptador na bandeja. Clique em Carregar no software e feche a porta na lateral da máquina. Em seguida, pressione Iniciar depois de contar. Certifique-se de que o arquivo seja salvo e, em seguida, abra o software QC de Controle de Qualidade para analisar os dados e contar o número de pontos. Exporte esses dados como um arquivo Excel. Uma vez que a análise esteja concluída, clique em Ejetar para recuperar a placa.
Neste experimento, células de tipo selvagem e camundongos portadores de tumor foram banhadas e analisadas para gama IFN. Observe que o número de manchas diminui com a diminuição da concentração celular. Normalmente, os dados DO ELISPOT são apresentados como o número de contagens pontuais por número de células emplacaram. Neste exemplo, o número de pontos foi exibido em um gráfico de barras, com cada concentração celular respectiva listada no eixo x. Observe que o número de manchas indica o número de células ativadas por número total de células em uma determinada população.
Subscription Required. Please recommend JoVE to your librarian.
Results
Neste ensaio ELISPOT, leucócitos esplênicos de camundongos selvagens e portadores de tumores foram analisados para ifn-γ. A Figura 2 A mostra a imagem visual do resultado do ensaio. Os números na cor verde indicam o número de pontos por poço (TNTC indica "numeroso demais para contar"). Observe que o número de manchas diminui com a diminuição da concentração celular.

Figura 2A: Diminuição das respostas imunes em camundongos portadores de tumores. Clique aqui para ver uma versão maior desta figura.
Normalmente, os dados DO ELISPOT são apresentados como o número de contagens pontuais por número de células emplacaram. Na Figura 2 B o número de pontos é exibido em um gráfico de barras, com cada concentração celular respectiva listada no eixo X. Para fins de grafação, 150 foram utilizados para indicar o número máximo de pontos. O número de ifn-γ produzindo leucócitos esplênicos murinos em animais portadores de tumores é menor do que os do tipo selvagem.

Figura 2B: Diminuição das respostas imunes em camundongos portadores de tumores. Os splenócitos foram colhidos a partir do controle C57BL/6 (tipo selvagem) e camundongos portadores de tumores e estimulados com PMA/ionomicina por 48 horas. Os ensaios ELISPOT foram usados para quantificar o número de leucócitos esplênicos produtores de IFN γ. (A) Representação gráfica visual e (B) dos dados. TNTC indica numerosos demais para contar. Para fins de grafação, 150 foram utilizados para indicar o número máximo de pontos. Os números verdes indicam o número de pontos contados por poço. Os números vermelhos indicam os poços de referência utilizados para determinar quais pontos eram células e quais manchas eram detritos, artefatos ou efeitos de borda e devem ser excluídos da análise.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
O ensaio ELISPOT permite avaliar a ativação de células imunes determinando o número de células que secretam um analito específico. O tamanho e intensidade das manchas fornece informações sobre a quantidade de analito que está sendo produzida por cada célula. O protocolo descrito acima detalhava a detecção de uma única citocina. No entanto, os desenvolvimentos recentes melhoraram a utilidade deste ensaio. Atualmente, pode-se usar corantes fluorescentes de detecção para detectar vários analitos dentro de um poço. Isso permite a detecção de diferentes subpopulações de células segregando um ou ambos analitos.
Subscription Required. Please recommend JoVE to your librarian.
References
- Czerkinsky, C. C., Nilsson, L. A., Nygren, H., Ouchterlony, O., & Tarkowski, A. A solid-phase enzyme-linked immunospot (ELISPOT) assay for enumeration of specific antibody-secreting cells. Journal of Immunological Methods, 65 (1), 109-121(1983).
- Wahid, R., Simon, J. K., Picking, W. L., Kotloff, K. L., Levine, M. M., & Sztein, M. B. Shigella antigen-specific B memory cells are associated with decreased disease severity in subjects challenged with wild-type Shigella flexneri 2a. Clinical Immunology, 148 (1), 35-43 (2013).
- Roberts, T. J., Lin, Y., Spence, P. M., Van Kaer, L., & Brutkiewicz, R. R. CD1d1-dependent control of the magnitude of an acute antiviral immune response. The Journal of Immunology, 172, 3454-3461 (2004).




