Overview
Fonte: Tilde Andersson1, Rolf Lood1
1 Dipartimento di Scienze Cliniche Lund, Divisione di Medicina delle Infezioni, Centro Biomedico, Università di Lund, 221 00 Lund, Svezia
I virus che infettano gli organismi procariotici, chiamati batteriofagi o semplicemente fagi, sono stati identificati all'inizio del 20° secolo da Twort (1) e d'Hérelle (2) indipendentemente. Da allora i fagi sono stati ampiamente riconosciuti per il loro valore terapeutico (3) e la loro influenza sugli ecosistemi umani (4), così come globali (5). Le attuali preoccupazioni hanno alimentato un rinnovato interesse per l'uso dei fagi come alternativa ai moderni antibiotici nel trattamento delle malattie infettive (6). Essenzialmente tutta la ricerca sui fagi si basa sulla capacità di purificare e quantificare i virus, noto anche come titolo virale. Inizialmente descritto nel 1952, questo era lo scopo del test della placca (7). Decenni e molteplici progressi tecnologici dopo, il test della placca rimane uno dei metodi più affidabili per la determinazione del titolo virale (8).
I batteriofagi sopravvivono iniettando il loro materiale genetico nelle cellule ospiti, dirottando i macchinari per la produzione di nuove particelle fagiche e alla fine causando all'ospite di rilasciare numerosi virioni di progenie attraverso la lisi cellulare. A causa delle loro dimensioni ridotte, i batteriofagi non possono essere osservati usando esclusivamente la microscopia ottica; pertanto, è necessaria la microscopia elettronica a scansione (Figura 1). Inoltre, i fagi non possono essere coltivati su piastre di agar nutrizionali come i batteri, poiché hanno bisogno di cellule ospiti per predare.
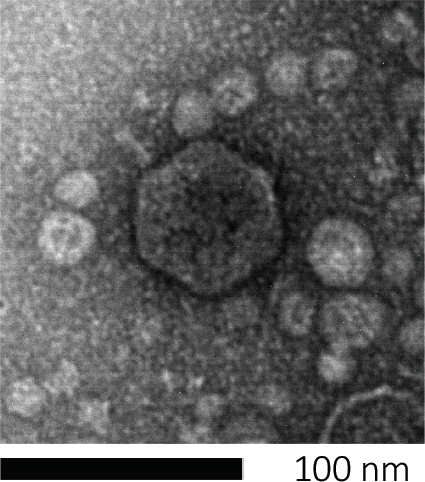
Figura 1: La morfologia di un batteriofago, qui esemplificata da un fago di E. coli, può essere studiata utilizzando la microscopia elettronica a scansione. La maggior parte dei batteriofagi appartiene a Caudovirales (batteriofagi dalla coda). Questo particolare fago ha una struttura della coda molto corta e una testa icosaedrica, collocandolo nella famiglia dei Podovirus.
Il test della placca (Figura 2) si basa sull'incorporazione di cellule ospiti, preferenzialmente in fase logaritmica, nel mezzo. Questo crea uno strato denso e torbido di batteri in grado di sostenere la crescita virale. Un fago isolato può successivamente infettare, replicarsi all'interno e lisi di una cellula. Con ogni cellula lsata, più cellule adiacenti vengono immediatamente infettate. Diversi cicli in, una zona chiara (una placca) possono essere osservati nella piastra altrimenti torbida (Figura 2B / Figura 3A), indicando la presenza di quella che inizialmente era una singola particella batteriofago. Il numero di unità formanti placche per volume(cioè PFU/mL) di un campione, può quindi essere determinato dal numero di placche generate.
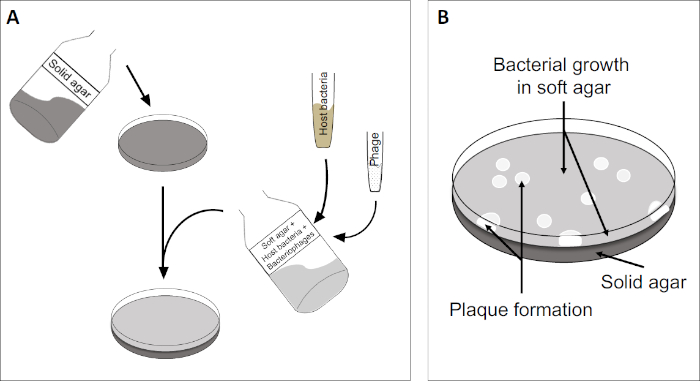
Figura 2: Il test per le unità formanti placche (PFU) è un metodo comune per determinare il numero di batteriofagi in un campione. (A) La base di una capsula di Petri sterile è coperta da un adeguato mezzo nutritivo solido, seguito da una miscela di mezzi molli, cellule ospiti sensibili e una diluizione del campione di batteriofago originale. Si noti che la sospensione dei fagi potrebbe, in alcuni casi, anche essere distribuita uniformemente sulla superficie dell'agar morbido già solidificato. (B) La crescita dei batteri ospiti forma un prato di cellule nello strato superiore di agar. La replicazione dei batteriofagi genera zone chiare, o placche, causate dalla lisi delle cellule ospiti.
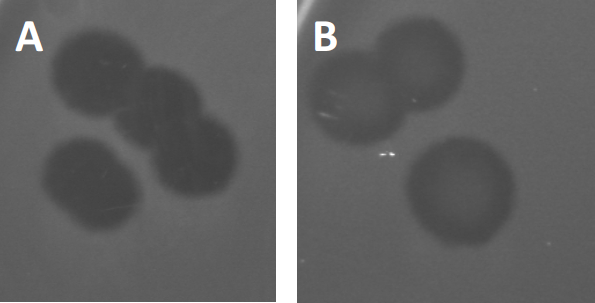
Figura 3: I risultati del test PFU mostrano placche multiple generate da batteriofagi. A causa della lisi delle cellule ospiti sensibili, le placche possono essere viste come zone di pulizia nel prato batterico, sia con (A) clearance completa, sia (B) parziale ricrescita causata dalla generazione di batteri resistenti (o possibilmente da fagi temperati nel ciclo lisogenico).
Alcuni fagi temperati possono adottare quello che viene definito un ciclo di vita litogenico, oltre alla crescita litica precedentemente descritta. Nella lisogenia, il virus assume uno stato latente attraverso l'incorporazione del suo materiale genetico nel genoma della cellula ospite (9), spesso conferendo resistenza a ulteriori infezioni fagiche. Questo a volte si rivela attraverso un leggero annebbiamento della placca (Figura 3B). Vale la pena notare, tuttavia, che le placche possono anche apparire sfocate a causa della ricrescita di batteri che hanno sviluppato resistenza al fago indipendentemente dalle precedenti infezioni dei fagi.
I virus possono attaccarsi, o adsorbire, solo a una gamma limitata di batteri ospiti (10). Gli intervalli dell'ospite sono ulteriormente limitati da strategie antivirali intracellulari come il sistema CRISPR-Cas (11). La resistenza/sensibilità verso specifici fagi mostrati da sottogruppi batterici è stata storicamente utilizzata per classificare i ceppi batterici in diversi tipi di fagi (Figura 4). Sebbene l'efficacia di questo metodo sia stata ora superata da nuove tecniche di sequenziamento, la tipizzazione dei fagi può ancora fornire preziose informazioni sulle interazioni batterio-fago, ad esempio, facilitando la progettazione di un cocktail di fagi per uso clinico.
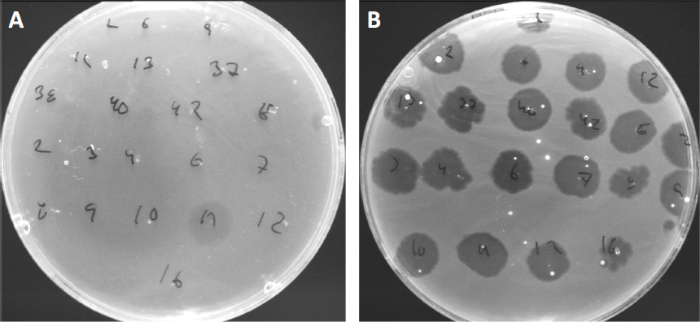
Figura 4: Sensibilità ai fagi di diversi ceppi batterici. Le piastre di agar morbido con Cutibacterium acnes ceppo (A) AD27 e (B) AD35, sono state individuate con 21 diversi batteriofagi di C. acnes. Solo il fago 11 è stato in grado di infettare e uccidere AD27 mentre il ceppo AD35 ha mostrato sensibilità verso tutti i fagi. Questa tecnica, chiamata tipizzazione dei fagi, può essere utilizzata per dividere specie e ceppi batterici in diversi sottogruppi in base alla suscettibilità dei fagi.
Procedure
1. Configurazione
- Prima di iniziare qualsiasi lavoro che coinvolga i microbi, assicurarsi che lo spazio di lavoro sia sterilizzato(ad esempio pulito con etanolo al 70%). Indossare sempre un cappotto da laboratorio e guanti, tenere i capelli lunghi legati all'indietro e assicurarsi che eventuali ferite siano particolarmente ben protette.
- Al termine, sterilizzare tutte le superfici e lavare accuratamente / sterilizzare mani e polsi.
2. Protocollo
- Preparazione LB Media
Nota: A seconda del ceppo batterico dell'ospite e del batteriofago, un mezzo liquido diverso può essere più adatto per la coltura iniziale del ceppo batterico dell'ospite o un mezzo solido diverso può essere più adatto per la crescita successiva. Il brodo di lysogeny (LB) viene utilizzato in questo protocollo per il brodo e l'agar.- Mescolare 4 g di LB in 200 ml di acqua distillata, in triplice copia, per il brodo LB, l'agar fondo solido e l'agar soft top. Tutte le soluzioni devono essere preparate in contenitori in grado di contenere il doppio del volume finale per evitare il trabocco durante l'autoclave.
Nota: Se si esegue il test in triplice copia, preparare il doppio della quantità di agar inferiore LB. - Regolare il pH di tutte e tre le soluzioni a 7,4 utilizzando NaOH o HCl a seconda dei casi.
- Aggiungere 3 g di energia agar alla bottiglia di agar inferiore per creare una soluzione di agar all'1,5% per l'agar solido
- Aggiungere 1,2 g di energia agar alla bottiglia di agar superiore per creare una soluzione di agar allo 0,6% per l'agar morbido.
- Posizionare le bottiglie, con tappi semiserdati, in un'autoclave impostata a 121°C per 20 minuti per sterilizzare le soluzioni. Chiudere i tappi non appena la corsa è terminata per evitare contaminazioni.
- Quando il mezzo LB ha raggiunto una temperatura di circa 45-50°C, aggiungere 450 μL di CaCl 2 sterile da1 M a tutte e tre le soluzioni LB da 200 mL per raggiungere una concentrazione finale di 2,25 mM.
- Versare 15 mL di aliquote del mezzo di agar solido in piastre di Petri sterili (evitare di agitare per evitare la formazione di schiuma) e lasciare che l'agar si solidifichi per alcune ore o durante la notte a temperatura ambiente (Figura 4A). Le piastre possono essere conservate a testa in giù a 4°C per diversi giorni.
- Mescolare 4 g di LB in 200 ml di acqua distillata, in triplice copia, per il brodo LB, l'agar fondo solido e l'agar soft top. Tutte le soluzioni devono essere preparate in contenitori in grado di contenere il doppio del volume finale per evitare il trabocco durante l'autoclave.
- Coltivazione di cellule ospiti
- Un giorno prima del test, aggiungere 10 μL di coltura di E. coli a 10 ml di brodo LB.
- Incubare i batteri a 37°C durante la notte a 160 giri/min in un incubatore vibrante.
- La mattina del test, aggiungere 0,5 ml di coltura notturna a 10 ml di LB fresco.
Nota: Se si esegue il test in triplice copia, preparare il doppio della quantità di questa cultura. - Incubare il a 37 ° C a 160 giri / min in un incubatore vibrante fino a quando la coltura batterica è in fase di crescita logaritmica. Questo può essere determinato spettrofotometricamente da un OD600 di 0,5-0,7.
- Mantenere la coltura a temperatura ambiente fino a quando i batteri non devono essere aggiunti all'agar LB superiore.
- Diluizione seriale 10 volte del batteriofago
- Aggiungere 180μL di brodo LB a sette pozzetti nella prima fila di un piatto da 96 pozzetti
Nota: Si consiglia di eseguire la diluizione in triplice copia al fine di aumentarne l'affidabilità statistica. Per fare questo, preparare ulteriori diluizioni del batteriofago nella seconda e terza fila della piastra. - Vortice con attenzione il campione di batteriofago originale per garantire l'omogeneità e trasferire 20 μL nel primo pozzo.
- Mescolare bene il campione pipettando e verso il basso.
- Trasferire 20 μL della sospensione risultante nel secondo pozzo.
- Continuare la diluizione seriale trasferendo 20 μL della soluzione nel secondo pozzo nel terzo pozzo, e così via, fino al sesto pozzo, lasciando il settimo pozzo come controllo negativo a cui non verrà aggiunta alcuna sospensione fagica. Ciò creerà un intervallo di diluizione di 10-1-10-6.
- Aggiungere 180μL di brodo LB a sette pozzetti nella prima fila di un piatto da 96 pozzetti
- Placcatura
- Etichettare la base delle piastre di Petri (precedentemente preparate al punto 2.1.7) con nome, data e una breve descrizione del campione (incluso il fattore di diluizione del campione di fagi). Preriscaldarsi delle piastre di Petri in incubatrice a 37°C un'ora prima del test.
- Sciogliere l'agar-medium morbido solidificato (in genere fatto usando un forno a microonde; l'agar solidificato fonde a 85 ° C) e lasciarlo arrivare a circa 45 ° C. Il mezzo riscaldato può essere posto in un bagno d'acqua a 45 ° C per ~ 1 ora per raggiungere una temperatura appropriata. Dovrebbe essere abbastanza caldo da rimanere in forma liquida, ma abbastanza freddo da non uccidere i batteri aggiunti.
- Mescolare 4 mL di coltura batterica (dal punto 2.2) con 35 mL lb di agar morbido (a 45°C). Ruotare per distribuire uniformemente le cellule ma evitare di scuotere per evitare la formazione di schiuma (Figura 4A).
- Etichettare una provetta sterile per ciascuna delle fasi di diluizione seriale e una per il campione di controllo, per un totale di 7 provette etichettate. Inserire 5 mL aliquote della coltura batterica/miscela di agar molle dal punto 2.4.3 nei 7 tubi. Lavora rapidamente attraverso il passaggio 2.4.6 perché volumi così piccoli di supporti a base di agar si solidificheranno rapidamente a temperatura ambiente.
- Aggiungere 100 μL del campione di controllo (dal punto 2.3) alla provetta di controllo e ruotare con attenzione. Scartare la punta della pipetta utilizzata e trasferire lo stesso volume da ciascuno dei campioni di batteriofago diluiti in serie (fase 2.3) alle rispettive provette, ruotando per mescolare.
- Trasferire immediatamente le miscele da 5 ml sulle piastre di agar solido, preriscaldato, etichettate (Figura 4A). Ruotare delicatamente i piatti per stendere anche le miscele.
Nota: Se si esegue il test in triplice copia, ripetere i passaggi 2.4.3-6 altre due volte. - Sigillare ogni piastra con pellicola da laboratorio e lasciare che entrambi gli strati si solidifichino correttamente a temperatura ambiente (circa 15 minuti) prima di posizionarli a testa in giù in un incubatore a 37 ° C, stimolando la crescita sia dei batteri che del fago, per 24 ore o fino a quando non si sviluppano placche, in genere ci vogliono circa 1-5 giorni perché appaiano le placche (Figura 4B), ma i tempi variano considerevolmente a seconda delle condizioni di incubazione, del mezzo e delle specie batteriche.
3. Analisi dei dati e risultati
-
Conteggio delle placche
- Assicurarsi che non siano visibili placche nelle piastre contrassegnate come "controllo", in quanto ciò indicherebbe una contaminazione virale.
- Inizia con le piastre etichettate 10-6, contenenti il campione di batteriofago più diluito. Conta le placche senza togliere il coperchio, contrassegnandole con una penna mentre vai a indicare quali placche sono già state contate.
- Conta i piatti rimanenti. Alcuni piatti possono avere troppo poche o troppe placche da contare. Utilizzare le piastre con 10-150 placche per ulteriori analisi.
-
Calcolo della PFU
- Dividere il numero di placche per il fattore di diluizione (es. 10-6 per il campione più diluito) per raggiungere il numero di unità formanti placche (PFU) in 100 μL di miscela fagica.
Nota: Se si esegue il test in triplice copia, utilizzare il numero medio di placche dalle tre piastre. - Per determinare la concentrazione (in PFU/mL) del campione originale, moltiplicare per un fattore di diluizione aggiuntivo di 10, poiché sono stati placcati solo 100 μL di campione. (vale
 a)
a) - Calcola il valore medio del PFU/mL per tutte le diluizioni che avevano tra 10 e 150 placche per ottenere un risultato più affidabile.
- Dividere il numero di placche per il fattore di diluizione (es. 10-6 per il campione più diluito) per raggiungere il numero di unità formanti placche (PFU) in 100 μL di miscela fagica.
I batteriofagi, chiamati anche fagi, sono virus che infettano specificamente i batteri e possiamo confermare la loro presenza e quantificarli utilizzando uno strumento chiamato test della placca. I batteriofagi infettano i loro ospiti sensibili attaccandosi prima alla parete cellulare batterica e iniettando il loro materiale genetico. Quindi, dirottano il macchinario biosintetico della cellula per replicare il loro DNA e produrre numerose particelle fagiche di progenie, che poi rilasciano lysing e uccidendo la cellula ospite.
Questa attività titica è alla base di una tecnica di enumerazione dei fagi ampiamente utilizzata nota come test della placca o test del doppio strato di agar. Qui, una miscela di batteriofagi viene prima preparata in un brodo di nutrienti fusi contenente agar a bassa concentrazione. Tutti i batteri utilizzati nel mix dovrebbero essere vivi e dividersi attivamente nella fase di log della loro crescita, il che garantirà che una grande percentuale dei batteri sia vitale e in grado di formare un prato denso attorno alle placche. Successivamente, questa miscela di agar batterico-fagico fuso viene distribuita su un mezzo nutritivo agar più solido e concentrato che è già solidificato su una capsula di Petri. All'incubazione a temperatura ambiente, anche il brodo agar-fagi-batteri a bassa concentrazione si solidifica per formare una morbida sovrapposizione di agar.
Qui, le cellule batteriche possono derivare nutrienti aggiuntivi dallo strato inferiore e dovrebbero moltiplicarsi rapidamente per produrre un prato confluente di batteri. Tuttavia, poiché le particelle fagiche sono presenti anche nello strato morbido, queste infettano e replicano il loro materiale genetico all'interno dei batteri, culminando nella lisi cellulare, che rilascia più progenie. Questi fagi progenie infettano quindi le cellule vicine, poiché lo stato semi-solido dello strato batterio-fago limita il loro movimento a cellule ospiti più lontane. Questo ciclo di infezione e lisi continua su più cicli, uccidendo un gran numero di batteri in un'area localizzata. L'effetto delle cellule vicine che vengono distrutte, è quello di produrre una singola zona circolare chiara, chiamata placca, che può essere vista ad occhio nudo, amplificando efficacemente l'attività litica batterica del fago e consentendo la loro enumerazione.
Il numero di placche su una capsula di Petri è indicato come unità formanti placche o PTU e, a condizione che la concentrazione iniziale di batteriofago fosse sufficientemente diluita, dovrebbe corrispondere direttamente al numero di particelle fagiche infettive nel campione originale. Questa tecnica può anche essere utilizzata per la caratterizzazione della morfologia della placca, per aiutare nell'identificazione dei tipi di fagi o per isolare i mutanti dei fagi. In questo laboratorio, imparerai come eseguire il test della placca per enumerare i fagi, usando il fago T7 di E. coli come esempio.
In primo luogo, identificare un mezzo adatto per la coltura delle cellule batteriche ospiti e del batteriofago. Qui il brodo di lasogenia, o mezzo LB, è stato usato per la coltura di E. coli e del fago T7. Quindi, prendi tre bottiglie di vetro pulite ed etichettale con media, nome, e poi la prima come LB-Broth, la seconda come LB-Bottom Agar e la terza come LB-Top Agar. Ora, pesare quattro grammi di polvere LB pre-formulata in tre serie e quindi trasferire un set di mezzi secchi pesati in ogni bottiglia. Aggiungere 200 millilitri di acqua alla prima bottiglia. Mescolare il contenuto utilizzando una barra magnetica.
Quindi, utilizzando un pHmetro e mescolando costantemente, portare il pH finale a 7,4 attraverso l'aggiunta di idrossido di sodio o acido cloridrico. Ripetere l'aggiunta di acqua e la regolazione del pH anche per le altre due bottiglie rimanenti. Ora, pesa tre grammi di polvere di agar e aggiungilo alla seconda bottiglia per fare un agar inferiore all'1,5%. Infine, pesare 1. 2 grammi di agar e aggiungerlo alla terza bottiglia per fare l'agar superiore .6 % LB. La condizione di brodo in bottiglia non ha bisogno di un'aggiunta di agar. Tappare il flacone semi-saldamente e quindi sterilizzare il supporto mediante autoclave a 121 gradi Celsius per 20 minuti. Una volta completato, rimuovere le bottiglie di supporto dall'autoclave e ruotare immediatamente i tappi della bottiglia per chiuderli completamente per evitare contaminazioni. Tenere i supporti LB-Broth e LB-Top Agar sul banco per un uso successivo. Posizionare l'LB-Bottom Agar per raffreddare a bagnomaria preimpostato a circa 45 gradi Celsius.
Quando l'agar LB-Bottom raggiunge circa 45 gradi Celsius, trasferirlo sul banco di lavoro. Quindi, sterilizzare lo spazio di lavoro utilizzando il 70% di etenolo. Quindi, aggiungere 450 microlitri di cloruro di calcio molare sterile all'agar fondo fuso per creare una concentrazione finale di 2,25 millimolari. Ruotare delicatamente la bottiglia per mescolare. Quindi, prepara sette piastre di Petri pulite. Etichettare ogni piatto sul fondo con il nome del supporto e la data di preparazione. Quindi, versare 15 millilitri dell'agar inferiore in ciascuna delle sette piastre di Petri. Lasciare impostare le piastre per alcune ore o durante la notte a temperatura ambiente. Una volta impostate, le piastre di coltura possono essere conservate a quattro gradi Celsius per diversi giorni, se necessario, capovolte per ridurre al minimo la condensa. Trasferire le piastre di Petri dal frigorifero a quattro gradi Celsius a un incubatore a 37 gradi Celsius un'ora prima del test.
Il giorno prima che il test sia preformato, l'E. coli deve essere coltivato. Qui, 10 microlitri della coltura di E. coli sono stati inoculati in 10 millilitri di LB-Broth. Posizionare i batteri per crescere durante la notte in un incubatore vibrante impostato a 37 gradi Celsius a 160 RPM. Quindi, il giorno del test, rimuovere la coltura batterica dall'incubatrice. Semina un fresco 10 millilitri di brodo LB fresco con 0,5 millilitri della coltura notturna. Posiziona queste cellule per crescere in un incubatore vibrante impostato a 37 gradi Celsius a 160 RPM. Quindi, utilizzare uno spettrofotometro per verificare quando questa coltura raggiunge la crescita della fase logaritmica, indicata da una densità ottica da 0,5 a 0,7. Una volta che l'OD raggiunge questo livello, interrompere l'incubazione trasferendo la coltura cellulare al banco. Ora sono pronti per essere utilizzati per il test di sovrapposizione dei fagi.
I titoli dei fagi possono variare esponenzialmente tra diversi tipi di fagi e campioni. Quindi, per contarli in modo efficace, dovrebbero essere diluiti per generare una vasta gamma di concentrazioni di fagi. Il giorno del test, generare una serie di diluizioni fagitiche che vanno da un decimo a un milionesimo di concentrazione, seguendo una tecnica di diluizione 10 volte. Per ottenere dati statisticamente significativi e accurati, eseguire la diluizione seriale in triplice copia.
Quindi, sciogliere l'agar LB-top solidificato usando un forno a microonde. Quindi, metterlo in un bagno d'acqua preimpostato a 45 gradi Celsius per un'ora. Dopo un'ora, raccogliere le piastre di Petri contenenti lo strato inferiore di agar dall'incubatrice. Etichettare le piastre con la concentrazione dei fagi e la data del test. Quindi, impostare sette provette pulite. Etichettare ogni provetta con il numero di diluizione seriale dei fagi e designarne una come controllo.
Quando l'agar LB-top raggiunge i 45 gradi Celsius, trasferirlo sul banco di lavoro. Ora, aggiungi 450 microlitri di un cloruro di calcio molare all'agar da 200 millilitri per creare una concentrazione finale di 2,25 millimolari. Ruotare delicatamente la bottiglia per mescolare. Quindi, aggiungere 35 millilitri di agar LB-top e quattro millilitri di sospensione batterica a un tubo conico sterile. Ruotare delicatamente per distribuire uniformemente le cellule, ma evitare di scuotere per evitare la formazione di schiuma.
Ora, aliquot cinque millilitri di questo batterio- top agar mix a ciascuna delle sette provette. Quindi, trasferire 100 microlitri dei campioni di batteriofagi diluiti in serie e dei mezzi di controllo, che dovrebbero essere semplicemente mezzi senza batteriofago, alle provette rispettosamente etichettate. Ruotare delicatamente il composto per garantire una corretta miscelazione. Trasferire delicatamente cinque millilitri di miscela di batteriofagi sulla rispettiva piastra di Petri. Distribuire uniformemente la miscela su tutta la superficie ruotando delicatamente la piastra di Petri.
Una volta che tutte le piastre di Petri sono stratificate con la miscela, consentire la solidificazione dello strato superiore incubando a temperatura ambiente per 15 minuti. Dopo aver completato questi passaggi, ripetere il processo per il secondo e poi il terzo set delle piastre di Petri utilizzando i restanti due set di diluizioni fagiche. Sigillare ogni piatto con parafilm e incubare a temperatura ambiente per 15 minuti. Posizionare la piastra di coltura capovolta a una temperatura adeguata per 24 ore o fino a quando non si sviluppano placche. Qui, le piastre sono state poste in un incubatore a 37 gradi Celsius per un giorno, una condizione di crescita stimolante per E. coli e il fago T7.
Le placche appariranno dopo uno o cinque giorni di incubazione, a seconda delle specie batteriche, delle condizioni di incubazione e della scelta del mezzo. Qui, le placche erano visibili dopo un giorno di incubazione a 37 gradi Celsius. Inizia controllando il controllo delle piastre contrassegnate e assicurati che non si siano formate placche in queste piastre, poiché ciò indicherebbe una contaminazione virale. Per determinare il titolo dei fagi nel campione originale, iniziare con le piastre contenenti prima il campione di fagi più diluito e contare le placche senza rimuovere le palpebre, contrassegnandole per indicare quali sono già state contate. Ripetere il conteggio per ogni piatto in ogni set. Alcune piastre potrebbero avere troppe o troppo poche placche per essere contate. Considera da 10 a 150 come un conteggio ideale della placca.
Quindi, generare una tabella che elenca i valori del numero di placca per le diverse diluizioni e repliche. Quindi, calcolare i valori medi del numero di placca per le piastre di diluizione che contenevano il numero ideale di conteggi di placca. In questo esempio, questi erano il numero medio di placche formate tra 10 e meno tre e 10 per le piastre di diluizione meno quattro. Ora, aggiustare per il fattore di diluizione dei fagi dividendo i valori medi della placca ottenuti per i rispettivi fattori di diluizione dei fagi. Qui, il numero medio di placche formate da 10 a meno tre e da 10 a meno quattro piastre di diluizione, sono state divise per i rispettivi fattori di diluizione per ottenere il numero di unità formanti placche, o PDU, in 100 microlitri di miscela di fagi. Per convertire il valore in PFU per millilitro, moltiplicare i valori generati per 10, poiché solo 100 microlitri di miscela di diluizione dei fagi sono stati utilizzati durante la fase di preparazione della sovrapposizione di batteriofagi, producendo un fattore di diluizione aggiuntivo di 10. Infine, calcolare la media dei valori ottenuti dalle diverse piastre di diluizione. Questo darà il numero medio di PPU per millilitro. Il numero di PPU corrisponde al numero di particelle di fagi infettivi nel campione originale.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
Nonostante i molteplici progressi tecnologici, i saggi della placca rimangono il gold standard per la determinazione del titolo virale (come PFU) ed essenziali per l'isolamento delle popolazioni di batteriofagi puri. Le cellule ospiti sensibili vengono coltivate nel rivestimento superiore di una piastra di agar a due strati, formando un letto omogeneo che consente la replicazione virale. L'evento iniziale in cui un batteriofago isolato nel ciclo di vita della lirica infetta una cellula, si replica al suo interno e alla fine la lisi è troppo piccolo per essere osservato. Tuttavia, i virioni rilasciati infetteranno le cellule adiacenti, dando successivamente origine a una zona di compensazione, o placca, che denota la presenza di una singola PFU.
Subscription Required. Please recommend JoVE to your librarian.
References
- Twort, F. An investigation on the nature of ultra-microscopic viruses. Lancet. 186 (4814): 1241-1243. (1915)
- d'Hérelle, F. An invisible antagonist microbe of dysentery bacillus. Comptes Rendus Hebdomadaires Des Seances De L Academie Des Sciences. 165: 373-375. (1917)
- Cisek AA, Dąbrowska I, Gregorczyk KP, Wyżewski Z. Phage Therapy in Bacterial Infections Treatment: One Hundred Years After the Discovery of Bacteriophages. Current Microbiology. 74 (2):277-283. (2017)
- Mirzaei MK, Maurice CF. Ménage à trois in the human gut: interactions between host, bacteria and phages. Nature Reviews Microbiology. 15 (7):397. (2017)
- Breitbart M, Bonnain C, Malki K, Sawaya NA. Phage puppet masters of the marine microbial realm. Nature Microbiology. 3 (7):754-766. (2018)
- Leung CY, Weitz JS. Modeling the synergistic elimination of bacteria by phage and the innate immune system. Journal of Theoretical Biology. 429:241-252. (2017)
- Dulbecco R. Production of Plaques in Monolayer Tissue Cultures by Single Particles of an Animal Virus. Proceedings of the National Academy of Sciences of the United States of America. 38 (8):747-752. (1952)
- Juarez D, Long KC, Aguilar P, Kochel TJ, Halsey ES. Assessment of plaque assay methods for alphaviruses. J Virol Methods. 187 (1):185-9. (2013)
- Clokie MRJ, Millard AD, Letarov AV, Heaphy S. 2011. Phages in nature. Bacteriophage. 1 (1):31-45. (2011)
- Moldovan R, Chapman-McQuiston E, Wu XL. On kinetics of phage adsorption. Biophys J. 93 (1):303-15. (2007)
- Garneau JE, Dupuis M-È, Villion M, Romero DA, Barrangou R, Boyaval P, Fremaux C, Horvath P, Magadán AH, Moineau S.. The CRISPR/Cas bacterial immune system cleaves bacteriophage and plasmid DNA. Nature. 468 (7320):67. (2010)





 a)
a)