Overview
출처: 알렉산더 S. 골드1, 토냐 M. 콜핏스1
1 미생물학학과, 보스턴 대학교 의과대학, 국립 신흥 감염 질병 연구소, 보스턴, MA
1946년 Lederberg와 테이텀에 의해 처음 발견된, 결합은 두 개의 세균세포(1)의 직접적인 물리적 접촉에 의존하는 박테리아 간의 수평 유전자 전달의 한 형태이다. 변형 이나 트랜스포션과 같은 다른 형태의 유전자 전달과 달리, 컨쥬게이션은 DNA가 기증자 세포에서 단방향 방식으로 받는 세포로 분비되는 자연발생 적인 과정입니다. 이러한 방향성 및 박테리아의 유전적 다양성을 증가시키는 이 과정에 대한 능력은 최근 항생제 내성 박테리아(2, 3)의 상승에 크게 기여한 것으로 여겨지는 세균성 "짝짓기"의 한 형태로 명성을 얻었습니다. 선택적 압력을 이용하여, 예를 들어 항생제의 사용, 결합은 실험실 환경에서 사용하기 위해 조작되어 박테리아 간의 수평 유전자 전달을 위한 강력한 도구이며, 어떤 경우에는 박테리아에서 효모, 식물 및 동물 세포(4)로 균계로 이동한다. 실험실에서 응용 프로그램 외에도, 균-진핵생물 유전자 전달 은 가능한 생체 공학 응용 및 자연 발생 의미 (5)의 무리와 DNA 전송의 흥미로운 경로입니다.
컨쥬게이션은 "2단계 메커니즘"(6)에 의해 작동하도록 생각됩니다. 첫째, 어떤 DNA든지 전송될 수 있기 전에, 기증자 세포는 수령인과 직접 세포 대 세포 접촉을 해야 합니다. 이 과정은 그람 음성 박테리아에서 가장 잘 특징지어졌으며, 가장 많이 연구된 것은 대장균이다. 세포-세포 접촉은 F(불임) 인자(7, 8)로 알려진 전달 가능한 유전자에 의해 인코딩된 유도체인 성필루스로 알려진 기증자에 세포외 필라멘트의 복잡한 네트워크의 존재에 의해 확립된다. 기증자와 수령인 간의 접촉을 확립하는 것 외에도, 여러 단백질은 성필루스를 통해 받는 자 세포질로 이송되어 두 세포 사이에 형 IV 분비 시스템(T4SS) 도관을 형성하며, 2차 컨쥬게이션, DNA 전달(6)에 필요한 구조이다. 성필루의 이러한 기능을 DNA의 롤링 원 복제와 결합함으로써, 기증자 세포는 플라스미드 또는 트랜스포슨과 같은 형질전환 가능한 요소의 형태로 DNA를 "촬영 및 펌프" 모델(6)에 의해 받는 사람에게 전달할 수 있다. 이 경우, "사격"은 시험 단백질의 수송이며, 연결된 DNA를 가진, T4SS에 의해 수신자 세포로, 그리고 "펌핑"은 수신자에게 DNA의 활성 수송, T4SSS에 의존하는 과정및 결합 단백질(6)에 의해 촉매된다. 이 과정에 사용되는 기계는 시스 및 트랜스 유전자의 DNA에 의해 제공되어야 하는 전사 서열(oriT)의 기원으로 구성되며, 이는 이완제, 짝짝 쌍 형성 복합체 및 타입 IV 커플링 단백질을 인코딩하고 시스 또는 트랜스(9)에 존재할 수 있다. 이 릴렉스아제는 오리T 서열 내에서 닉 사이트를 갈라놓고 다른 보조 단백질 (9)과 함께 단일 가닥 DNA 이완제 복합체인 이완을 생성하기 위해 전달된 가닥의 5'말에 공유적으로 부착합니다. 일단 형성되면, 이완성은 T4SS (10)에 의해 수신자 세포로 ssDNA-relaxase 복합체의 전송을 허용하는 타입 IV 커플링 단백질을 통해 결합 쌍 형성 복합체에 연결합니다. 일단 수령인의 세포질에서, DNA는 수신자 게놈으로 통합하거나 그것의 유전자의 발현을 허용하는 플라스미드의 양식에서 별도로 존재할 수 있습니다.
본 실험에서, 널리 사용되는 유도균 균주 대장균 WM3064는 수취인균 균주 E. coli J53에 ampicillin 내성을 위한 유전자 인코딩을 전송하는 데 사용되었다. 그람 음성 박테리아의 두 변종은 테트라사이클린에 저항하는 동안, 만 기증자 균주 WM3064는 ampicillin 저항을 위한 유전자를 가지고, pWD2-oriT 셔틀 벡터에 대한 인코딩, 및 diaminopimelic 산 (DAP)에 보조 trophic이었다 (11-13). 본 실험은 두 가지 주요 단계, 기증자 및 수령인 균주의 제제, 유도체에서 양수로 암피실린 저항 유전자의 전송으로 구성하였다(도 1).
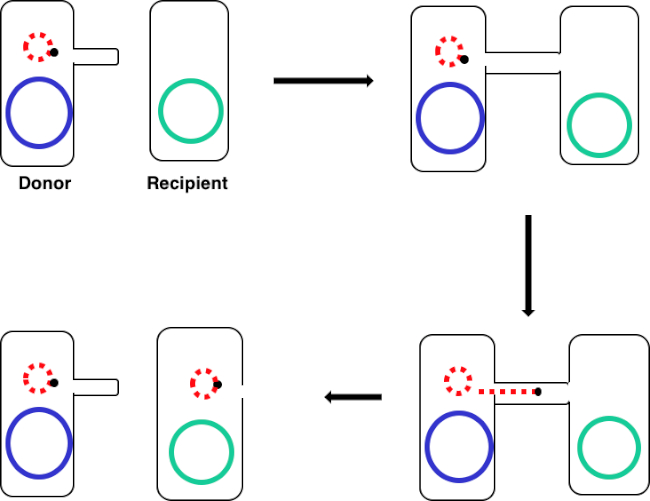
그림 1: 컨쥬게이션 회로도. 이 회로도는 골치를 이용한 기증자 세포에서 수신자 세포로 의한 전형 가능한 DNA 요소의 단 하나의 예인 플라스미드의 성공적인 전달을 보여줍니다. 성별 필러스를 통해 기증자 세포에 의해 받는 사람 세포와 접촉하면, 플라스미드는 롤링 원 복제에 의해 복제되고, 두 세포에 결합하는 다단백 복합체를 통해 이동하고, 받는 사람 세포에 새로운 전체 길이 플라스미드를 형성한다.
기증자와 수령인 세포의 혼합물을 배양함으로써 테트라사이클린과 DAP의 존재속에서 이러한 세포를 연속적으로 도금함으로써, 이것은 암피실린 저항 유전자의 성공적인 전달을 허용했다. 테트라사이클린과 암피실린이 존재하여 이 혼합물에서 자라는 세포는, 증폭균 저항 유전자를 얻지 못했을 수 있는 DAP 및 수신자 세포의 부족으로 인해 모든 기증자 세포를 제거하여 암피실린 저항성을 획득한 J53 균주 균을 엄격하게 산출하였다(도 2). 일단 수행되면, 암피실린 저항 유전자의 성공적인 전송은 PCR에 의해 확인되었다. 인쥬게이션이 성공했기 때문에 대장균의 J53 균주는 pWD2-oriT를 함유하고 암피실린에 내성이 있었으며, 이러한 저항을 위한 유전자 인코딩은 PCR에 의해 검출될 수 있다. 그러나, 성공하지 못하면 암피실린 저항 유전자의 검출이 없었을 것이고 암피실린은 여전히 J53 균주에 대한 효과적인 항생제로 기능할 것이다.
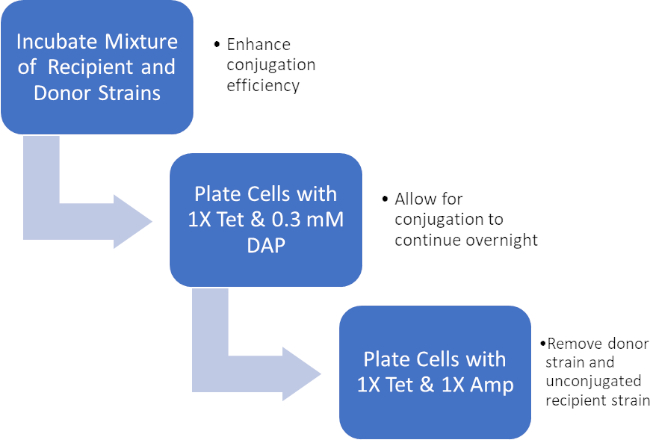
그림 2: 프로토콜 회로도. 이 회로도는 제시된 프로토콜에 대한 개요를 보여 주어 있습니다.
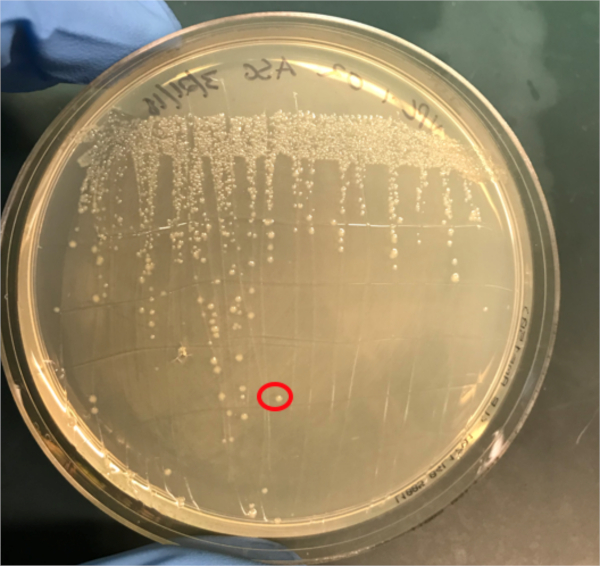
그림 3A: PCR에 의한 성공적인 컨쥬게이션의 확인. A) 컨쥬게이트 및 음극식 샘플의 냉동고 주식이 천판에 줄지어 서 있었고, DNA 절연을 위해 콜로니가 선택되었다(빨강).
Procedure
1. 셋업
- 루리아-베르타니 매체(LB)의 약 1L 오토클레이브. 이 멸균 LB는 0.3 mM 디아미미노피멜산(DAP)을 함유한 LB약 5mL를 만드는 데 사용될 것이다.
- 1X Tet와 0.3mM DAP의 LB 한천 플레이트, 1X Tet만 있는 LB 한천 플레이트, 1X Amp/Tet만 있는 LB 한천 플레이트.
- 일부 글리세롤과 미리 멸균된 플라스틱 파이펫 팁 상자가 가까이 있는지 확인하십시오.
- 미생물과 관련된 작업을 시작하기 전에 70 %의 에탄올로 작업 공간을 살균하십시오. 항상 실험실 코트와 장갑을 포함하여 필요한 개인 보호 장비를 착용하십시오.
- 완성되면 모든 표면과 장갑을 70% 에탄올로 살균하고 손을 씻으실 수 있습니다.
2. 기증자 및 수령인 균주 준비
- 기증자와 수령인 균주의 5mL 세균 배양을 준비하고 37 °C에서 하룻밤 동안 증가시키고 220 rpm에서 흔들어. 기증자 균주는 0.3 mM DAP와 LB에서 성장해야합니다.
- 두 배양물 1mL(~3000rpm 5분)를 회전시키고 PBS로 셀을 세척합니다.
- 인산염 완충식식염(PBS)의 500μL에서 세포를 재연한다.
3. 컨쥬게이션
- 수신자 세포의 50 μL과 기증자 세포의 50 μL을 마이크로 원심 분리기 튜브에 결합하고 파이펫팅하여 혼합합니다.
- 세포 혼합물을 37°C에서 1시간 동안 배양한다. 이렇게 하면 다음 도금 단계 전과 도중 컨쥬게이션의 효율성을 향상시킬 수 있습니다.
- 1X Tet 및 0.3 mM DAP를 가진 천접시에 셀 혼합물의 파이프 100 μL. 접시에 퍼지지 마십시오.
- 1X Tet 및 0.3 mM DAP를 가진 한천 판에 받는 세포 배양의 파이프 100 μL. 접시에 퍼지지 마십시오.
- 37 °C에서 하룻밤 동안 두 플레이트를 배양합니다.
- 멸균 세포 스크레이퍼로 결합 세포 혼합물 및 받는 사람 세포 배양을 긁어냅니다. 세포를 멸균 미세 원심분리기 튜브로 옮기고 PBS의 1mL에서 세포를 재연한다.
- 세포를 소용돌이시키고 부드럽게 아래로 회전 (~ 3000 rpm 5 분).
- PBS의 1 mL에서 세포를 다시 중단합니다.
- 1X Amp/Tet만으로 LB 천판에 접합 반응 세포 혼합물을 플레이트. 이 플레이트에서, 성공적으로 컨쥬게이션을 통해 Amp 저항 유전자를 얻은 수신자 박테리아만이 증가할 것으로 예상된다.
- 수신자 셀을 1X Tet만 으로 LB 한천 플레이트에 플레이트합니다. 이 플레이트에서는 Amp 저항 유전자가 없는 수렴되지 않은 받는 사람 박테리아만이 증가할 것으로 예상됩니다.
- 플레이트를 37°C에서 하룻밤 동안 배양합니다.
- 플레이트 에서 단일 콜로니를 선택하고 5mL의 미디어 (220 rpm에서 폭이있는 37 °C)에서 하룻밤 문화를 성장시키는 데 사용합니다.
4. DNA 격리
- DNA 미니프렙에 의한 총 배양량의 4.5mL를 사용하여 이전에 준비된 배양으로부터 DNA를 분리한다.
- 이렇게하려면, 뉴클레아제없는 물의 35 μL을 사용하여 DNA를 엘테.
- 순수 DNA는 약 1.8의 흡광도 비(A260/280)를생성합니다.
- 세균 배양1:1 혼합물과 100% 글리세롤을 만들어 글리세롤 주식을 준비하기 위해 각 배양의 나머지 0.5 mL을 사용하십시오.
- 냉동고 재고를 -80 °C에 보관하십시오.
5. PCR에 의한 플라스미드 전송 컨쥬게이션 확인
- 두 개의 PCR 마스터 믹스를 준비, 앞으로 및 역 프라이머의 다른 세트와 각각, 하나는 암피실린 저항 유전자 내의 500 베이스 쌍 세그먼트를 대상으로하고 다른 가사 유전자 내에서 세그먼트를 대상으로.
- 가사 유전자 프라이머는 DNA 자이라제 B (14)에 대한 인코딩 세균 유전자 내의 DNA 세그먼트를 증폭하도록 설계되었습니다.
- 다음 시약 볼륨은 각 마스터 믹스의 90 μL을 준비하는 데 사용되었습니다.
7.5 μL 10 μM 포워드 프라이머
7.5 μL 10 μM 역 프라이머
2X PCR 마스터 믹스75 μL
- 15 μL 마스터 믹스, 템플릿 DNA의 10 ng 및 25 μL의 최종 부피까지 핵세없는 물을 사용하여 다음 6 개의 PCR 반응을 준비하십시오.
컨쥬게이션 반응 DNA 및 암피실린 프라이머
컨쥬게이션 반응 DNA 및 하우스키핑 프라이머
네거티브 컨트롤 DNA 및 암피실린 프라이머
네거티브 컨트롤 DNA 및 하우스키핑 프라이머
DNA 및 암피실린 프라이머 없음
DNA 및 하우스키핑 프라이머 없음 - 이러한 반응을 98C로 예열된 블록을 PCR 기계로 전송하고 다음 조건에서 열순환을 시작합니다.
98°C 30초
5-10초 동안 98°C의 25-35사이클, 10~30초 동안 45-72°C, KB당 15-30초 동안 72°C
5-10분 동안 72°C
4°C에서 유지 - 6개의 PCR 반응을 모두 1% 아가로즈 젤에 적재하고 ~150V에서 약 20분간 실행합니다.
- UV 조명을 사용하여 PC 제품을 시각화합니다.
대장균과같은 세균성 세포는 세포에서 세포로 유전 정보를 전송할 수 있다. 컨쥬게이션은 세포 간의 물리적 접촉이 필요하다는 점에서 트랜스듀션 또는 변형과 같은 DNA 전달의 다른 메커니즘과 다릅니다.
진행하려면, 융합은 불임, 또는 F, 요인 및 그것 없이 받는 세포, F 마이너스 세포를 표현하는 기증자 세포가 필요합니다. 이 프로세스에는 두 단계가 필요합니다. 첫 번째는 직접 세포 대 세포 접촉의 확립입니다. 이렇게 하기 위해, 기증자 세포 세포 는 성 필러스에게 불린 세포 외 필라멘트 구조물을 생성합니다. 그것은 연상 이 성적으로 재생 박테리아에 대 한 짝짓기의 형태 이기 때문에 이 이름, 하지만 그것은 어떤 게임 교환 하 고 어떤 자손 형성 으로 그것은 진정한 성적 재생 되지 않습니다 주목 한다.
두 번째 단계는 받는 사람에게 DNA를 전달하는 것입니다. 성 필루스가 두 세포 사이의 접촉을 확립 한 후, 타입 IV 분비 시스템이라는 도관은 DNA의 전송을 허용내장된다. 기증자 세포는 그 때 OriT 또는 전송의 기원으로 알려져 있는 유전 요소의 존재에 따라 선택될 외염색체 DNA를 복제하기 시작합니다. 새로 복제된 DNA의 한쪽 끝은 DNA 단백질 결합을 통해 도관으로 나사로 연결됩니다. DNA가 더 복제됨에 따라, OriT에 가까운 유전자에 의해 인코딩된 단백질의 복합체에 의해 촉진되는 채널을 통해 펌핑된다. DNA가 완전히 전달되면, 그것은 여분의 염색체 플라스미드를 형성하거나 받는 사람의 염색체에 통합 될 수 있습니다. 전송된 DNA의 끝점은 어느 쪽이든, 암호화하는 유전자는 그 때 표현될 것입니다. 이러한 유전자 발현은 성공적인 연상을 확인하기 위해 사용될 수 있다.
예를 들어, 기증자 균주가 암피실린 내성을 발현하고 컨쥬게이드 된 DNA에서 이를 수신자 박테리아로 전달하는 시나리오를 고려하지만, 받는 사람 균주는 또한 기증자에 존재하지 않는 테트라사이클린 저항 유전자를 갖는다. 이 경우, 세포가 테트라사이클린과 암피실린을 모두 포함하는 LB 매체에 도금될 때, 식민지는 성공적으로 공주된 박테리아에서만 성장해야 하며, 이는 두 가지 저항 표현형을 모두 표현할 것이다. 성공적인 컨쥬게이션을 더욱 확인하기 위해, 이들 식민지로부터의 플라스미드 DNA를 수확한 다음, 이송된 플라스미드에 특이적인 DNA의 단면을 폴리머라제 연쇄 반응 또는 PCR을 사용하여 증폭될 수 있다. PCR 제품이 표준 크기의 사다리와 함께 전기 전구 젤에서 실행되면 알려진 크기의 PCR 단편이 젤에 표시되어 성공적인 컨쥬게이션을 확인해야합니다. 본 실험에서, 플라스미드는 기증자 균주에서 테트라사이클린 내성 받는 사람 균주로 컨쥬레이션을 통해 암피실린 저항 유전자를 전송하는 데 사용될 것이다. 그 후, 유도를 확인하기 위해, 유도 혼합물은 변형된 박테리아만 떠나는 두 항생제를 포함하는 접시에 배양될 것이다. 마지막으로, 성공적인 컨쥬게이션은 PCR을 통해 더욱 확인될 것입니다.
절차를 시작하기 전에 실험실 코트와 장갑을 포함한 적절한 개인 보호 장비를 착용하십시오. 다음으로, 70% 에탄올을 사용하여 작업 공간을 살균하여 표면을 닦아냅니다.
이 절차에서, 암피실린 저항 유전자는 균주를 통해 대장균의 J53 균주에 대장균의 WM3064 균주에서 전달될 것이다. 기증자 균주 WM3064는 테트라사이클린과 암피실린에 내성이 있으며, 다이미노피멜산 또는 DAP가 필요합니다. 받는 사람 변형 J53은 테트라사이클린에만 내성이 있으며 DAP가 성장할 필요는 없습니다. 이것은 성공적으로 공주한 세포가 테트라사이클린과 암피실린에 저항해야 하며 DAP 없이 성장할 수 있다는 것을 의미합니다.
냉동 기증자 균주 글리세롤 주식의 스크랩과 DAP의 0.3 밀리몰을 포함하는 LB의 5 밀리리터를 접종하여 기증자 균주 문화를 준비. 이어서, 냉동 받는 사람 균주 글리세롤 재고의 스크랩과 DAP없이 LB 국물의 5 밀리리터를 접종하여 받는 사람 균주를 준비한다. 이 문화를 밤새 섭씨 37도에서 성장시키고 흔들리는 인큐베이터에서 220 RPM에서 기화와 흔들림을 제공합니다. 문화가 2의 OD 600로 성장하면, 각각에서 문화의 1 밀리리터를 제거하고 두 개의 새로운 별도의 1.5 밀리리터 미세 원심 분리 튜브에 배치합니다. 그런 다음, 이러한 알리쿼트3000 RPM에서 세균 세포를 펠릿하는 5분 동안 원심분리. 1X PBS 250 마이크로리터로 상류제를 버리고 각 펠릿을 세척합니다. 원심 분리시 시료를 다시 제거하고, 상류체를 폐기한 후, PBS의 500 마이크로리터에서 각 펠릿을 재연한다.
컨쥬게이션 절차를 시작하려면 먼저 1.5 밀리리터 미세 센심 분리튜브에 기증자 세포의 50 마이크로리터와 수신자 세포의 50 마이크로리터를 결합하고 부드럽게 위아래로 파이펫팅하여 혼합합니다. 다음으로, 수신자 세포 배양의 파이펫 100 마이크로리터는 DAP를 포함하는 또 다른 1X 테트라사이클린 플레이트에. 다음으로, 받는 세포 배양의 100마이크로리터를 DAP를 포함하는 비선택적 한천 판에만 배관하여 음의 제어를 준비한다. 그런 다음, 37섭씨에서 하룻밤 동안 컨쥬게이션과 음의 대조판을 배양한다.
다음 날, 식민지를 수집하여 균주 판에서 멸균 세포 스크레이퍼와 수확 세포를 가져 가라. 이어서, 1X PBS의 1밀리리터를 포함하는 멸균 1.5 밀리리터 미세원심분리기 튜브로 콜로니를 이송한다. 이 과정을 반복하여 다른 플레이트에서 받는 셀을 수집합니다.
그 후 샘플을 혼합합니다. 혼합 후 튜브를 원심분리기로 옮겨 세포를 부드럽게 펠릿합니다. 상체를 버리고, PBS의 1 밀리리터에 세포 펠릿을 씻고 세포를 재보편하기 위해 튜브를 소용돌이시다. 원심분리로 세포를 다시 펠렛. 상체를 다시 버리고 PBS의 1 밀리리터에서 두 세포 펠릿을 다시 중단하십시오. 이제 멸균 파이펫 팁을 사용하여 1X 테트라사이클린과 1X 암피실린을 함유하지 않은 LB 천판에 접합 반응 세포 혼합물의 플레이트 100 마이크로리터를 사용한다. 1X 테트라사이클린과 1X 암피실린을 함유하지 않고 PBS에서 동일한 세포 혼합물의 10배 희석제 100마이크로리터를 다른 LB 한천 판에 사용하여 도금 방법을 반복한다.
마지막으로, 1X 테트라사이클린만으로 단일 LB 한 천 판에 네거티브 대조군 세포 혼합물의 파이펫 100 마이크로리터. 섭씨 37도에서 하룻밤 잠복 후 식민지를 볼 수 있어야합니다. 멸균 파이펫 팁을 사용하여, 컨쥬게이션 반응 플레이트에서 단일 콜로니를 선택하고 두 항생제를 포함하는 선택적 LB 매체의 5 밀리리터를 포함하는 튜브에 추가한다. 이어서, 받는 세포판으로부터 단일 콜로니를 선택하여 콜로니 절연을 반복한다. 220 RPM에서 폭기와 함께 섭씨 37도에서 하룻밤 사이에 이러한 문화를 성장시다.
다음 날, 70 % 에탄올로 벤치 상단을 닦고 인큐베이터에서 플레이트를 제거합니다. DNA 미니 준비 키트를 사용하여 DNA를 4에서 격리시합니다. 제조업체의 지침에 따라 각 문화의 5 밀리리터. DNA 미니 준비를 마친 후, 35마이크로리터의 뉴클레아제 없는 물을 사용하여 DNA를 엘테한다. 마지막으로 나머지 0을 사용합니다. 각 배양의 밀리리터는 1대 1 희석을 위해 100% 글리세롤의 0.5 밀리리터를 첨가하여 1밀리리터 글리세롤 주식을 준비합니다. 필요할 때까지 보관을 위해 이 알리코를 영하 80도에 놓습니다.
PCR의 성공적인 컨쥬게이션을 확인하기 위해 먼저 마이크로센심분리기 튜브에 2X PCR 마스터 믹스 75마이크로리터를 추가하여 PCR 마스터 믹스를 준비합니다. 이어서, 플라스미드로부터 암피실린 저항 유전자를 증폭하도록 설계된 10마이크로몰러 포워드 프라이머와 10마이크로몰러 역프라이머 각각 7.5 마이크로리터를 첨가한다. 다음으로, 2X PCR 마스터 믹스 75마이크로리터를 마이크로센티르후지 튜브에 첨가한 다음, 10마이크로몰러 포워드 프라이머와 10마이크로몰러 역프라이머 각각 7.5 마이크로리터를 첨가하여 두 번째 PCR 마스터 믹스를 준비하여 가사 유전자를 증폭하도록 설계된 10마이크로몰러 역프라이머를 증액하여 DNA gyrase B를 준비한다.
이제 첫 번째 마스터 믹스의 15 마이크로 리터를 PCR 튜브에 추가한 다음 템플릿 실험 DNA의 약 2 개의 마이크로 리터인 10 나노 그램을 동일한 튜브에 추가합니다. 핵이 없는 물을 가진 25마이크로리터의 최종 부피까지 반응을 가져옵니다. 튜브에 여기에 표시된 구성 요소를 포함하도록 나머지 5개의 반응을 생성하기 위해 이러한 단계를 반복합니다. 이제 이러한 반응을 온도 온도 98도로 예열된 블록이 있는 열순환기로 전송한 다음 프로그램을 시작합니다. PCR이 완료된 후 기기에서 튜브를 제거합니다. 그런 다음 각 반응의 마이크로리터 2개와 분자량 마커 4개의 마이크로리터를 1% 아가로즈 젤의 연속 우물로 혼합하여 로드합니다. 젤을 150볼트에서 20분간 실행하도록 설정합니다. 마지막으로, UV 조명을 사용하여 젤을 시각화합니다.
본 실험에서, 마우스를 통한 암피실린 저항 유전자의 성공적인 전달은 PCR을 통해 확인되었다. 여기서, 약 500개의 염기 쌍 크기의 대역은 공자 DNA 및 암피실린 프라이머를 포함하는 우물에서 관찰되어야 하며, 이 예에서는 잘 두 개있다. 가사 유전자, DNA gyrase B는 각각 결합된 DNA및 수령인 세포 DNA를 가진 우물 3그리고 5에 로드되었습니다. 이러한 우물에서 관찰된 밴드는 DNA 템플릿이 존재하고 PCR이 성공적임을 보장하기 위한 긍정적인 제어 역할을 합니다. 대역은 수신자 세포 DNA 및 암피실린 프라이머 쌍에 대한 반응을 포함하는 웰에서 관찰되어서는 안되며, 이 예에서는 잘 4개의 수취인 세포가 암피실린 내성이 없기 때문이다. 또한, 템플릿 DNA가 부족한 반응에서 어떤 밴드도 관찰되어서는 안되며, 여기서 는 6개와 7개의 밴드가 관찰되어야 합니다. 이러한 조건이 충족되면, 이는 대장균의J53 균주에 대장균의 WM3064 균주로부터 암피실린 저항을 부여하는 암피실린 저항 유전자의 성공적인 전송을 확인할 것이다.
Subscription Required. Please recommend JoVE to your librarian.
Results
컨쥬게이션이 성공하면 PCR 반응 1(도 3B의 #2)이 로드된 웰에서 500개의 베이스 페어 크기의 밴드 PCR 제품이 관찰될 것이며, PCR 반응 3이 로드된 우물에서 는 밴드가 관찰되지 않습니다(그림 3B에서 잘 #4). 이 밴드의 존재는 암피실린 저항 유전자의 성공적인 전달을 확인하여 대장균의 J53 균주에 대한 암피실린 내성을 부여한다.

그림 3B: PCR에 의한 성공적인 컨쥬게이션의 확인. B) PCR 분석은 선택된 식민지로부터 분리된 DNA를 사용하여 수행하였다. 각 웰의 내용은 다음과 같습니다 : 1) DNA 사다리, 2) 컨쥬게이션 DNA 및 암피실린 프라이머, 3) 컨쥬게이션 DNA 및 하우스 키핑 프라이머, 4) 네거티브 컨트롤 DNA 및 암피실린 프라이머, 5) 네거티브 컨트롤 DNA 및 하우스키핑 프라이머, 6) DNA 및 암피실린 프라이머, 그리고 7) DNA 및 부정 조절제. PCR 반응 1(웰 2)으로부터 ~ 500개의 베이스 페어 밴드 PCR 제품의 존재와 PCR 반응 3(웰 4)로부터 이 제품의 부재는 성공적인 컨쥬게이션을 확인한다.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
컨쥬게이션은 기증자 세포 및 수령세포의 직접적인 세포 대 세포 접촉에 의존하는 수평 유전자 전달의 자연발생 적인 과정이다. 이 과정은 박테리아의 모든 종류 사이에서 공유 하 고 세균성 진화에 중요 한 되었습니다., 특히 항생 저항. 실험실에서, 유도는 다른 기술에 비해 훨씬 덜 파괴적인 유전자 전송의 효과적인 방법으로 사용될 수있다. 실험실 밖에서, 박테리아에서 진핵생물에 DNA를 전송하는 기능은 유전자 치료의 흥미로운 새로운 길을 제공하고 이러한 자연 발생 유전자 전송의 의미를 이해하는, 예를 들어 세균 감염과 암 사이의 관계는 연구의 급속하게 신흥 영역입니다.
Subscription Required. Please recommend JoVE to your librarian.
References
- Lederberg J, Tatum, E.L. Gene recombination in Escherichia coli Nature. 1946;158:558.
- Holmes R.K. J, M.G. Genetics: Exchange of Genetic Information. 4th Edition ed. Baron S, editor. Galveston, TX: University of Texas Medical Branch at Galveston; 1996.
- Cruz F, Davies, J. Horizontal gene transfer and the origin of species: lessons from bacteria. Trends in Microbiology. 2000;8:128-33.
- Llosa M, Cruz, F. Bacterial conjugation: a potential tool for genomic engineering. Ressearch in Microbiology. 2005;156:1-6.
- Lacroix B, Citovsky, V. Transfer of DNA from Bacteria to Eukaryotes. mBio. 2016;7(4):1-9.
- Llosa M, et al. Bacterial conjugation: a two-step mechanism for
- DNA transport. Molecular Microbiology. 2002;45:1-8.
- Grohmann E, Muth, G., Espinosa, M. Conjugative Plasmid Transfer in Gram-Positive Bacteria. Microbiology and Molecular Biology Reviews. 2003;67:277-301.
- Firth N, Ippen-Ihler, K, Skurray, RA. Structure and function of the F factor and mechanism of conjugation. Escherichia coli and salmonella: cellular and molecular biology. 1996;2:2377-401.
- Smillie C, Garcillan-Barcia MP, Francia MV, Rocha EPC, De La Cruz F. Mobility of Plasmids. Microbiology and Molecular Biology Reviews. 2010;74(3):434-52.
- Cascales E. Definition of a Bacterial Type IV Secretion Pathway for a DNA Substrate. 2004;304(5674):1170-3.
- Wang P, Yu Z, Li B, Cai X, Zeng Z, Chen X, et al. Development of an efficient conjugation-based genetic manipulation system for Pseudoalteromonas. Microbial Cell Factories. 2015;14(1):11.
- Yi H, Cho YJ, Yong D, Chun J. Genome Sequence of Escherichia coli J53, a Reference Strain for Genetic Studies. Journal of Bacteriology. 2012;194(14):3742-3.
- Baumann RLB, E. H.; Wiseman, J. S.; Vaal, M.; Nichols, J. S. Inhibition of Escherichia coli Growth and Diaminopimelic Acid Epimerase by 3-Chlorodiaminopimelic Acid. Antimicrobial Agents and Chemotherapy 1988;32:1119-23.
- Rocha D, Santos, CS, Pacheco LG. Bacterial reference genes for gene expression studies by RT-qPCR: survey and analysis. Antonie Van Leeuwenhoek. 2015;108:685-93.




