Overview
מקור: אלכסנדר ס. גולד1, טוניה מ. קולפיטס1
1 המחלקה למיקרוביולוגיה, בית הספר לרפואה של אוניברסיטת בוסטון, המעבדות הלאומיות למחלות זיהומים מתעוררות, בוסטון, תואר שני
ההטיה, שהתגלתה לראשונה על ידי לדרברג וטאטום בשנת 1946, היא צורה של העברת גנים אופקית בין חיידקים הנשענת על מגע פיזי ישיר בין שני תאים חיידקיים (1). שלא כמו צורות אחרות של העברת גנים, כגון טרנספורמציה או טרנסדוקציה, הטיות הוא תהליך טבעי שבו דנ"א מופרש מתא תורם לתא נמען באופן חד-כיווני. כיווניות זו והיכולת של תהליך זה להגדיל את המגוון הגנטי של חיידקים העניקו להטיה את המוניטין כצורה של "הזדווגות" חיידקית, אשר ככל הנראה תרמה רבות לעלייה האחרונה בחיידקים עמידים לאנטיביוטיקה (2, 3). על ידי שימוש בלחצים סלקטיביים, למשל השימוש באנטיביוטיקה, ההטיה עברה מניפולציה לשימוש בסביבת המעבדה, מה שהופך אותה לכלי רב עוצמה להעברת גנים אופקית בין חיידקים, ובמקרים מסוימים מחיידקים ועד שמרים, צמחים ותאי בעלי חיים (4). מלבד יישומים במעבדה, העברת גנים חיידק-אאוקריוטה על ידי הטיות היא שדרה מרגשת של העברת DNA עם שפע של יישומים ביוטכנולוגיה אפשריים והשלכות טבעיות (5).
ההטיות נחשבות לפעולה על ידי "מנגנון דו-שלבי" (6). ראשית, לפני שניתן יהיה להעביר דנ"א כלשהו, על התא התורם ליצור קשר ישיר בין התא לתא עם הנמען. תהליך זה מאופיין בצורה הטובה ביותר בחיידקים גרם שלילי, הנחקר ביותר שבהם הוא Escherichia coli. קשר בין תא לתא נוצר על ידי נוכחות של רשת מורכבת של חוטים חוץ תאיים על התורם המכונה pilus המין, אלמנט הצמדי מקודד על ידי הגן להעברה המכונה F (פוריות) גורם (7, 8). בנוסף ליצירת קשר בין התורם לנמען, מספר חלבונים מועברים באמצעות פילוס המין לציטופלזמה של הנמען, ויוצרים צינור הפרשת סוג IV (T4SS) בין שני התאים, מבנה הכרחי לשלב השני של ההטיה, העברת DNA (6). על ידי שילוב פונקציה זו של פילוס המין עם שכפול מעגל מתגלגל של DNA, התא התורם מסוגל להעביר DNA בצורה של אלמנט ניתן להעברה, כגון plasmid או transposon, לנמען על ידי מודל "לירות ולשאוב" (6). במקרה זה, "הירי" הוא הובלת חלבון הפיילוט, עם DNA מקושר, על ידי T4SS לתא הנמען, ואת "שאיבה" הוא ההובלה הפעילה של DNA לנמען, תהליך הנשען על T4SS ומזרז על ידי חלבוני צימוד (6). המכונות המשמשות בתהליך זה מורכבות ממקור של רצף העברה (oriT), אשר חייב להיות מסופק על ידי ה- DNA בגנים cis ו trans, אשר מקודדים relaxase, קומפלקס היווצרות זוג בן זוג, סוג חלבון צימוד IV, והוא יכול להיות נוכח cis או טרנס (9). רגיעה זו מצמידה את אתר ה-nic בתוך רצף ה-OriT ומתחברת באופן קוולנטי לקצה ה-5' של הגדיל המועבר כדי לייצר את ה-relaxosome, קומפלקס דנ"א-relaxase חד-גדילי עם חלבוני עזר אחרים (9). לאחר שנוצר, relaxosome מתחבר קומפלקס היווצרות זוג הזדווגות, באמצעות סוג חלבון צימוד IV, המאפשר העברה של קומפלקס ssDNA-relaxase לתאי הנמען על ידי T4SS (10). פעם אחת בציטופלסמה של הנמען, ה- DNA יכול להשתלב בגנום המטופל או להתקיים בנפרד בצורה של פלסמיד, שכל אחד מהם מאפשר ביטוי של הגנים שלה.
בניסוי זה, זן תורם ההטיה הנפוץ E. coli WM3064 שימש להעברת קידוד הגן להתנגדות אמפיצלין לזן הנמען E. coli J53. בעוד ששני הזנים של החיידקים גרם שלילי היו עמידים טטרציקלין, רק זן התורם WM3064 היה הגן להתנגדות אמפיצלין, מקודד בווקטור המעבורת pWD2-oriT, והיה auxotrophic לחומצה diaminopimelic (DAP) (11-13). ניסוי זה כלל שני שלבים עיקריים, הכנת זנים של תורמים ומקבלים, ולאחר מכן העברת הגן עמידות אמפיצלין מתורם למקבל על ידי הטיות (איור 1).
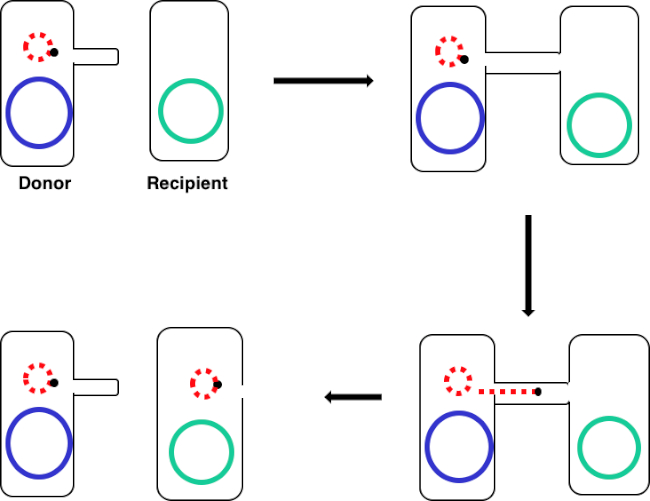
איור 1: שרטוט ההטיה. סכמטי זה מציג את ההעברה המוצלחת של פלסמיד, רק דוגמה אחת של רכיב DNA הניתן להעברה, מתא תורם לתא נמען באמצעות הטיות. לאחר מגע עם תא הנמען על ידי תא התורם באמצעות פילוס המין, הפלסמיד משכפל על ידי שכפול מעגל מתגלגל, עובר דרך קומפלקס הרב-פרוטיין המצטרף לשני התאים ויוצר פלסמיד חדש באורך מלא בתא הנמען.
על ידי דגירה של תאים תורמים ונמענים, ולאחר מכן ברצף ציפוי תאים אלה בנוכחות טטרציקלין ו- DAP, זה איפשר העברה מוצלחת של הגן עמידות אמפיצלין. תאי ציפוי רצופים שגדלו מתערובת זו בנוכחות טטרציקלין ואמפצילין, הסירו את כל התאים התורמים בשל היעדר DAP וכל תאי הנמען שאולי לא השיגו את הגן עמידות אמפיצלין, הניבו חיידקי זן J53 שקיבלו עמידות בפני אמפיצ'ין (איור 2). לאחר ביצוע, ההעברה המוצלחת של הגן עמידות אמפצילין אושרה על ידי PCR. מאז ההטיה הצליחה, זן J53 של E. coli הכיל pWD2-oriT והיה עמיד בפני אמפיצלין, ואת קידוד הגן עבור התנגדות זו ניתן לזהות על ידי PCR. עם זאת, אם לא הצליח לא היה זיהוי של הגן עמידות אמפצילין אמפצילין עדיין לתפקד כאנטיביוטיקה יעילה נגד זן J53.
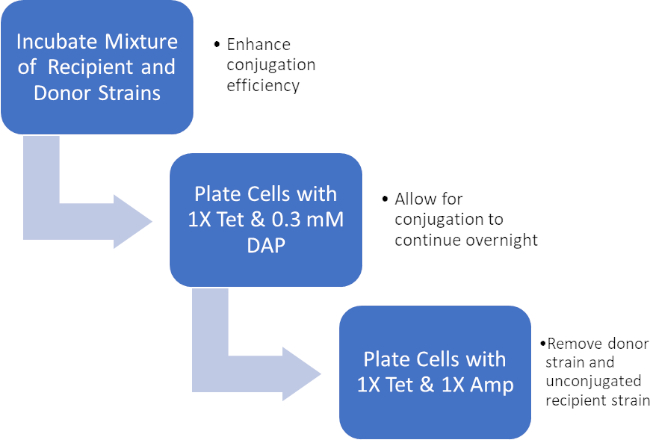
איור 2: שרטוט פרוטוקול. סכמטי זה מציג מבט כולל על הפרוטוקול המוצג.
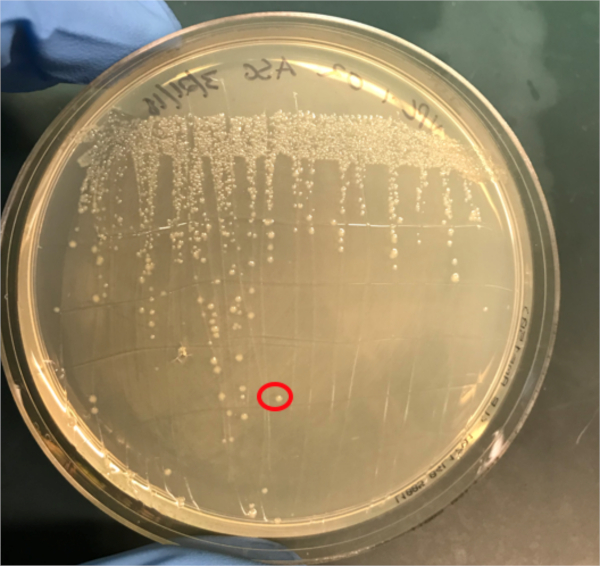
איור 3א: אישור ההטיות המוצלחות על ידי PCR. א) מלאי המקפיא של דגימות השליטה הצומדות והשליליות הושלכו על לוחות אגר ונבחרה מושבה (אדומה) לבידוד DNA.
Procedure
1. הגדרת
- Autoclave כ 1L של לוריא-ברטאני בינוני (LB). זה סטרילי LB ישמש כדי להפוך כ 5 מ"ל של LB המכיל 0.3 mM חומצה diaminopimelic (DAP).
- לאסוף את הצלחות הבאות: צלחות אגר LB עם 1X טט ו 0.3 mM DAP, צלחות אגר LB עם 1X טט בלבד, ו צלחות אגר LB עם 1X Amp / Tet בלבד.
- ודא כי כמה גליצרל וקופסה של טיפים פיפטה פלסטיק מעוקר מראש נמצאים בהישג יד.
- לפני תחילת כל עבודה מעורבים חיידקים, לחטא את סביבת העבודה עם 70% אתנול. תמיד ללבוש את ציוד המגן האישי הדרוש, כולל חלוק מעבדה וכפפות.
- לאחר סיום, לחטא את כל המשטחים והכפפות עם 70% אתנול ולשטוף ידיים.
2. הכנת מאמץ תורם ומקבל
- הכן תרביות חיידקיות 5 מ"ל של זנים התורם והנמען ולגדל אותם לילה ב 37 °C עם aeration ורעד ב 220 סל"ד. זן התורם צריך להיות גדל LB עם 0.3 mM DAP.
- ספין למטה 1 מ"ל של שתי תרביות (~ 3000 סל"ד במשך 5 דקות) ולשטוף את התאים עם PBS.
- resuspend התאים 500 μL של תמיסת מלח חוצץ פוספט (PBS).
3. הטיות
- שלב 50 μL של תאים נמענים עם 50 μL של תאים תורמים בצינור microcentrifuge לערבב על ידי pipetting.
- לדגור על תערובת התא במשך 1 שעה ב 37 °C (50 °F). זה ישפר את היעילות של הטיות לפני ובמהלכו של שלב ה ציפוי הבא.
- Pipet 100 μL של תערובת התא על צלחת אגר עם 1X טט ו 0.3 mM DAP. אין למרוח על הצלחת.
- Pipet 100 μL של תרבית תא הנמען על צלחת אגר עם 1X טט ו 0.3 mM DAP. אין למרוח על הצלחת.
- לדגור על שתי הצלחות בלילה ב 37 °C (50 °F).
- לגרד את תערובת תא ההטיות ואת תרבית התא הנמען עם מגרד תאים סטרילי. העבר את התאים לצינור microcentrifuge סטרילי ו resuspend התאים ב 1 מ"ל של PBS.
- מערבולת את התאים בעדינות לסובב אותם למטה (~ 3000 סל"ד במשך 5 דקות).
- resuspend התאים ב 1 מ"ל של PBS.
- צלחת תערובת תא תגובת ההטיה על צלחת אגר LB עם 1X Amp / Tet בלבד. על צלחת זו, רק החיידקים הנמענים שהצליחו להשיג את הגן התנגדות אמפר באמצעות הטיות צפויים לגדול.
- צלחת התאים הנמען על צלחת אגר LB עם 1X טט בלבד. על צלחת זו, רק חיידקי נמען ללא מנונים, שאין להם את הגן התנגדות אמפר, צפויים לגדול.
- לדגור על הצלחות לילה ב 37 °C (50 °F).
- בחר מושבות בודדות משתי הצלחות והשתמש בהן כדי לגדל תרביות לילה ב-5 מ"ל מדיה (37 מעלות צלזיוס עם אוויר ב-220 סל"ד).
4. בידוד דנ"א
- לבודד DNA מן התרבויות שהוכנו בעבר באמצעות 4.5 מ"ל של נפח התרבות הכולל על ידי מיניכנה DNA.
- כדי לעשות זאת, לחמוק DNA באמצעות 35 μL של מים ללא נוקלאז.
- DNA טהור ייצור יחס ספיגה (A260/280) של כ 1.8.
- השתמש 0.5 מ"ל הנותרים של כל תרבית כדי להכין מניות גליצרול על ידי ביצוע תערובת 1:1 של תרבית חיידקים 100% גליצל.
- לאחסן את מלאי המקפיא ב -80 מעלות צלזיוס.
5. אישור הטיות העברת פלסמיד על ידי PCR
- הכן שני תערובות מאסטר PCR, כל אחד עם קבוצה שונה של פריימרים קדימה והפוך, אחד מיקוד קטע 500 זוג בסיס בתוך הגן התנגדות אמפיצלין והשני מיקוד קטע בתוך גן משק בית.
- פריימרים של גנים משק בית נועדו להגביר קטע של DNA בתוך קידוד הגן החיידקי עבור DNA gyrase B (14).
- אמצעי האחסון המחודשים הבאים שימשו להכנת 90 μL של כל תערובת ראשית:
7.5 μL של פריימר קדמי של 10 מיקרומטר
7.5 μL של פריימר הפוך 10 מיקרומטר
75 μL של 2X PCR מאסטר מיקס
- הכן את שש תגובות ה- PCR הבאות באמצעות תערובת מאסטר של 15 μL, 10 ננוגרם של DNA תבנית ומים ללא נוקלאז עד לנפח סופי של 25 μL.
DNA תגובת הטיות פריימרים אמפיצלין
DNA תגובת הטיות וראשי משק בית
פריימרים של שליטה שלילית בדנ"א ובאמפיצילין
דנ"א שליטה שלילית וראשי תוצאות משק בית
אין פריימרים DNA ואמפיצילין
אין פריימרים לדנ"א ולניקיון הבית - העבר תגובות אלה למכונת PCR עם הבלוק שחומם מראש ל- 98 C והתחל לבצע תרמוגמה בתנאים הבאים:
98 °C (70°F) למשך 30 שניות
25-35 מחזורים של 98 °C (5-10 שניות), 45-72 °C למשך 10 עד 30 שניות ו- 72 °C למשך 15-30 שניות לק"ג
72 °C (5-10 דקות)
החזק ב- 4 °C (70 °F) - לטעון את כל שש תגובות PCR על ג'ל אגרוז 1% ולהפעיל ב ~ 150V במשך כ 20 דקות.
- דמיינו את מוצר המחשב באמצעות תאורת UV.
תאים חיידקיים, כגון E. coli, מסוגלים להעביר מידע גנטי מתא לתא. ההטיה שונה ממנגנונים אחרים של העברת DNA, כגון טרנסדוקציה או טרנספורמציה, בכך שהיא דורשת מגע פיזי בין התאים.
כדי להמשיך, ההטיה דורשת תא תורם המבטא את הפוריות, או F, גורם ותא נמען בלעדיו, תא F מינוס. התהליך דורש שני שלבים. הראשון הוא הקמת קשר ישיר בין תא לתא. כדי לעשות זאת, התא התורם מייצר מבנה חוטים חוץ תאי הנקרא פילוס מין. זה נקרא כך שכן ההטיות הן סוג של הזדווגות עבור חיידקים רבייה א-מינית, אבל יש לציין כי זה לא רבייה מינית אמיתית כמו לא gametes מוחלפים ולא נוצרים צאצאים.
השלב השני הוא מסירת דנ"א לתא הנמען. לאחר pilus המין יוצר קשר בין שני תאים, צינור בשם מערכת הפרשת סוג IV בנוי המאפשר העברת DNA. לאחר מכן התא התורם מתחיל לשכפל את ה- DNA החוץ-טרומוזומלי שיועבר על בסיס נוכחותו של יסוד גנטי המכונה OriT או מקור ההעברה. קצה אחד של הדנ"א המשוכפל החדש מושרה לתוך הצינור באמצעות כריכת חלבון דנ"א. ככל שהדנ"א משוכפל עוד יותר, הוא נשאב דרך התעלה, בהקלה על ידי קומפלקס של חלבונים המקודדים על ידי גנים הממוקמים קרוב ל- OriT. לאחר העברת הדנ"א במלואו, הוא ייצר פלסמיד כרומוזומלי נוסף, או שהוא עשוי להשתלב בכרומוזום של תא הנמען. לא משנה מה נקודת הקצה של הדנ"א המועבר, הגנים שהוא מקודד יבעו לאחר מכן. ביטוי גנים זה יכול לשמש כדי לאשר הטיות מוצלחות.
לדוגמה, שקול תרחיש שבו זן התורם מבטא עמידות אמפיצלין ומעביר את זה הלאה ב- DNA מצומד לחיידק הנמען, אך לזן הנמען יש גם גן עמידות טטרציקלין שאינו קיים בתורם. במקרה זה, כאשר התאים מצופים על מדיה LB המכילה הן טטרציקלין ואמפצילין, המושבות צריכות לגדול רק מחיידקים מצומדים בהצלחה, אשר יבטאו את שני פנוטיפים התנגדות. כדי לאשר עוד יותר הטיות מוצלחות, DNA plasmid ממושבות אלה ניתן לקצור ולאחר מכן קטע של DNA ספציפי plasmid הועבר ניתן להגביר באמצעות תגובת שרשרת פולימראז, או PCR. כאשר מוצר PCR מופעל על ג'ל אלקטרופורזה לצד סולם בגדלים סטנדרטיים, שבר PCR בגודל ידוע צריך להיות גלוי על הג'ל, מה שמאשר עוד יותר הטיות מוצלחות. בניסוי זה, פלסמיד ישמש להעברת הגן עמידות אמפיצלין באמצעות הטיות מזן תורם לזן נמען טטרציקלין עמיד. לאחר מכן, כדי לאשר הטיות, תערובת ההטיה תהיה דגירה על צלחת המכילה את שתי האנטיביוטיקות משאיר רק את החיידקים שהשתנו. לבסוף, הטיות מוצלחות יאושרו עוד יותר עם PCR.
לפני תחילת ההליך, לבשו את ציוד המגן האישי המתאים, כולל חלוק מעבדה וכפפות. לאחר מכן, לעקר את סביבת העבודה באמצעות 70% אתנול כדי לנגב את פני השטח.
בהליך זה, הגן עמידות אמפצילין יועבר מזן WM3064 של E. coli לזן J53 של E. coli באמצעות הטיות. זן התורם WM3064 עמיד טטרציקלין ואמפצילין וזה דורש חומצה diaminopimelic, או DAP, לגדול. זן הנמען J53 עמיד רק לטטרציקלין ואינו דורש DAP לגדול. משמעות הדבר היא כי תאים מצומדים בהצלחה צריך להיות עמיד טטרציקלין ואמפצילין והוא יכול לגדול ללא DAP.
הכן את תרבות זן התורם על ידי חנק חמישה מיליליטר של LB המכיל 0.3 מילימולים של DAP עם פיסת מלאי זן התורם הקפוא. לאחר מכן, להכין את זן הנמען על ידי חנק חמישה מיליליטר של מרק LB ללא DAP עם פיסת מלאי זן הנמען הקפוא. לגדל את התרבויות האלה בן לילה ב 37 מעלות צלזיוס עם aeration ורעד ב 220 סל"ד באינקובטור רועד. לאחר שהתרביות גדלו למנת יתר של 600 של שתיים, הסירו מיליליטר אחד של תרבות מכל אחת והכניסו את זה לשני צינורות מיקרוצנטריפוגה נפרדים חדשים של 1.5 מיליליטר. לאחר מכן, צנטריפוגות אלה aliquots ב 3000 סל"ד במשך חמש דקות כדי כדורי התאים החיידקיים. השלך את supernatant ולשטוף כל גלולה עם 250 microliters של 1X PBS. צנטריפוגות הדגימות שוב, ולאחר השלכת supernatant, resuspend כל גלולה ב 500 microliters של PBS.
כדי להתחיל את הליך ההטיה, שלב תחילה 50 מיקרוליטרים של תאים נמענים עם 50 מיקרוליטרים של תאים תורמים בצינור מיקרוצנטריפוגה 1.5 מיליליטר ומערבבים על ידי צנרת למעלה ולמטה בעדינות. לאחר מכן, pipette 100 microliters של תרבית תא הנמען על צלחת טטרציקלין 1X אחר המכיל DAP. לאחר מכן, הכינו את השליטה השלילית שלכם על-ידי צנרת של 100 מיקרו-לייטרים של תרבית תאי הנמען רק על צלחת אגר לא סלקטיבית המכילה DAP. לאחר מכן, לדגור על ההטיה ולוחות הבקרה השליליים בין לילה ב 37 מעלות צלזיוס.
למחרת, לקחת מגרד תאים סטריליים לקצור תאים מצלחת ההטיות על ידי איסוף מושבות. לאחר מכן, להעביר את המושבות לצינור microcentrifuge סטרילי 1.5 מיליליטר המכיל מיליליטר אחד של 1X PBS. חזור על תהליך זה כדי לאסוף את תאי הנמען מהצלחת האחרת.
אחרי זה, מערבולת הדגימות לערבב. לאחר ערבוב, להעביר את הצינורות לצנטריפוגה כדי גלולה בעדינות את התאים. להשליך את supernatant, ולאחר מכן לשטוף את כדורי התא במיליליטר אחד של PBS מערבולת הצינורות כדי resuspend התאים. גלולה התאים שוב על ידי צנטריפוגה. להשליך את supernatant שוב ו resuspend שני כדורי התא במיליליטר אחד של PBS. עכשיו, באמצעות קצה פיפטה סטרילי, צלחת 100 מיקרוליטרים של תערובת תא תגובת ההטיה על צלחת אגר LB ללא DAP המכיל 1X טטרציקלין ו אמפיסילין 1X. חזור על שיטת הציפוי באמצעות 100 מיקרוליטרים של דילול פי עשרה של אותה תערובת תאים ב- PBS על צלחת אגר LB אחרת ללא DAP המכילה 1X טטרציקלין ואמפיצלין 1X.
לבסוף, pipette 100 microliters של תערובת תא בקרה שלילית על צלחת אגר LB אחת עם 1X טטרציקלין בלבד. לאחר דגירה לילית ב 37 מעלות צלזיוס, המושבות צריכות להיות גלויות. בעזרת קצה פיפטה סטרילי, בחרו מושבה אחת מצלחת התגובה של ההטיה והוסיפו אותה לצינור המכיל חמישה מיליליטר של מדיית LB סלקטיבית המכילה את שתי האנטיביוטיקות. לאחר מכן, חזור על בידוד המושבה על-ידי בחירת מושבה אחת מצלחת תא הנמען. לגדל תרבויות אלה בן לילה ב 37 מעלות צלזיוס עם aeration ב 220 סל"ד.
למחרת, לנגב את הספסל העליון עם 70% אתנול ולהסיר את הצלחות מן האינקובטור. השתמש בערכת הכנת מיני דנ"א כדי לבודד דנ"א מ-4. 5 מיליליטר של כל תרבות על פי הוראות היצרן. לאחר השלמת הכנת מיני ה- DNA, יש לחמוק מהדנ"א באמצעות 35 מיקרוליטרים של מים ללא נוקלאז. לבסוף, השתמש ב- 0 הנותרים. 5 מיליליטר של כל תרבות כדי להכין אחד מיליליטר מניות גליצריל על ידי הוספת 0.5 מיליליטר של 100% גלילסול עבור דילול אחד על אחד. מניחים את ה-aliquots האלה במינוס 80 מעלות צלזיוס לאחסון עד הצורך.
כדי לאשר הטיות מוצלחות על ידי PCR, תחילה להכין תערובת מאסטר PCR על ידי הוספת 75 microliters של 2X PCR תערובת מאסטר לצינור microcentrifuge. לאחר מכן, הוסף 7.5 מיקרוליטרים כל אחד מפריימר קדמי של 10 מיקרומולר ובריימר הפוך של 10 מיקרומולר שנועד להגביר את הגן עמידות אמפצילין מהפלסטיד. לאחר מכן, הכינו תערובת מאסטר PCR שנייה על ידי הוספת 75 מיקרוליטרים של תערובת מאסטר PCR 2X לצינור microcentrifuge ולאחר מכן הוספת 7.5 מיקרוליטרים כל אחד של פריימר קדמי 10 מיקרומולר 10 פריימר הפוך מיקרומולר שנועד להגביר גן משק בית, במקרה זה DNA gyrase B.
עכשיו, להוסיף 15 microliters של תערובת האב הראשונה לצינור PCR ולאחר מכן להוסיף 10 ננוגרם, בערך שני microliters של התבנית DNA ניסיוני לאותו צינור. העלה את התגובה לנפח סופי של 25 מיקרוליטרים עם מים ללא נוקלאז. חזור על שלבים אלה כדי לייצר את חמש התגובות הנותרות, כך הצינורות מכילים את הרכיבים המוצגים כאן. עכשיו, להעביר את התגובות האלה תרמוcycler עם הבלוק מחומם מראש ל 98 מעלות צלזיוס ולאחר מכן ליזום את התוכנית. לאחר השלמת ה- PCR, הסר את הצינורות מהמכונה. לאחר מכן, לטעון שני microliters של כל תגובה מעורבב עם שני microliters של צבע טעינה וארבע microliters של סמן משקל מולקולרי לתוך בארות רצופות של ג'ל אגרוז 1%. הגדר את הג'ל לרוץ ב 150 וולט במשך 20 דקות. לבסוף, דמיינו את הג'ל באמצעות מאיר UV.
בניסוי זה, ההעברה המוצלחת של הגן עמידות אמפיצלין באמצעות הטיות אושרה באמצעות PCR. כאן, יש לצפות בלהקה בגודל של כ-500 זוגות בסיסים בבאר המכילה את ה-DNA הצומד ואת פריימרי האמפיצלין הצומדים, גם שניים בדוגמה זו. גן משק בית, DNA gyrase B, הוטען לתוך בארות שלוש וחמש עם DNA מצומד ודנ"א תא הנמען, בהתאמה. להקות שנצפו בבארות אלה פועלות כשליטה חיובית כדי להבטיח שתבנית ה- DNA הייתה קיימת וש- PCR הצליח. רצועות לא צריך להיות נצפה בבאר המכילה את התגובה עבור DNA תא הנמען ואת זוג פריימר אמפצילין, גם ארבעה בדוגמה זו, כי התאים הנמען אינם עמידים אמפצילין. בנוסף, אין לראות להקות בתגובות חסרות DNA תבנית, בארות שש ושבע כאן. אם תנאים אלה מתקיימים, זה יאשר את ההעברה המוצלחת של הגן עמידות אמפיצלין, מתן עמידות אמפיצלין מן זן WM3064 של E. coli לזן J53 של E. coli.
Subscription Required. Please recommend JoVE to your librarian.
Results
אם ההטיה הצליחה, מוצר PCR בגודל 500 בסיסים של הלהקה ייבחן בבאר שבה נטען תגובת PCR 1 (ובכן #2 באיור 3B), בעוד שלא יתבונן רצועות בבאר שבה נטען תגובת PCR 3 (ובכן #4 באיור 3B). נוכחותה של להקה זו מאשרת את ההעברה המוצלחת של הגן עמידות אמפיצלין, ובכך מעניקה עמידות אמפיצלין לזן J53 של E. coli.

איור 3B: אישור הטיות מוצלחות על ידי PCR. ב) ניתוח PCR נעשה באמצעות DNA מבודד מהמושבה הנבחרת. התוכן של כל באר הוא כדלקמן: 1) סולם DNA, 2) פריימרים DNA הטיות ואמפצילין, 3) DNA הטיות פריימרים משק בית, 4) פריימרים DNA ושליטה שלילית, 5) DNA שליטה שלילית פריימרים משק בית, 6) אין פריימרים DNA ואמפצילין, ו 7) אין DNA פריימרים שליטה שלילית. נוכחותו של מוצר PCR של רצועת בסיס ~ 500 מתגובה PCR 1 (טוב 2), והיעדר מוצר זה מתגובת PCR 3 (טוב 4), מאשרת הטיות מוצלחות.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
הטיות הוא תהליך טבעי של העברת גנים אופקית הנשען על קשר ישיר בין תא לתא של תא תורם ותא נמען. תהליך זה משותף בין כל סוגי החיידקים והיה אינסטרומנטלי באבולוציה חיידקית, בעיקר עמידות לאנטיביוטיקה. במעבדה, הטיות יכולות לשמש כשיטה יעילה להעברת גנים שהיא הרבה פחות מפריעה בהשוואה לטכניקות אחרות. מחוץ למעבדה, היכולת להעביר דנ"א מחיידקים לאאוקריוטים באמצעות הטיות מציעה שדרה חדשה ומרגשת של טיפול גנטי והבנת ההשלכות של העברות גנים טבעיות אלה, למשל הקשר בין זיהום חיידקי לסרטן, הוא תחום מחקר המתהווה במהירות.
Subscription Required. Please recommend JoVE to your librarian.
References
- Lederberg J, Tatum, E.L. Gene recombination in Escherichia coli Nature. 1946;158:558.
- Holmes R.K. J, M.G. Genetics: Exchange of Genetic Information. 4th Edition ed. Baron S, editor. Galveston, TX: University of Texas Medical Branch at Galveston; 1996.
- Cruz F, Davies, J. Horizontal gene transfer and the origin of species: lessons from bacteria. Trends in Microbiology. 2000;8:128-33.
- Llosa M, Cruz, F. Bacterial conjugation: a potential tool for genomic engineering. Ressearch in Microbiology. 2005;156:1-6.
- Lacroix B, Citovsky, V. Transfer of DNA from Bacteria to Eukaryotes. mBio. 2016;7(4):1-9.
- Llosa M, et al. Bacterial conjugation: a two-step mechanism for
- DNA transport. Molecular Microbiology. 2002;45:1-8.
- Grohmann E, Muth, G., Espinosa, M. Conjugative Plasmid Transfer in Gram-Positive Bacteria. Microbiology and Molecular Biology Reviews. 2003;67:277-301.
- Firth N, Ippen-Ihler, K, Skurray, RA. Structure and function of the F factor and mechanism of conjugation. Escherichia coli and salmonella: cellular and molecular biology. 1996;2:2377-401.
- Smillie C, Garcillan-Barcia MP, Francia MV, Rocha EPC, De La Cruz F. Mobility of Plasmids. Microbiology and Molecular Biology Reviews. 2010;74(3):434-52.
- Cascales E. Definition of a Bacterial Type IV Secretion Pathway for a DNA Substrate. 2004;304(5674):1170-3.
- Wang P, Yu Z, Li B, Cai X, Zeng Z, Chen X, et al. Development of an efficient conjugation-based genetic manipulation system for Pseudoalteromonas. Microbial Cell Factories. 2015;14(1):11.
- Yi H, Cho YJ, Yong D, Chun J. Genome Sequence of Escherichia coli J53, a Reference Strain for Genetic Studies. Journal of Bacteriology. 2012;194(14):3742-3.
- Baumann RLB, E. H.; Wiseman, J. S.; Vaal, M.; Nichols, J. S. Inhibition of Escherichia coli Growth and Diaminopimelic Acid Epimerase by 3-Chlorodiaminopimelic Acid. Antimicrobial Agents and Chemotherapy 1988;32:1119-23.
- Rocha D, Santos, CS, Pacheco LG. Bacterial reference genes for gene expression studies by RT-qPCR: survey and analysis. Antonie Van Leeuwenhoek. 2015;108:685-93.




