ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Dit protocol demonstreert robotische echografie (VS) als een praktisch, kosteneffectief en snel alternatief voor traditionele niet-invasieve beeldmodaliteiten.
Abstract
Veel voorkomende modaliteiten voor in vivo beeldvorming van knaagdieren zijn positronemissietomografie (PET), computertomografie (CT), magnetische resonantiebeeldvorming (MRI) en echografie (VS). Elke methode heeft beperkingen en voordelen, waaronder beschikbaarheid, gebruiksgemak, kosten, grootte en het gebruik van ioniserende straling of magnetische velden. Dit protocol beschrijft het gebruik van 3D robotic US voor in vivo beeldvorming van knaagdiernieren en -hart, daaropvolgende gegevensanalyse en mogelijke onderzoekstoepassingen. Praktische toepassingen van robotic US zijn de kwantificering van het totale niervolume (TKV), evenals de meting van cysten, tumoren en vasculatuur. Hoewel de resolutie niet zo hoog is als andere modaliteiten, maakt robotic US het mogelijk om meer praktische gegevensverzameling met hoge doorvoer mogelijk te maken. Bovendien kan met behulp van Amerikaanse M-modus beeldvorming de hartfunctie worden gekwantificeerd. Aangezien de nieren 20% -25% van de cardiale output ontvangen, is het beoordelen van de hartfunctie van cruciaal belang voor het begrip van nierfysiologie en pathofysiologie.
Introduction
De meest voorkomende modaliteiten voor in vivo beeldvorming van knaagdieren zijn positronemissietomografie (PET), optische beeldvorming (OI), computertomografie (CT), magnetische resonantiebeeldvorming (MRI) en echografie (VS). Deze technieken bieden in vivo beelden met een hoge resolutie, waardoor onderzoekers ziektemodellen niet-invasief kwantitatief kunnen beoordelen en longitudinaal kunnen volgen1. Hoewel elke beeldvormingsmodaliteit beperkingen heeft, bieden ze ook onschatbare hulpmiddelen voor preklinisch onderzoek.
Hier beschrijft de studie een Amerikaans systeem en presenteert het protocol voor robot- en 3D-knaagdierbeeldvorming. Amerikaanse golven worden geproduceerd door een sonde die een transducer wordt genoemd en die meestal in de hand wordt gehouden. Geluidsgolven worden teruggekaatst terwijl ze interageren met weefsels en de echo's worden gereconstrueerd tot beelden2. Het hier beschreven protocol zal zich richten op nier- en hartbeeldvorming met behulp van een robotgestuurde transducer en met behulp van software die snelle 3D-reconstructie mogelijk maakt voor kwantitatieve beoordeling.
Robotic US is een snelle, betrouwbare en niet-invasieve beeldvormingsmodaliteit waarmee onderzoekers high-throughput en longitudinale studies kunnen uitvoeren. In vergelijking met draagbare Amerikaanse methoden is de robotachtige Amerikaanse methode tijdsefficiënt, omdat maximaal drie dieren binnen enkele minuten kunnen worden gescand. Hoge doorvoer voor niermetingen suggereert dat tot 20 muizen per uur in beeld kunnen worden gebracht. De robottransducers bevinden zich onder de akoestische membranen en bewegen onafhankelijk van het dier met twee vrijheidsgraden (figuur 1A). Hierdoor kunnen beginnende gebruikers afbeeldingen van hoge kwaliteit verkrijgen, terwijl amerikaanse methoden in de hand gevoeliger zijn voor gebruikersfouten. De gekoppelde software maakt een efficiënte, real-time 3D nierreconstructie mogelijk. Voorheen was magnetische resonantie beeldvorming (MRI) een gangbare methode voor niet-invasieve beeldvorming vanwege het uitstekende contrast van zacht weefsel, gebrek aan radioactiviteit en penetratiediepte. MRI vereist echter vaak lange acquisitietijden en is duur om uit te voeren. De VS is geëvalueerd als een betrouwbaar en sneller alternatief voor MRI bij het beoordelen van het totale niervolume (TKV)3.
Protocol
Alle stappen in dit protocol voldoen aan de Mayo Clinic (Rochester, MN) richtlijnen voor het gebruik van dieren en zijn goedgekeurd door de Mayo Clinic Institutional Animal Care and Use Committee.
1. Diermodel
- Verkrijg muizen uit commerciële bronnen.
OPMERKING: C57BL/6J (leeftijd = 18 maanden; n = 22 (7 mannen, 15 vrouwen)) (Tabel met materialen) en Pkd1(RC/RC) (leeftijd = 18 maanden; n = 9 (3 mannen, 6 vrouwen))4 werden gebruikt voor het onderzoek.
2. Ontharing
- Anesthetiseer het dier met behulp van verdamp isofluraan (2% -3%) in een anesthesiekamer. Zorg ervoor dat het dier voldoende wordt verdoofd door een teenknijpen uit te voeren. Zorg ervoor dat de muis ademt met een snelheid van ongeveer 60-90 ademhalingen / min zonder duidelijke luchtslurping.
OPMERKING: Verdamp isofluraan werd gekozen vanwege het vermogen om het anesthesieniveau van het dier te controleren en af te stellen. Isofluraan gemengd met 100% zuurstof werd gebruikt. - Gebruik een elektrisch scheermes om het gewenste huidgebied te scheren voor Amerikaanse metingen.
OPMERKING: In deze studie ligt de focus op nier- en hartmetingen, dus de borst en rug van het dier werden geschoren. - Breng de ontharingscrème aan op de geschoren huid van het dier met een applicator met katoenen punt. Veeg de crème na 30-60 s af met een droge papieren handdoek. Blijf vervolgens ontharingsmiddelresten wegvegen met natte gaasjes. Zorg ervoor dat de ontharing is voltooid voordat u met scans begint.
OPMERKING: Eventuele resterende haren zullen de beeldkwaliteit verstoren; volledige ontharing is cruciaal. Het is echter noodzakelijk om de ontharingscrème binnen een minuut af te vegen om te voorkomen dat de huid van het dier wordt verwond. Overgebleven ontharingscrème op het dier kan het beeldmembraan van de Amerikaanse machine bevlekken. Zorg voor een goede reiniging van het dier met behulp van natte gaasjes.
3. Positionering van dieren
- Schakel de Amerikaanse machine en de schakelaar voor het interne verwarmingselement voor de Amerikaanse bays in. Schakel de juiste anesthesiekleppen in voor de overeenkomstige Amerikaanse bays die zullen worden gebruikt.
OPMERKING: Het apparaat in de VS moet zijn ingeschakeld voordat u de Amerikaanse imaging-software start. - Vul de baaien met voldoende water om het membraan te bedekken. Plaats het verdoofde dier in de neuskegel.
- Voor hartmetingen plaatst u het dier in buikligging en richt u het ongeveer 30° naar rechts.
- Voor niermetingen, plaats het dier in een rechte en liggende positie. Maak het lichaam van het dier voorzichtig plat om de luchtzakken tussen het dier en het membraan te minimaliseren (figuur 1B).
OPMERKING: Het laten lopen van een vinger langs het lichaam van het dier kan alle luchtbellen verwijderen die zich aan de huid hechten, wat de beeldvorming zal verstoren. Gebruik water of Amerikaanse zoutoplossing gel als Us medium; maar water vergemakkelijkt de snelle beeldvorming die hier wordt besproken.
4. Ultrasone metingen
- Selecteer in de Amerikaanse imaging-software US Acquisition en laat het instrument initialiseren.
- Nierbeeldvorming met behulp van B-modus.
- Voer een naam voor het onderzoek in het desbetreffende dialoogvenster in.
- Voer de dier-id in het juiste dialoogvenster in.
OPMERKING: Maximaal drie dieren kunnen achtereenvolgens worden afgebeeld. - Klik op het tabblad met het label 3D om 3D-scannen te initialiseren.
- Gebruik de live camerafeed om het gebied van interesse (ROI) te verplaatsen om de nieren te bevatten.
OPMERKING: De grootte van de ROI kan worden aangepast afhankelijk van de grootte van het afbeeldingsdoel. Het verhogen van de grootte van de ROI zal de scantijd iets verhogen (figuur 1C). Afhankelijk van de ROI-grootte past de scanner automatisch het aantal passen aan dat nodig is voor de transducer om de volledige ROI te scannen. - Afhankelijk van het gewenste type afbeelding selecteert u Linear Array of Wobbler om de transducer te kiezen. Kies uit Fast Scan of Optimized voor beide transducers.
OPMERKING: Lineaire array is sneller en biedt meestal voldoende beeldvorming. De wobbler transducer kan worden gebruikt als het niet in staat is om de gewenste beeldkwaliteit te verkrijgen met de lineaire array. De wobbler transducer maakt gebruik van een hogere frequentie golflengte en biedt daarom meer definitie in beelden. De fast scan-optie verkrijgt beelden van gemiddelde kwaliteit zonder ademhalingscorrectie bij een hogere snelheid. Hoewel de optie Geoptimaliseerd iets meer tijd nodig heeft, biedt deze een betere beeldkwaliteit en maakt het ademhalingscorrectie mogelijk. Dit manuscript zal zich richten op het gebruik van de geoptimaliseerde lineaire arrayvoorinstelling. - Klik op de Live View om een live beeld van het gewenste weergavegebied te zien.
- Om de transducer te verplaatsen, klikt u op de ronde knop Ga naar en klikt u vervolgens op het gebied van de muis dat moet worden afgebeeld. Gebruik de richtingspijlen met vooraf bepaalde stapgroottes om de positie van de transducer nauwkeurig aan te passen.
- Klik op de pijl aan de zijkant van het configuratiescherm om het instellingenvak te openen. Klik op Scan Protocol om de scaninstellingen te openen.
- Bepaal de ideale scherptediepte en pas de schuifregelaars voor de TGC (tijdwinstcompensatie) aan om het beeldcontrast te wijzigen om de nieren het beste te bekijken. Nadat u de gewenste instellingen hebt bereikt, klikt u nogmaals op de pijl om het instellingenvak te sluiten.
- Druk op de knop Statisch aanschaffen om het 3D-scannen te starten.
OPMERKING: De voortgang van de scan wordt aangegeven via een voortgangsbalk linksonder in de software. - Zodra het scannen is voltooid, controleert u de beeldkwaliteit door op de blauwe downloadpijl te klikken om de scan in de voorbeeldmodus te openen. Door de 3D-frames van de scan gaan door de rode pijl boven in het venster te slepen. Als u wilt in- of uitzoomen, houdt u de Ctrl-toets ingedrukt en gebruikt u de schuifknop op de muis.
- Als u extra dieren wilt scannen, vernieuwt u de dialoogvensters voor dier-id's, voert u de nieuwe id's in en herhaalt u de bovenstaande stappen.
OPMERKING: Wanneer de scans zijn voltooid, droogt u de dieren af en brengt u ze terug naar hun thuiskooien.
- Cardiale beeldvorming met behulp van M-modus.
OPMERKING: M-modus is de weergave van een ultrasone golf langs een specifieke, gekozen ultrasone lijn.- Klik op het tabblad M-modus om cardiale beeldvorming te activeren.
OPMERKING: Er kan slechts één dier tegelijk worden afgebeeld. - Zorg ervoor dat het dier zich in de juiste positie bevindt voor hartscans (stap 2.2). Verplaats de ROI naar de geschatte locatie van het hart.
- Druk op de Heart Finder-knop om het hart te lokaliseren. Gebruik de heatmap om de locatie van de transducer te optimaliseren. Gebruik de cirkelvormige knop Ga naar om de transducer naar de linker ventrikel te verplaatsen (figuur 2A).
- Ga naar de Live View en gebruik de pijlknoppen om de transducer tussen de papillaire spieren te plaatsen (figuur 2B). Als u de juiste plaatsing van de transducer wilt controleren, bekijkt u de live M Mode-tracering (afbeelding 2D).
- Zodra de transducer zich in de juiste positie bevindt, klikt u op Acquire Sequence. Klik op de blauwe downloadpijl om de voltooide scan te bekijken.
- Klik op het tabblad M-modus om cardiale beeldvorming te activeren.
5. Nieranalyse (analysemechanica)
- Open het tabblad Afbeeldingsanalyse en selecteer de knop Volume(s) laden om de afbeeldingsbestanden/mappen in te voeren.
- Segmentatie
- Verplaats de gekleurde lijnen die verschillende vlakken vertegenwoordigen om de nier in alle vlakken te vinden.
- Klik op Toevoegen om een nieuwe segmentatie toe te voegen. Geef een opmaaknaam op voor het bestand.
- Gebruik de Surface Cut-knop om punten rond de buitenrand van de nier in meerdere vlakken toe te voegen. Klik op Toepassen om segmentatie door de gehele nier te genereren (figuur 3A).
- Blader door de verschillende frames in elk vlak en bewerk eventuele onnauwkeurige gebieden door op Bewerken te klikken en de punten naar de juiste locatie te slepen.
- Als de nier onregelmatig van vorm is, gebruikt u de Draw-functie om een onregelmatig gevormd spoor rond de nier te maken. Klik op punten rond de rand of houd de linkerklik ingedrukt om de tracering uit de vrije hand te tekenen.
- Als u de tracering wilt voltooien met de knop Tekenen , klikt u met de rechtermuisknop. Blader door meerdere frames en herhaal het overtrekproces.
- Herhaal dit totdat de frames zijn getraceerd in het hele interessante gebied.
- Als de functie Tekenen wordt gebruikt, selecteert u Vulling tussen segmenten om de overtrek te controleren en aan te passen. Klik op Initialiseren om een voorbeeld te bekijken. Als het voorbeeld acceptabel is, klikt u op Toepassen. Zo niet, klik dan op Annuleren en wijzig de traceringen.
OPMERKING: Met de knop Wissen kunt u een gebied binnen een tracering verwijderen. Met de knop Vloeiend worden de gekartelde randen van een spoor vloeiend gemaakt. - Wanneer de beeldanalyse bevredigend is, selecteert u Opslaan om de analyse op te slaan in het oorspronkelijke afbeeldingsbestand.
- Meting
- Gebruik de functie Remklauwen om functies in de afbeelding te meten. Klik op de remklauwenknop en klik met de linkermuisknop op de twee punten van de te meten afstand (figuur 3B).
- Sla de meting op door op de schijfknop boven aan het scherm te klikken.
- Segmentatie
6. Cardiale analyse
- Selecteer Volumes laden om de te analyseren bestanden in te voeren.
- Selecteer de optie Toevoegen .
- Gebruik het gereedschap Puntplaatsing om de systole en diastole voor elke laag hartweefsel te traceren. Ga verder met de andere lagen hartweefsel. Gebruik de functie Bewerken om de traceringen te wijzigen (Figuur 2C,D).
OPMERKING: Als de M-modus tracering erg duidelijk is, gebruikt u de knop (automatisch) toevoegen om automatisch traceringen van elke laag te genereren. - Selecteer Toepassen om de hartparameters te berekenen. Bekijk het tabblad Kwantificeren en selecteer Statistieken exporteren om alle gegevens te exporteren als een *.csv bestand (Afbeelding 2E).
Representative Results
Resultaten van nieranalyse
Oppervlakte- en volumegegevens worden verkregen uit de segmentatie van de nieren. Deze informatie kan worden gebruikt om experimentele en controlemodellen te vergelijken of veranderingen in de loop van de tijd te volgen. De remklauwentool is handig voor het snel meten van afwijkingen (d.w.z. cysten, tumoren) en hoe ze in de loop van de tijd in lengte veranderen. Figuur 3 suggereert dat zowel de segmentatie- als de remklauwmethoden kunnen worden gebruikt om cystevolumes nauwkeurig te meten. Figuur 4 toont een duidelijk verschil in totaal niervolume (TKV) tussen leeftijdsgematchte controle en experimentele (Pkd1RC/RC) muizen. 3D-visualisatie van deze volumerenderingen kan binnen het systeem worden uitgevoerd, inclusief rotaties binnen de 3D-ruimte (figuur 5). Deze 3D-reconstructies worden vervolgens gebruikt om TKV (mm3; Figuur 4) evenals individueel groot cystevolume.
Resultaten van cardiale analyse
Veel nuttige parameters worden verkregen uit de analyse van M Mode-beelden. Deze gegevens geven een goede momentopname van de linkerventrikel (LV) hartfunctie op dat moment. De gegevensuitvoer omvat LV interne diameter, LV achterwand, LV voorste wanddiameter, ejectiefractie, fractionele verkorting, slagvolume, hartslag, cardiale output, LV-volume en LV-massa. Het succes van hartanalyse is afhankelijk van nauwkeurige segmentatie van de lagen op het M Mode-beeld. De meeste cardiovasculaire resultaten worden berekend door de piek systolische en diastolische fasen van de achterste en anterieure endocardiale lagen. De achterste epicardiale laag lijkt helder wit en volgt een vergelijkbaar patroon als de achterste endocardiale laag. De tracering voor de achterste endocardiale laag moet op de laagste contour worden geplaatst. De voorste endocardiale laag moet langs de hoogste contour van die laag worden getraceerd. De voorste epicardiale laag lijkt lineair aan de onderkant van het beeld als gevolg van de buikligging van het dier (figuur 2D). Figuur 6 toont een voorbeeld van één studie zonder significant verschil in cardiale output tussen experimentele en controlemuizen. Net als bij renale beeldvorming is 3D-cardiale visualisatie mogelijk. Niettemin stelt een 4D-visualisatie van de hartcyclus (aanvullende figuur 1) de onderzoeker in staat om zowel morfologische als cyclusdynamische afwijkingen bij het beoordeelde dier te visualiseren en te lokaliseren.
Morfologie beoordeling
Voor een snelle en goedkope beoordeling kan de VS fysiologische parameters effectief longitudinaal bewaken. Veel studies willen echter ook fijnere morfologische kenmerken bepalen, bijvoorbeeld het aantal en de grootte van cysten, verkalkingen (nierstenen), vascularisatie of mate van fibrose. Figuur 7 vergelijkt een normale muizennier met een cystische muizennier met een matig verkalkte muizennier. Door de Amerikaanse middenfrequentie (10 MHz met de lineaire array) te verhogen tot 35 MHz (wobblerversterker), kunnen foto's van toenemende details worden verkregen.

Figuur 1: Echografiesysteem en muisplaatsing. (A) Diagram van het echografiesysteem en de locatie van transducers. (B) Zicht op muizen in rugligging op ultrasoon platform. (C) Voorbeeld van regio van belang (ROI) voor interessegebied (nieren) met dierlijke ID's. Klik hier om een grotere versie van deze figuur te bekijken.

Figuur 2: Cardiale echografie om fysiologische parameters te verkrijgen. (A) Gebruik van de Heart Finder heatmap-afbeelding om de transducer in de linker ventrikel te positioneren voor M-Mode beeldvorming. De locatie van de transducer in de linker ventrikel wordt aangegeven door de grote groene stip. (B) Zicht op de transducer wanneer deze correct over papillaire spieren wordt geplaatst (gestippelde doos). (C) Voorbeeldweergave van lagen die nodig zijn om hartparameters te meten. (D) Weergave van live M-Mode-afbeelding met lagen aangeduid als in paneel C. (Lagen van boven naar beneden: posterieur epicardiaal, posterieur endocardiaal, anterieur endocardiaal en voorste epicardiaal.) (E) Voorbeeld output van statistieken gegenereerd uit hartmetingen. Klik hier om een grotere versie van deze figuur te bekijken.

Figuur 3: Segmentatie- en remklauwgereedschappen gebruiken om nieren en cysten te meten. (A) Voorbeeldsegmentaties (axiale weergave) van beide nieren (blauwe en oranje schaduw) en een grote cyste (geel) met onderstaande volumes. Hieronder worden niet-gesegmenteerde weergaven weergegeven, zodat de niet-geobserveerde VS kan worden bekeken. (B) Voorbeeld van het gebruik van remklauwen om dezelfde cyste (sagittale weergave) uit figuur 3A met metingen hieronder te meten. Het volume werd berekend met behulp van de formule voor een ellips (volume = (4/3)π x a x b x c, waarbij a, b, c respectievelijk relatief x, y, z zijn). Klik hier om een grotere versie van deze figuur te bekijken.

Figuur 4: TKV-verdelingen van WT- en cystische muizennieren. Representatie van TKV's voor wild-type (WT) (C57BL/6J) en zieke (Pkd1RC/RC) muizen. n = 22 (WT) n = 9 (Pkd1RC/RC); Resultaten van de tweezijdige t-test: p < 0,0001. Box toont 25-75e percentielwaarden en snorharen tonen 1,5 keer interkwartielbereik. Klik hier om een grotere versie van deze figuur te bekijken.

Figuur 5: Geanimeerde 3D-reconstructie van gesegmenteerde nieren en cyste. Met behulp van de software kunnen de 3D-projecties van de nieren en cyste worden gedraaid of gewiegd in de 3D-ruimte (blauw = linker nier; geel = grote cyste; oranje = rechternier). Klik hier om deze figuur te downloaden.

Figuur 6: Cardiale fysiologische parameters van Amerikaanse metingen. Representatie van cardiale output (ml/min) voor WT en zieke (Pkd1RC/RC) muizen. n = 22 (WT) n = 9 (Pkd1RC/RC). De onderste tabelgegevens laten zien dat er geen significant verschil is voor deze twee groepen in ejectiefractie, slagvolume, hartslag (HR) of cardiale output (CO). Resultaten van de tweezijdige t-test: p > 0,05. Box toont 25-75e percentielwaarden. Klik hier om een grotere versie van deze figuur te bekijken.

Figuur 7: Vergelijking van Amerikaanse sagittale secties van normale en twee pathologieën. (A) Wild-type (C57BL / 6J-stam) nier (TKV = 143.202 mm3). (B) Cystische nier met verhoogde TKV (Pkd1RC/RC muis) (TKV = 333,158 mm3). Cysten worden aangegeven door gele pijlen. (C) Nier met vasculaire verkalkingen (Model = Low-Density Lipoprotein Receptor Deficiënt, Apolipoproteïne B100-only muis gevoed een westers dieet gedurende 12 maanden5) (TKV = 127,376 mm3). Nierstenen worden aangegeven door groene pijlen. Klik hier om een grotere versie van deze figuur te bekijken.
Aanvullende figuur 1: 4D-hartcyclusfilm van Amerikaanse metingen. Met behulp van de software wordt een weergave van het kloppende hart vastgelegd in 3D US en geprojecteerd door de hartcyclus. De groene pijl geeft de aortaklep aan. (Model = Low-Density Lipoprotein Receptor Deficient, Apolipoproteïne B100-only muis, gevoed een westers dieet gedurende 12 maanden5). Dit model genereert vasculaire verkalkingen die een eenvoudigere visualisatie van het hart en de kleppen mogelijk maken vanwege de grotere akoestische reflectiviteit van de verkalkingen in de VS. Vergelijkbare 4D-reconstructies zijn mogelijk met WT-muizen; het vastgelegde akoestische contrast zal echter niet zo hoog zijn. Klik hier om dit bestand te downloaden.
Discussion
Echografie maakt gebruik van geluidsgolven en eventuele barrières voor de voortplanting van geluidsgolven zullen de beeldkwaliteit verstoren. Volledige ontharing van het in beeld te brengen gebied is dus van cruciaal belang. Het is ook belangrijk om ervoor te zorgen dat de ontharingscrème volledig wordt verwijderd, omdat dit brandwonden / irritatie van de huid van het dier kan veroorzaken en het transparante membraan van de scanner kan verkleuren. Voldoende waterstanden in de baaien zijn noodzakelijk voor een optimale geluidsgolfvoortplanting, dus vereist voor het verkrijgen van de hoogste beeldresolutie. Wanneer het dier zich echter in een buikligging bevindt, moet u ervoor zorgen dat de snuit van het dier boven het waterniveau ligt of dat het dier het risico loopt op waterinhalatie. Optimalisatie van beeldparameters, met name scherptediepte, is van cruciaal belang voor het verkrijgen van beelden van hoge kwaliteit. Wijzigingen in parameters kunnen nodig zijn voor individuele dieren.
Robotic US biedt veel voordelen ten opzichte van traditionele draagbare Amerikaanse modaliteiten. Ten eerste maakt het systeem gebruik van een eenvoudige point-and-click camera-gebaseerde interface. Deze functie pakt de complexiteit van conventionele VS aan en produceert consistente gegevens, zelfs wanneer deze wordt gebruikt door een beginnende gebruiker6. Ten tweede maakt het systeem het gebruik van water mogelijk in plaats van traditionele Amerikaanse gel als akoestisch medium. Eerder maakte het gebruik van Amerikaanse gel de vorming van bubbels mogelijk die de kwaliteitsbeeldacquisitie verstoorden. Ook is de Amerikaanse gel rommelig en biedt het uitdagingen voor het opruimen. Verder wordt het water verwarmd door de warmtelamp en helpt het de lichaamstemperatuur van het dier te handhaven. Ten derde is de robotachtige VS sneller, dus artefacten van ademhalingsbewegingen zijn niet problematisch. De verhoogde beeldsnelheid zorgt voor de praktische voltooiing van gegevensverzameling met hoge doorvoer. Ten vierde verkrijgt de robotachtige VS 3D-beelden en maakt daarom 3D-reconstructie van objecten eenvoudig (figuur 4). MRI en andere modaliteiten zijn duur, tijdrovend en niet altijd beschikbaar. Belangrijk is dat het robotsysteem van de VS op een tafel of bank past en kostenefficiënter is. Ten slotte toonde eerder werk aan dat robotic US vergelijkbare meetgegevens kon leveren als duurdere modaliteiten, zoals MRI3.
Hoewel de beeldkwaliteit en resolutie van het in dit werk beschreven amerikaanse robotsysteem voldoende waren voor de voorgestelde toepassing (figuur 7), zijn er verschillende manieren waarop de beeldkwaliteit in de toekomst kan worden verbeterd. Het gebruik van transducers met een hogere frequentie (bijvoorbeeld 50-70 MHz) zou bijvoorbeeld resulteren in afbeeldingen met een hogere resolutie en een betere functiedefinitie. Hoewel het gebruik van hogere frequenties zou resulteren in een slechtere penetratiediepte, zouden de beelden voldoende moeten zijn voor in vivo beeldvorming van oppervlakkige organen, zoals de muizennier. Net als bij andere beeldvormingsmodaliteiten kunnen contrastmiddelen worden gebruikt om specifieke kenmerken te verbeteren. Voor de VS betekent dit meestal het gebruik van iets dat geluidsgolven sterk weerspiegelt. Intravasculaire microbubbels waarin lipiden zeer kleine gasbellen omringen, zijn zo'n middel. De gasbellen ter grootte van micron zijn sterk reflecterend en geven zo een tweede duidelijk signaal dat zich vertaalt in een hoge resolutie van vasculatuur7. Hoewel deze akoestische contrasttechniek heel nuttig kan zijn, kan het verschillende nadelen hebben. Eerst moeten de microbubbels vers worden gemaakt en alleen in vivo gedurende 5-10 minuten aanhouden. Ten tweede vereist in vivo intravasculaire injectie meestal staartsluierkatheterisatie voor injectie, en dit kan technisch uitdagend zijn. Onder bepaalde omstandigheden en pulserende regimes kan microbubbelbeeldvorming zelf leiden tot niervaculatuurschade8.
Er zijn ook enkele meer algemene beperkingen van het specifieke Amerikaanse systeem dat wordt gebruikt. Ten eerste is slechts één lineaire array (gecentreerd op 18 MHz) opgenomen in het robotchassis, dus overschakelen naar sondes met een hogere of lagere frequentie is momenteel niet mogelijk. Dit kan van invloed zijn op de breedte van modellen (groter of kleiner) die met het systeem kunnen worden geëvalueerd. Toekomstige iteraties van het instrument moeten meerdere lineaire arrays omvatten om het volledige scala aan preklinische diermodellen te bestrijken. Ten tweede kan de transducerhoek ten opzichte van het dier niet worden gecontroleerd. Daarom vereist het uitvoeren van hoekafhankelijke beeldvormingstechnieken, zoals Doppler, of het bereiken van alternatieve in-plane weergaven van bepaalde organen (bijv. Lange asweergave van de nier) herpositionering van het dier en kan het moeilijk te bereiken zijn. Extra vrijheidsgraden kunnen worden toegevoegd aan de robotbeweging om deze uitdaging te verbeteren. Ten derde hebben we af en toe nagalmartefacten waargenomen die voortkomen uit het akoestische membraan dat het dier scheidt van de transducer die de visualisatie van oppervlakkige kenmerken en grenzen kan verdoezelen. In deze gevallen kan het gebruik van een gel standoff om het dier uit de buurt van het membraan te brengen de situatie verhelpen. Ten slotte is de temperatuurregeling via een warmtelamp onnauwkeurig en daarom moet er tijdens het beeldmateriaal veel aandacht worden besteed aan de kerntemperatuur van het dier. Meer gecontroleerde verwarmingsmechanismen, zoals een geïntegreerd verwarmingskussen, zullen waarschijnlijk het homeostasebeheer en de beeldvormingsdoorvoer verbeteren.
Het gebruik van robotic US kan van toepassing zijn op verschillende onderzoeksgebieden. Deze technologie maakt visualisatie van grove weefselstructuren mogelijk, dus kan worden gebruikt om tumorprogressie en potentiële therapieën6,9 te volgen, evenals renale morfologie zoals hier gepresenteerd. De mogelijkheid om de specifieke kenmerken van de afbeeldingen te segmenteren maakt het een aantrekkelijk hulpmiddel voor het bestuderen van modellen van polycystische nierziekte (PKD)3. M-modus beelden maken een eenvoudige kwantificering van vele belangrijke cardiale parameters mogelijk, waardoor in vivo beoordeling van de hartfysiologie mogelijk is. Aangezien de nieren 20% -25% van de cardiale output ontvangen10, is het belangrijk om de hartfunctie te begrijpen tijdens de longitudinale beoordeling van nierpathologie. Via deze Amerikaanse protocollen hebben we geprobeerd te illustreren dat Amerikaanse beeldvorming niet alleen praktisch is voor in vivo en longitudinale nierstudies, maar ook dat in toenemende mate Amerikaanse hulpmiddelen zowel morfologische als fysiologische beoordeling van muizen in preklinische studies mogelijk maken.
Disclosures
Verschillende auteurs zijn in dienst van, hebben een aanzienlijk financieel belang in, of zijn mede-uitvinders van octrooien in licentie gegeven door SonoVol, Inc. (CJM, RCG, TJC).
Acknowledgments
Dit werk werd ondersteund door de NIH (R43-DK126607, TJC, TLK, MFR) en de Mayo Foundation.
Materials
| Name | Company | Catalog Number | Comments |
| Electric Razor | Braintree Scientific, Inc | CLP-9868 14 | |
| C57bk6j | The Jackson laboratory | https://www.jax.org/ | |
| Cotton gauze pads | Fisher Scientific | ||
| Cotton tipped applicators | Fisher Scientific | ||
| Depilatory cream | N/a | N/a | This study used Nair |
| Heat lamp | Included with SonoVol Vega system | ||
| Robotic Ultrasound System | SonoVol Inc | SonoVol Vega system includes anesthesia system | |
| SonoEQ Software | SonoVol | Included with SonoVol Vega system | |
| TERRELL Isoflurane | Piramal Critical Care, Inc | NDC 66794-019-10 |
References
- Cunha, L., et al. Preclinical imaging: an essential ally in modern biosciences. Molecular Diagnostics & Therapy. 18 (2), 153-173 (2014).
- Ultrasound. NIBIB. , Available from: https://www.nibib.nih.gov/science-education/science-topics/ultrasound#pid-936 (2016).
- Beaumont, N. J., et al. Assessing polycystic kidney disease in rodents: Comparison of robotic 3d ultrasound and magnetic resonance imaging. Kidney360. 1 (10), 1128-1136 (2020).
- Hopp, K., et al. Functional polycystin-1 dosage governs autosomal dominant polycystic kidney disease severity. The Journal of Clinical Investigation. 122 (11), 4257-4273 (2012).
- Weiss, R. M., Ohashi, M., Miller, J. D., Young, S. G., Heistad, D. D. Calcific aortic valve stenosis in old hypercholesterolemic mice. Circulation. 114 (19), 2065-2069 (2006).
- Czernuszewicz, T. J., et al. A new preclinical ultrasound platform for widefield 3D imaging of rodents. Review of Scientific Instruments. 89 (7), 075107 (2018).
- Chong, W. K., Papadopoulou, V., Dayton, P. A. Imaging with ultrasound contrast agents: current status and future. Abdominal Radiology (NY). 43 (4), 762-772 (2018).
- Nyankima, A. G., Kasoji, S., Cianciolo, R., Dayton, P. A., Chang, E. H. Histological and blood chemistry examination of the rodent kidney after exposure to flash-replenishment ultrasound contrast imaging. Ultrasonics. 98, 1-6 (2019).
- Rojas, J. D., et al. Ultrasound measurement of vascular density to evaluate response to anti-angiogenic therapy in renal cell carcinoma. IEEE Transactions on Biomedical Engineering. 66 (3), 873-880 (2019).
- Boron, W. F., Boulpaep, E. L. Medical Physiology. 3rd edn. , Elsevier. (2017).
Tags
Geneeskunde Nummer 174Erratum
Formal Correction: Erratum: Use of 3D Robotic Ultrasound for In Vivo Analysis of Mouse Kidneys
Posted by JoVE Editors on 10/06/2021.
Citeable Link.
An erratum was issued for: Use of 3D Robotic Ultrasound for In Vivo Analysis of Mouse Kidneys. An author name was updated, along with the Protocol and Representative Results sections.
The name of an author was updated from:
Ryan C. Gesser
to:
Ryan C. Gessner
Step 3.1 of the Protocol was updated from:
Turn on the US machine and the heat lamp above the US platforms. Turn on the appropriate anesthesia valves for the corresponding US bays that will be used.
to:
Turn on the US machine and the switch for the internal heating element for the US bays. Turn on the appropriate anesthesia valves for the corresponding US bays that will be used.
Figue 1 in the Representative Results was updated from:
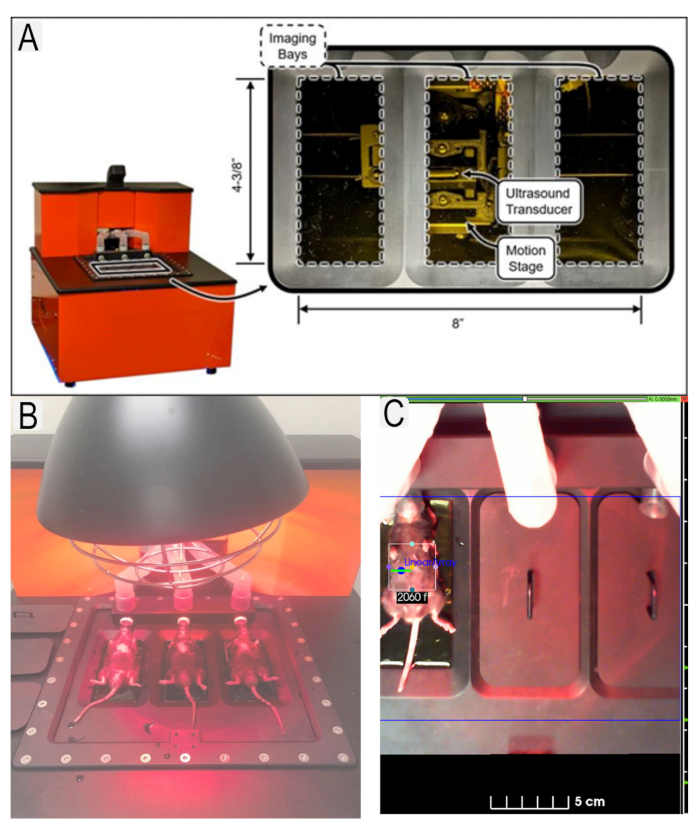
Figure 1: Ultrasound system and mouse placement. (A) Diagram of ultrasound system and location of transducers. (B) View of mice in supine position on ultrasound platform with heat lamp. (C) Example of region of interest (ROI)s in place for area of interest (kidneys) with animal IDs. Please click here to view a larger version of this figure.
to:

Figure 1: Ultrasound system and mouse placement. (A) Diagram of ultrasound system and location of transducers. (B) View of mice in supine position on ultrasound platform. (C) Example of region of interest (ROI)s in place for area of interest (kidneys) with animal IDs. Please click here to view a larger version of this figure.



