ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Denne protokollen demonstrerer robot ultralyd (USA) som et praktisk, kostnadseffektivt og raskt alternativ til tradisjonelle ikke-invasive bildemodaliteter.
Abstract
Vanlige modaliteter for in vivo-avbildning av gnagere inkluderer positronutslippstomografi (PET), beregnet tomografi (CT), magnetisk resonansavbildning (MR) og ultralyd (USA). Hver metode har begrensninger og fordeler, inkludert tilgjengelighet, brukervennlighet, kostnad, størrelse og bruk av ioniserende stråling eller magnetiske felt. Denne protokollen beskriver bruken av 3D robotic US for in vivo-avbildning av gnager nyrer og hjerte, påfølgende dataanalyse og mulige forskningsapplikasjoner. Praktiske anvendelser av robot-USA er kvantifisering av totalt nyrevolum (TKV), samt måling av cyster, svulster og vaskulatur. Selv om oppløsningen ikke er så høy som andre modaliteter, gir robotisert USA mulighet for mer praktisk innsamling av data med høy gjennomstrømning. Ved bruk av amerikansk M-modus-avbildning kan hjertefunksjonen kvantifiseres. Siden nyrene får 20% -25% av hjerteutgangen, er vurdering av hjertefunksjon avgjørende for forståelsen av nyrefysiologi og patofysiologi.
Introduction
De vanligste modalitetene for in vivo gnageravbildning inkluderer positronutslippstomografi (PET), optisk avbildning (OI), beregnet tomografi (CT), magnetisk resonansavbildning (MR) og ultralyd (USA). Disse teknikkene gir in vivo-bilder med høy oppløsning, slik at undersøkere kvantitativt kan vurdere og langsgående følge sykdomsmodeller som ikke er invasivt1. Mens hver bildemodalitet har begrensninger, gir de også uvurderlige verktøy for preklinisk forskning.
Her beskriver studien et amerikansk system og presenterer protokollen for robot- og 3D-gnageravbildning. Amerikanske bølger produseres av en sonde kalt en svinger, som vanligvis holdes for hånd. Lydbølger reflekteres tilbake når de samhandler med vev, og ekkoene rekonstrueres til bilder2. Protokollen beskrevet her vil fokusere på nyre- og hjerteavbildning ved hjelp av en robotstyrt transduser og bruke programvare som tillater rask 3D-rekonstruksjon for kvantitativ vurdering.
Robotic US er en rask, pålitelig og ikke-invasiv avbildningsmodalitet som gjør det mulig for etterforskere å gjennomføre studier med høy gjennomstrømning og langsgående studier. Sammenlignet med håndholdte amerikanske metoder er den robotiserte amerikanske metoden tidseffektiv, da opptil tre dyr kan skannes i løpet av få minutter. Høy gjennomstrømning for nyremålinger tyder på at opptil 20 mus per time kan avbildes. Robottransduserne er plassert under de akustiske membranene og beveger seg uavhengig av dyret med to frihetsgrader (figur 1A). Dette gjør det mulig for nybegynnere å skaffe bilder av høy kvalitet, mens håndholdte amerikanske metoder er mer utsatt for brukerfeil. Den koblede programvaren tillater effektiv 3D-nyrerekonstruksjon i sanntid. Tidligere har magnetisk resonansavbildning (MR) vært en utbredt metode for ikke-invasiv avbildning på grunn av den utmerkede bløtvevskontrasten, mangelen på radioaktivitet og penetrasjonsdybde. MR krever imidlertid ofte lange anskaffelsestider og er kostbar å utføre. USA har blitt evaluert som et pålitelig og raskere alternativ til MR i vurderingen av totalt nyrevolum (TKV)3.
Protocol
Alle trinnene i denne protokollen er i samsvar med Mayo Clinic (Rochester, MN) dyr bruker retningslinjer og har blitt godkjent av Mayo Clinic Institutional Animal Care and Use Committee.
1. Dyremodell
- Få mus fra kommersielle kilder.
MERK: C57BL/6J (alder = 18 måneder; n = 22 (7 menn, 15 kvinner)) (Materialtabell) og Pkd1(RC/RC) (alder = 18 måneder; n = 9 (3 menn, 6 kvinner))4 ble brukt til studien.
2. Hårfjerning
- Bedøv dyret ved hjelp av fordampet isofluran (2%-3%) i et anestesikammer. Forsikre deg om at dyret er tilstrekkelig bedøvet ved å utføre en tåklemme. Sørg for at musen puster med en hastighet på ca. 60-90 pust/min uten åpenbar luft gulping.
MERK: Fordampet isofluran ble valgt på grunn av evnen til å kontrollere og finjustere dyrets anestesinivå. Isofluran blandet med 100% oksygen ble brukt. - Bruk en elektrisk barberhøvel til å barbere ønsket hudområde for amerikanske målinger.
MERK: I denne studien er fokuset på nyre- og hjertemålinger, slik at dyrets bryst og rygg ble barbert. - Påfør depilatorisk krem på dyrets barberte hud med en bomullsspisset applikator. Tørk av fløten etter 30-60 s med et tørt papirhåndkle. Fortsett deretter å tørke bort depilatoriske kremrester ved hjelp av våte gasbindputer. Kontroller at hårfjerningen er fullført før du begynner å skanne.
MERK: Gjenværende hår vil forstyrre bildekvaliteten; fullstendig hårfjerning er avgjørende. Det er imidlertid nødvendig å tørke av depilatorisk krem innen et minutt for å forhindre skade dyrets hud. Rester av depilatorisk krem på dyret kan flekke bildemembranen til den amerikanske maskinen. Sørg for riktig rengjøring av dyret ved hjelp av våte gasbindputer.
3. Dyreposisjonering
- Slå på den amerikanske maskinen og bryteren for det interne varmeelementet for de amerikanske buktene. Slå på de aktuelle anestesiventilene for de tilsvarende amerikanske buktene som skal brukes.
MERK: Den amerikanske maskinen må være slått på før du starter den amerikanske bildeprogramvaren. - Fyll buktene med nok vann til å dekke membranen. Plasser det bedøvede dyret i nesekjeglen.
- For hjertemålinger, plasser dyret i en utsatt posisjon og vinkle det ca. 30° til høyre.
- For nyremålinger, plasser dyret i en rett og liggende stilling. Flat forsiktig ut dyrets kropp for å minimere luftlommene mellom dyret og membranen (figur 1B).
MERK: Hvis du kjører en finger ved siden av dyrets kropp, kan du fjerne eventuelle luftbobler som holder seg til huden, noe som vil forstyrre avbildningen. Bruk vann eller amerikansk saltvannsgel som amerikansk medium; men vann letter den raske avbildningen som er diskutert her.
4. Ultralydmålinger
- I den amerikanske bildebehandlingsprogramvaren velger du AMERIKANSK anskaffelse og lar instrumentet initialiseres.
- Nyreavbildning ved hjelp av B-modus.
- Skriv inn et navn på studien i den aktuelle dialogboksen.
- Angi dyre-IDen i den aktuelle dialogboksen.
MERK: Opptil tre dyr kan avbildes sekvensielt. - Klikk på fanen merket 3D for å initialisere 3D-skanning.
- Bruk live kamera feed, flytte regionen av interesse (ROI) boksen for å inneholde nyrene.
MERK: Størrelsen på avkastningen kan justeres avhengig av størrelsen på bildemålet. Hvis du øker størrelsen på avkastningen, øker skannetiden litt (figur 1C). Avhengig av avkastningens størrelse, vil skanneren automatisk justere antall passeringer som kreves for at svingeren skal kunne skanne hele avkastningen. - Avhengig av hvilken type bilde du ønsker, velger du Lineær matrise eller Wobbler for å velge svingeren. Velg mellom Hurtigskanning eller Optimalisert for enten svinger.
MERK: Lineær matrise er raskere og gir vanligvis tilstrekkelig avbildning. Wobbler-svingeren kan brukes hvis den ikke er i stand til å oppnå ønsket bildekvalitet med den lineære matrisen. Wobbler-svingeren bruker en bølgelengde med høyere frekvens og gir derfor mer definisjon i bilder. Alternativet Hurtigskanning får bilder av middels kvalitet uten pustekorrigering med høyere hastighet. Selv om det optimaliserte alternativet krever litt mer tid, gir det bedre bildekvalitet og gir mulighet for pustekorrigering. Dette manuskriptet vil fokusere på å bruke den optimaliserte lineære matriseforhåndsinnstillingen. - Klikk på Live View for å se et live bilde av ønsket visningsområde.
- Hvis du vil flytte svingeren, klikker du den sirkelformede Gå til -knappen, og deretter klikker du på området med musen som skal avbildes. Bruk retningspilene med forhåndsbestemte trinnstørrelser for å finjustere svingerposisjonen.
- Klikk på pilen ved siden av kontrollpanelvinduet for å åpne innstillingsskuffen. Klikk på Scan Protocol for å åpne skanneinnstillinger.
- Bestem den ideelle brennvidden og juster glidebryterne for TGC (tidsøkningskompensasjon) for å endre bildekontrasten for å vise nyrene best mulig. Etter å ha oppnådd de ønskede innstillingene, klikker du på pilen igjen for å lukke innstillingsskuffen.
- Trykk på Acquire Static-knappen for å starte 3D-skanning.
MERK: Fremdriften av skanningen vises via en fremdriftslinje nederst til venstre i programvaren. - Når skanningen er fullført, kontrollerer du bildekvaliteten ved å klikke på den blå nedlastingspilen for å åpne skanningen i forhåndsvisningsmodus. Flytt gjennom 3D-rammene i skanningen ved å dra den røde pilen øverst i vinduet. Hvis du vil zoome inn eller ut, holder du nede CTRL-tasten og bruker rulleknappen på musen.
- Hvis du vil skanne flere dyr, oppdaterer du dialogboksene for dyre-ID, skriver inn de nye IDene og gjentar trinnene ovenfor.
MERK: Når skanningene er fullført, tørker du av dyrene og returnerer dem til hjemmeburene.
- Hjerteavbildning ved hjelp av M-modus.
MERK: M-modus er visning av en ultralydbølge langs en bestemt, valgt ultralydlinje.- Klikk på M-modus-fanen for å aktivere hjerteavbildning.
MERK: Bare ett dyr kan avbildes om gangen. - Forsikre deg om at dyret er i riktig posisjon for hjerteskanning (trinn 2.2). Flytt avkastningen til den omtrentlige plasseringen av hjertet.
- Trykk på Hjertesøker-knappen for å finne hjertet. Bruk varmekartet til å optimalisere plasseringen av svingeren. Bruk den sirkulære Gå til-knappen for å flytte svingeren til venstre ventrikel (figur 2A).
- Gå til Live View og bruk pilknappene til å plassere svingeren mellom papillære muskler (figur 2B). Hvis du vil kontrollere riktig plassering av svingeren, kan du se sporingen av M-modus (figur 2D).
- Når svingeren er i riktig posisjon, klikker du på Acquire Sequence. Klikk på den blå nedlastingspilen for å se den fullførte skanningen.
- Klikk på M-modus-fanen for å aktivere hjerteavbildning.
5. Nyreanalyse (analysemekanikk)
- Åpne Bildeanalyse-fanen , og velg Last inn volum(er) -knappen for å legge inn bildefilene/mappene.
- Segmentering
- Flytt de fargede linjene som representerer ulike plan for å finne nyrene i alle flyene.
- Klikk på Legg til for å legge til en ny segmentering. Angi et kodenavn for filen.
- Bruk Surface Cut-knappen til å legge til punkter rundt den ytre kanten av nyrene i flere plan. Klikk på Bruk for å generere segmentering gjennom hele nyrene (figur 3A).
- Bla gjennom de forskjellige rammene i hvert plan og rediger eventuelle unøyaktige regioner ved å klikke på Rediger og dra punktene til riktig sted.
- Alternativt, hvis nyrene er uregelmessige i form, kan du bruke Draw-funksjonen til å lage et uregelmessig formet spor rundt nyrene. Klikk punkter rundt kanten, eller hold nede venstre klikk for å tegne sporfrihånden.
- Høyreklikk med musen for å fullføre sporingen med Tegne-knappen . Rull fremover flere rammer, og gjenta sporingsprosessen.
- Gjenta til rammene spores i hele interesseområdet.
- Hvis Draw-funksjonen brukes, velger du Fyll mellom stykker for å kontrollere og justere sporingen. Klikk på Initialiser for å se en forhåndsvisning. Hvis forhåndsvisningen er akseptabel, klikker du på Bruk. Hvis ikke, klikker du avbryt og endrer sporingene.
MERK: Slett-knappen tillater sletting av et område i en sporing. Jevn ut-knappen jevner ut ujevne kanter på en sporing. - Når bildeanalysen er tilfredsstillende, velger du Lagre for å lagre analysen i den opprinnelige bildefilen.
- Måling
- Bruk Calipers-funksjonen til å måle funksjoner i bildet. Klikk på Calipers-knappen og venstreklikk på de to punktene i avstanden som skal måles (figur 3B).
- Lagre målingen ved å klikke på diskknappen øverst på skjermen.
- Segmentering
6. Hjerteanalyse
- Velg Last inn volumer for å skrive inn filen(e) som skal analyseres.
- Velg alternativet Legg til .
- Bruk punktplasseringsverktøyet til å spore systolen og diastolen for hvert lag med hjertevev. Fortsett med de andre lagene av hjertevev. Bruk Rediger-funksjonen til å endre sporene (figur 2C,D).
MERK: Hvis M-modussporingen er veldig klar, bruker du Legg til (automatisk) -knappen for å generere sporinger av hvert lag automatisk. - Velg Bruk for å beregne hjerteparametrene. Vis kategorien Kvantifiser , og velg Eksporter statistikk for å eksportere alle data som en *.csv-fil (figur 2E).
Representative Results
Resultater av nyreanalyse
Overflateareal og volumdata er hentet fra segmentering av nyrene. Denne informasjonen kan brukes til å sammenligne eksperimentelle modeller og kontrollmodeller eller spore endringer over tid. Kaliperverktøyet er nyttig for raskt å måle abnormiteter (dvs. cyster, svulster) og hvordan de endres i lengde over tid. Figur 3 antyder at både segmenterings- og kalipermetodene kan brukes til å måle cystevolumer nøyaktig. Figur 4 viser en klar forskjell i totalt nyrevolum (TKV) mellom alderstilpassede kontroll- og eksperimentelle (Pkd1RC/RC)-mus. 3D-visualisering av disse volumgjengivelsene kan utføres i systemet, inkludert rotasjoner innenfor 3D-rom (figur 5). Disse 3D-rekonstruksjonene brukes deretter til å beregne TKV (mm3; Figur 4) så vel som individuelle store cystevolum.
Resultater av hjerteanalyse
Mange nyttige parametere er hentet fra analysen av M Mode-bilder. Disse dataene gir et godt øyeblikksbilde av venstre ventrikulær (LV) hjertefunksjon på det tidspunktet. Datautgangen inkluderer LV intern diameter, LV bakre vegg, LV fremre veggdiameter, utkasterfraksjon, brøkdelsforkortelse, slagvolum, hjertefrekvens, hjerteutgang, LV-volum og LV-masse. Suksessen med hjerteanalyse er avhengig av nøyaktig segmentering av lagene på M Mode-bildet. De fleste kardiovaskulære resultater beregnes av topp systoliske og diastoliske faser av bakre og fremre endokardiale lag. Det bakre epikardiale laget ser lyst hvitt ut og følger et lignende mønster som det bakre endokardielle laget. Sporingen for det bakre endokardlaget bør plasseres på den laveste konturen. Det fremre endokardielle laget skal spores langs den høyeste konturen til det laget. Det fremre epikardiallaget vises lineært nederst i bildet på grunn av dyrets utsatte posisjonering (figur 2D). Figur 6 viser et eksempel på en studie uten signifikant forskjell i hjerteutgang mellom eksperimentelle mus og kontrollmus. Som med nyreavbildning er 3D-hjertevisualisering mulig. Likevel tillater en 4D-visualisering av hjertesyklusen (tilleggsfigur 1) undersøkeren å visualisere og finne både morfologiske og syklus-dynamiske abnormiteter i det vurderte dyret.
Morfologi vurdering
For rask og billig vurdering kan USA effektivt overvåke fysiologiske parametere langsgående. Imidlertid ønsker mange studier i tillegg å bestemme finere morfologiske egenskaper, for eksempel antall og størrelser av cyster, forkalkninger (nyrestein), vaskularisering eller grad av fibrose. Figur 7 sammenligner en normal muse nyre med en cystisk mus nyre til en moderat forkalket mus nyre. Ved å øke den amerikanske senterfrekvensen (10 MHz med den lineære matrisen) til 35 MHz (wobblerforsterker), kan bilder av økende detaljer oppnås.

Figur 1: Ultralydsystem og museplassering. (A) Diagram over ultralydsystem og plassering av transdusere. (B) Syn på mus i liggende stilling på ultralydplattform. (C) Eksempel på interesseområde (ROI) er på plass for interesseområde (nyrer) med dyre-IDer. Klikk her for å se en større versjon av denne figuren.

Figur 2: Hjerte ultralydavbildning for å oppnå fysiologiske parametere. (A) Bruk av Heart Finder-varmekartbildet for å plassere svingeren i venstre ventrikel for M-modus-avbildning. Svingerens plassering i venstre ventrikel er indikert av den store grønne prikken. (B) Visning av transduseren når den plasseres riktig over papillære muskler (prikket boks). (C) Eksempelvisning av lag som trengs for å måle hjerteparametere. (D) Visning av levende M-modus-bilde med lag angitt som i panel C. (Lag fra topp til bunn: bakre epikardiale, bakre endokardiale, fremre endokardielle og fremre epikardielle.) (E) Eksempel på produksjon av statistikk generert fra hjertemålinger. Klikk her for å se en større versjon av denne figuren.

Figur 3: Bruke segmenterings- og kaliperverktøy til å måle nyrer og cyster. (A) Eksempelsegmenteringer (aksialvisning) av begge nyrene (blå og oransje skyggelegging) og en stor cyste (gul) med volumer listet opp nedenfor. Visninger som ikke er segmentert, vises under slik at usa som ikke er usikret, kan vises. (B) Eksempel på bruk av kalipere for å måle samme cyste (sagittal visning) fra figur 3A med målinger nedenfor. Volumet ble beregnet ved hjelp av formelen for en ellipse (volum = (4/3)π x x b x c, der a, b, c er relative x, y, z, henholdsvis). Klikk her for å se en større versjon av denne figuren.

Figur 4: TKV-distribusjoner av WT og cystiske muse nyrer. Representasjon av TV-er for villtype (WT) (C57BL/6J) og syke (Pkd1RC/RC) mus. n = 22 (WT) n = 9 (Pkd1RC/RC); Resultater av to-tailed t-test: p < 0.0001. Boksen viser 25-75. persentilverdier og whiskers viser 1,5 ganger interkvartilt område. Klikk her for å se en større versjon av denne figuren.

Figur 5: Animert 3D-rekonstruksjon av segmenterte nyrer og cyste. Ved hjelp av programvaren kan 3D-projeksjonene av nyrene og cysten roteres eller gynges i 3D-rommet (blå = venstre nyre; gul = stor cyste; oransje = høyre nyre). Klikk her for å laste ned denne figuren.

Figur 6: Hjertefysiologiske parametere fra amerikanske målinger. Representasjon av hjerteutgang (ml/min) for WT og syke (Pkd1RC/RC) mus. n = 22 (WT) n = 9 (Pkd1RC/RC). De lavere tabulerte dataene viser at det ikke er noen signifikant forskjell for disse to gruppene i ejeksjonsfraksjon, slagvolum, hjertefrekvens (HR) eller hjerteutgang (CO). Resultater av to-tailed t-test: p > 0,05. Boksen viser 25-75. Klikk her for å se en større versjon av denne figuren.

Figur 7: Sammenligning av amerikanske sagittale deler av normale og to patologier. (A) Wild-type (C57BL/6J stamme) nyre (TKV = 143,202 mm3). (B) Cystisk nyre med økt TKV (Pkd1RC/RC-mus ) (TKV = 333,158 mm3). Cyster er indikert med gule piler. (C) Nyre med vaskulære forkalkninger (Modell = Lav tetthet Lipoprotein Reseptor Mangelfull, Apolipoprotein B100-bare mus matet et vestlig kosthold i 12 måneder5) (TKV = 127.376 mm3). Nyrestein er indikert med grønne piler. Klikk her for å se en større versjon av denne figuren.
Supplerende figur 1: 4D-hjertesyklusfilm fra amerikanske målinger. Ved hjelp av programvaren fanges en representasjon av det bankende hjertet i 3D USA og projiseres gjennom hjertesyklusen. Den grønne pilen angir aortaventilen. (Modell = Lipoproteinreseptormangel med lav tetthet, Apolipoprotein B100-mus, matet et vestlig kosthold i 12 måneder5). Denne modellen genererer vaskulære forkalkninger som muliggjør enklere visualisering av hjerte og ventiler på grunn av større akustisk reflektivitet av forkalkningene i USA. Lignende 4D-rekonstruksjoner er mulig med WT-mus; Den fangede akustiske kontrasten vil imidlertid ikke være så høy. Klikk her for å laste ned denne filen.
Discussion
Ultralyd utnytter lydbølger, og eventuelle barrierer for lydbølgeutbredelse vil forstyrre bildekvaliteten. Dermed er fullstendig hårfjerning av området som skal avbildes kritisk. Det er også viktig å sikre fullstendig fjerning av depilatorisk krem, da det kan forårsake brannskader / irritasjon av dyrets hud og misfarge skannerens gjennomsiktige membran. Tilstrekkelig vannstand i buktene er nødvendig for optimal lydbølgeutbredelse, og kreves derfor for å oppnå den høyeste bildeoppløsningen. Men når dyret er i en utsatt posisjon, må du sørge for at dyrets snute er over vannstanden eller at dyret er i fare for vanninnånding. Optimalisering av bildeparametere, spesielt brennvidde, er avgjørende for å få bilder av høy kvalitet. Modifikasjoner på parametere kan være nødvendig for individuelle dyr.
Robotic US gir mange fordeler i forhold til tradisjonelle håndholdte amerikanske modaliteter. For det første bruker systemet et enkelt pek-og-klikk kamerabasert grensesnitt. Denne funksjonen tar for seg kompleksiteten i konvensjonelle USA og produserer konsistente data selv når de drives av en nybegynner bruker6. For det andre tillater systemet bruk av vann i stedet for tradisjonell amerikansk gel som et akustisk medium. Tidligere tillot bruken av amerikansk gel dannelsen av bobler som forstyrret kvalitetsbildeanskaffelse. Den amerikanske gelen er også rotete og gir utfordringer for opprydding. Videre blir vannet oppvarmet av varmelampen og bidrar til å opprettholde dyrets kroppstemperatur. For det tredje er det robotiserte USA raskere, så gjenstander fra respiratorisk bevegelse er ikke problematiske. Den økte bildehastigheten gjør det mulig å fullføre datainnsamling med høy gjennomstrømning. For det fjerde får robot-USA 3D-bilder, og gjør derfor 3D-rekonstruksjon av objekter enkelt (figur 4). MR og andre modaliteter er dyre, tidkrevende og ikke alltid tilgjengelige. Det er viktig at det robotiserte amerikanske systemet passer på et bord eller en benk og er mer kostnadseffektivt. Til slutt viste tidligere arbeid at robotisert USA kunne gi sammenlignbare måledata til dyrere modaliteter, for eksempel MR3.
Mens bildekvaliteten og oppløsningen til det robotiserte amerikanske systemet som er beskrevet i dette arbeidet, var tilstrekkelig for den foreslåtte applikasjonen (figur 7), er det flere måter bildekvaliteten kan forbedres i fremtiden. Bruk av svingere med høyere frekvens (f.eks. 50-70 MHz) vil for eksempel resultere i bilder med høyere oppløsning med bedre funksjonsdefinisjon. Mens bruk av høyere frekvenser vil resultere i en dårligere dybde av penetrasjon, bildene bør være tilstrekkelig for in vivo avbildning av overfladiske organer, for eksempel musen nyre. Som med andre bildemodaliteter, kan kontrastmidler brukes til å forbedre spesifikke funksjoner. For USA betyr dette vanligvis å bruke noe svært reflekterende av lydbølger. Intravaskulære mikrobobler der lipider omgir svært små gassbobler er et slikt middel. Gassboblene i mikronstørrelse er svært reflekterende og gir dermed et annet tydelig signal som oversettes til en høy oppløsning av vaskulatur7. Selv om denne akustiske kontrastteknikken kan være ganske nyttig, kan den ha flere ulemper. For det første må mikroboblene gjøres friske og bare vedvare in vivo i 5-10 min. For det andre krever in vivo intravaskulær injeksjon vanligvis tail veil kateterisering for injeksjon, og dette kan være teknisk utfordrende. Under visse omstendigheter og pulserende regimer kan mikrobubble-avbildning i seg selv føre til nyrevaskulaturskade8.
Det er også noen mer generelle begrensninger i det aktuelle amerikanske systemet som brukes. For det første er bare en lineær matrise (sentrert ved 18 MHz) inkludert i robotkabinettet, så det er for øyeblikket ikke mulig å bytte til høyere eller lavere frekvenssonder. Dette kan påvirke bredden av modeller (enten større eller mindre) som kan evalueres med systemet. Fremtidige gjentakelser av instrumentet bør inneholde flere lineære matriser for å dekke hele spekteret av prekliniske dyremodeller. For det andre kan svingervinkelen i forhold til dyremotivet ikke kontrolleres. Derfor krever det å utføre vinkelavhengige bildeteknikker, for eksempel Doppler, eller oppnå alternative in-plane visninger av visse organer (f.eks. lang aksevisning av nyre) omplassering av dyret og kan være vanskelig å oppnå. Ytterligere frihetsgrader kan legges til robotbevegelsen for å forbedre denne utfordringen. For det tredje har vi noen ganger observert gjenklangartefakter som oppstår fra den akustiske membranen som skiller dyret fra transduseren som kan skjule visualisering av overfladiske egenskaper og grenser. I disse tilfellene kan bruk av gel standoff for å heve dyret bort fra membranen rette opp situasjonen. Til slutt er temperaturkontroll via varmelampe upresis, og derfor må det tas hensyn til dyrets kjerne kroppstemperatur mens du forestiller deg. Mer kontrollerte varmemekanismer, for eksempel en integrert varmepute, vil sannsynligvis forbedre homeostasestyring og bildegjennomstrømning.
Bruken av robot-USA kan gjelde for ulike forskningsfelt. Denne teknologien muliggjør visualisering av grove vevsstrukturer, og kan dermed brukes til å spore tumorprogresjon og potensielle terapier6,9 samt nyremorfologi som presentert her. Evnen til å segmentere de spesifikke egenskapene til bildene gjør det til et attraktivt verktøy for å studere modeller av polycystisk nyresykdom (PKD)3. M-modus bilder tillater enkel kvantifisering av mange viktige hjerteparametere som muliggjør in vivo vurdering av hjertefysiologi. Ettersom nyrene får 20% -25% av hjerteutgangen10, er det viktig å forstå hjertefunksjon under langsgående vurdering av nyrepatologi. Gjennom disse amerikanske protokollene har vi forsøkt å illustrere at amerikansk avbildning ikke bare er praktisk for in vivo- og langsgående nyrestudier, men også at stadig mer amerikanske verktøy muliggjør både morfologiske så vel som fysiologiske vurderinger av mus i prekliniske studier.
Disclosures
Flere forfattere er enten ansatt av, har en betydelig økonomisk interesse i, eller er medoppfinnere på patenter lisensiert av SonoVol, Inc. (CJM, RCG, TJC).
Acknowledgments
Dette arbeidet ble støttet av NIH (R43-DK126607, TJC, TLK, MFR) og Mayo Foundation.
Materials
| Name | Company | Catalog Number | Comments |
| Electric Razor | Braintree Scientific, Inc | CLP-9868 14 | |
| C57bk6j | The Jackson laboratory | https://www.jax.org/ | |
| Cotton gauze pads | Fisher Scientific | ||
| Cotton tipped applicators | Fisher Scientific | ||
| Depilatory cream | N/a | N/a | This study used Nair |
| Heat lamp | Included with SonoVol Vega system | ||
| Robotic Ultrasound System | SonoVol Inc | SonoVol Vega system includes anesthesia system | |
| SonoEQ Software | SonoVol | Included with SonoVol Vega system | |
| TERRELL Isoflurane | Piramal Critical Care, Inc | NDC 66794-019-10 |
References
- Cunha, L., et al. Preclinical imaging: an essential ally in modern biosciences. Molecular Diagnostics & Therapy. 18 (2), 153-173 (2014).
- Ultrasound. NIBIB. , Available from: https://www.nibib.nih.gov/science-education/science-topics/ultrasound#pid-936 (2016).
- Beaumont, N. J., et al. Assessing polycystic kidney disease in rodents: Comparison of robotic 3d ultrasound and magnetic resonance imaging. Kidney360. 1 (10), 1128-1136 (2020).
- Hopp, K., et al. Functional polycystin-1 dosage governs autosomal dominant polycystic kidney disease severity. The Journal of Clinical Investigation. 122 (11), 4257-4273 (2012).
- Weiss, R. M., Ohashi, M., Miller, J. D., Young, S. G., Heistad, D. D. Calcific aortic valve stenosis in old hypercholesterolemic mice. Circulation. 114 (19), 2065-2069 (2006).
- Czernuszewicz, T. J., et al. A new preclinical ultrasound platform for widefield 3D imaging of rodents. Review of Scientific Instruments. 89 (7), 075107 (2018).
- Chong, W. K., Papadopoulou, V., Dayton, P. A. Imaging with ultrasound contrast agents: current status and future. Abdominal Radiology (NY). 43 (4), 762-772 (2018).
- Nyankima, A. G., Kasoji, S., Cianciolo, R., Dayton, P. A., Chang, E. H. Histological and blood chemistry examination of the rodent kidney after exposure to flash-replenishment ultrasound contrast imaging. Ultrasonics. 98, 1-6 (2019).
- Rojas, J. D., et al. Ultrasound measurement of vascular density to evaluate response to anti-angiogenic therapy in renal cell carcinoma. IEEE Transactions on Biomedical Engineering. 66 (3), 873-880 (2019).
- Boron, W. F., Boulpaep, E. L. Medical Physiology. 3rd edn. , Elsevier. (2017).
Tags
Medisin utgave 174Erratum
Formal Correction: Erratum: Use of 3D Robotic Ultrasound for In Vivo Analysis of Mouse Kidneys
Posted by JoVE Editors on 10/06/2021.
Citeable Link.
An erratum was issued for: Use of 3D Robotic Ultrasound for In Vivo Analysis of Mouse Kidneys. An author name was updated, along with the Protocol and Representative Results sections.
The name of an author was updated from:
Ryan C. Gesser
to:
Ryan C. Gessner
Step 3.1 of the Protocol was updated from:
Turn on the US machine and the heat lamp above the US platforms. Turn on the appropriate anesthesia valves for the corresponding US bays that will be used.
to:
Turn on the US machine and the switch for the internal heating element for the US bays. Turn on the appropriate anesthesia valves for the corresponding US bays that will be used.
Figue 1 in the Representative Results was updated from:
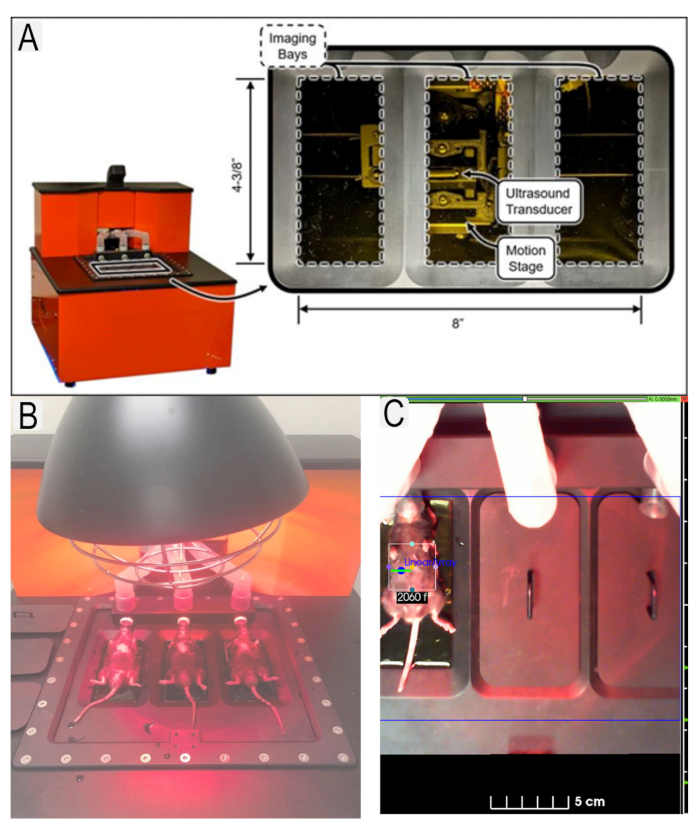
Figure 1: Ultrasound system and mouse placement. (A) Diagram of ultrasound system and location of transducers. (B) View of mice in supine position on ultrasound platform with heat lamp. (C) Example of region of interest (ROI)s in place for area of interest (kidneys) with animal IDs. Please click here to view a larger version of this figure.
to:

Figure 1: Ultrasound system and mouse placement. (A) Diagram of ultrasound system and location of transducers. (B) View of mice in supine position on ultrasound platform. (C) Example of region of interest (ROI)s in place for area of interest (kidneys) with animal IDs. Please click here to view a larger version of this figure.



