ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Este protocolo demonstra o ultrassom robótico (EUA) como uma alternativa prática, econômica e rápida às modalidades tradicionais de imagem não invasiva.
Abstract
As modalidades comuns para imagem in vivo de roedores incluem tomografia de emissão de pósitrons (PET), tomografia computadorizada (TC), ressonância magnética (RM) e ultrassom (EUA). Cada método tem limitações e vantagens, incluindo disponibilidade, facilidade de uso, custo, tamanho e uso de radiação ionizante ou campos magnéticos. Este protocolo descreve o uso de US robótico 3D para imagens in vivo de rins e coração de roedores, análise de dados subsequentes e possíveis aplicações de pesquisa. Aplicações práticas de US robótica são a quantificação do volume renal total (TKV), bem como a medição de cistos, tumores e vasculatura. Embora a resolução não seja tão alta quanto outras modalidades, os EUA robóticos permitem uma coleta de dados de alto rendimento mais prática. Além disso, usando imagens do modo M dos EUA, a função cardíaca pode ser quantificada. Como os rins recebem de 20%-25% da produção cardíaca, avaliar a função cardíaca é fundamental para a compreensão da fisiologia renal e da fisiopatologia.
Introduction
As modalidades mais comuns para imagem de roedores in vivo incluem tomografia de emissão de pósitrons (PET), imagem óptica (OI), tomografia computadorizada (TC), ressonância magnética (RM) e ultrassom (EUA). Essas técnicas fornecem imagens in vivo de alta resolução, permitindo que os pesquisadores avaliem quantitativamente e sigam longitudinalmente modelos de doenças não invasivamente1. Embora cada modalidade de imagem tenha limitações, elas também fornecem ferramentas inestimáveis para pesquisas pré-clínicas.
Aqui, o estudo detalha um sistema dos EUA e apresenta o protocolo para imagens robóticas e roedores 3D. As ondas americanas são produzidas por uma sonda chamada transdutor, que é tipicamente portátil. As ondas sonoras são refletidas de volta à medida que interagem com tecidos, e os ecos são reconstruídos em imagens2. O protocolo descrito aqui se concentrará em imagens renais e cardíacas usando um transdutor roboticamente controlado e usando um software que permite reconstrução 3D rápida para avaliação quantitativa.
Robotic US é uma modalidade de imagem rápida, confiável e não invasiva que permite aos investigadores realizar estudos longitudinais e de alta produtividade. Comparado aos métodos manuais dos EUA, o método robótico dos EUA é eficiente no tempo, já que até três animais podem ser escaneados em questão de minutos. O alto rendimento das medidas renais sugere que até 20 ratos por hora podem ser imagens. Os transdutores robóticos estão localizados sob as membranas acústicas e se movem independentemente do animal com dois graus de liberdade (Figura 1A). Isso permite que os usuários iniciantes obtenham imagens de alta qualidade, enquanto os métodos dos EUA portáteis são mais suscetíveis ao erro do usuário. O software acoplado permite uma reconstrução renal 3D eficiente e em tempo real. Anteriormente, a ressonância magnética (RM) tem sido um método prevalente para imagens não invasivas devido ao excelente contraste de tecido mole, falta de radioatividade e profundidade de penetração. No entanto, a ressonância magnética muitas vezes requer longos tempos de aquisição e é cara para realizar. Os EUA têm sido avaliados como uma alternativa confiável e mais rápida à ressonância magnética na avaliação do volume total dos rins (TKV)3.
Protocol
Todas as etapas deste protocolo estão em conformidade com as diretrizes de uso de animais da Clínica Mayo (Rochester, MN) e foram aprovadas pelo Comitê Institucional de Cuidados e Uso de Animais da Clínica Mayo.
1. Modelo animal
- Obtenha ratos de fontes comerciais.
NOTA: C57BL/6J (idade = 18 meses; n = 22 (7 machos, 15 fêmeas)) (Tabela de Materiais) e Pkd1(RC/RC) (idade = 18 meses; n = 9 (3 machos, 6 fêmeas))4 foram utilizados para o estudo.
2. Remoção de cabelo
- Anestesiar o animal usando isoflurano vaporizado (2%-3%) em uma câmara de anestesia. Certifique-se de que o animal está suficientemente anestesiado realizando uma pitada de dedo do dedo do dedo. Certifique-se de que o rato está respirando a uma velocidade de aproximadamente 60-90 respirações/min sem o ar óbvio de engolir.
NOTA: A isoflurano vaporizada foi escolhida devido à capacidade de controlar e ajustar o nível de anestesia do animal. Foi utilizado isoflurane misturado com 100% de oxigênio. - Use uma navalha elétrica para raspar a área de pele desejada para medições dos EUA.
NOTA: Neste estudo, o foco está nas medidas renais e cardíacas, de modo que o peito e as costas do animal foram raspados. - Aplique o creme depilatório na pele raspada do animal com um aplicador de ponta de algodão. Limpe o creme depois dos 30-60 usando uma toalha de papel seco. Em seguida, continue a limpar o resíduo de creme depilatório usando almofadas de gaze molhadas. Certifique-se de que a depilação esteja completa antes do início dos exames.
NOTA: Qualquer cabelo restante interferirá na qualidade da imagem; depilação completa é crucial. No entanto, é necessário limpar o creme depilatório dentro de um minuto para evitar ferir a pele do animal. O creme depilatório que sobra no animal pode manchar a membrana de imagem da máquina dos EUA. Certifique-se de limpeza adequada do animal usando almofadas de gaze molhadas.
3. Posicionamento animal
- Ligue a máquina dos EUA e o interruptor para o elemento de aquecimento interno para as baías dos EUA. Ligue as válvulas de anestesia apropriadas para as baias correspondentes dos EUA que serão utilizadas.
NOTA: A máquina dos EUA deve ser ligada antes de iniciar o software de imagem dos EUA. - Encha as baias com água suficiente para cobrir a membrana. Coloque o animal anestesiado no cone do nariz.
- Para medidas cardíacas, coloque o animal em posição propensa e o angule aproximadamente 30° para a direita.
- Para medições renais, coloque o animal em uma posição reta e supina. Achate suavemente o corpo do animal para minimizar as bolsas de ar entre o animal e a membrana (Figura 1B).
NOTA: Correr um dedo ao lado do corpo do animal pode remover quaisquer bolhas de ar que aduem na pele, o que interferirá com a imagem. Use água ou gel salino dos EUA como meio dos EUA; mas a água facilita a rápida imagem discutida aqui.
4. Medições de ultrassom
- No software de imagem dos EUA, selecione a aquisição dos EUA e permita que o instrumento inicialize.
- Imagem renal usando modo B.
- Digite um nome para o estudo na caixa de diálogo apropriada.
- Digite o ID animal na caixa de diálogo apropriada.
NOTA: Até três animais podem ser imagens sequencialmente. - Clique na guia rotulada 3D para inicializar a digitalização 3D.
- Usando a transmissão da câmera ao vivo, mova a caixa de região de interesse (ROI) para conter os rins.
NOTA: O tamanho do ROI pode ser ajustado dependendo do tamanho do alvo da imagem. O aumento do tamanho do ROI aumentará ligeiramente o tempo de varredura (Figura 1C). Dependendo do tamanho do ROI, o scanner ajustará automaticamente o número de passes necessários para o transdutor digitalizar todo o ROI. - Dependendo do tipo de imagem desejada, selecione Linear Array ou Wobbler, para escolher o transdutor. Selecione em Fast Scan ou Otimizado para transdutor.
NOTA: A matriz linear é mais rápida e geralmente fornece imagens adequadas. O transdutor oscilante pode ser utilizado se não for possível adquirir a qualidade de imagem desejada com a matriz linear. O transdutor oscilante utiliza um comprimento de onda de maior frequência e, portanto, fornece mais definição em imagens. A opção Fast Scan adquire imagens de qualidade média sem correção respiratória em uma velocidade maior. Embora a opção Otimizada exija um pouco mais de tempo, ela proporciona melhor qualidade de imagem e permite a correção da respiração. Este manuscrito se concentrará em usar a predefinição de matriz linear Otimizada. - Clique no Live View para ver uma imagem ao vivo da área de visualização desejada.
- Para mover o transdutor, clique no botão Circular Go To e clique na área do mouse a ser imagen. Use as setas direcionais com tamanhos de passo predeterminados para ajustar bem a posição do transdutor.
- Clique na seta na lateral da janela do Painel de Controle para abrir a bandeja de configurações. Clique em Protocolo de varredura para abrir as configurações de digitalização.
- Determine a profundidade focal ideal e ajuste os controles deslizantes para o TGC (compensação do ganho de tempo) para alterar o contraste de imagem para melhor visualizar os rins. Depois de alcançar as configurações desejadas, clique na seta novamente para fechar a Bandeja de Configurações.
- Pressione o botão Acquire Static para iniciar a digitalização 3D.
NOTA: O progresso da varredura é indicado através de uma barra de progresso no canto inferior esquerdo do software. - Uma vez que a digitalização esteja concluída, verifique a qualidade da imagem clicando na seta azul de download para abrir a varredura no Modo de Visualização. Mova-se através dos quadros 3D da varredura arrastando a seta vermelha na parte superior da janela. Para ampliar ou diminuir, segure a tecla Ctrl e use o botão de rolagem no mouse.
- Para digitalizar animais adicionais, atualize as caixas de diálogo do Animal ID, insira os novos IDs e repita as etapas acima.
NOTA: Quando os exames estiverem completos, seque os animais e devolva-os para suas gaiolas.
- Imagem cardíaca usando o modo M.
NOTA: O modo M é o display de uma onda de ultrassom ao longo de uma linha de ultrassom específica e escolhida.- Clique na guia Modo M para ativar imagens cardíacas.
NOTA: Apenas um animal pode ser imageado por vez. - Certifique-se de que o animal está na posição adequada para exames cardíacos (etapa 2.2). Mova o ROI para a localização aproximada do coração.
- Pressione o botão Localizador de Coração para localizar o coração. Use o mapa de calor para otimizar a localização do transdutor. Use o botão Ir circular para mover o transdutor para o ventrículo esquerdo (Figura 2A).
- Vá para o Live View e use os botões de seta para colocar o transdutor entre os músculos papilares (Figura 2B). Para verificar a colocação adequada do transdutor, visualize o traço do Modo M ao vivo (Figura 2D).
- Uma vez que o transdutor esteja na posição apropriada, clique em Adquirir sequência. Clique na seta de download azul para ver a digitalização completa.
- Clique na guia Modo M para ativar imagens cardíacas.
5. Análise renal (mecânica da análise)
- Abra a guia Análise de imagens e selecione o botão Volume de carga para inserir os arquivos/pastas de imagem.
- Segmentação
- Mova as linhas coloridas representando vários aviões para encontrar o rim em todos os aviões.
- Clique em Adicionar para adicionar uma nova segmentação. Forneça um nome de marcação para o arquivo.
- Use o botão Surface Cut para adicionar pontos ao redor da borda externa do rim em vários planos. Clique em Aplicar para gerar segmentação através de todo o rim (Figura 3A).
- Role os diferentes quadros em cada plano e edite quaisquer regiões imprecisas clicando em Editar e arrastando os pontos para o local correto.
- Alternativamente, se o rim estiver irregular em forma, use a função Draw para criar um traço de forma irregular ao redor do rim. Clique em pontos ao redor da borda ou segure o clique esquerdo para desenhar o traço à mão livre.
- Para completar o rastreamento com o botão Desenhar , clique com o botão direito do mouse. Role em frente vários quadros e repita o processo de rastreamento.
- Repita até que os quadros sejam rastreados por toda a região de interesse.
- Se a função Desenhar for usada, selecione Enchar entre fatias para verificar e ajustar o rastreamento. Clique em Initialize para ver uma pré-visualização. Se a visualização for aceitável, clique em Aplicar. Caso não, clique em Cancelar e modifique os rastreamentos.
NOTA: O botão Apagar permitirá a exclusão de uma região dentro de um traço. O botão Smooth suaviza as bordas irregulares de um traço. - Quando a análise da imagem for satisfatória, selecione Salvar para salvar a análise no arquivo de imagem original.
- Medição
- Use a função Pinças para medir características dentro da imagem. Clique no botão Pinças e à esquerda clique nos dois pontos da distância a ser medida (Figura 3B).
- Salve a medição clicando no botão de disco na parte superior da tela.
- Segmentação
6. Análise cardíaca
- Selecione Carregar volumes para inserir os arquivos para analisar.
- Selecione a opção Adicionar .
- Use a ferramenta Colocação de pontos para rastrear a sístole e a diastole para cada camada de tecido cardíaco. Continue com as outras camadas de tecido cardíaco. Use a função Editar para modificar os traços (Figura 2C,D).
NOTA: Se o traço do modo M estiver muito claro, use o botão Adicionar (automático) para gerar automaticamente traçados de cada camada. - Selecione Aplicar para calcular os parâmetros cardíacos. Exibir a guia Quantificar e selecione Estatísticas de Exportação para exportar todos os dados como um arquivo *.csv (Figura 2E).
Representative Results
Resultados da análise renal
Os dados de área de superfície e volume são adquiridos a partir da segmentação dos rins. Essas informações podem ser usadas para comparar modelos experimentais e de controle ou rastrear mudanças ao longo do tempo. A ferramenta de pinças é útil para medir rapidamente anormalidades (ou seja, cistos, tumores) e como elas mudam de comprimento ao longo do tempo. A Figura 3 sugere que os métodos de segmentação e pinça podem ser usados para medir os volumes de cisto com precisão. A Figura 4 demonstra uma clara diferença no volume total de rins (TKV) entre o controle compatível com a idade e os camundongos experimentais (Pkd1RC/RC). A visualização 3D dessas renderizações de volume pode ser realizada dentro do sistema, incluindo rotações dentro do espaço 3D (Figura 5). Essas reconstruções 3D são então usadas para calcular TKV (mm3; Figura 4) bem como volume individual de cisto grande.
Resultados da análise cardíaca
Muitos parâmetros úteis são adquiridos a partir da análise de imagens do Modo M. Esses dados fornecem um bom instantâneo da função cardíaca ventricular esquerda (LV) naquele momento. A saída de dados inclui diâmetro interno lv, parede posterior lv, diâmetro da parede anterior lv, fração de ejeção, encurtamento fracionado, volume de derrame, frequência cardíaca, saída cardíaca, volume LV e massa LV. O sucesso da análise cardíaca depende da segmentação precisa das camadas na imagem do Modo M. A maioria dos resultados cardiovasculares são calculados pelas fases sistólica e diastólica máxima das camadas posterior e anterior do endocárdio. A camada epicárardial posterior aparece branca brilhante e segue um padrão semelhante à camada endocárdial posterior. O traçado para a camada endocárdial posterior deve ser colocado no contorno mais baixo. A camada endocárdial anterior deve ser rastreada ao longo do contorno mais alto dessa camada. A camada epicárida anterior aparece linear na parte inferior da imagem devido ao posicionamento propenso do animal (Figura 2D). A Figura 6 mostra um exemplo de um estudo sem diferença significativa na produção cardíaca entre camundongos experimentais e de controle. Assim como a imagem renal, a visualização cardíaca 3D é possível. No entanto, uma visualização 4D do ciclo cardíaco (Figura Suplementar 1) permite ao pesquisador visualizar e identificar anormalidades morfológicas e ciclo-dinâmicas no animal avaliado.
Avaliação da morfologia
Para uma avaliação rápida e barata, os EUA podem monitorar efetivamente parâmetros fisiológicos longitudinalmente. No entanto, muitos estudos desejam determinar adicionalmente características morfológicas mais finas, por exemplo, número e tamanhos de cistos, calcificações (pedras nos rins), vascularização ou grau de fibrose. A Figura 7 compara um rim de rato normal a um rim de rato cístico a um rim de rato moderadamente calcificado. Ao aumentar a frequência central dos EUA (10 MHz com a matriz linear) para 35 MHz (amplificador oscilador), podem ser obtidas imagens de detalhes crescentes.

Figura 1: Sistema de ultrassom e colocação do rato. (A) Diagrama do sistema de ultrassom e localização de transdutores. (B) Vista dos camundongos em posição supina na plataforma de ultrassom. (C) Exemplo de região de interesse (ROI) em vigor para área de interesse (rins) com Ys animais. Clique aqui para ver uma versão maior desta figura.

Figura 2: Imagem de ultrassom cardíaco para obter parâmetros fisiológicos. (A) Uso da imagem do mapa de calor do Localizador de Coração para posicionar o transdutor no ventrículo esquerdo para imagem do Modo M. A localização do transdutor no ventrículo esquerdo é indicada pelo grande ponto verde. (B) Ver o transdutor quando colocado corretamente sobre os músculos papilares (caixa pontilhada). (C) Visão de exemplo das camadas necessárias para medir parâmetros cardíacos. (D) Ver a imagem do modo M ao vivo com camadas designadas como no painel C. (Camadas de cima para baixo: epicárido posterior, endocárdio posterior, endocardial anterior e epicardial anterior.) (E) Exemplo de saída de estatísticas geradas a partir de medidas cardíacas. Clique aqui para ver uma versão maior desta figura.

Figura 3: Utilização de ferramentas de segmentação e pinças para medir rins e cistos. (A) Segmentações de exemplo (visão axial) de ambos os rins (sombreamento azul e laranja) e um grande cisto (amarelo) com volumes listados abaixo. As visualizações não segmentadas são mostradas por baixo para que os EUA não obscurecidos possam ser vistos. (B) Exemplo de uso de pinças para medir o mesmo cisto (visão sagital) da Figura 3A com medidas abaixo. O volume foi calculado utilizando-se a fórmula para uma elipse (volume = (4/3)π x x b x c, onde a, b, c são relativos x, y, z, respectivamente). Clique aqui para ver uma versão maior desta figura.

Figura 4: Distribuições TKV de WT e rins de camundongos císticos. Representação de TKVs para camundongos do tipo selvagem (WT) (C57BL/6J) e doentes (Pkd1RC/RC). n = 22 (WT) n = 9 (Pkd1RC/RC); Resultados do teste t de duas caudas: p < 0,0001. A caixa mostra valores percentil de 25 a 75 vezes e os bigodes mostram 1,5 vezes a faixa interquartil. Clique aqui para ver uma versão maior desta figura.

Figura 5: Reconstrução 3D animada de rins segmentados e cisto. Utilizando o software, as projeções 3D dos rins e do cisto podem ser giradas ou balançadas no espaço 3D (azul = rim esquerdo; amarelo = cisto grande; laranja = rim direito). Clique aqui para baixar este número.

Figura 6: Parâmetros fisiológicos cardíacos das medições dos EUA. Representação de produção cardíaca (mL/min) para camundongos WT e doentes (Pkd1RC/RC). n = 22 (WT) n = 9 (Pkd1RC/RC). Os dados mais fracos tabulados mostram que não há diferença significativa para esses dois grupos em fração de ejeção, volume de derrame, frequência cardíaca (RH) ou saída cardíaca (CO). Resultados do teste t de duas caudas: p > 0,05. A caixa mostra valores percentil 25-75. Clique aqui para ver uma versão maior desta figura.

Figura 7: Comparação das seções sagiais dos EUA de rim normal e duas patologias. (A) Rim tipo selvagem (C57BL/6J) (TKV = 143.202 mm3). (B) Rim cístico com aumento de TKV (rato Pkd1RC/RC ) (TKV = 333.158 mm3). Cistos são indicados por setas amarelas. (C) Rim com calcificações vasculares (Modelo = Receptor de Lipoproteína de Baixa Densidade Deficiente, Apolipoproteína B100-only mouse alimentado com uma dieta ocidental por 12 meses5) (TKV = 127.376 mm3). Pedras renais são indicadas por flechas verdes. Clique aqui para ver uma versão maior desta figura.
Figura suplementar 1: filme de ciclo cardíaco 4D das medições dos EUA. Usando o software, uma representação do coração pulsante é capturada em 3D US e projetada através do ciclo cardíaco. A seta verde indica a válvula aórtica. (Modelo = Receptor de Lipoproteína de baixa densidade Deficiente, camundongo somente Apolipoproteína B100, alimentado com uma dieta ocidental por 12 meses5). Este modelo gera calcificações vasculares permitindo uma visualização mais fácil do coração e das válvulas devido à maior reflexividade acústica das calcificações nos EUA. Reconstruções 4D semelhantes são possíveis com ratos WT; no entanto, o contraste acústico capturado não será tão alto. Clique aqui para baixar este Arquivo.
Discussion
O ultrassom utiliza ondas sonoras, e quaisquer barreiras à propagação de ondas sonoras interferirão na qualidade da imagem. Assim, a depilação completa da área a ser imagem é fundamental. Também é importante garantir a remoção completa do creme depilatório, pois pode causar queimaduras/irritação da pele do animal e descolorir a membrana transparente do scanner. Níveis de água adequados nas baias são necessários para a propagação ideal de ondas sonoras, necessária para a obtenção da maior resolução de imagem. No entanto, quando o animal estiver em uma posição propensa, certifique-se de que o focinho do animal esteja acima do nível da água ou o animal esteja em risco de inalação de água. A otimização dos parâmetros de imagem, especialmente a profundidade focal, é fundamental para a obtenção de imagens de alta qualidade. Modificações nos parâmetros podem ser necessárias para animais individuais.
A robótica dos EUA oferece muitas vantagens sobre as modalidades tradicionais dos EUA. Primeiro, o sistema usa uma interface simples baseada em câmera de ponto e clique. Esse recurso aborda a complexidade dos EUA convencionais e produz dados consistentes mesmo quando operado por um usuário iniciante6. Em segundo lugar, o sistema permite o uso de água em vez de gel tradicional dos EUA como um meio acústico. Anteriormente, o uso de gel americano permitia a formação de bolhas que interferissem na aquisição de imagem de qualidade. Além disso, o gel dos EUA é bagunçado e oferece desafios para a limpeza. Além disso, a água é aquecida pela lâmpada de calor e ajuda a manter a temperatura corporal do animal. Terceiro, o US robótico é mais rápido, então artefatos do movimento respiratório não são problemáticos. O aumento da velocidade de imagem permite a conclusão prática da coleta de dados de alto rendimento. Em quarto lugar, o US robótico obtém imagens 3D e, portanto, torna a reconstrução 3D de objetos simples (Figura 4). A ressonância magnética e outras modalidades são caras, demoradas e nem sempre estão disponíveis. É importante ressaltar que o sistema robótico dos EUA se encaixa em uma mesa ou banco e é mais econômico. Finalmente, trabalhos anteriores demonstraram que os EUA robóticos poderiam fornecer dados de medição comparáveis a modalidades mais caras, como a MRI3.
Embora a qualidade da imagem e a resolução do sistema robótico dos EUA descritos neste trabalho tenham sido adequadas para a aplicação proposta (Figura 7), existem várias maneiras de que a qualidade da imagem possa ser melhorada no futuro. Por exemplo, utilizar transdutores de maior frequência (por exemplo, 50-70 MHz) resultaria em imagens de maior resolução com melhor definição de recursos. Embora utilizar frequências mais altas resultaria em uma menor profundidade de penetração, as imagens devem ser suficientes para imagens in vivo de órgãos superficiais, como o rim do rato. Assim como outras modalidades de imagem, os agentes de contraste podem ser usados para aprimorar características específicas. Para os EUA, isso normalmente significa usar algo altamente reflexivo de ondas sonoras. Microbolhas intravasculares em que lipídios cercam bolhas de gás muito pequenas são um desses agentes. As bolhas de gás do tamanho de micron são altamente reflexivas e, portanto, fornecem um segundo sinal distinto que se traduz em uma alta resolução de vasculatura7. Embora esta técnica de contraste acústico possa ser bastante útil, pode ter várias desvantagens. Primeiro, os microbolhas devem ser frescos e só persistem in vivo por 5-10 min. Em segundo lugar, a injeção intravascular in vivo normalmente requer cateterismo do véu de cauda para injeção, e isso pode ser tecnicamente desafiador. Sob certas circunstâncias e regimes pulsantes, a imagem de microbolhas pode levar a danos à vasculatura renal8.
Há também algumas limitações mais gerais do sistema dos EUA em particular utilizado. Primeiro, apenas uma matriz linear (centrada em 18 MHz) está incluída no chassi robótico, portanto, mudar para sondas de maior ou menor frequência não é atualmente possível. Isso pode impactar a amplitude de modelos (maiores ou menores) que podem ser avaliados com o sistema. As futuras iterações do instrumento devem incluir múltiplas matrizes lineares para cobrir toda a gama de modelos animais pré-clínicos. Em segundo lugar, o ângulo do transdutor em relação ao objeto animal não pode ser controlado. Portanto, a realização de técnicas de imagem dependentes de ângulos, como Doppler, ou alcançar visões alternativas in-plane de determinados órgãos (por exemplo, visão de eixo longo do rim) requer reposicionamento do animal e pode ser difícil de alcançar. Graus adicionais de liberdade poderiam ser adicionados ao movimento robótico para amenizar esse desafio. Em terceiro lugar, na ocasião, observamos artefatos de reverberação decorrentes da membrana acústica que separa o animal do transdutor que pode obscurecer a visualização de características e limites superficiais. Nesses casos, o uso de um impasse em gel para elevar o animal para longe da membrana pode remediar a situação. Finalmente, o controle de temperatura via lâmpada de calor é impreciso e, portanto, deve-se prestar muita atenção à temperatura corporal do núcleo do animal durante a imagem. Mecanismos de aquecimento mais controlados, como uma almofada de aquecimento integrada, provavelmente melhorarão o gerenciamento de homeostase e o throughput de imagem.
O uso de US robótica pode ser aplicável a vários campos de pesquisa. Essa tecnologia permite a visualização de estruturas de tecidos brutos, podendo, assim, ser utilizada para acompanhar a progressão do tumor e terapias potenciais6,9, bem como a morfologia renal apresentada aqui. A capacidade de segmentar as características específicas das imagens torna-a uma ferramenta atraente para estudar modelos de doença renal policística (PKD)3. As imagens do modo M permitem uma quantificação simples de muitos parâmetros cardíacos importantes que permitem a avaliação in vivo da fisiologia cardíaca. Como os rins recebem 20%-25% da saída cardíaca10, a compreensão da função cardíaca durante a avaliação longitudinal da patologia renal é importante. Através desses protocolos norte-americanos, tentamos ilustrar que a imagem dos EUA não é apenas prática para estudos renais in vivo e longitudinal, mas também que ferramentas cada vez mais americanas permitem tanto a morfológica quanto a avaliação fisiológica de camundongos em estudos pré-clínicos.
Disclosures
Vários autores são empregados, têm um interesse financeiro significativo ou são co-inventores em patentes licenciadas pela SonoVol, Inc. (CJM, RCG, TJC).
Acknowledgments
Este trabalho foi apoiado pelo NIH (R43-DK126607, TJC, TLK, MFR) e pela Fundação Mayo.
Materials
| Name | Company | Catalog Number | Comments |
| Electric Razor | Braintree Scientific, Inc | CLP-9868 14 | |
| C57bk6j | The Jackson laboratory | https://www.jax.org/ | |
| Cotton gauze pads | Fisher Scientific | ||
| Cotton tipped applicators | Fisher Scientific | ||
| Depilatory cream | N/a | N/a | This study used Nair |
| Heat lamp | Included with SonoVol Vega system | ||
| Robotic Ultrasound System | SonoVol Inc | SonoVol Vega system includes anesthesia system | |
| SonoEQ Software | SonoVol | Included with SonoVol Vega system | |
| TERRELL Isoflurane | Piramal Critical Care, Inc | NDC 66794-019-10 |
References
- Cunha, L., et al. Preclinical imaging: an essential ally in modern biosciences. Molecular Diagnostics & Therapy. 18 (2), 153-173 (2014).
- Ultrasound. NIBIB. , Available from: https://www.nibib.nih.gov/science-education/science-topics/ultrasound#pid-936 (2016).
- Beaumont, N. J., et al. Assessing polycystic kidney disease in rodents: Comparison of robotic 3d ultrasound and magnetic resonance imaging. Kidney360. 1 (10), 1128-1136 (2020).
- Hopp, K., et al. Functional polycystin-1 dosage governs autosomal dominant polycystic kidney disease severity. The Journal of Clinical Investigation. 122 (11), 4257-4273 (2012).
- Weiss, R. M., Ohashi, M., Miller, J. D., Young, S. G., Heistad, D. D. Calcific aortic valve stenosis in old hypercholesterolemic mice. Circulation. 114 (19), 2065-2069 (2006).
- Czernuszewicz, T. J., et al. A new preclinical ultrasound platform for widefield 3D imaging of rodents. Review of Scientific Instruments. 89 (7), 075107 (2018).
- Chong, W. K., Papadopoulou, V., Dayton, P. A. Imaging with ultrasound contrast agents: current status and future. Abdominal Radiology (NY). 43 (4), 762-772 (2018).
- Nyankima, A. G., Kasoji, S., Cianciolo, R., Dayton, P. A., Chang, E. H. Histological and blood chemistry examination of the rodent kidney after exposure to flash-replenishment ultrasound contrast imaging. Ultrasonics. 98, 1-6 (2019).
- Rojas, J. D., et al. Ultrasound measurement of vascular density to evaluate response to anti-angiogenic therapy in renal cell carcinoma. IEEE Transactions on Biomedical Engineering. 66 (3), 873-880 (2019).
- Boron, W. F., Boulpaep, E. L. Medical Physiology. 3rd edn. , Elsevier. (2017).
Tags
Medicina Edição 174Erratum
Formal Correction: Erratum: Use of 3D Robotic Ultrasound for In Vivo Analysis of Mouse Kidneys
Posted by JoVE Editors on 10/06/2021.
Citeable Link.
An erratum was issued for: Use of 3D Robotic Ultrasound for In Vivo Analysis of Mouse Kidneys. An author name was updated, along with the Protocol and Representative Results sections.
The name of an author was updated from:
Ryan C. Gesser
to:
Ryan C. Gessner
Step 3.1 of the Protocol was updated from:
Turn on the US machine and the heat lamp above the US platforms. Turn on the appropriate anesthesia valves for the corresponding US bays that will be used.
to:
Turn on the US machine and the switch for the internal heating element for the US bays. Turn on the appropriate anesthesia valves for the corresponding US bays that will be used.
Figue 1 in the Representative Results was updated from:
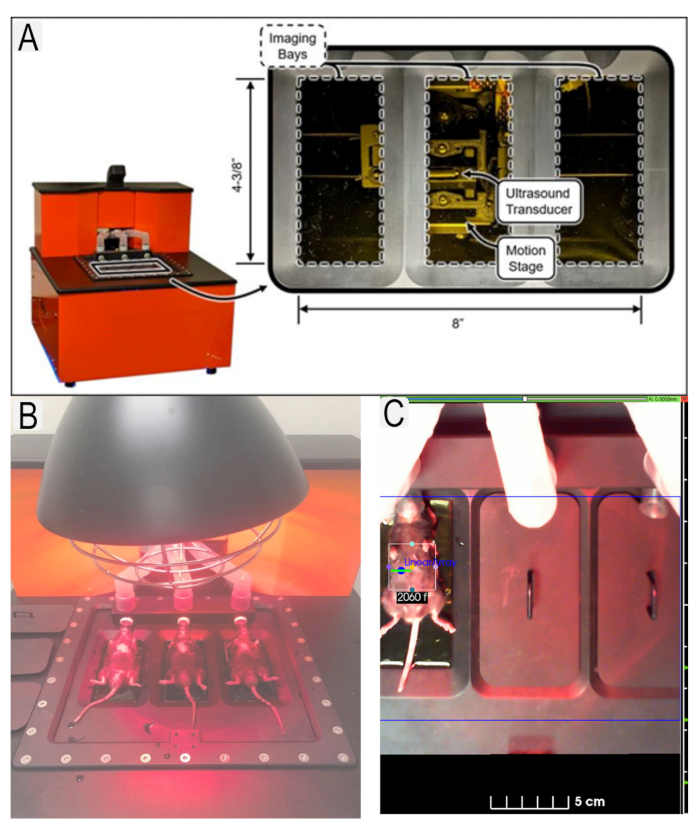
Figure 1: Ultrasound system and mouse placement. (A) Diagram of ultrasound system and location of transducers. (B) View of mice in supine position on ultrasound platform with heat lamp. (C) Example of region of interest (ROI)s in place for area of interest (kidneys) with animal IDs. Please click here to view a larger version of this figure.
to:

Figure 1: Ultrasound system and mouse placement. (A) Diagram of ultrasound system and location of transducers. (B) View of mice in supine position on ultrasound platform. (C) Example of region of interest (ROI)s in place for area of interest (kidneys) with animal IDs. Please click here to view a larger version of this figure.



