12.12:
Electrolitos: Factor de van't Hoff
12.12:
Electrolitos: Factor de van't Hoff
Propiedades coligativas de los electrolitos
Las propiedades coligativas de una solución dependen sólo del número, no de la identidad, de las especies solutos disueltas. Los términos de concentración en las ecuaciones para varias propiedades coligativas (depresión del punto de congelación, elevación del punto de ebullición, presión osmótica) pertenecen a todas las especies solutos presentes en la solución. Los no electrolitos se disuelven físicamente sin disociación ni ningún otro proceso que lo acompañe. Cada molécula que disuelve produce una molécula de soluto disuelto. La disolución de un electrolito, sin embargo, no es tan simple, como se ilustra en los dos ejemplos comunes a continuación:
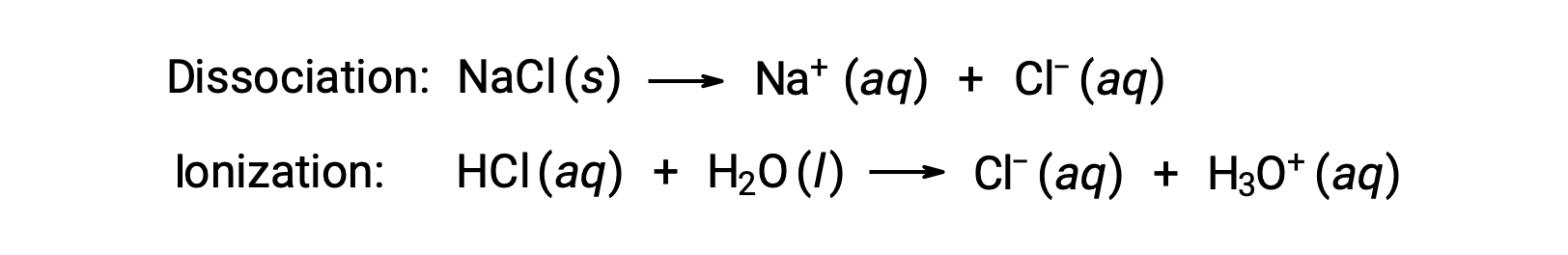
Considerando el primero de estos ejemplos, y suponiendo una disociación completa, una solución acuosa de NaCl 1,9m contiene 2,0 moles de iones (1,0 mol Na+ y 1,0 mol Cl−) por cada kilogramo de agua, y se espera que la depresión de su punto de congelación sea
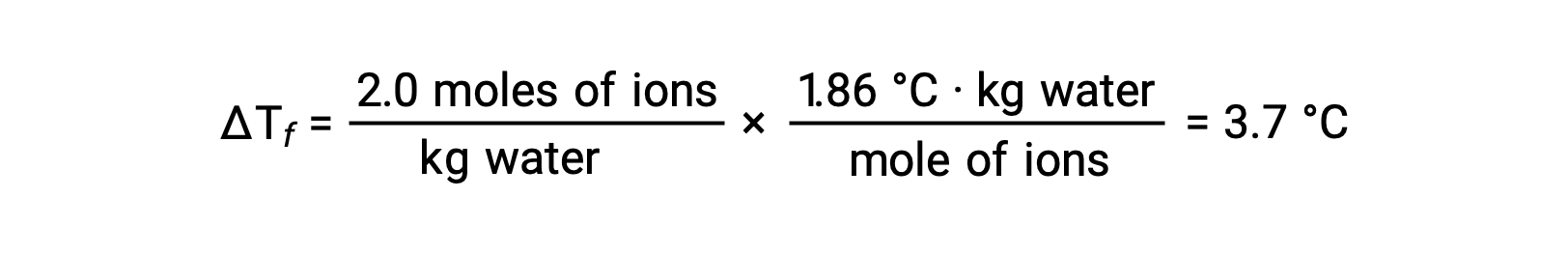
Sin embargo, cuando esta solución es realmente preparada y se mide la depresión de su punto de congelación, se obtiene un valor de 3,4 °C. Se observan discrepancias similares para otros compuestos iónicos, y las diferencias entre los valores de las propiedades coligativas medidos y esperados suelen ser más significativas a medida que aumentan las concentraciones de soluto. Estas observaciones sugieren que los iones del cloruro de sodio (y otros electrolitos fuertes) no están completamente disociados en solución.
Para explicar esto y evitar los errores que acompañan a la asunción de la disociación total, se utiliza un parámetro medido experimentalmente nombrado en honor del químico alemán galardonado con el Premio Nobel Jacobus Henricus va Non Hoff. El factor Van Hoff (i) se define como la relación entre las partículas de soluto en solución y el número de unidades de fórmula disueltas:

En 1923, los químicos Peter Debye y Erich Hückel propusieron una teoría para explicar la aparente ionización incompleta de los electrolitos fuertes. Sugirieron que aunque la atracción interiónica en una solución acuosa se reduce en gran medida por la solvatación de los iones y la acción aislante del disolvente polar, no se anula completamente. Las atracciones residuales impiden que los iones se comporten como partículas totalmente independientes. En algunos casos, un ion positivo y uno negativo pueden llegar a tocarse, dando una unidad solvatada llamada par iónico. Por lo tanto, la actividad —o la concentración efectiva— de cualquier tipo particular de ión es menor que la indicada por la concentración real. Los iones se separan cada vez más a medida que la solución se diluye y las atracciones interiónicas residuales se vuelven cada vez menores. Así, en soluciones extremadamente diluidas, las concentraciones efectivas de los iones (sus actividades) son esencialmente iguales a las concentraciones reales. Para soluciones de 0,05 m, el valor de i para NaCl es 1,9, frente a un valor ideal de 2.
Este texto es adaptado de Openstax, Química 2e, Sección 11.4: Propiedades Colligativas.
Suggested Reading
- Van Houten, Josh. "A century of chemical dynamics traced through the Nobel Prizes. 1901: Jacobus van't Hoff." Journal of Chemical Education 78, no. 12 (2001): 1570.
- Harned, Herbert S. "Activity Coefficients And Colligative Properties Of Electrolytes." Journal of the American Chemical Society 44, no. 2 (1922): 252-267.
- Randall, Merle, and Clyve Allen. "The Interpretation Of The Colligative Properties Of Weak Electrolytes." Journal of the American Chemical Society 52, no. 5 (1930): 1814-1823.
