12.12:
전해질: 반트호프 계수
12.12:
전해질: 반트호프 계수
전해질의 정렬 특성
용액의 정렬 특성은 용해 된 독단 종의 정체성이 아닌 숫자에만 의존합니다. 다양한 컬링 특성(동결점 우울증, 비등점 고도, 삼투압)에 대한 방정식의 농도 용어는 용액에 존재하는 모든 독단종에 해당한다. 비전기분해는 해리나 다른 수반되는 공정 없이 물리적으로 용해됩니다. 용해되는 각 분자는 용존된 솔루트 분자 1개를 산출합니다. 그러나 전해질의 용해는 아래의 두 가지 일반적인 예에서 설명한 것처럼 간단하지 않습니다.
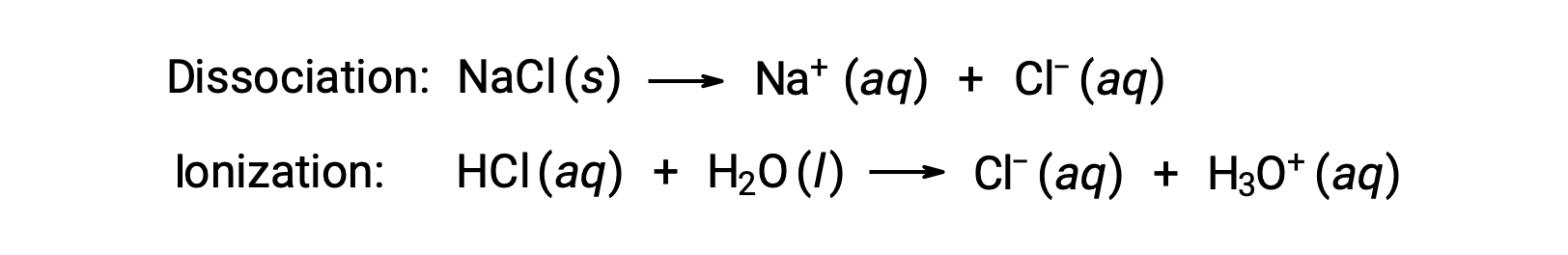
이러한 예의 첫 번째를 고려하고 완전한 해리를 가정, NaCl의 1.0 m 수성 용액은 물 킬로그램 당 2.0 몰 (1.0 mol Na+ 및 1.0 mol Cl−)를포함하고 있으며, 동결 점 우울증은 될 것으로 예상된다.
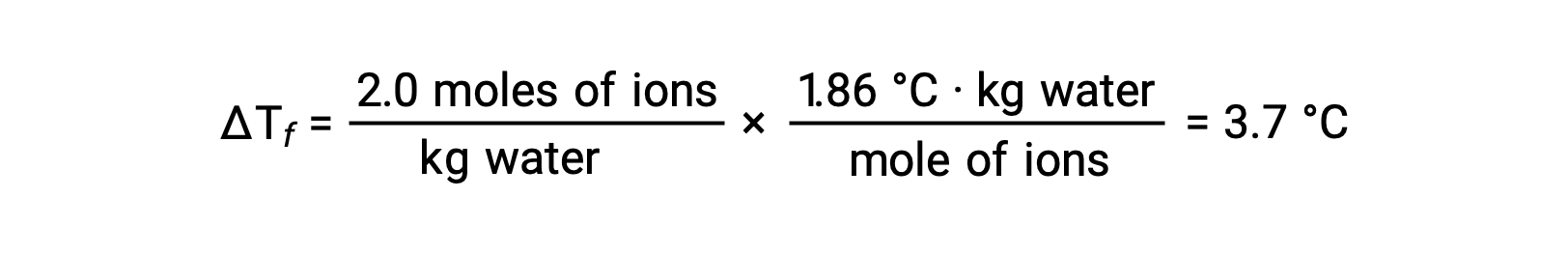
그러나, 이 용액이 실제로 준비되고 동결점 우울증이 측정되면, 3.4°C의 값을 얻을 수 있다. 다른 이온 화합물에 대해 유사한 불일치가 관찰되고, 측정된 및 예상 된 정렬 특성 값 사이의 차이는 일반적으로 솔직 한 농도 증가로 더 중요해진다. 이러한 관측은 염화나트륨(및 기타 강한 전해질)의 이온이 용액에서 완전히 해리되지 않는다는 것을 시사한다.
이를 설명하고 총 해리의 가정과 함께 오류를 피하기 위해, 노벨상을 수상한 독일 화학자 야코부스 헨리쿠스 반호프의 명예에 명명 된 실험적으로 측정 된 매개 변수가 사용됩니다. van’t Hoff계수(i)는용액에서 용액의 염두 입자의 비율로 정의되며 용해된 수식 단위의 수에 대해 다음과 같이 정의됩니다.

1923년, 화학자 피터 데비와 에리히 휘켈은 강한 전해질의 명백한 불완전한 이온화를 설명하는 이론을 제안했다. 그들은 수성 용액의 상호 매력이 극성 용매의 이온 및 절연 작용의 용해에 의해 매우 크게 감소되지만 완전히 무효화되지는 않는다고 제안했습니다. 잔류 어트랙션은 이온이 완전히 독립적인 입자로 행동하지 못하게 합니다. 경우에 따라 긍정적이고 부정적인 이온이 실제로 만질 수 있으므로 이온 쌍이라고 불리는 솔바게된 유닛을 제공합니다. 따라서, 활성-또는 유효 농도-임의의 특정 종류의 이온은 실제 농도에 의해 표시된 것보다 적습니다. 용액이 희석되고 잔류 상호 명소가 점점 더 적게 변해짐에 따라 이온이 점점 더 광범위하게 분리됩니다. 따라서, 극도로 희석된 솔루션에서, 이온(그들의 활동)의 유효 농도는 본질적으로 실제 농도와 동일하다. 0.05m 솔루션의 경우 이상적인 값 2와 는 달리 NaCl용 i값은 1.9입니다.
Suggested Reading
- Van Houten, Josh. "A century of chemical dynamics traced through the Nobel Prizes. 1901: Jacobus van't Hoff." Journal of Chemical Education 78, no. 12 (2001): 1570.
- Harned, Herbert S. "Activity Coefficients And Colligative Properties Of Electrolytes." Journal of the American Chemical Society 44, no. 2 (1922): 252-267.
- Randall, Merle, and Clyve Allen. "The Interpretation Of The Colligative Properties Of Weak Electrolytes." Journal of the American Chemical Society 52, no. 5 (1930): 1814-1823.
