12.12:
Elettroliti: fattore di van't Hoff
12.12:
Elettroliti: fattore di van't Hoff
Proprietà colligative degli elettroliti
Le proprietà colligative di una soluzione dipendono solo dal numero, non dall’identità, delle specie di soluto sciolte. I termini di concentrazione nelle equazioni per varie proprietà colligative (depressione del punto di congelamento, elevazione del punto di ebollizione, pressione osmotica) riguardano tutte le specie di soluti presenti nella soluzione. I non elettrici si dissolvono fisicamente senza dissociazione o qualsiasi altro processo di accompagnamento. Ogni molecola che si dissolve produce una molecola di soluto disciolto. La dissoluzione di un elettrolita, tuttavia, non è così semplice, come illustrato dai due esempi comuni seguenti:
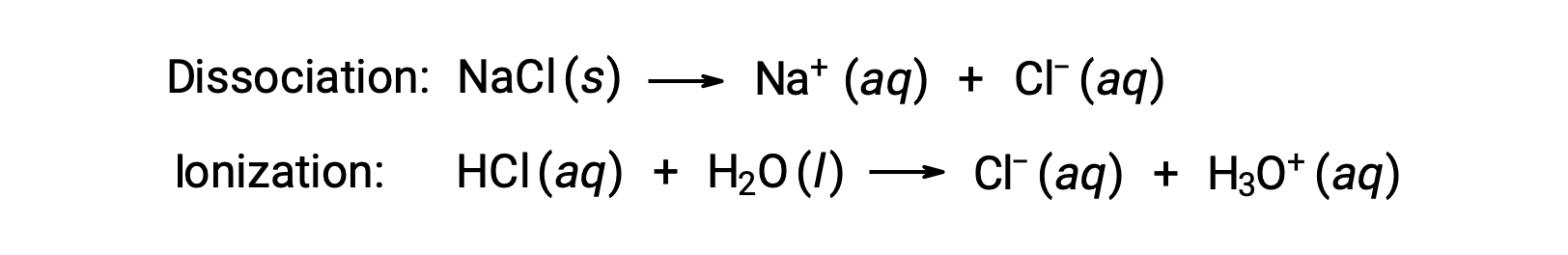
Considerando il primo di questi esempi, e assumendo una dissociazione completa, una soluzione acquosa di 1,0 m di NaCl contiene 2,0 moli di ioni (1,0 mol Na+ e 1,0 mol Cl−) per ogni chilogrammo di acqua, e si prevede che la sua depressione del punto di congelamento sia
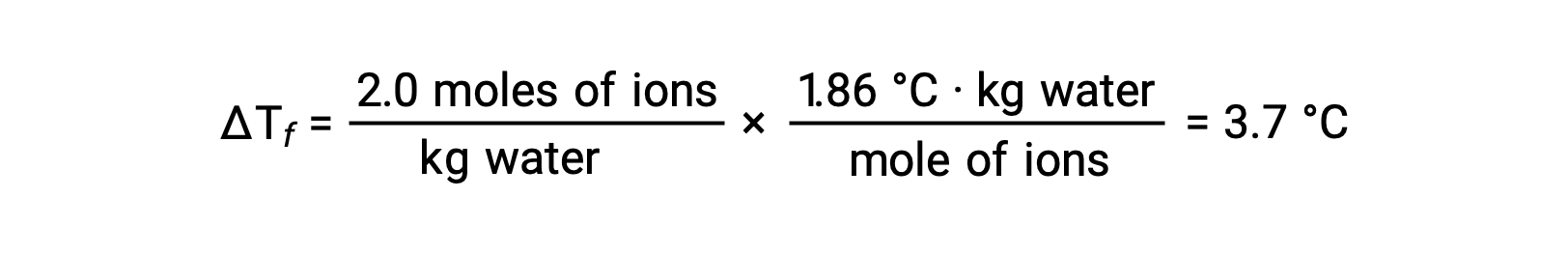
Tuttavia, quando questa soluzione viene effettivamente preparata e viene misurata la sua depressione del punto di congelamento, si ottiene un valore di 3,4 °C. Discrepanze simili si osservano per altri composti ionici, e le differenze tra i valori misurati e attesi delle proprietà colligative diventano tipicamente più significative con l’aumento delle concentrazioni di soluto. Queste osservazioni suggeriscono che gli ioni del cloruro di sodio (e di altri forti elettroliti) non sono completamente dissociati in soluzione.
Per rendere conto di ciò ed evitare gli errori che accompagnano l’assunzione della dissociazione totale, viene utilizzato un parametro misurato sperimentalmente in onore del chimico tedesco Jacobus Henricus van’t Hoff, vincitore del Premio Nobel. Il fattore di van’t Hoff (i) è definito come il rapporto tra particelle di soluto in soluzione e il numero di unità di formula sciolte:

Nel 1923, i chimici Peter Debye e Erich Hückel proposero una teoria per spiegare l’apparente ionizzazione incompleta degli elettroliti forti. Hanno suggerito che sebbene l’attrazione interionica in una soluzione acquosa sia molto ridotta dalla soluzione degli ioni e dall’azione isolante del solvente polare, non è completamente annullata. Le attrazioni residue impediscono agli ioni di comportarsi come particelle totalmente indipendenti. In alcuni casi, uno ione positivo e negativo può effettivamente toccare, dando un’unità solvata chiamata coppia di ioni. Pertanto, l’attività — o la concentrazione effettiva — di un particolare tipo di ioni è inferiore a quella indicata dalla concentrazione effettiva. Gli ioni diventano sempre più separati man mano che la soluzione diventa più diluita e le attrazioni interioniche residue diventano sempre meno. Pertanto, in soluzioni estremamente diluite, le concentrazioni effettive degli ioni (le loro attività) sono essenzialmente uguali alle concentrazioni effettive. Per soluzioni da 0,05 m, il valore di i per nacl è 1,9, contro un valore ideale di 2.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 11.4: Proprietà Colligative.
Suggested Reading
- Van Houten, Josh. "A century of chemical dynamics traced through the Nobel Prizes. 1901: Jacobus van't Hoff." Journal of Chemical Education 78, no. 12 (2001): 1570.
- Harned, Herbert S. "Activity Coefficients And Colligative Properties Of Electrolytes." Journal of the American Chemical Society 44, no. 2 (1922): 252-267.
- Randall, Merle, and Clyve Allen. "The Interpretation Of The Colligative Properties Of Weak Electrolytes." Journal of the American Chemical Society 52, no. 5 (1930): 1814-1823.
